基于数字PCR技术检测猪瘟病毒的引物和探针及其试剂盒与方法与流程
本发明属于分子生物学
技术领域:
,涉及一种基于数字pcr技术检测猪瘟病毒的引物和探针及其试剂盒与方法。
背景技术:
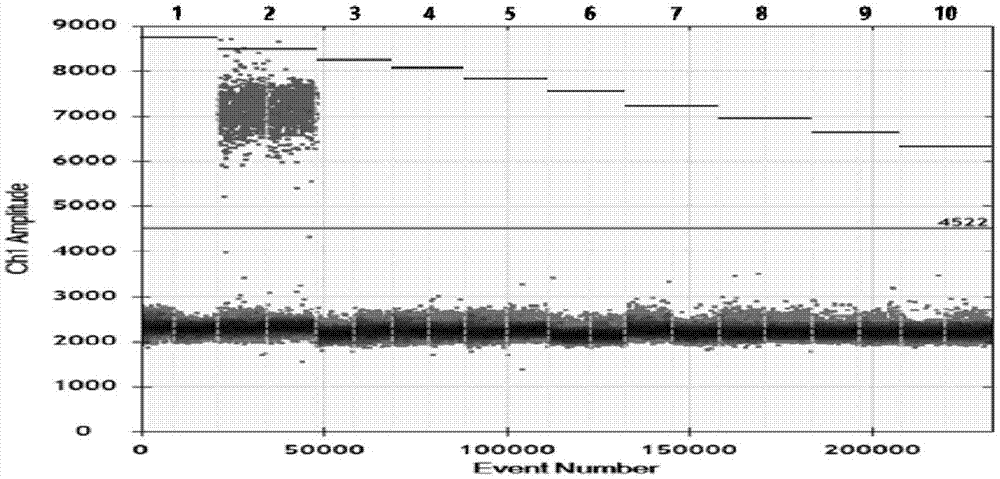
猪瘟(classicalswinefever,csf;也称hogcholera,hc)是由猪瘟病毒(classicalswinefevervirus,csfv)引起的一种急性、发热、接触性传染病,其临床症状为全身皮肤、浆膜、粘膜和内脏器官有不同程度的出血,全身淋巴结肿胀等,严重威胁着养猪业的发展,给养猪业带来了巨大的损失,被国际兽疫局(oie)列为a类法定传染病。csfv属于黄病毒科瘟病毒属,基因组为单链正股rna,大小约12.5kb,包含1个开放阅读框,高度保守的5`端非编码区和3`端非编码区。目前检测csfv的方法主要包括传统的病毒分离和鉴定、免疫荧光和间接血凝试验等,这些方法都存在着技术上要求高、耗时耗力和低灵敏度等缺点,不适用于日常诊断分析。同时,在病毒结构和抗原性上,csfv与同属的牛病毒性腹泻粘膜病病毒(bovineviraldiarrheamucosaldiseasevirus,bvdv)和羊边界病病毒(borderdiseasevirus,bdv)有极高的相似性,在血清学上有交叉反应,因此不利于疾病确诊。近年来,以分子生物学为基础的检测方法包括反转录聚合酶链式反应(reversetranscriptasepolymerasechainreaction,rt-pcr)、实时荧光pcr(realtimert-pcr)和反转录环介导等温扩增技术(reversetranscriptionloop-mediatedisothermalamplification,rt-lamp)因其灵敏度高、特异性强和方便快速而广泛应用于临床诊断。但是,rt-pcr操作复杂,需进行跑胶分析,并且灵敏度低;实时荧光pcr需使用昂贵的仪器设备并依赖标准曲线进行定量检测;rt-lamp由于引物间的非特异性扩增而易产生假阳性结果。数字pcr(digitalpcr,dpcr)是近十年来兴起的第三代pcr技术,其原理是将预混的pcr反应体系进行微滴化处理,形成几万至几十万个油包水的液化微滴中,保证每个微滴中含有一个或不含有核酸模板,经过pcr扩增后,经过荧光检测每个微滴中的阳性微滴数和阴性微滴数,根据泊松分布原理即可计算出核酸模板的初始拷贝数。与实时荧光pcr相比,该方法具有精准、灵敏度超高和不易受pcr抑制物影响等优点。而现有技术并没有利用数字pcr技术针对猪瘟病毒进行绝对定量检测的相关研究以及是否可行的相关方案及适合产业化的成品试剂盒。因此,开发相关利用数字pcr技术对猪瘟病毒进行检测的方法和试剂是业界亟待解决的技术问题。技术实现要素:有鉴于此,本发明所解决的技术问题在于提供一种基于数字pcr技术检测猪瘟病毒的引物和探针。本发明所解决的技术问题还在于提供一种基于数字pcr技术检测猪瘟病毒的试剂盒。本发明所解决的技术问题还在于提供一种基于数字pcr技术检测猪瘟病毒的方法。为了解决上述技术问题,本发明所采用的技术方案如下:一方面,本发明提供了一种基于数字pcr技术检测猪瘟病毒的引物和探针,包括上游引物fp、下游引物bp、探针probe,其核苷酸序列分别如下所示:fp:5-tggacaaaacaaaatttcaa-3(seqidno:1);bp:5-cctgtactcaggacttag-3(seqidno:2);probe:5-fam-tccctccagcgacggc-bhq1-3(seqidno:3),其中5端标记的荧光基团是fam,3端标记的淬灭基团是bhq1。优选地,扩增反应时,fp引物、bp引物和探针的摩尔比为3:3:2。另一方面,本发明还公开了一种基于数字pcr技术检测猪瘟病毒的试剂盒,其特征在于,试剂盒包含权利要求1或2中所述的引物和探针。优选地,基于数字pcr技术检测猪瘟病毒的试剂盒还包括以下成分的部分或者全部:(1)2×rt-ddpcrsupermix;(2)无rna酶的蒸馏水;(3)阳性对照和阴性对照;(4)病毒总rna提取试剂。优选地,所述的2×rt-ddpcrsupermix含有:2×one-steprt-ddpcrsupermix和25mmmanganousacetate。优选地,阳性对照为猪瘟病毒细胞培养物,阴性对照为去离子水。优选地,病毒总rna提取试剂包括裂解液a、洗液b、洗液c、洗脱液d、吸附柱和收集管。再有,本发明还公开了一种基于数字pcr技术检测猪瘟病毒的方法,包括如下步骤:(1)病毒rna的提取1)取待检样品和阳性对照,分别加入600μl裂解液a,涡旋混匀20秒,室温静置10分钟;2)将混合液移至吸附柱中,12,000×g离心30~60秒;3)丢弃收集管中液体,加入500μl洗液b至吸附柱中,12,000×g离心30~60秒;4)丢弃收集管中液体,加入500μl洗液c至吸附柱中,12,000×g离心30~60秒;5)丢弃收集管中液体,12,000×g离心2分钟以甩干柱子;6)将吸附柱移入新的1.5ml离心管中,向柱子中央加入洗脱液50μl,室温静置2分钟,12,000×g离心1分钟,离心管中液体即为模板rna;(2)rt-ddpcr操作1)设待检样品、阴性对照和阳性对照总和为n,反应体系配置rt-ddpcr反应体系,将以上配置的反应体系充分混匀后,分装至每个反应管各19μl;2)分别取1μl模板rna,加入相应的反应管中,终体积为20μl,所述模板rna包括待检样品、阴性对照和阳性对照;3)将20μl样品反应液加入到微滴发生卡内,制备微滴;4)将微滴转入pcr板中,放入pcr仪中进行扩增;5)将扩增完成的pcr板放入微滴分析仪中,检测微滴中的荧光信号,分析数据,显示检测结果;6)结果判定及描述:阳性对照:30±2个拷贝,阴性对照:<1个拷贝时,实验结果成立;待检测样品结果≥1个拷贝时为阳性;待检测样品结果<1个拷贝时为阴性。优选地,rt-ddpcr反应体系为20μl反应体系,其含有10μmol/lfp和bp引物各0.6μl,10μmol/l探针0.4μl,2×rt-ddpcrsupermix10μl,用去离子水补齐到19μl,加入1μl模板后为20μl。优选地,扩增程序为:60℃反应30min;95℃反应5min;94℃反应30sec,60℃反应60sec,40个循环;98℃反应10min;每步都设置2.5℃/sec的升降温速度。本发明以微滴数字pcr(dropletdigitalpcr,ddpcr)技术为依托,开发基于数字pcr技术绝对定量检测猪瘟病毒的试剂盒及检测方法。目前尚未有将微滴数字pcr技术应用于检测猪瘟病毒的试剂盒。本试剂盒能够在短时间内实现猪瘟病毒的快速、精准定量,为猪瘟的早期诊断提供有力的技术支持,有着广阔的应用前景和产业化前景。因此,相比于现有的其他检测技术,本发明技术具有精准、灵敏、适用性广等优点:(1)结果精准:实现绝对定量,不依赖ct值,无需标准曲线,更精准的检测病毒含量,为猪病诊断提供准确的诊断依据;(2)灵敏度高:可检测单拷贝模板;(3)适用性广:适用复杂样品检测,不易受pcr抑制物影响。因此,本方法克服了现有实时荧光pcr依赖标准曲线的限制,可实现精准的绝对定量,无需依赖标准曲线;灵敏度超高,检测限低至单拷贝,可实现猪瘟诊断的早发现、早预防,可有效避免大面积爆发猪瘟而导致经济损失。附图说明图1是本发明实施例3中特异性实验的检测结果图。图1中,1:阳性对照;2:阴性对照;3:健康猪的血清样;4:伪狂犬病毒;5:猪呼吸繁殖综合症美洲型病毒;6:猪流行性腹泻病毒;7:猪圆环病毒;8:副猪嗜血杆菌;9:猪链球菌;10:猪胸膜肺炎放线杆菌.具体实施方式以下结合实施例对本发明作进一步的说明,但并不局限于此。实施例1基于数字pcr技术绝对定量检测猪瘟病毒的试剂盒的建立基于数字pcr技术绝对定量检测猪瘟病毒的试剂盒,包括引物组、2×rt-ddpcrsupermix、无rna酶的蒸馏水、病毒总rna提取试剂、阳性对照和阴性对照。(1)数字pcr扩增引物设计:以猪瘟病毒特异性保守序列为靶基因进行引物的设计。引物序列见表1。表1引物序列表(2)引物组中fp引物、bp引物和探针的摩尔比为3:3:2。(3)2×rt-ddpcrsupermix含有:2×one-steprt-ddpcrsupermix和25mmmanganousacetate。(4)阳性对照为猪瘟病毒细胞培养物,阴性对照为去离子水。(5)病毒总rna提取试剂包括裂解液a、洗液b、洗液c、洗脱液d、吸附柱和收集管。实施例2基于数字pcr技术绝对定量检测猪瘟病毒的检测方法利用实施例1的试剂盒检测猪瘟病毒的方法,包括如下步骤:(1)病毒rna的提取:1)取待检样品和阳性对照,分别加入600ul裂解液a,涡旋混匀20秒,室温静置10分钟;2)将混合液移至吸附柱中,12,000×g离心30~60秒;3)丢弃收集管中液体,加入500ul洗液b至吸附柱中,12,000×g离心30~60秒;4)丢弃收集管中液体,加入500ul洗液c至吸附柱中,12,000×g离心30~60秒;5)丢弃收集管中液体,12,000×g离心2分钟以甩干柱子;6)将吸附柱移入新的1.5ml离心管中,向柱子中央加入洗脱液50ul,室温静置2分钟,12,000×g离心1分钟,离心管中液体即为模板rna。(2)rt-ddpcr操作1)设待检样品、阴性对照和阳性对照总和为n,反应体系配置如下:表2rt-ddpcr反应体系名称体系2×rt-ddpcrsupermix10×(n+1)ul引物组1.6×(n+1)ul无rna酶的蒸馏水7.4×(n+1)ul将以上配置的反应体系充分混匀后,分装至每个反应管各19ul。其中,引物和探针含有10μmol/lfp和bp引物各0.6μl,10μmol/l探针0.4μl。2)分别取1ul模板rna(包括待检样品、阴性对照和阳性对照),加入相应的反应管中,终体积为20ul。3)将一个新的微滴发生卡放入卡托中,将20ul样品反应液加入到微滴发生卡中间一排的8个孔中,不足8个样品时用20ul去离子水补足,建议使用8通道排枪,加样时枪头接近孔一侧底部,与侧壁呈现大约15°角,缓慢打出液体,打出一部分后缓慢提升枪头位置再打出余下液滴,不要将枪打至第一档位置以免引入气泡;4)在微滴发生卡最底下一排8个孔中加入70ul微滴生成油,同样不能有空着的孔;5)盖上胶垫,注意两边的小孔都要钩牢;6)将卡托轻轻地平稳放置于微滴生成仪中,开始生成微滴,注意仪器上指示灯状态,一般2分钟之内完成;7)微滴生成于微滴发生卡最上面一排孔内,建议使用8通道排枪小心缓慢吸取,调整吸取体积为40ul,将卡托放平,枪头以与孔壁呈30~45°角放入,轻触孔底,约5秒吸取40ul,再同样缓慢地打入96孔板相应位置孔内(约5秒),枪头贴近孔壁接近孔底,注意封上盖以防油挥发,每次弃去已使用过的微滴发生卡和胶垫;8)转移油滴进入96孔板内完成后,用预热好的px1热封仪对其进行封膜(红线朝上),运行程序为:180℃,5s,无需颠倒方向二次封膜;9)封好膜之后应该在30分钟内进行pcr反应,或者放于4℃冰箱4小时之内进行pcr。扩增程序为:60℃反应30min;95℃反应5min;94℃反应30sec,60℃反应60sec,40个循环;98℃反应10min。每步都设置2.5℃/sec的降温速度。10)将pcr扩增完成的96板放入微滴分析仪的plateholder中,注意板斜角方位,组装好之后轻轻地平稳放入微滴读取仪中。11)打开quantasoft软件,建议每次实验之前做一次flushsystem,若一周以上未使用建议先做一次prime再做flushsystem。然后对96孔板中样品信息进行设置,完成后即可进行检测,结束后结果会被自动分析,人工核实后保存结果。12)结果判定及描述:阳性对照:30±2个拷贝,阴性对照:<1个拷贝时,实验结果成立;待检测样品结果≥1个拷贝时为猪瘟病毒阳性;待检测样品结果<1个拷贝时为猪瘟病毒阴性。实施例3特异性验证用本发明试剂盒分别检测健康猪的血清样本,临床得到的伪狂犬病毒、猪呼吸繁殖综合症美洲型病毒、猪流行性腹泻病毒、猪圆环病毒、副猪嗜血杆菌、猪链球菌、猪胸膜肺炎放线杆菌样本共8份样品,所有样品均经过测序法验证,检测结果见图1。实施例4实际样品验证用本发明试剂盒对实际样本进行检测,检测临床得到的疑似猪瘟样本56份,同时用测序法验证,其中,本发明试剂盒和测序法检测均为阳性的有19例,检测方法均为阴性的有37例,检测结果表3所示:表3上表的实验结果可以说明本试剂盒及方法准确性高,特异性强,与测序法有很高的一致性。最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。sequencelisting<110>暨南大学<120>基于数字pcr技术检测猪瘟病毒的引物和探针及其试剂盒与方法<130>2018<160>3<170>patentinversion3.3<210>1<211>20<212>dna<213>人工序列(artificialsequence)<400>1tggacaaaacaaaatttcaa20<210>2<211>18<212>dna<213>人工序列(artificialsequence)<400>2cctgtactcaggacttag18<210>3<211>16<212>dna<213>人工序列(artificialsequence)<400>3tccctccagcgacggc16当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 用于检测CYP2C19基因多态性的引物、探针及检测试剂盒的制造方法与工艺
- 分子信标探针及引物对、GC基因SNPs位点检测方法与流程
- 一种表面修饰分子印迹固相微萃取探针及其制备与应用的制造方法与工艺
- 一种木瑚菌属食用菌鉴别用分子标记及引物和探针的制造方法与工艺
- 一种用于检测样品中牛凸隆病毒的荧光RT-PCR引物、探针和试剂盒及检测方法与制造工艺
- CYP2C19基因多态性检测引物、探针及试剂盒的制造方法与工艺
- 检测CYP2C9和VKORC1基因多态性的引物、探针和试剂盒的制造方法与工艺
- 一种用于检验临床样本中活菌体的荧光PCR引物探针组及试剂盒的制造方法与工艺
- 含反义碱基的探针法实时荧光PCR的制造方法与工艺
- PCR反应管及包含其的固相载具的制造方法与工艺
- 一种木瑚菌属食用菌鉴别用分子标记及引物和探针的制造方法与工艺
- 一组用于驴源性的实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 一组用于鸡源性实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 一种快速检测异鳞蛇鲭和棘鳞蛇鲭源性成分的方法与制造工艺
- 一种检测食管癌相关标志物的探针组合及其试剂盒的制造方法与工艺
- 一种检测皮肤癌相关标志物的探针组合及其试剂盒的制造方法与工艺
- 一种检测骨髓瘤相关标志物的探针组合及其试剂盒的制造方法与工艺
- 一种用于检测样品中牛凸隆病毒的荧光RT-PCR引物、探针和试剂盒及检测方法与制造工艺
- CYP2C19基因多态性检测引物、探针及试剂盒的制造方法与工艺
- 检测CYP2C9和VKORC1基因多态性的引物、探针和试剂盒的制造方法与工艺
- 一种用于评估皮肤抗过敏情况的引物和探针及试剂盒的制作方法
- 一种用于评估皮肤防御情况的引物和探针及试剂盒的制作方法
- 一种荧光定量PCR检测猪delta冠状病毒的引物、探针、试剂盒及方法
- 一种快速区分HP-PRRS疫苗GDr180株与野毒株的引物、探针及方法
- 一种用于检测样品中猪凸隆病毒的荧光rt-pcr引物和探针和试剂盒及检测方法
- 一种阿胶中驴、马、牛和猪源性巢式荧光pcr检测引物、探针、试剂盒、检测方法及应用
- 一种用于评估皮肤防晒情况的引物和探针及试剂盒的制作方法
- 一种用于评估皮肤抗皱情况的引物和探针及试剂盒的制作方法
- 一种用于检测car-t转导效率的引物、探针和方法
- 用于微嵌合检测和个体识别的引物、探针、试剂盒及方法