一种烷基取代的化合物及其应用的制作方法
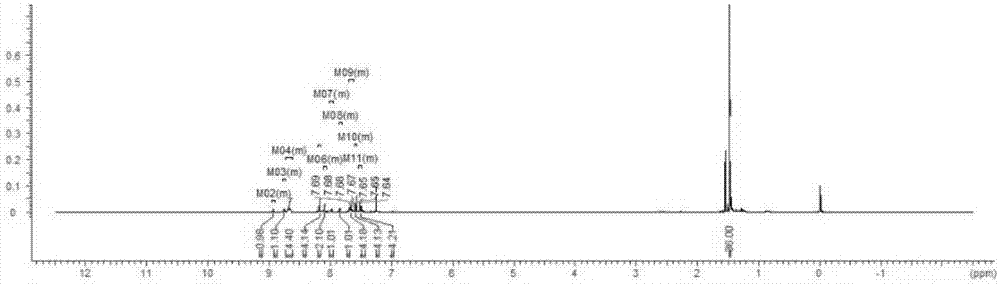
本发明属于有机电致发光材料领域,特别涉及一种烷基取代的化合物及其在有机电致发光器件中的应用。
背景技术:
在有机电致发光器件
技术领域:
,可通过不同的方式实现高效、高寿命的发光,对于发射光谱的发光层,其中一种方式就是采用主客体掺杂的形式进行效率和寿命的提升。主体材料接收能量并传递给客体,客体材料接收能量后发射相应的光谱;不同的主体和客体材料,可以实现不同颜色的发光。此外,为了更好地提升器件的效率和寿命,可以进一步引入不发光的功能层,如空穴传输层。为了实现高效率的发光,避免能量从客体材料向主体材料的逆向能量回传,同时将三重态激子限定在发光层,主体材料的三重态能级应该大于掺杂材料的三重态能级。当主体材料的三重态能级小于掺杂材料的三重态能量时,将会发生从掺杂材料至主体材料能级反跃迁的现象,从而导致发光效率降低。因此,对于发光材料层,需要高热稳定性和高于掺杂材料三重态能量的主体材料。现有技术中,大部分主体材料是空穴传输型主体材料或电子传输型主体材料。由于载流子传输性能的不平衡,这种单极性的主体材料容易形成不利的窄的复合区域,加快三重态-三重态湮灭过程,从而导致发光效率下降。为了避免这种效应,业内通常采用的策略是:(1)使用两个发光层,其中一层使用空穴传输型主体材料,另一个发光层使用电子传输型主体材料;(2)将空穴传输型和电子传输型主体材料混合置于单个发光层中。然而,这两种策略使得器件的制备变得复杂,且混合的主体材料会导致相分离的问题。此外,对于荧光主体材料,还存在热稳定性和结晶性能的改良要求。因此,为了达到高效的电致发光效果,亟待开发出具有高发光效率、高热稳定性和优良成膜性的主体材料。技术实现要素:本发明的目的在于提供一种烷基取代的化合物以及该种化合物在有机电致发光器件中的应用。本发明的实施方式所提供的烷基取代的化合物,其具有式(i)所示的结构:其中,l1、l2各自独立地表示式(ii)所示的结构:式(ii)中,r1、r2各自独立地表示c1-c12烷基、c1-c12烷氧基、c1-c12烷硫基、c1-c12烷胺基、c1-c12烷砜基或c1-c12烷亚砜基;m为c6-c36芳基、c6-c36芳氧基、c6-c36芳硫基、c6-c36芳胺基、c6-c36芳硅基、c3-c36杂芳基、c3-c36杂芳氧基、c3-c36杂芳硫基、c3-c36杂芳胺基或c3-c36杂芳硅基;且m含有零个或一个烷基取代基。可选地,l1与l2为相同取代基,且m与l1为不同取代基。可选地,本发明的实施方式所提供的烷基取代的化合物,具有通式(iii)所示的结构:其中,r3选自c1-c6烷基,n11-n18各自独立地表示n原子或crx,所述rx为氢原子、氘原子、卤素取代基、c1-c12烷基、c1-c12烷氧基、c1-c12烷硫基、c1-c12烷胺基、c1-c12烷砜基、c6-c36芳基、c6-c36芳氧基、c6-c36芳硫基、c6-c36芳胺基、c6-c36芳硅基、c3-c36杂芳基、c3-c36杂芳氧基、c3-c36杂芳硫基、c3-c36杂芳胺基或c3-c36杂芳硅基;所述n11-n18为crx时,相邻的取代基不相连或通过化学键相连。可选地,本发明的实施方式所提供的烷基取代的化合物,具有通式(iv)所示的结构:其中,r4选自c1-c6烷基;所述烷基选自甲基、乙基、丙基、丁基、戊基或己基中的一种,所述烷基包括环烷基,n21-n30表示n原子或cry,所述ry为氢原子、氘原子、卤素取代基、c1-c12烷基、c1-c12烷氧基、c1-c12烷硫基、c1-c12烷胺基、c1-c12烷砜基、c6-c36芳基、c6-c36芳氧基、c6-c36芳硫基、c6-c36芳胺基、c6-c36芳硅基、c3-c36杂芳基、c3-c36杂芳氧基、c3-c36杂芳硫基、c3-c36杂芳胺基或c3-c36杂芳硅基;所述n21-n30为cry时,相邻的取代基不相连或通过化学键相连。可选地,本发明的实施方式所提供的烷基取代的化合物,具有通式(v)所示的结构:其中,r5选自c1-c6烷基;所述烷基选自甲基、乙基、丙基、丁基、戊基或己基中的一种,所述烷基包括环烷基,n41-n48表示n原子或crz,x表示-ch2-ch2-、-ch=ch-、氧原子、硫原子、nro、crmrn、sirprq,所述rz为氢原子、氘原子、卤素取代基、c1-c12烷基、c1-c12烷氧基、c1-c12烷硫基、c1-c12烷胺基、c1-c12烷砜基、c6-c36芳基、c6-c36芳氧基、c6-c36芳硫基、c6-c36芳胺基、c6-c36芳硅基、c3-c36杂芳基、c3-c36杂芳氧基、c3-c36杂芳硫基、c3-c36杂芳胺基或c3-c36杂芳硅基;所述n41-n48为crz时,相邻的取代基不相连或通过化学键相连;所述ro、rm、rn、rp、rq各自独立地为氢原子、氘原子、卤素取代基、c1-c12烷基或c3-c36芳基。可选地,上述r1、r2、r3、r4、r5各自独立地为叔丁基。可选地,本发明的实施方式所提供的烷基取代的化合物,具有选自如下之一的结构:可选地,本发明的实施方式所提供的烷基取代的化合物,具有选自如下之一的结构:可选地,本发明的实施方式所提供的烷基取代的化合物,具有选自如下之一的结构:本发明的实施方式还提供上述烷基取代的化合物在有机电致发光器件中的应用。申请人经深入研究发现,式(i)中的烷基取代基数目不多于五个时,其性能比无烷基取代化合物更佳。由于咔唑三位和六位的氢取代基是相对活泼的,三位和六位的氢被烷基取代后,活性位点消失,化学稳定性增加。此外,由于引入了烷基取代基,化合物的热稳定性和成膜性也均有明显改善。根据器件性能检测结果显示,采用本发明的实施方式所提供的烷基取代的化合物作为器件的主体材料,器件的发光效率得到显著提高。附图说明图1是本发明具体实施方式中实施例1制备的化合物h1的氢谱;图2是本发明具体实施方式中实施例2制备的化合物h2的氢谱;图3是本发明具体实施方式中实施例3制备的化合物h3的氢谱;图4是本发明具体实施方式中实施例4制备的化合物h4的氢谱。具体实施方式为使本发明的目的、技术方案和优点更加清楚,下面将结合实施例对本发明的各具体实施方式进行详细的阐述。然而,本领域的普通技术人员可以理解,在本发明各实施方式中,为了使读者更好地理解本发明而提出了许多技术细节。但是,即使没有这些技术细节和基于以下各实施方式的种种变化和修改,也可以实现本发明各权利要求所要求保护的技术方案。化合物在本发明的一些具体实施方式中,提供了一种烷基取代的化合物,其具有通式(i)所示的结构:其中,l1、l2各自独立地表示式(ii)所示的结构:式(ii)中,r1、r2各自独立地表示c1-c12烷基、c1-c12烷氧基、c1-c12烷硫基、c1-c12烷胺基、c1-c12烷砜基或c1-c12烷亚砜基;m为c6-c36芳基、c6-c36芳氧基、c6-c36芳硫基、c6-c36芳胺基、c6-c36芳硅基、c3-c36杂芳基、c3-c36杂芳氧基、c3-c36杂芳硫基、c3-c36杂芳胺基或c3-c36杂芳硅基;且m含有零个或一个烷基取代基。在本发明的一些具体实施方式中,l1与l2为相同取代基,且m与l1为不同取代基。在本发明的一些具体实施方式中,所提供的烷基取代的化合物,具有通式(iii)所示的结构:其中,r3选自c1-c6烷基,n11-n18各自独立地表示n原子或crx,所述rx为氢原子、氘原子、卤素取代基、c1-c12烷基、c1-c12烷氧基、c1-c12烷硫基、c1-c12烷胺基、c1-c12烷砜基、c6-c36芳基、c6-c36芳氧基、c6-c36芳硫基、c6-c36芳胺基、c6-c36芳硅基、c3-c36杂芳基、c3-c36杂芳氧基、c3-c36杂芳硫基、c3-c36杂芳胺基或c3-c36杂芳硅基;所述n11-n18为crx时,相邻的取代基不相连或通过化学键相连。在本发明的一些具体实施方式中,所提供的烷基取代的化合物,具有通式(iv)所示的结构:其中,r4选自c1-c6烷基;所述烷基选自甲基、乙基、丙基、丁基、戊基或己基中的一种,所述烷基包括环烷基,n21-n30表示n原子或cry,所述ry为氢原子、氘原子、卤素取代基、c1-c12烷基、c1-c12烷氧基、c1-c12烷硫基、c1-c12烷胺基、c1-c12烷砜基、c6-c36芳基、c6-c36芳氧基、c6-c36芳硫基、c6-c36芳胺基、c6-c36芳硅基、c3-c36杂芳基、c3-c36杂芳氧基、c3-c36杂芳硫基、c3-c36杂芳胺基或c3-c36杂芳硅基;所述n21-n30为cry时,相邻的取代基不相连或通过化学键相连。在本发明的一些具体实施方式中,所提供的烷基取代的化合物,具有通式(v)所示的结构:其中,r5选自c1-c6烷基;所述烷基选自甲基、乙基、丙基、丁基、戊基或己基中的一种,所述烷基包括环烷基,n41-n48表示n原子或crz,x表示-ch2-ch2-、-ch=ch-、氧原子、硫原子、nro、crmrn、sirprq,所述rz为氢原子、氘原子、卤素取代基、c1-c12烷基、c1-c12烷氧基、c1-c12烷硫基、c1-c12烷胺基、c1-c12烷砜基、c6-c36芳基、c6-c36芳氧基、c6-c36芳硫基、c6-c36芳胺基、c6-c36芳硅基、c3-c36杂芳基、c3-c36杂芳氧基、c3-c36杂芳硫基、c3-c36杂芳胺基或c3-c36杂芳硅基;所述n41-n48为crz时,相邻的取代基不相连或通过化学键相连;所述ro、rm、rn、rp、rq各自独立地为氢原子、氘原子、卤素取代基、c1-c12烷基或c3-c36芳基。在本发明的一些具体实施方式中,r1、r2、r3、r4、r5各自独立地为叔丁基。在本发明的一些具体实施方式中所提供的烷基取代的化合物,具有选自如下之一的结构:在本发明的另一些具体实施方式中所提供的烷基取代的化合物,具有选自如下之一的结构:在本发明的还一些具体实施方式中所提供的烷基取代的化合物,具有选自如下之一的结构:通用合成路线:本发明的化合物,采用业内通用的合成方法制备,举例而不受限的,合成方法如(syn-1)所示。其中,s1、s2、s3、s4各自独立地表示反应离去基团,反应离去基团是多种多样的,举例而不受限制的,可选择氟原子、氯原子、溴原子、碘原子、硼酸基团、硼酸酯基团;其他基团定义与本申请通式(i)相同。上述反应离去基团,在反应过程中离去时,可能是带电荷的,如氟原子在离去时多以负离子的形式离去。具体的反应条件是不受限制的,举例如温度、溶剂的种类和用量、催化剂的种类和用量、助催化剂的种类和用量、碱的种类和用量、水的用量、反应底物的投料比和顺序,业内一般技术人员可以容易地从本发明实施例中的实施例进行合理的推广,选择的一般依据可以参考有机合成反应的相关文献、专利和书籍。涉及偶联反应,可以优先参考铃木反应和乌尔曼反应的相关资料;涉及烷基化的反应,可以优先参考付克烷基化的相关资料。合成示例:以下提供在本发明公开化合物的制备方法。但是本公开内容不意图限于本文中所叙述的方法的任一种。所属领域的技术人员可容易地修改所叙述的方法或者利用不同的方法来制备所公开的化合物的一种或多种。下列方面仅是示例性的,且不意图限制本公开内容的范围。温度、催化剂、浓度、反应物组成、以及其它工艺条件可改变,并且对于期望的化合物,本公开内容所属领域的技术人员可以容易的选择合适的反应物和条件。本发明实施例中的缩写含义:pe:石油醚;dcm:二氯甲烷;ea:乙酸乙酯;chloroform-d,氘代氯仿;methf:甲基四氢呋喃;dmso:二甲基亚砜;hplc:高效液相色谱。实施例1:1-(苯并[9,10]菲-2-基)-3,5-二(3,6-二叔丁基)-咔唑-9-基苯(h1)向75ml封管内,依次加入2-频那醇硼酸酯三亚苯406mg(1.0eq),3,5-二(3,6-二叔丁基)咔唑-9-基溴苯815mg(1.0eq),碳酸钾320mg(2.0eq),双三苯基磷二氯化钯81mg(0.1eq)。再加入甲苯30ml(75vol),自来水3ml(7.5vol),向体系内通氮气鼓泡30min,至体系彻底脱气后,将体系升温至110℃,反应12h。将体系将至室温,过滤,滤液分液,有机相加入无水硫酸钠干燥。干燥后有机相浓缩,柱层析洗脱剂dcm:pe=1;10,洗脱液浓缩得白色固体886mg,产率=90%。hplc:99%。1hnmr(400mhz,chloroform-d)δppm:1.46-1.50(m,36h)7.49-7.55(m,4h)7.55-7.62(m,4h)7.62-7.71(m,4h)7.82-7.87(m,1h)7.95-8.02(m,1h)8.08-8.12(m,2h)8.16-8.21(m,4h)8.62-8.72(m,4h)8.72-8.79(m,1h)8.89-8.97(m,1h)。实施例2:1-(二苯并呋喃-4-基)-3,5-二(3,6-二叔丁基)-咔唑-9-基苯(h2)向75ml封管内,依次加入4-硼酸二并呋喃苯256mg(1.0eq),3,5-二(3,6-二叔丁基)咔唑基溴苯662mg(1.0eq),碳酸钾304mg(2.0eq),双三苯基磷二氯化钯78mg(0.1eq)。再加入甲苯25ml(100vol),自来水2.5ml(10vol),向体系内通氮气鼓泡30min,至体系彻底脱气后,将体系升温至110℃,反应12h。将体系将至室温,过滤,滤液分液,有机相加入无水硫酸钠干燥。干燥后有机相浓缩,柱层析洗脱剂dcm:pe=1:40-1:10,洗脱液浓缩得白色固体660mg(产率=88%)。1hnmr(400mhz,chloroform-d)δppm1.40-1.42(m,36h)7.30-7.33(m,1h)7.44-7.48(m,5h)7.54-7.58(m,1h)7.58-7.62(m,4h)7.64-7.67(m,1h)7.79-7.82(m,1h)7.90-7.99(m,3h)8.08-8.11(m,4h)8.14-8.17(m,2h)。实施例3:1-(1-n-咔啉-9-基)-3,5-二(3,6-二叔丁基)-咔唑-9-基苯(h3)氮气保护下,向38ml封管内依次加入3,5-二(3,6-二叔丁基)咔唑基溴苯455mg(1.0eq),1-咔啉216mg(2.0eq),叔丁醇钠132mg(2.0eq),pd2(dba)3(三二亚苄基丙酮二钯)59mg(0.1eq),s-phos(2-双环己基膦-2’,6’-二甲氧基-1,1’-联苯)53mg(0.2eq),18ml(40vol)dmso(二甲基亚砜),氮气鼓泡30min,将体系彻底脱氧后升温至140℃,反应18h。反应结束后,将体系降温至室温,加入20ml自来水,分液,水相拥30ml乙酸乙酯萃取一次,合并有机相加入无水硫酸钠干燥,干燥后有机相浓缩,柱层析,洗脱剂ea:pe=1:5,洗脱液浓缩。得白色固体612mg,产率=60%。1hnmr(400mhz,chloroform-d)δppm1.35-1.42(m,36h)6.91-6.94(m,1h)7.19-7.25(m,3h)7.25-7.31(m,5h)7.31-7.35(m,5h)7.44-7.49(m,1h)8.11-8.14(m,4h)8.17-8.21(m,1h)8.34-8.38(m,1h)8.46-8.49(m,1h)。实施例4:1-(3-n-咔啉-9-基)-3,5-二(3,6-二叔丁基)-咔唑-9-基苯(h4)氮气保护下,向38ml封管内依次加入3,5-二(3,6-二叔丁基)咔唑基溴苯450mg(1.0eq),1-咔啉202mg(2.0eq),叔丁醇钠120mg(2.0eq),pd2(dba)348mg(0.1eq),s-phos45mg(0.2eq),15ml(40vol)dmso,氮气鼓泡30min,将体系彻底脱氧后升温至140℃,反应18h。反应结束后,将体系降温至室温,加入20ml自来水,分液,水相用30ml乙酸乙酯萃取一次,合并有机相加入无水硫酸钠干燥,干燥后有机相浓缩,柱层析,洗脱剂ea:pe=1:5,洗脱液浓缩。得白色固体300mg,产率30%。1hnmr(400mhz,chloroform-d)δppm1.31-1.45(m,36h)6.80-6.87(m,1h)6.90-6.96(m,2h)7.22-7.30(m,4h)7.30-7.37(m,5h)7.40-7.43(m,1h)7.52-7.60(m,1h)7.65-7.76(m,1h)7.93-7.99(m,1h)8.08-8.17(m,4h)8.41-8.47(m,1h)9.26(s,1h)。实施例5:1-(吩噻嗪-9-基)-3,5-二(3,6-二叔丁基)-咔唑-9-基苯(h5)氮气保护下,向38ml封管内依次加入3,5-二(3,6-二叔丁基)咔唑基溴苯225mg(1.0eq),吩噻嗪125mg(2.0eq),叔丁醇钠90mg(2.0eq),pd2(dba)330mg(0.1eq),s-phos29mg(0.2eq),6ml(40vol)dmso,氮气鼓泡30min,将体系彻底脱氧后升温至140℃,反应18h。反应结束后,将体系降温至室温,加入20ml自来水,分液,水相用30ml乙酸乙酯萃取一次,合并有机相加入无水硫酸钠干燥,干燥后有机相浓缩,柱层析,洗脱剂ea:pe=1:5,洗脱液浓缩。得白色固体220mg,yield=85%。1hnmr(400mhz,chloroform-d)δppm1.32-1.43(m,36h)6.35-6.44(m,2h)6.67-6.72(m,1h)6.83-6.92(m,2h)6.95-7.04(m,2h)7.04-7.11(m,2h)7.21-7.29(m,6h)7.29-7.37(m,4h)8.06-8.17(m,4h)。实施例6:1-(4-异丙苯基-n-苯基胺基)-3,5-二(3,6-二叔丁基)-咔唑-9-基苯(h6)氮气保护下,向38ml封管内依次加入3,5-二(3,6-二叔丁基)咔唑基溴苯460mg(1.0eq),吩噻嗪300mg,叔丁醇钠210mg,pd2(dba)380mg,s-phos60mg,60mldmso,氮气鼓泡30min,将体系彻底脱氧后升温至140℃,反应18h。反应结束后,将体系降温至室温,加入20ml自来水,分液,水相用30ml乙酸乙酯萃取一次,合并有机相加入无水硫酸钠干燥,干燥后有机相浓缩,柱层析,洗脱剂ea:pe=1:3,洗脱液浓缩。得白色固体300mg。质谱分子离子峰:842。实施例7:1-(4-甲基苯基-n-苯基胺基)-3,5-二(3,6-二叔丁基)-咔唑-9-基苯(h7)氮气保护下,向38ml封管内依次加入3,5-二(3,6-二叔丁基)咔唑基溴苯300mg(1.0eq),吩噻嗪200mg,叔丁醇钠180mg,pd2(dba)370mg,s-phos50mg,60mldmso,氮气鼓泡30min,将体系彻底脱氧后升温至140℃,反应18h。反应结束后,将体系降温至室温,加入20ml自来水,分液,水相用30ml乙酸乙酯萃取一次,合并有机相加入无水硫酸钠干燥,干燥后有机相浓缩,柱层析,洗脱剂ea:pe=1:3,洗脱液浓缩。得白色固体220mg。质谱分子离子峰:814。化合物性能检测将上述制备的h1~h5化合物溶解在methf中,常温测量光致发光光谱,得到第一单重态能级s1能级,在低温77k测量光致发光光谱,得到第一三重态能级t1能级。将h1~h5化合物在氮气条件下以10k/min速度升温,得到玻璃化温度tg。结果见下表1:表1化合物的光学和热力学数据化合物名称s1(ev)t1(ev)tg(℃)h13.592.74131.3h23.652.97120.3h33.582.98157.8h43.653.03152.3h53.642.99106.3从上表1可以看到,本发明化合物的玻璃化温度较高。且h2~h5化合物的三重态能级均高于2.8ev,可以作为深蓝光的主体材料;而化合物h1可以作为绿光主体材料。有机发光二极管器件本发明的具体实施方式还提供一种有机发光二极管器件,该有机发光二极管器件包含上述实施例中制备的烷基取代的化合物。在本发明所提供的一些具体实施例中,本发明的烷基取代的化合物为有机发光二极管器件中的空穴传输材料、主体材料或客体材料。优选作为主体材料使用。有机发光二极管器件制备例本发明所涉及器件的制作,采用业内常规的制备方法,可选择如下方式进行:首先选择合适的阳极,用于引入空穴,阳极表面可以蒸镀其他材料改变阳极的功函数;再蒸镀有机层,然后继续蒸镀阴极,起到引入电子的作用。所述有机层可以是一层,也可以是多层。进一步的,有机层包括空穴传输层、发光层和电子传输层。所述空穴传输层还可以具有空穴注入功能、电子阻挡功能或激子阻挡功能;所述电子传输层还可以具有电子注入功能、空穴阻挡功能或激子阻挡功能;所述发光层可以为掺杂结构。所述发光层为掺杂结构时,将重量百分比高的称为主体材料,将重量百分比低的称为客体材料。主体材料可以只有一种,也可以为多种。当采用掺杂结构时,客体材料的掺杂比例为0.1~49.9%,优选0.5~20%。举例但不限定的,采用本发明材料作为主体材料的器件,可以按照如下方式制备:将清洗好的ito玻璃基板置于真空腔内,抽真空至10-5pa,蒸镀一层10nm的2,3,6,7,10,11-六氰基-1,4,5,8,9,12-六氮杂苯并菲(hat-cn),继续蒸镀一层20nm的4,4’-环己基二[n,n-二(4-甲基苯基)苯胺](tapc),继续蒸镀一层10nm的9,9-(1,3-苯基)二咔唑(mcp);继续共蒸镀一层30nm的二[2-(5-氰基-4,6-二氟苯基)吡啶-c2,n)]吡啶甲酰合铱(fcnirpic)和本发明化合物的发光层,掺杂浓度为8wt%;继续蒸镀一层50nm的tmpypb作为电子传输层;继续蒸镀一层1nm的氟化锂,继续蒸镀一层100nm的铝电极。上述制备的测量器件的外量子效率(eqe),数据见下表2:表2器件的外量子效率数据eqeh29.9h310.1h410.4h59.9从表2中的数据可以看到,本发明实施例中所制备的化合物的发光效率较高。本领域内的技术人员可以理解,当上述实施例中的fcnirpic替换为其他绿光材料,如irppy3时,也可以采用本发明实施例中所制备的化合物h1与其进行掺杂。在真空腔中的ito玻璃上,蒸镀一层50nm厚的薄膜(本发明实施例中制备的h1~h7化合物,并以化合物c1~c3作为对照化合物),然后通过原子力显微镜测量其均方根粗糙度(rrms)。均方根粗糙度(rrms)数据见下表3:表3均方根粗糙度数据化合物rrms化合物rrmsh11.28h61.73h21.34h71.67h31.35c15.52h41.26c28.10h51.41c34.91从表3的数据可以看出,本发明化合物h1~h7的成膜性明显优于对照化合物c1~c3。本领域的普通技术人员可以理解,上述各实施方式是实现本发明的具体实施例,而在实际应用中,可以在形式上和细节上对其作各种改变,而不偏离本发明的精神和范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1