四氢异喹啉并1,2,4-三唑类衍生物及其制备方法与流程
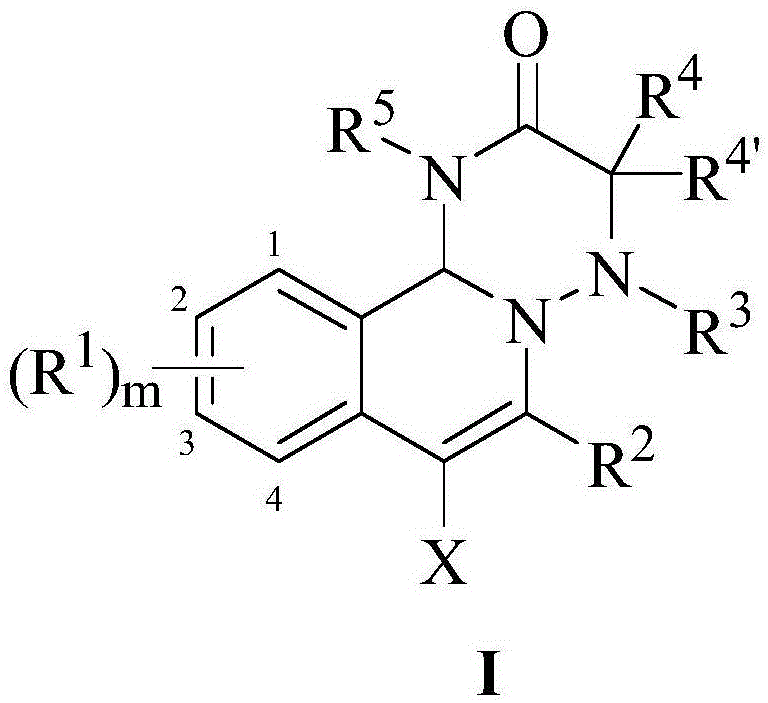
本发明涉及化学合成技术领域,具体地涉及一种四氢异喹啉并1,2,4-三唑类衍生物,以及在无过渡金属催化剂存在的情况下合成四氢异喹啉并1,2,4-三唑类衍生物的方法。
背景技术:
四氢异喹啉并1,2,4-三唑类衍生物是一类十分重要的杂环类化合物,其同时含有的两种杂环骨架-四氢异喹啉和1,2,4-三氮唑,广泛存在于多种天然产物和具有重要生物活性的药物分子之中,其广泛的生物活性引起了越来越多化学工作者的兴趣。
目前报道的关于四氢异喹啉并1,2,4-三唑类化合物的合成主要有以下三种:(1)过渡金属铜催化的2-炔基苯甲醛与吡咯-2-甲酰胺类化合物的偶联-环化反应;(2)过渡金属铑催化的烯基氮杂环丙烷与甲亚胺亚胺的环加成反应;(3)过渡金属银催化的α-卤代酰胺与甲亚胺亚胺的[3+3]环加成反应。上面这些方法虽然各有其特点和优势,但是上述三种合成手段都需要使用昂贵的过渡金属催化剂,并且均需要在高温下才能促进反应的进行,具有很大的局限性。因此发展更加高效,绿色、低成本的合成四氢异喹啉并1,2,4-三唑类化合物的方法具有十分重要的意义。
技术实现要素:
本发明目的是研究在无过渡金属的条件下,用碘或者溴促进甲亚胺与α-卤代酰胺的[3+3]环发生加成反应,高效、高选择性地合成四氢异喹啉并1,2,4-三唑类化合物的新方法。
本发明提供了四氢异喹啉并1,2,4-三唑类衍生物,其具有通式ⅰ所示的结构:
其中,
r1选自卤素;硝基;羟基;烷氧基;芳氧基;烷氨基;芳氨基;酰胺基;烷氧基羰基氨基;烷基;环烷基;卤代烷基;芳基取代的烷基;巯基;烷硫基;氰基;异氰基;芳基;杂芳基;烷基取代的芳基;芳基取代的芳基;醛基;羰基;酯基;烷氧基羰基;芳氧基羰基;氨基甲酰基;磺酰基;其中,m表示取代基r1的数目,m选自0、1、2、3或4,当m为2、3、4时,各个取代基r1之间可以相同或不同(例如,当m为2时,苯环上连接有两个r1取代基,其中一个取代基r1为2-甲氧基,另一个取代基r1为3-氟取代基);
r2选自取代或未取代的c1-c20烷基、取代或未取代的c3-c20环烷基;取代或未取代的c6-c20芳基、取代或未取代的c4-c20杂芳基;
r3选自叔丁氧羰基或取代或未取代的苯磺酰基;
r4和r4’各自独立地选自c1-c10烷基、取代或未取代的c1-c10环烷基,或r4和r4’形成c1-c10亚烷基;
r5选自c1-c10烷氧基、取未或未取代的芳烷氧基;
x选自cl、br或i。
优选地,在本发明所述的四氢异喹啉并1,2,4-三唑类衍生物中,r1选自卤素、c1-c10烷基、c1-c10烷氧基;更优选地,m=1且r1选自3-氟或2-甲氧基。
优选地,在本发明所述的四氢异喹啉并1,2,4-三唑类衍生物中,r2选自苯基、甲基、乙基、丙基、正丁基、环丙基、环丁基、环戊基或环己基。
优选地,在本发明所述的四氢异喹啉并1,2,4-三唑类衍生物中,r3选自4-甲基苯磺酰基、4-甲氧基苯磺酰基、4-氯苯磺酰基、4-溴苯磺酰基、4-氰基苯磺酰基、4-硝基苯磺酰基、2,4,6-三甲基苯磺酰基、2-萘磺酰基、噻吩-2-磺酰基或叔丁氧羰基。
优选地,在本发明所述的四氢异喹啉并1,2,4-三唑类衍生物中,r4选自甲基、乙基、丙基、丁基、戊基、己基、异丙基、异丁基、环丙基。r4与r4’可以是不同的基团,并且r4与r4’之间还可以与其连接的碳原子形成环。
优选地,在本发明所述的四氢异喹啉并1,2,4-三唑类衍生物中,r5选自苄氧基、甲氧基、乙氧基、丙氧基、丁氧基、叔丁氧基、戊氧基、异戊氧基。
本发明还提供了一种制备式i所示四氢异喹啉并1,2,4-三唑类衍生物的方法,所述方法包括以下步骤:
(1)将式ii所示的α-炔基腙化合物和x2加到有机溶剂中,溶解得到溶液a;其中,x选自cl、br或i;
(2)将式iii所示的α-卤代酰胺化合物和碱性试剂混合,得到碱性混合体系b;其中,y选自cl或br;
(3)将碱性混合体系b加到溶液a中,反应结束后经分离纯化即得。
优选地,在本发明所述方法的步骤(1)中,所述有机溶剂选自乙腈、二氯甲烷、1,2-二氯乙烷、或其组合;更优选地,所述有机溶剂为乙腈。
优选地,在本发明所述方法的步骤(2)中,所述碱性试剂选自碳酸钠、碳酸氢钠、碳酸钾、碳酸氢钾、或其组合;更优选地,所述碱性试剂为碳酸钾。
优选地,在本发明所述方法的步骤(1)中,以α-炔基腙化合物计,x2(碘或溴)的加入量为1.5-2.5摩尔当量。
优选地,在本发明所述的方法的步骤(2)中,以α-炔基腙化合物计,α-卤代酰胺化合物的加入量为1.2-2.0摩尔当量。
优选地,在本发明所述方法的步骤(2)中,以α-炔基腙化合物计,碱性试剂的加入量为3.0-5.0摩尔当量。
从化学式i的结构和实际的实验操作可知,在本发明的方法中,取代基r1对反应的影响很小,只要r1不容易与反应原料(例如x2,即氯气、溴素或碘)反应,都可以作为式i中苯环上的取代基。根据可取代的位置,取代基的数量可以是0、1、2、3、4个。
在本发明的方法中,在本发明化合物所限定的r4与r4’的基团范围,r4与r4’具体选择的基团对反应影响不大。但是从原料的易得性的角度,r4与r4’优选均为甲基。
另外,在本发明的方法中,r3与r5对反应的进行产生至关重要的影响。r3主要选自取代或未取代的苯磺酰基或叔丁氧羰基,r5主要选自取未或未取代的芳基甲氧基、c1-c6烷氧基。r3和r5选用其他很多类型的取代基容易导致式ii化合物与式iii化合物不发生反应或收率很低或副产物多。
在本发明所述方法中,对各个步骤的反应的温度没有特别的限制,但从反应速率、反应时间、能耗和操作简便性的角度考虑,反应温度以10-50℃为宜。优选地,各步反应在室温下进行。
在本发明所述方法的步骤(3)中,分离纯化的方法包括柱层析和重结晶,具体的分离纯化方法可以根据具体情况进行选择。在使用柱层析情形下,可以使用体积比为15∶1-10∶1的石油醚∶乙酸乙酯洗脱溶剂进行洗脱。
本发明的合成方法不需要使用昂贵的过渡金属催化剂,并且可以在较低的温度下反应,具有环保、低成本的优势。
附图说明
图1是本发明的四氢异喹啉并1,2,4-三唑类衍生物的化学通式
图2是本发明实施例1中的示例性化合物i-1的1hnmr图谱;
图3是本发明实施例1中的示例性化合物i-1的13cnmr核磁图谱;
图4是本发明实施例1中的示例性化合物i-1的质谱。
具体实施方式
下面通过实例来具体说明本发明的ⅰ式中化合物的制备方法。这些实例仅对本发明进行说明,而不对本发明进行限制。
实施例1
化合物i-1的制备
在室温下,原料α-炔基腙ii-1(r1=氢,r2=苯基,r3=4-甲苯磺酰基)(37.4mg,0.10mmol)与2.0当量的碘(50.8mg,0.20mmol)溶于乙腈中,反应混合物继续在室温下反应直到tlc检测ii-1转化完全。随后,将2.0当量的α-卤代酰胺iii-1(r4、r4’=甲基,r5=苄氧基)(54.4mg,0.20mmol)与碳酸钾(55.2mg,0.40mmol)加入反应体系,所得反应混合物继续在室温下反应直到tlc检测反应完全,以以体积比石油醚∶乙酸乙酯=15∶1-10∶1的混合溶剂进行柱层析,得到式i-1目标产物66.3mg,产率为96%。
1hnmr(400mhz,cdcl3)δ(ppm)=7.75–7.50(m,4h),7.48–7.34(m,3h),7.34–7.09(m,8h),6.87–6.74(m,3h),5.73(s,1h),4.86(d,j=9.3hz,1h),4.18(d,j=9.3hz,1h),2.46(s,3h),1.80(s,3h),1.23(s,3h)。化合物i-1的1hnmr图谱见图2。
13cnmr(100mhz,cdcl3)δ(ppm)=168.5,149.2,144.7,138.9,135.8,133.9,133.3,130.8,130.8,130.5,130.4,129.7,129.5,129.4,129.0,128.8,128.4,128.2,128.0,128.0,127.5,123.0,78.6,78.1,74.9,70.9,26.4,25.0,21.6。化合物i-1的13cnmr图谱见图3。
熔点:155–157℃。
ms:计算值:[m+h]+:692.1080,实测值:692.1075。化合物i-1的质谱见图4。
实施例2
化合物i-2的制备
在室温下,原料α-炔基腙ii-2(r1=氢,r2=苯基,r3=4-甲氧苯磺酰基)(78.1mg,0.20mmol)与2.0当量的碘(102.2mg,0.40mmol)溶于乙腈中,反应混合物继续在室温下反应直到tlc检测ii-2转化完全。随后,将2.0当量的α-卤代酰胺iii-1(r4、r4’=甲基,r5=苄氧基)(108.8mg,0.40mmol)与碳酸钾(111.0mg,0.80mmol)加入反应体系,所得反应混合物继续在室温下反应直到tlc检测反应完全,以以体积比石油醚∶乙酸乙酯=15∶1-10∶1的混合溶剂进行柱层析,得到式i-2目标产物132.2mg,产率为94%。
1hnmr(400mhz,cdcl3)δ(ppm)=7.66(d,j=8.9hz,3h),7.56(t,j=7.3hz,1h),7.46–7.35(m,2h),7.33–7.10(m,6h),7.02–6.60(m,6h),5.77(s,1h),4.86(d,j=9.3hz,1h),4.19(d,j=9.3hz,1h),3.89(s,3h),1.82(s,3h),1.24(s,3h)。
13cnmr(100mhz,cdcl3)δ(ppm)=168.5,163.7,149.2,138.9,133.9,133.3,131.5,130.8,130.7,130.5,130.3,130.1,129.7,129.0,128.8,128.5,128.2,128.0,127.9,127.4,123.0,114.0,78.5,78.0,74.9,70.8,55.8,26.3,24.9。
熔点:169–171℃。
ms:计算值:[m+h]+:708.1029,实测值:708.1024.
实施例3
化合物i-3的制备
在室温下,原料α-炔基腙ii-3(r1=氢,r2=苯基,r3=4-氯苯磺酰基)(78.9mg,0.20mmol)与2.0当量的碘(102.2mg,0.40mmol)溶于乙腈中,反应混合物继续在室温下反应直到tlc检测ii-3转化完全。随后,将2.0当量的α-卤代酰胺iii-1(r4、r4’=甲基,r5=苄氧基)(108.8mg,0.40mmol)与碳酸钾(111.0mg,0.80mmol)加入反应体系,所得反应混合物继续在室温下反应直到tlc检测反应完全,以以体积比石油醚∶乙酸乙酯=15∶1-10∶1的混合溶剂进行柱层析,得到式i-3目标产物137.8mg,产率为97%。
1hnmr(400mhz,cdcl3)δ(ppm)=7.67(dd,j=7.8,4.5hz,3h),7.60–7.54(m,1h),7.44–7.37(m,4h),7.35–7.26(m,3h),7.21(t,j=7.3hz,2h),7.13(dd,j=5.1,3.3hz,1h),6.87–6.78(m,3h),5.72(s,1h),4.85(d,j=9.3hz,1h),4.20(d,j=9.3hz,1h),1.81(s,3h),1.26(s,3h)。
13cnmr(100mhz,cdcl3)δ(ppm)=168.2,148.8,140.4,138.7,137.1,133.9,133.2,130.9,130.7,130.7,130.4,129.7,129.2,129.1,128.8,128.3,128.1,128.1,127.7,123.0,79.1,78.1,75.0,71.0,26.4,24.9。
熔点:150–152℃。
ms:计算值:[m+h]+:712.0534,实测值:712.0528.
实施例4
化合物i-4的制备
在室温下,原料α-炔基腙ii-4(r1=氢,r2=苯基,r3=4-溴苯磺酰基)(87.9mg,0.20mmol)与2.0当量的碘(102.2mg,0.40mmol)溶于乙腈中,反应混合物继续在室温下反应直到tlc检测ii-4转化完全。随后,将2.0当量的α-卤代酰胺iii-1(r4、r4’=甲基,r5=苄氧基)(108.8mg,0.40mmol)与碳酸钾(111.0mg,0.80mmol)加入反应体系,所得反应混合物继续在室温下反应直到tlc检测反应完全,以以体积比石油醚∶乙酸乙酯=15∶1-10∶1的混合溶剂进行柱层析,得到式i-4目标产物138.6mg,产率为92%。
1hnmr(400mhz,cdcl3)δ(ppm)=7.67(d,j=7.1hz,1h),7.63–7.53(m,5h),7.45–7.37(m,2h),7.36–7.26(m,3h),7.21(dd,j=7.9,6.6hz,2h),7.16–7.10(m,1h),6.86–6.80(m,3h),5.72(s,1h),4.85(d,j=9.3hz,1h),4.21(d,j=9.3hz,1h),1.81(s,3h),1.26(s,3h)。
13cnmr(100mhz,cdcl3)δ(ppm)=168.2,148.8,138.7,137.7,133.9,133.3,132.2,131.0,130.8,130.7,130.4,129.7,129.2,129.0,128.8,128.3,128.1,128.1,127.7,123.0,79.1,78.1,75.1,71.1,26.4,24.9。
熔点:157–159℃。
ms:计算值:[m+h]+:756.0024,实测值:756.0029.
实施例5
化合物i-5的制备
在50℃条件下,原料α-炔基腙ii-5(r1=氢,r2=苯基,r3=4-氰基苯磺酰基)(77.1mg,0.20mmol)与2.0当量的碘(102.2mg,0.40mmol)溶于乙腈中,反应混合物继续在50℃下反应直到tlc检测ii-5转化完全。随后,将2.0当量的α-卤代酰胺iii-1(r4、r4’=甲基,r5=苄氧基)(108.8mg,0.40mmol)与碳酸钾(111.0mg,0.80mmol)加入反应体系,所得反应混合物继续在50℃下反应直到tlc检测反应完全,以以体积比石油醚∶乙酸乙酯=15∶1-10∶1的混合溶剂进行柱层析,得到式i-5目标产物118.2mg,产率为84%。
1hnmr(400mhz,cdcl3)δ(ppm)=7.87(d,j=8.4hz,2h),7.73(d,j=8.6hz,2h),7.68(d,j=7.4hz,1h),7.59(td,j=7.8,1.2hz,1h),7.45–7.27(m,6h),7.21(t,j=7.3hz,2h),7.17–7.10(m,1h),6.85–6.76(m,3h),5.63(s,1h),4.85(d,j=9.3hz,1h),4.20(d,j=9.3hz,1h),1.79(s,3h),1.27(s,3h)。
13cnmr(100mhz,cdcl3)δ(ppm)=167.9,148.4,142.6,138.4,133.7,133.1,132.6,131.1,130.8,130.6,130.5,129.9,129.7,129.3,128.9,128.3,128.3,128.1,128.1,127.9,122.9,117.2,116.9,79.6,78.1,75.1,71.2,26.4,24.9。
熔点:138–140℃。
ms:计算值:[m+h]+:703.0876,实测值:703.0871.
实施例6
化合物i-6的制备
在50℃条件下,原料α-炔基腙ii-6(r1=氢,r2=苯基,r3=4-硝基苯磺酰基)(81.0mg,0.20mmol)与2.0当量的碘(102.2mg,0.40mmol)溶于乙腈中,反应混合物继续在50℃下反应直到tlc检测ii-6转化完全。随后,将2.0当量的α-卤代酰胺iii-1(r4、r4’=甲基,r5=苄氧基)(108.8mg,0.40mmol)与碳酸钠(75.4mg,0.80mmol)加入反应体系,所得反应混合物继续在50℃下反应直到tlc检测反应完全,以以体积比石油醚∶乙酸乙酯=15∶1-10∶1的混合溶剂进行柱层析,得到式i-6目标产物108.1mg,产率为75%。
1hnmr(400mhz,cdcl3)δ(ppm)=8.26(d,j=8.9hz,2h),7.94(d,j=8.8hz,2h),7.69(d,j=7.5hz,1h),7.60(t,j=8.3hz,1h),7.49–7.24(m,6h),7.20(t,j=7.3hz,2h),7.14(d,j=6.7hz,1h),6.85–6.78(m,3h),5.67(s,1h),4.84(d,j=9.3hz,1h),4.21(d,j=9.3hz,1h),1.80(s,3h),1.29(s,3h)。
13cnmr(100mhz,cdcl3)δ(ppm)=167.9,150.5,148.4,144.2,138.4,133.8,133.1,131.1,130.9,130.6,130.5,129.7,129.4,128.9,128.3,128.3,128.1,128.1,128.0,124.0,122.9,79.8,78.2,75.2,71.3,26.4,24.9。
熔点:157–159℃。
ms:计算值:[m+h]+:723.0774,实测值:723.0769.
实施例7
化合物i-7的制备
在50℃条件下,原料α-炔基腙ii-7(r1=氢,r2=苯基,r3=2,4,6-三甲基苯磺酰基)(80.5mg,0.20mmol)与2.0当量的碘(102.2mg,0.40mmol)溶于乙腈中,反应混合物继续在50℃下反应直到tlc检测ii-7转化完全。随后,将2.0当量的α-卤代酰胺iii-1(r4、r4’=甲基,r5=苄氧基)(108.8mg,0.40mmol)与碳酸钾(111.0mg,0.80mmol)加入反应体系,所得反应混合物继续在50℃下反应直到tlc检测反应完全,以以体积比石油醚∶乙酸乙酯=15∶1-10∶1的混合溶剂进行柱层析,得到式i-7目标产物96.6mg,产率为67%。
1hnmr(400mhz,cdcl3)δ(ppm)=7.59–7.47(m,2h),7.40–7.24(m,5h),7.06(d,j=7.3hz,2h),6.94–6.81(m,5h),6.75(s,1h),5.21(d,j=7.6hz,1h),4.87(d,j=9.7hz,1h),4.33(d,j=9.7hz,1h),2.33(s,3h),2.23(s,3h),2.16(s,3h),1.79(s,3h),1.66(s,3h)。
13cnmr(100mhz,cdcl3)δ(ppm)=168.8,148.0,143.7,143.0,142.5,138.7,134.2,133.4,132.4,132.0,131.7,130.6,130.2,130.2,129.8,129.4,128.9,128.8,128.6,128.3,128.1,127.8,127.7,123.2,78.5,78.0,75.1,71.3,27.3,24.4,22.7,22.4,21.2。
熔点:187–189℃。
ms:计算值:[m+h]+:720.1393,实测值:720.1388.
实施例8
化合物i-8的制备
在50℃条件下,原料α-炔基腙ii-8(r1=氢,r2=苯基,r3=2-萘苯磺酰基)(82.1mg,0.20mmol)与2.0当量的碘(102.2mg,0.40mmol)溶于乙腈中,反应混合物继续在50℃下反应直到tlc检测ii-8转化完全。随后,将2.0当量的α-卤代酰胺iii-1(r4、r4’=甲基,r5=苄氧基)(108.8mg,0.40mmol)与碳酸钾(111.0mg,0.80mmol)加入反应体系,所得反应混合物继续在50℃下反应直到tlc检测反应完全,以以体积比石油醚∶乙酸乙酯=15∶1-10∶1的混合溶剂进行柱层析,得到式i-8目标产物116.9mg,产率为80%。
1hnmr(400mhz,cdcl3)δ(ppm)=8.30(s,1h),7.93(d,j=8.1hz,1h),7.86(d,j=8.6hz,1h),7.81–7.65(m,4h),7.65–7.53(m,2h),7.44–7.33(m,2h),7.22(dd,j=15.5,8.5hz,2h),7.15(t,j=6.7hz,4h),6.79(d,j=7.4hz,2h),6.61(d,j=7.5hz,1h),5.69(s,1h),4.82(d,j=9.3hz,1h),4.17(d,j=9.3hz,1h),1.82(s,3h),1.29(s,3h)。
13cnmr(100mhz,cdcl3)δ(ppm)=168.4,149.1,138.8,135.6,135.1,133.9,133.4,132.0,130.9,130.6,130.4,129.7,129.5,129.5,129.1,128.9,128.8,128.5,128.2,128.1,127.9,127.7,127.5,124.2,123.0,78.7,78.1,75.0,71.1,26.5,25.1。
熔点:124–127℃。
ms:计算值:[m+h]+:728.1080,实测值:728.1075.
实施例9
化合物i-9的制备
在50℃条件下,原料α-炔基腙ii-9(r1=氢,r2=苯基,r3=噻吩-2-磺酰基)(73.3mg,0.20mmol)与2.0当量的碘(102.2mg,0.40mmol)溶于乙腈中,反应混合物继续在50℃下反应直到tlc检测ii-9转化完全。随后,将2.0当量的α-卤代酰胺iii-1(r4、r4’=甲基,r5=苄氧基)(108.8mg,0.40mmol)与碳酸钾(111.0mg,0.80mmol)加入反应体系,所得反应混合物继续在50℃下反应直到tlc检测反应完全,以以体积比石油醚∶乙酸乙酯=15∶1-10∶1的混合溶剂进行柱层析,得到式i-9目标产物41.8mg,产率为31%。
1hnmr(400mhz,cdcl3)δ(ppm)=7.71–7.65(m,2h),7.60–7.54(m,2h),7.46–7.35(m,3h),7.31–7.26(m,2h),7.23–7.14(m,3h),7.12–6.99(m,2h),6.87–6.80(m,3h),5.71(s,1h),4.89(d,j=9.1hz,1h),4.18(d,j=9.2hz,1h),1.85(s,3h),1.22(s,3h)。
13cnmr(100mhz,cdcl3)δ(ppm)=168.2,149.2,139.1,138.9,134.7,134.0,133.8,133.3,130.9,130.8,130.6,130.5,129.7,129.2,128.8,128.4,128.3,128.1,128.1,127.6,127.3,123.2,79.2,78.2,75.0,71.3,25.9,25.0。
熔点:155–157℃。
ms:计算值:[m+h]+:684.0488,实测值:684.0482.
实施例10
化合物i-10的制备
在50℃条件下,原料α-炔基腙ii-10(r1=氢,r2=苯基,r3=叔丁氧羰基)(64.0mg,0.20mmol)与2.0当量的碘(102.2mg,0.40mmol)溶于乙腈中,反应混合物继续在50℃下反应直到tlc检测ii-10转化完全。随后,将2.0当量的α-卤代酰胺iii-1(r4、r4’=甲基,r5=苄氧基)(108.8mg,0.40mmol)与碳酸钾(111.0mg,0.80mmol)加入反应体系,所得反应混合物继续在50℃下反应直到tlc检测反应完全,以以体积比石油醚∶乙酸乙酯=15∶1-10∶1的混合溶剂进行柱层析,得到式i-10目标产物30.1mg,产率为24%。
1hnmr(400mhz,cdcl3)δ(ppm)=7.65(d,j=7.6hz,1h),7.53(td,j=7.8,1.2hz,1h),7.46–7.20(m,9h),7.14(d,j=7.3hz,1h),6.93–6.87(m,2h),6.16(s,1h),4.91(d,j=9.0hz,1h),4.05(d,j=9.0hz,1h),1.70(s,3h),1.43(s,9h),1.09(s,3h)。
13cnmr(100mhz,cdcl3)δ(ppm)=168.8,153.1,149.1,138.9,133.9,133.1,131.1,130.7,130.1,129.9,129.2,129.2,128.8,128.4,128.2,128.1,127.9,126.8,122.4,82.4,78.2,75.4,75.0,67.7,28.3,27.4,21.9。
熔点:178–180℃
ms:计算值:[m+h]+:638.1516,实测值:638.1510.
实施例11
化合物i-11的制备
在50℃条件下,原料α-炔基腙ii-11(r1=3-氟,r2=苯基,r3=4-甲基苯磺酰基)(78.5mg,0.20mmol)与2.0当量的碘(102.2mg,0.40mmol)溶于二氯甲烷中,反应混合物继续在室温下反应直到tlc检测ii-11转化完全。随后,将2.0当量的α-卤代酰胺iii-1(r4、r4’=甲基,r5=苄氧基)(108.8mg,0.40mmol)与碳酸钾(111.0mg,0.80mmol)加入反应体系,所得反应混合物继续在50℃下反应直到tlc检测反应完全,以以体积比石油醚∶乙酸乙酯=15∶1-10∶1的混合溶剂进行柱层析,得到式i-11目标产物63.3mg,产率为45%。
1hnmr(400mhz,cdcl3)δ(ppm)=7.60(d,j=8.2hz,2h),7.42–7.35(m,3h),7.30–7.17(m,6h),7.11(d,j=6.8hz,1h),6.98–6.87(m,3h),6.84–6.52(m,2h),5.75(s,1h),4.85(d,j=9.6hz,1h),4.24(d,j=9.6hz,1h),2.46(s,3h),1.81(s,3h),1.24(s,3h)。
13cnmr(100mhz,cdcl3)δ(ppm)=168.6,164.0(d,j=249.7),150.2,144.8,138.6,135.9,135.8,135.6,134.0,130.5,130.3(d,j=9.1),130.1,129.7,129.5,129.3,129.3,129.1,128.8,128.3,128.0,128.0,118.9(d,j=3.0),117.6(d,j=25.3),114.2(d,j=22.5),78.1,77.3,77.0,76.7,74.4,70.9,26.3,25.0,21.6。
熔点:148–150℃。
ms:计算值:[m+h]+:710.0986,实测值:710.0980.
实施例12
化合物i-12的制备
在50℃条件下,原料α-炔基腙ii-12(r1=2-甲氧基,r2=苯基,r3=4-甲基苯磺酰基)(80.8mg,0.20mmol)与2.0当量的碘(102.2mg,0.40mmol)溶于二氯乙烷中,反应混合物继续在50℃下反应直到tlc检测ii-12转化完全。随后,将2.0当量的α-卤代酰胺iii-1(r4、r4’=甲基,r5=苄氧基)(108.8mg,0.40mmol)与碳酸钾(111.0mg,0.80mmol)加入反应体系,所得反应混合物继续在50℃下反应直到tlc检测反应完全,以以体积比石油醚∶乙酸乙酯=15∶1-10∶1的混合溶剂进行柱层析,得到式i-12目标产物105.6mg,产率为73%。
1hnmr(400mhz,cdcl3)δ(ppm)=7.64(d,j=8.1hz,2h),7.58(d,j=8.7hz,1h),7.45–7.33(m,4h),7.26–7.19(m,5h),7.15–7.04(m,2h),6.87(d,j=7.0hz,2h),6.43(s,1h),5.69(s,1h),4.91(d,j=9.1hz,1h),4.21(d,j=9.3hz,1h),3.83(s,3h),2.46(s,3h),1.80(s,3h),1.21(s,3h)。
13cnmr(100mhz,cdcl3)δ(ppm)=168.6,159.0,144.6,138.9,135.8,134.0,132.0,130.7,129.6,129.5,129.4,128.9,128.7,128.5,128.2,127.9,126.5,124.2,116.2,113.7,78.2,78.1,75.2,70.9,55.7,26.4,24.9,23.2。
熔点:154–156℃。
ms:计算值:[m+h]+:722.1186,实测值:722.1180.
实施例13
化合物i-13的制备
在50℃条件下,原料α-炔基腙ii-13(r1=氢,r2=正丁基,r3=4-甲基苯磺酰基)(71.0mg,0.20mmol)与2.0当量的碘(102.2mg,0.40mmol)溶于乙腈中,反应混合物继续在50℃下反应直到tlc检测ii-13转化完全。随后,将2.0当量的α-卤代酰胺iii-1(r4、r4’=甲基,r5=苄氧基)(108.8mg,0.40mmol)与碳酸钾(111.0mg,0.80mmol)加入反应体系,所得反应混合物继续在50℃下反应直到tlc检测反应完全,以以体积比石油醚∶乙酸乙酯=15∶1-10∶1的混合溶剂进行柱层析,得到式i-13目标产物96.4mg,产率为72%。
1hnmr(400mhz,cdcl3)δ(ppm)=7.67(d,j=8.3hz,2h),7.58(d,j=7.2hz,1h),7.51(t,j=8.2hz,1h),7.24–7.08(m,7h),6.75(t,j=6.9hz,3h),5.55(s,1h),4.68(d,j=9.0hz,1h),3.86(d,j=8.9hz,1h),2.76–2.58(m,2h),2.41(s,3h),1.95(s,3h),1.90(s,3h),1.74–1.66(m,1h),1.47–1.37(m,3h),0.96(t,j=7.0hz,3h)。
13cnmr(100mhz,cdcl3)δ(ppm)=167.7,148.5,144.8,135.3,133.7,133.4,130.7,129.6,129.6,129.5,129.2,128.8,128.6,128.5,128.1,126.4,121.5,78.1,74.2,70.7,34.7,28.9,26.3,25.9,22.8,21.6,13.5。
熔点:171–173℃。
ms:计算值:[m+h]+:672.1393,实测值:672.1388.
实施例14
化合物i-14的制备
在50℃条件下,原料α-炔基腙ii-14(r1=氢,r2=环丙基,r3=4-甲基苯磺酰基)(68.0mg,0.20mmol)与2.0当量的碘(102.2mg,0.40mmol)溶于乙腈中,反应混合物继续在50℃下反应直到tlc检测ii-14转化完全。随后,将2.0当量的α-卤代酰胺iii-1(r4、r4’=甲基,r5=苄氧基)(108.8mg,0.40mmol)与碳酸钾(111.0mg,0.80mmol)加入反应体系,所得反应混合物继续在50℃下反应直到tlc检测反应完全,以以体积比石油醚∶乙酸乙酯=15∶1-10∶1的混合溶剂进行柱层析,得到式i-14目标产物86.4mg,产率为66%。
1hnmr(400mhz,cdcl3)δ(ppm)=7.68(d,j=8.3hz,3h),7.52(t,j=7.7hz,1h),7.25–7.10(m,6h),6.74(d,j=7.0hz,2h),6.67(d,j=7.3hz,1h),5.46(s,1h),4.70(d,j=9.2hz,1h),3.98(d,j=9.2hz,1h),2.43(s,3h),2.01(s,3h),1.86(s,3h),1.58–1.47(m,1h),1.46–1.35(m,1h),1.20–1.05(m,2h),0.83–0.70(m,1h)。
13cnmr(100mhz,cdcl3)δ(ppm)=168.5,147.0,144.7,136.2,134.4,133.9,130.6,130.0,129.6,129.5,129.0,128.7,128.1,127.9,126.9,122.5,78.2,78.1,74.9,71.2,26.6,26.3,21.6,18.9,13.3,12.6。
熔点:151–153℃
ms:计算值:[m+h]+:656.1080,实测值:656.1074.
实施例15
化合物i-15的制备
在50℃条件下,原料α-炔基腙ii-15(r1=氢,r2=环己基,r3=4-甲基苯磺酰基)(76.0mg,0.20mmol)与2.0当量的碘(102.2mg,0.40mmol)溶于乙腈中,反应混合物继续在50℃下反应直到tlc检测ii-15转化完全。随后,将2.0当量的α-卤代酰胺iii-1(r4、r4’=甲基,r5=苄氧基)(108.8mg,0.40mmol)与碳酸钾(111.0mg,0.80mmol)加入反应体系,所得反应混合物继续在50℃下反应直到tlc检测反应完全,以以体积比石油醚∶乙酸乙酯=15∶1-10∶1的混合溶剂进行柱层析,得到式i-15目标产物105.8mg,产率为76%。
1hnmr(400mhz,cdcl3)δ(ppm)=7.76(d,j=7.9hz,1h),7.64(d,j=8.3hz,2h),7.52(td,j=8.0,1.3hz,1h),7.24–7.11(m,6h),6.79–6.68(m,3h),5.63(s,1h),4.72(d,j=9.1hz,1h),3.96(d,j=9.1hz,1h),2.94(t,j=12.5hz,1h),2.58(q,j=12.7hz,1h),2.52–2.41(m,1h),2.39(s,3h),1.96(s,3h),1.94(s,3h),1.88(d,j=16.2hz,1h),1.74–1.65(m,2h),1.49–1.42(m,1h),1.35–1.19(m,3h),0.91–0.82(m,1h)。
13cnmr(100mhz,cdcl3)δ(ppm)=167.5,150.0,144.7,135.1,134.3,133.8,130.4,129.8,129.6,129.5,128.9,128.6,128.1,128.0,126.8,121.8,78.0,74.6,72.2,70.8,38.7,27.8,27.0,26.8,26.6,25.9,25.5,25.4,21.5。
熔点:152–154℃。
ms:计算值:[m+h]+:698.1549,实测值:698.1544.
实施例16
化合物i-16的制备
在室温条件下,原料α-炔基腙ii-1(r1=氢,r2=苯基,r3=4-甲基苯磺酰基)(75.0mg,0.20mmol)与2.0当量的碘(102.2mg,0.40mmol)溶于乙腈中,反应混合物继续在50℃下反应直到tlc检测ii-1转化完全。随后,将2.0当量的α-卤代酰胺iii-2(r4、r4’=甲基,r5=乙氧基)(84.0mg,0.40mmol)与碳酸钾(111.0mg,0.80mmol)加入反应体系,所得反应混合物继续在室温下反应直到tlc检测反应完全,以以体积比石油醚∶乙酸乙酯=15∶1-10∶1的混合溶剂进行柱层析,得到式i-16目标产物107.5mg,产率为85%。
1hnmr(400mhz,cdcl3)δ(ppm)=7.63(d,j=8.5hz,3h),7.53(td,j=7.7,1.2hz,1h),7.42–7.27(m,4h),7.23(d,j=8.0hz,2h),7.13–7.07(m,1h),7.04(d,j=7.4hz,1h),6.83(s,1h),5.76(s,1h),3.87–3.73(m,1h),3.33(p,j=7.2hz,1h),2.47(s,3h),1.78(s,3h),1.22(s,3h),0.78(t,j=7.1hz,3h)。
13cnmr(100mhz,cdcl3)δ(ppm)=168.6,149.1,144.7,138.9,135.9,133.2,130.8,130.7,130.5,130.3,129.5,129.3,129.0,128.0,128.0,127.3,123.1,78.5,74.7,72.1,70.8,26.3,25.0,21.7,13.0。
熔点:171–173℃。
ms:计算值:[m+h]+:630.0923,实测值:630.0918.
实施例17
化合物i-17的制备
在室温条件下,原料α-炔基腙ii-1(r1=氢,r2=苯基,r3=4-甲基苯磺酰基)(75.0mg,0.20mmol)与2.0当量的碘(102.2mg,0.40mmol)溶于乙腈中,反应混合物继续在50℃下反应直到tlc检测ii-1转化完全。随后,将2.0当量的α-卤代酰胺iii-3(r4、r4’=甲基,r5=叔丁氧基)(95.2mg,0.40mmol)与碳酸钾(111.0mg,0.80mmol)加入反应体系,所得反应混合物继续在室温下反应直到tlc检测反应完全,以以体积比石油醚∶乙酸乙酯=15∶1-10∶1的混合溶剂进行柱层析,得到式i-17目标产物123.6mg,产率为94%。
1hnmr(400mhz,cdcl3)δ(ppm)=7.66–7.56(m,3h),7.50(td,j=7.8,1.2hz,1h),7.43–7.29(m,3h),7.26–7.12(m,4h),7.02(d,j=7.3hz,1h),5.90(s,1h),2.47(s,3h),1.85(s,3h),1.24(s,3h),0.92(s,9h)。
13cnmr(100mhz,cdcl3)δ(ppm)=173.4,148.2,144.6,138.7,135.8,134.1,131.0,130.4,130.2,129.5,129.5,128.9,128.8,127.8,126.8,123.8,84.5,79.5,77.2,71.2,27.5,26.4,25.2,21.7。
熔点:172–174℃。
ms:计算值:[m+h]+:658.1236,实测值:658.1231.
实施例18
化合物i-18的制备
在室温条件下,原料α-炔基腙ii-1(r1=氢,r2=苯基,r3=4-甲基苯磺酰基)(75.0mg,0.20mmol)与2.0当量的碘(102.2mg,0.40mmol)溶于乙腈中,反应混合物继续在50℃下反应直到tlc检测ii-1转化完全。随后,将2.0当量的α-卤代酰胺iii-4(r4、r4’=环己基,r5=苄氧基)(125.3mg,0.40mmol)与碳酸钾(111.0mg,0.80mmol)加入反应体系,所得反应混合物继续在室温下反应直到tlc检测反应完全,以以体积比石油醚∶乙酸乙酯=15∶1-10∶1的混合溶剂进行柱层析,得到式i-18目标产物62.9mg,产率为43%。
1hnmr(400mhz,cdcl3)δ(ppm)=7.61(d,j=7.8hz,1h),7.49(t,j=7.7hz,3h),7.43–7.28(m,3h),7.26–7.09(m,7h),6.88(d,j=6.9hz,2h),6.72(d,j=7.2hz,1h),6.33(s,1h),6.10(s,1h),4.70(d,j=10.2hz,1h),4.49(d,j=10.2hz,1h),2.85–2.69(m,1h),2.45(s,3h),2.22–2.01(m,2h),1.89–1.79(m,1h),1.77–1.61(m,3h),1.55–1.24(m,3h)。
13cnmr(100mhz,cdcl3)δ(ppm)=169.7,148.1,144.6,138.7,136.1,134.7,133.6,130.7,130.4,130.3,129.6,129.6,129.4,128.7,128.5,128.2,127.9,127.7,127.6,127.3,123.6,78.7,77.7,75.8,74.8,33.9,33.2,24.4,23.9,23.4,21.6。
熔点:158–160℃。
ms:计算值:[m+h]+:732.1393,实测值:732.1364.
实施例19
化合物i-19的制备
在室温条件下,原料α-炔基腙ii-1(r1=氢,r2=苯基,r3=4-甲基苯磺酰基)(75.0mg,0.20mmol)与2.0当量的溴(64.0mg,0.40mmol)溶于乙腈中,反应混合物继续在50℃下反应直到tlc检测ii-1转化完全。随后,将2.0当量的α-卤代酰胺iii-1(r4、r4’=甲基,r5=苄氧基)(108.8mg,0.40mmol)与碳酸钾(111.0mg,0.80mmol)加入反应体系,所得反应混合物继续在室温下反应直到tlc检测反应完全,以以体积比石油醚∶乙酸乙酯=15∶1-10∶1的混合溶剂进行柱层析,得到式i-19目标产物82.7mg,产率为65%。
1hnmr(400mhz,cdcl3)δ(ppm)=7.71(d,j=7.5hz,1h),7.63(d,j=7.2hz,2h),7.57(t,j=7.2hz,1h),7.45–7.14(m,11h),6.84(t,j=8.7hz,3h),5.74(s,1h),4.90–4.78(m,1h),4.21(d,j=9.0hz,1h),2.45(s,3h),1.80(s,3h),1.21(s,3h)。
13cnmr(100mhz,cdcl3)δ(ppm)=168.5,145.4,144.7,135.8,135.2,133.9,131.7,130.7,130.6,130.5,129.6,129.4,129.3,128.9,128.7,128.3,128.2,127.9,127.9,127.6,125.9,123.2,102.6,78.0,75.0,70.8,26.3,24.9,21.6。
熔点:126–128℃。
ms:计算值:[m+h]+:644.1219,实测值:644.1213.
本申请虽然以较佳实施例公开如上,但并不是用来限定权利要求,任何本领域技术人员在不脱离本申请构思的前提下,都可以做出若干可能的变动和修改,因此本申请的保护范围应当以本申请权利要求所界定的范围为准。
- 还没有人留言评论。精彩留言会获得点赞!