一种耐辐射酿酒酵母菌及其诱导方法与流程
本发明涉及微生物领域,特别涉及一种耐辐射酿酒酵母菌及其诱导方法。
背景技术:
:核能的开发和利用在给人类带了巨大的经济效益和社会效益的同时也产生了大量的放射性废水。放射性废水中主要含有u(铀),i(碘),sr(锶)等高放射性和长半衰期核素,它们通常以离子形式存在,具有很强的迁移能力,可以通过食物链,大气循环等多方式对人类健康和生态环境造成潜在威胁。通常对于放射性废水的处理方式是蒸发—离子交换,然而,使用上述的方法处理一次后的出水很难达到国际允许排放标准(放射性活度小于3.7bq/l)。利用新型的膜分离技术处理放射性废水虽然效率很高,但却要与常用的废水处理相技术相结合,如混凝沉淀,过滤,吸附等,使成本增加,产生泥浆量较大,其处理周期也会加长,并且用于处理低放射性废水时,往往操作费用和原材料成本相对较高。近些年来,随着微生物的发展,利用微生物处理放射性废水中的放射性核素正在日益引起人们的关注。自然界中的微生物种类多,数量大,分布广,是一种极其宝贵,开发能力巨大的自然资源。利用微生物处理重金属废水在国内外已有许多报道,虽然微生物不能对重金属离子进行破坏或者消除,但是它们可以通过自身的结构或者在生长过程中改变重金属的化学或者物理特性影响他们在环境中的迁移,降低对人类健康的威胁。利用微生物作为吸附剂处理放射性废水,富集水溶液中的铀等放射性核素效率高,成本低,耗能少,没而且有二次污染。微生物处理放射性核素在国内外都有研究,但是大多都是考虑培养后的静态吸附以及低放水平中的吸附效果,且研究核素大多集中在u(铀),cs(铯)等常见元素。sr离子作为反应堆裂变产物之一,具有很强的毒性和半衰期,利用微生物富集处理sr元素的研究鲜有报道。利用微生物修复放射性的污染环境必须考虑到以下两个方面:第一,必须是强耐辐射的微生物;第二,微生物修复环境时不能威胁到公共安全,也不能产生二次污染。由于大多数的细菌对放射性比较敏感,因此它们修复放射性污染环境的能力会受到较大的限制。因此,需要从自然环境中去分离具有辐射抗性的微生物,或者通过基因工程技术来改造一些微生物使之获得辐射抗性。目前尚无有关酿酒酵母菌及其在放射性核素吸附中应用的报导。技术实现要素:针对上述
背景技术:
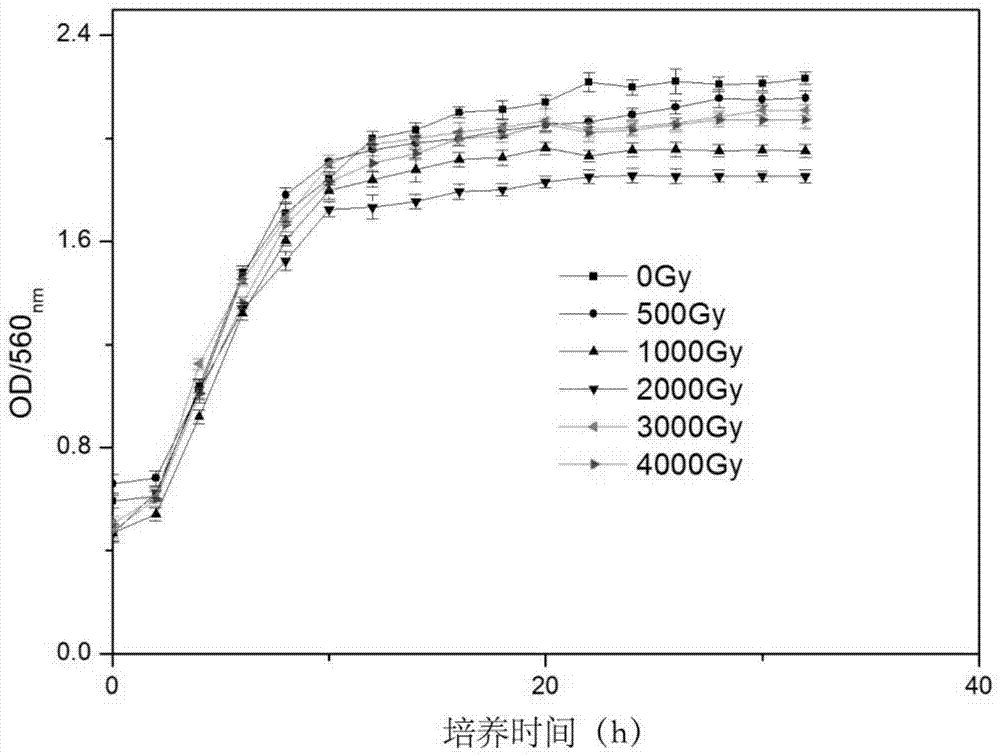
的不足,本发明的目的在于提出一种耐辐射酿酒酵母菌及其诱导方法,运用梯度诱导以及梯度驯化的方法诱导出酿酒酵母菌的辐射抗性,有效的解决了酿酒酵母菌在放射性核素吸附中的应用的问题。本发明为实现上述发明目的采用如下技术方案:一种耐辐射酿酒酵母菌,所述酿酒酵母菌对放射性核素锶具有吸附作用。一种耐辐射酿酒酵母菌的诱导方法,具体方法如下:1)选取原始菌株进行活化,然后接种至液体培养基培养至对数期,得到起始菌株;2)对所述起始菌株进行辐照循环诱导处理,得到辐照抗性菌株;3)使用含有重金属离子锶的培养液对所述辐照抗性菌株进行驯化培养。进一步的,所述步骤2)的具体过程为:2.1)将起始菌株震荡培养至对数期,无菌条件下选取多组菌液作为平行组,采用伽马放射性源60co对起始菌株进行梯度辐照处理;2.2)每次辐照完后,将菌体接种至固体培养基,培养至对数期后再接种至液体培养基,然后取对数期菌体进行下一梯度抗性诱导。进一步的,步骤2.1)所述伽马放射性源60co的剂量率为750gy/h,所采用的剂量梯度为500,1000,1500,2000,3000和4000gy。进一步的,所述步骤3)的具体过程为:3.1)配制不同浓度梯度含锶的液体培养基,然后对液体培养基灭菌,将辐照抗性菌株接种至含锶的液体培养基中进行梯度辐照处理;3.2)每次辐照处理取对数期菌体进行下一梯度抗性诱导;3.3)选取驯化培养后的耐辐射酿酒酵母菌菌株存液氮备用。进一步的,所述步骤3.1)含锶液体培养基浓度梯度为100,500,800,1000,2000,3000,4000mg/l。本发明采用以上技术方案与现有技术相比,具有以下技术效果:1.本发明制备的耐辐射酿酒酵母菌是经过梯度循环诱导,没有使用任何基因手段;经过辐照抗性能力测试:在2000gy的时候其存活率达到90%以上;当射线能量达到4000gy时其存活率依然还有10%以上;其抗辐照能力远远超过了原始菌株;2.本发明制备的耐辐射酿酒酵母菌是经过循环辐照,依靠其自身的修复机制诱导而成,方法简单,绿色环保;3.本发明制备的耐辐射酿酒酵母菌对核素锶的吸附能力良好,实验结果表明:最佳的吸附浓度在150-200mg/l,吸附率最高可达90%左右,其后续处理也非常方便,是一种非常有前景的生物吸附剂。附图说明图1为辐照后的酿酒酵母菌(k-4000)的生长曲线;图2为驯化后的酿酒酵母菌(y-7)的生长曲线;图3为三种酿酒酵母菌的红外对比图;图4为改良后的酿酒酵母菌对不同浓度的锶离子的吸附能力比较;图5为改良后的酿酒酵母菌对锶离子吸附的langmuir和freundlich拟合图;图6为改良后的酿酒酵母菌对锶离子吸附的二级动力学拟合图;图7为初代酿酒酵母菌(k-0)和辐照抗性菌株(k-4000)的差异基因火山图。具体实施方式为使本发明的目的、技术方案和优点更加清楚明白,下面结合附图及具体实施例对本发明的技术方案做进一步的详细说明。诱导辐照抗性菌株ⅰ.酿酒酵母菌的培养:选用酿酒酵母菌(购置于国家菌种保藏中心)。配制培养基(酵母膏1%,蛋白陈2%,葡萄糖2%)。将活化后的菌种(k-0)接种到液体培养基中,37℃培养。ⅱ.菌种中选取3个单菌落,作为辐照循环诱导处理的起始菌株,分别标记为(a啤,b啤,c啤),(a面,b面,c面)2组起始菌株。ⅲ.反复辐照与快速辐照抗性鉴定辐照循环诱导处理在南京航空航天大学辐照中心内进行,采用60co为辐照源。将处于指数生长期的菌体培养液做辐照循环诱导处理,3小时/次,进行4次梯度辐照处理。每个梯度辐照的总剂量见表1。表1胁迫诱导福射抗性所需射线能量表dose(gy)time(h)500(k-500)31000(k-1000))31500(k-1500)32000(k-2000)33000(k-3000)34000(k-4000)3当每次辐照结束后,菌液进行离心,将菌体接种至固体培养基,培养5-10代,待其稳定后见图1,选取存活率较高的菌株,作为下一次辐照的处理菌株。循环4次后从每个菌种中选取存活分数最高的菌株,传代培养8代,备用保存。驯化耐受菌株选取辐照抗性菌株(k-4000)进行锶离子梯度胁迫驯化。在所使用的液体培养基中加入一定量的锶达到计算浓度,灭菌后使用。用于胁迫驯化的含锶离子液体培养基的浓度梯度为100(y-1),500(y-2),1000(y-3),1500(y-4),2000(y-5),3000(y-6),4000(y-7)mg/l。将辐照抗性菌株(k-4000)接种至液体培养基中,每隔2h用紫外分光光度仪(od560nm)测量od值,根据od值绘制生长曲线如图2所示。取对数期菌体接种至下一高浓度核素培养基中,按照上述方法循环至4000mg/l。将选取的菌株存液氮备用。图3为三种酿酒酵母菌的红外对比图,展示了锶和辐照对酵母官能团的影响。实施例一:y-7对放射性锶的同位素sr2+的吸附研究y-7菌株对锶的吸附能力的实验结果表明:最佳的吸附浓度在150-200mg/l,吸附率最高可达90%左右。以硝酸锶为观察对象,探究改良后的酵母菌(y-7)对锶的吸附能力。在生长培养基中,按锶浓度0-1250mg/l共6个梯度加入锶,配置不同的浓度梯度的含锶培养基,每个组分3个平行对照组。每隔2h取10ml培养液,4500rpm离心12min,取上清液,用原子吸收分光光度计测定锶的含量如图4所示。沉淀烘干后用分析天平测定菌体干重。实验结果按下列公式计算得到:其中r(%)为吸附率,q(mg/l)为吸附量,c0(mg/l)为起始离子浓度,ct(mg/l)为时间t时刻的离子浓度,v(l)为吸附体系体积。如图5所示,观察耐辐射酿酒酵母菌吸附锶的过程是否符合freundlich经验公式(w=kc1/n,k和n是freundlich常数,分别表征吸附容量和吸附强度的大小,w是每个生物细胞的吸附量,c是溶液的放射核素浓度)或langmuir吸附等温式(c0/w=1/kb+c0/b,c0为溶液中放射核素浓度,w为吸附量,k为吸附常数,b为最大吸附量)。发现改良后酿酒酵母对锶离子的吸附可以较好地拟合上述两个等温线吸附模型,利用langmuir模型拟合可以得到锶的饱和吸附量。图6为改良后的酿酒酵母菌对锶离子吸附的二级动力学拟合图,利用二级动力学方程:ln(qe-qt)=lnqe-k1t其中k1是速率常数,qt是时间t的吸附量,qe是平衡吸附量,从图中可以发现酵母对锶的吸附符合二级动力学模型:活细胞通过代谢,与锶形成复合物以及防止生物膜渗透等机制对锶暴露具有抗性。在传统的生物吸附中,锶没有这种生物抗性。在培养物逐渐适应锶暴露后,活细胞的生物吸附率开始增加。实施例二:y-7菌株的rna鉴定为探究y-7菌株改良后的成功性,本发明采用一种目前使用最广泛的rna-seq测序方法即solexa测序方法进行改良前与改良后的酵母菌的rna鉴定。solexa是一种基于边合成边测序技术的新型测序方法。通过利用单分子阵列实现在小型芯片上进行桥式pcr反应。由于新的可逆阻断技术可以实现每次只合成一个碱基,并标记荧光基团,再利用相应的激光激发荧光基团,捕获激发光,从而读取碱基信息。通过cufflinks软件的cufflink命令进行的处理组(y-7)与未处理组(k-0)的差异分析,发现共有613个差异基因,其中处理组相对于未处理组高表达的差异基因有316个,相对低表达的差异基因有297个。本发明对两个样本中的差异表达基因进行筛选,p-value和log2foldchange作为筛选差异表达基因的阈值,如图7所示,图中差异点表示具有差异表达的基因,非差异点表示非差异表达的基因。从图中可以看出,差异表达基因主要分布在log2foldchange值大于1或小于-1的区域内。通过go功能显著性富集分析确定差异表达基因的主要生物学功能。注释上goterm的基因总数为970个,其中差异表达基因总数为357个。213个差异表达基因属于分子功能(59.67%),90个差异表达基因属于生物进程(25.21%),其余的差异表达基因属于细胞成分(15.12%),如表2所示。通过pathway显著性富集分析确定差异表达基因参与的最主要生化代谢途径和信号转导途径。注释上pathway的基因总数为451个,其中差异表达基因总数为130个。40个差异表达基因属于代谢途径(30.77%),7个差异表达基因属于信号通路(5.38%),其余的差异表达基因属于遗传信息(63.85%),如表3所示。表2差异基因的goterm富集列表top10(未处理–处理,全部)表3差异基因的pathway富集列表(未处理–处理,全部)需要指出的是:实施例仅仅是为了更加清楚的说明本发明,而不是以任何方式限制本发明的范围。以上所述仅为本发明的较佳实施例,对本发明而言仅仅是说明性的,而非限制性的。本专业技术人员理解,在本发明权利要求所限定的精神和范围内可对其进行许多改变,修改,甚至等效,但都将落入本发明的保护范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1