甘草ISSR荧光分子标记引物及其应用的制作方法
本发明涉及一种甘草issr荧光分子标记引物及其应用,特别是一种对药用甘草及其近缘种亲缘关系的鉴定的甘草issr荧光分子标记引物。
背景技术:
甘草,豆科植物多年生草本。甘草属glycyrrhizalinn.全球约20个物种,在亚洲、欧洲、澳洲、美洲等地都有分布,我国有8个种,分为2个组-甘草组sect.glycyrrhiza和刺果甘草组sect.pseudoglycyrrhizae.u.krug.,其中,甘草组sect.glycyrrhiza中包含甘草(glycyrrhizauralensisfisch.)、光果甘草(glycyrrhizaglabral.又名洋甘草)、胀果甘草(glycyrrhizainflatebatal.)、无腺毛甘草(glycyrrhizaeglandulosax.y.li.)和粗毛甘草(glycyrrhizaasperapall.)5个物种,刺果甘草组sect.pseudoglycyrrhizae.u.krug.包含刺果甘草(glycyrrhizapallidifloramaxim.)、云南甘草(glycyrrhizayunnanensischengf.etl.k.daiexp.c.li)和圆果甘草(glycyrrhizasquamulosafranch.)3个物种[1]。2015版《中华人民共和国药典》中明确指出我国药用甘草为甘草(g.uralensisfisch.)、光果甘草(g.glabral.)及胀果甘草(g.inflatabat.)的干燥根及根茎。具有补脾益气、清热解毒、祛痰止咳、缓急止痛、调和诸药的功效。
甘草的药用和商用价值很高。在我国,甘草作为大宗药材,素有“十方九草”之称,且由于其无毒,可以药食同源,被《神农本草经》列为上品。此外,甘草还用于生活、畜牧和化工的多个方面。作为甘草产出大国,我国甘草资源丰富,但也确实存在诸多问题:
甘草广泛的药用和商用价值促使甘草需求量逐年增加,野生甘草资源因大量采挖急剧下降。尽管建国以来,国家对其进行了资源保护的同时,并大力提倡人工种植,但部分研究结果表明,栽培甘草和野生甘草的有效成分含量差异较大,甚至部分栽培甘草的质量根本达不到《中华人民共和国药典》标准。
申请人在进行甘草资源调查过程中还发现:人工种植甘草中存在诸多变异和杂交现象,很难界定它的分类以及明确其是否为药用甘草基源物种,这就使得甘草用药的安全性和有效性受到了很大质疑。
从国外引进优良甘草种质进行选育或直接进口采购也是解决国内甘草市场资源短缺的问题的可行方法之一,但全球甘草属下物种较多,国外甘草种属在我国是否适合药用也是我们需要亟待解决的问题。
基于以上原因,申请人发现,想要维持甘草市场的稳定发展,甘草属植物资源的保护、优质品种的筛选和属内物种的准确鉴别显得尤为重要。而解决这些问题的基础是甘草亲缘关系的鉴定。
简单重复序列区间(inter-simplesequencerepeat,issr)多态性分子技术是以ssr(simplesequencerepeat)为基础发展起来的分子标记技术,相较于ssr技术而言,它克服了ssr技术引物设计需要进行测序,以及由于引物物种特异性而受到限制的缺点,使用更加广泛。且由于其专一性强,揭示的多态性较高,已经成为现今鉴定物种、亲缘关系分析、遗传多样性分析等的有效方法之一。而20世纪80年代发展起来的毛细管电泳技术,通过对荧光标记物进行检测,具有结果更准确、灵敏度更高、分析更精密、操作自动化、更适用于大批量材料的检测分析等特点。该技术与issr分子标记技术相结合的issr荧光分子标记技术逐渐应用于物种亲缘关系和多样性研究中],使得大批量样本亲缘关系的研究结果更加方便,快捷,可靠。
issr荧光分子标记技术是issr标记技术和毛细管电泳的结合,由于其通过对荧光标记物进行检测,具有结果更准确、灵敏度更高、分析更精密和操作自动化等特点。相较于传统的凝胶电泳法,毛细管电泳技术更适用于大批量材料的检测分析,在部分作物的遗传研究中已有应用。
部分学者前期利用issr技术对甘草属植物的研究已经有一些进展,但结合毛细管凝胶电泳技术对其进行分析的文章并未被发现。毛细管电泳技术与issr分子标记技术相结合是否可以有效反应甘草属植物的亲缘关系有待探讨。
技术实现要素:
本发明的目的在于,提供一种甘草issr荧光分子标记引物及其应用。本发明通过从67条已知issr引物中筛选出部分(8条)引物,并随机选取部分对issr引物进行适用性验证。并用这些引物对已知物种甘草样本进行鉴定,验证该方法的可靠性,然后利用该方法对未知甘草物种进行鉴定。因此,该引物的开发对甘草属不同物种之间的鉴定和聚类分析具有重要意义,能对甘草属内药用甘草物种与其近缘种进行区分鉴定,使得药用甘草物种与其近缘种容易被区分,避免了甘草药用情况混乱,确保了甘草临床用药的有效性和安全性。为甘草资源保驾护航。
本发明的技术方案:甘草issr荧光分子标记引物,其特征在于:包括以下引物:
前述的甘草issr荧光分子标记引物中,所述引物的退火温度在48-52℃之间,所述引物长度17-18bp之间,所述引物的cg含量44.44%-55.56%,pcr产物大小50bp-1100bp。
前述的甘草issr荧光分子标记引物中,所述引物的退火温度为:
一种前述甘草issr荧光分子标记引物的应用,用于对药用甘草及其近缘种亲缘关系的鉴定。
与现有技术相比,本发明具有以下有益效果:
1、本发明引物可用于未鉴定基源物种的甘草属植物与我国药用甘草的亲缘关系评判。为规范利用国内外甘草原材料,解决我国甘草市场资源短缺的问题,提供了理论依据和技术支持。而通过遗传聚类分析研究甘草属植物的亲缘关系则有助于阐明甘草属植物栽培种的遗传背景,为优良品种的选育提供理论依据。
2、本发明利用issr荧光分子标记技术对甘草材料进行总dna提取、pcr反应体系优化及稳定性检测,筛选出带有issr荧光分子标记序列,将符合issr引物设计要求的序列进行issr引物开发,该引物对甘草属不同物种之间的鉴定和聚类分析具有重要意义能对甘草属内药用甘草物种与其近缘种进行区分鉴定,使得药用甘草物种与其近缘种容易被区分,避免了甘草药用情况混乱,确保了甘草临床用药的有效性和安全性。为甘草资源保驾护航。
附图说明
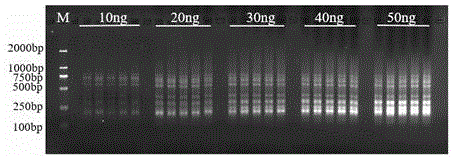
图1是issr-pcr反应体系优化部分电泳结果;其中(10ng(0.125μm,0.25μm,0.375μm,0.5μm,0.625μm);20ng(0.125μm,0.25μm,0.375μm,0.5μm,0.625μm);30ng(0.125μm,0.25μm,0.375μm,0.5μm,0.625μm);40ng(0.125μm,0.25μm,0.375μm,0.5μm,0.625μm);50ng(0.125μm,0.25μm,0.375μm,0.5μm,0.625μm);
图2是issr-pcr优化反应体系稳定性部分电泳结果;
图3是毛细管电泳检测到的部分峰图(自上而下样本编号为63g.uralensis、85g.glabra、98g.inflata、110g.pallidiflora、111g.yunnanensis、125g.aspera);
图4是甘草样本的issr荧光分子标记法的聚类分析图;
图5是甘草样本的issr荧光分子标记法的聚类分析图。
具体实施方式
下面结合实施例对本发明作进一步的说明,但并不作为对本发明限制的依据。
实施例1。
1、材料
实验涉及材料收集自我国黑龙江、吉林、内蒙古、陕西、甘肃、宁夏、新疆、云南、四川、河北10个省,共125个样本,以及收集自我国内蒙古、甘肃、宁夏、新疆、吉林的43个表观判定为变异植株的甘草样本;41个采自国外的未鉴定到种的甘草样本。125个实验样本经贵阳中医学院刘育辰副教授鉴定均为甘草属植物,且经表观鉴定,可分为6个物种(甘草g.uralensisfisch.、光果甘草g.glabral.、胀果甘草g.inflatabatal.、粗毛甘草g.asperapall.、刺果甘草g.pallidifloramaxim.和云南甘草g.yunnanensischengf.etl.k.daiexp.c.li.。所有样本均保存在贵阳中医学院。对照药材(甘草g.uralensisfisch.(120904-201519)和胀果甘草g.inflatabatal.(121303-201003),以‘fdc’为编号)来自中国食品药品检定研究院。样本标号见表1、表2和表3。
2、仪器
电子天平:fa2004型十万分之一,上海舜宇恒平科学仪器有限公司;超净工作台:sm-cj-2f型,苏州安泰空气技术有限公司;精密微量移液器:德国eppendorf公司;多功能酶标仪:multiskango型,美国thermo公司;pcr循环扩增仪:c1000touchtm型,美国bio-rad公司;凝胶成像系统:chemidoctmmp型,美国bio-rad公司;稳压稳流电泳仪和平板电泳槽:dyy-6d型和dycp-32c,北京六一仪器厂;三重蒸馏水机:sz-97型,上海亚荣生化仪器厂;高速冷冻离心机:tgl20m型,长沙迈佳森仪器设备有限公司;低温保存箱:thermoscientifictmformatm991型,美国thermo公司。
3、试剂
植物基因组dna提取试剂盒:dp305,天根生化科技(北京)有限公司;抽提液(苯酚:氯仿:异戊醇=25:24:1);2×powertaqpcrmastermix:北京百泰克生物技术有限公司;dnamarker2000:北京百泰克生物技术有限公司;其它试剂除文中注明外,均为国产分析试剂。
所用引物均由生工生物工程(上海)股份有限公司合成(具体引物序列见表1)。
4、方法
甘草总dna提取
取甘草样本组织约100mg,用体积分数为75%的酒精擦拭表面后晾干,用植物基因组dna提取试剂盒(dp305)提取总dna,65℃水浴1h,其余步骤按照试剂盒说明进行,具体步骤如下:
(1)取甘草组织约100mg,加入液氮充分碾磨。
(2)将研磨好的粉末迅速转移到预先装有700μl65℃预热缓冲液gp1的离心管中(实验前在预热的gp1中加入巯基乙醇0.7μl,使其终浓度为0.1%),迅速颠倒混匀后,将离心管放在65℃水浴1h,水浴过程中颠倒离心管以混合样品数次。
(3)加入700μl抽提液(苯酚:氯仿:异戊醇=25:24:1),充分混匀,12,000rpm(~13,400×g)离心10min。
(4)小心地将上一步所得上层水相转入一个新的离心管中,加入700μl氯仿,充分混匀,12,000rpm(~13,400×g)离心5min。
(5)再小心地将上一步所得上层水相转入一个新的离心管中,加入700μl缓冲液gp2,充分混匀。
(6)将混匀的液体转入装在收集管上的吸附柱cb3中,12,000rpm(~13,400×g)离心30sec,弃掉废液,将吸附柱cb3放回收集管中。(吸附柱容积为700μl左右,可分次加入离心。)
(7)向吸附柱cb3中加入500μl缓冲液gd(使用前请先检查是否已加入无水乙醇),12,000rpm(~13,400×g)离心30sec,倒掉废液,将吸附柱cb3放回收集管中。
(8)向吸附柱cb3中加入600μl漂洗液pw(使用前请先检查是否已加入无水乙醇),12,000rpm(~13,400×g)离心30sec,倒掉废液,将吸附柱cb3放回收集管中。
(9)重复操作步骤(8)。
(10)将吸附柱cb3放回收集管中,12,000rpm(~13,400×g)离心2min,直接弃掉收集管。将吸附柱cb3置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗液。
(11)将吸附柱cb3转入一个干净的离心管中,向吸附膜的中间部位悬空滴加100μl洗脱缓冲液te,室温放置2-5min,12,000rpm(~13,400×g)离心2min,将溶液收集到离心管中。
(12)为增加基因组dna的得率,将离心得到的溶液再加入吸附柱cb3中,室温放置2min,12,000rpm(~13,400×g)离心2min。
multiskango多功能酶标仪初步测定dna模板浓度和od260/od280值,将模板dna浓度稀释为10ng·μl-1,-20℃保存备用。
pcr反应体系优化及稳定性检测
issr引物是从加拿大哥伦比亚大学设计出的通用引物(共计100条)的二核苷酸重复引物、三核苷酸重复引物、四核苷酸重复引物以及5'锚定的重复引物中筛选出gc含量在35%~70%的引物,共67条,具体引物信息见表1。由生工生物工程(上海)有限公司合成。
表1issr-pcr引物序列
注:n=(a,g,c,t);r=(a,g);y=(c,t);b=(c,g,t);d=(a,g,t);h=(a,c,t);v=(a,c,g)
选取编号为108的甘草样本的dna模板和引物807进行体系的优化。issr-pcr反应体系(20μl)如下:2×taqpcrmastermix10μl,引物(2.5μmol·l-1),模板dna(10ng·μl-1),ddh2o补至20μl。其中以引物(2.5μmol·l-1)和模板dna(10ng·μl-1)的量为变量,进行单因素实验,实验重复3次,实验具体优化方案见表2。
表2issr反应体系单因素实验方案
用引物807对随机选取的12个甘草样本的dna模板进行扩增,并随机选取12条引物对编号为108的甘草样本dna模板进行扩增,所用扩增体系为通过单因素实验得出的优化体系,每个反应体系做3次平行实验,查看体系的稳定性。
以上所有实验的扩增程序为:94℃预变性3min;94℃变性1min,52℃退火1min,72℃延伸2min,进行35个循环;循环结束后72℃延伸5min。pcr结束后取各产物10μl,d2000marker2μl,在1.8%的琼脂糖凝胶上电泳(1×tae缓冲液,电压120v,1h)。电泳结束后在凝胶成像系统中对琼脂糖凝胶进行观察、拍照并保存图像。
引物筛选
甘草对照药材的模板dna在上述优化体系下对引物进行筛选,同时筛选出每个引物的最适退火温度(温度梯度根据引物合成温度设定为55℃,54.6℃,53.7℃,52.1℃,50.2℃,48.6℃,47.5℃,47℃)。选出条带清晰、重复性高、稳定性好、具有差异的引物由生工生物工程(上海)有限公司合成荧光引物,用于后续实验。
pcr扩增及产物检测
筛选出的引物送生工生物工程(上海)有限公司合成末端加5'6-fam荧光标记的荧光引物后,对所有样本进行扩增,扩增体系如下(即表3):
表3扩增体系
扩增程序为:94℃预变性3min;94℃变性1min,退火1min(退火温度根据引物筛选时的最佳退火温度定),72℃延伸2min,进行35个循环;循环结束后72℃延伸5min。pcr结束后扩增产物于4℃避光保存,并用锡铂纸包好送生工生物工程(上海)有限公司纯化,用3730xl测序仪进行片段长度多态性的毛细管电泳分离检测。
数据统计和分析
毛细管电泳检测结果使用genemappersoftwarev3.2进行分析,软件系统将根据目标峰的位置与同一泳道中的内标liz-1200进行比较,从而确定不同样品issr扩增片段的精确大小(单位bp),获取扩增片段大小的数据导出,生成pdf图谱和excel表,将有效峰转化为“0、1”原始数据矩阵。采用软件ntsys-2.1e检测遗传距离,并按非加权算数平均数聚类(upgma)方法构建聚类图。
4、结果与分析
甘草总dna的提取
提取的甘草属样本dna经multiskango多功能酶标仪测定,质量浓度均在10ng·μl-1以上,od260/od280值均在1.7-2.0之间。
5、pcr反应体系优化及稳定性检测
issr-pcr反应体系通过单因素实验进行引物和dna模板量的优化,1.8%的琼脂糖凝胶经电泳得出的部分结果显示如图1。可以看出,dna模板量加入3μl(即30ng)时条带数量较多,较清晰;而引物量对于扩增影响并不大,故取3μl(终浓度为0.375μm)作为最佳引物量。所以模板(10ng·μl-1)和引物(2.5μmol·l-1)量均加3μl被认为是issr-pcr反应的最佳体系(3次实验得出的结果相当)。
用引物807对随机选取的12个甘草样本的dna模板进行扩增,并随机选取12条引物对编号为108的甘草样本dna模板进行扩增,检测优化的扩增体系的稳定性,电泳部分结果见图2。3次平行实验的结果相当,可以看出,优化体系的稳定性良好。
引物筛选
甘草对照药材的dna模板进行引物筛选,同时筛选每个引物的退火温度。最终确定8条扩增产物条带清晰、重复性高、稳定性好、具有差异的引物用于后续实验。筛选的引物信息见表4。
表4筛选的issr引物信息
注:y=(c,t)。
pcr扩增及产物检测
筛选出的引物送生工生物工程(上海)有限公司合成末端加5'6-fam荧光标记的荧光引物,对所有样本进行扩增,扩增产物用锡铂纸包好送生工生物工程(上海)有限公司纯化,进行片段长度多态性的毛细管电泳分离检测,检测得到的部分谱图结果见图3。
遗传信息分析
筛选出的8条issr引物共扩增出3079个多态性位点。引物扩增得到的多态性位点数在272-516个,平均每条引物扩增得到的位点数为384.9个。
127个已知物种甘草样本的聚类分析
基于issr荧光分子标记的125个已鉴定甘草属植物和2个对照药材的扩增产物得到的基础矩阵,用软件ntsys-pc2.1检测其遗传距离,127份已知甘草物种样本基于遗传相似系数按非加权算数平均数聚类(upgma)方法构建聚类图(图4),结果显示:所有125份材料也可分为3个组群,第ⅰ组群中大部分为g.uralensis,且大部分g.uralensis聚集在这个组群中,成为一个大分支,g.aspera的2个样本也很好的聚为一支,与g.uralensis一起分在这个组群中;第ⅱ组群中的样本大部分为g.glabra和g.inflata,虽有部分掺杂,但大部分的g.glabra可聚为一支;第ⅲ组群中的样本为g.pallidiflora和g.yunnanensis,可以分别较好的聚为一支。由此可以看出,基于issr的分子鉴定技术在3种药用甘草样本中可以较好将其进行很好的聚类,特别是g.uralensis,可以很好的与g.glabra和g.inflata区分开。而在非药用甘草中,issr分子标记技术能很好的将非药用甘草样本g.pallidiflora、g.yunnanensis和g.aspera分别聚为一支。其中,g.pallidiflora和g.yunnanensis聚为一大支,成为一个单系分支,两者亲缘关系较近,与其它物种亲缘关系较远;g.aspera的2个样本与g.uralensis一起分在第ⅰ组群中,聚为一大支,再与g.glabra和g.inflata聚集,遗传关系较近。证明3种药用甘草以及其g.aspera亲缘关系较近,而与g.pallidiflora和g.yunnanensis亲缘关系。
5、issr荧光分子标记技术对未知甘草物种样本药用亲缘关系的研究
issr-pcr反应体系、引物和扩增条件以及参照127个已知物种甘草属植物得出的结果,扩增产物的检测和数据统计与分析方法也参见上法。具体issr-pcr反应体系和扩增条件见表5。引物及退火温度详见表4。
表5issr-pcr反应体系和扩增程序
issr荧光分子标记技术对未知甘草的药用亲缘关系的研究
利用8个筛选出来的荧光引物对所有采集的211个样本进行issr-pcr扩增,进行片段长度多态性的毛细管电泳分离检测,统计分析数据,所有采集的211份甘草样本按非加权算数平均数聚类(upgma)方法构建聚类图(图5),结果显示:所有211份材料可分为3个组群,大体结构和第三章中已鉴定的125份材料相同:第ⅰ组群中的样本大部分为g.uralensis,聚为一大支,g.aspera的2个样本也很好的聚为一支,与g.uralensis一起分在这个组群中;第ⅱ组群中的样本大部分为g.glabra和g.inflata,国外采集的甘草样本大部分聚集在这一组群中;第ⅲ组群中的样本为g.pallidiflora和g.yunnanensis,可以分别较好的聚为一支,国内疑似为g.pallidiflora的样本v-40、v-41、v-42、v-43也聚为一支,并和野外采集的g.pallidiflora聚为一支。而国内采集的疑似变异植株整个树状图中均有分布,但均存在于第ⅰ和第ⅱ组群,由此可以看出,国外采集的甘草样本或与g.glabra和g.inflata亲缘关系较近,国内变异植株大部分与g.pallidiflora和g.yunnanensis亲缘关系较远。
issr荧光分子标记技术在本实验中6个经表观鉴定的甘草物种中的研究结果具有现实意义,其结果表明issr荧光分子标记技术可以较好的对不同物种甘草药材进行聚类,可以较有效的研究本实验所收集的甘草属植物种个体间种质资源的亲缘关系。结果与dna条形码结果相似,表明:g.uralensis、g.glabra、g.inflata和g.aspera的亲缘关系较近,与其它两个物种亲缘关系较远。故判断g.aspera或可作为药用甘草,进行后期遗传栽培育种,进行进一步的研究。
6、结论
issr荧光分子标记技术的聚类分析
基于issr荧光分子标记技术对127个已知甘草物种样本的聚类分析可以看出:issr荧光分子标记技术能较好的将3种药用甘草样本(g.uralensis、g.glabra和g.inflata)和3种非药用甘草样本(g.pallidiflora、g.yunnanensis和g.aspera)分别聚类,且其亲缘关系的远近也显而易见。由此可见,相较于scot分析来说,issr荧光分子标记技术对于甘草属不同物种之间的鉴定和聚类分析具有更好的优势。
利用issr荧光分子标记技术对127个国内不同地区采集的6种表观鉴定到种的甘草样本进行个体间的聚类分析,其结果与dna条形码结果相似:125个甘草样本中,大部分g.uralensis可聚为一支;大部分的g.glabra和g.inflata聚集在一个大组群中,且相互掺杂,不能单独聚为一支;g.pallidiflora可单独聚为一支;g.yunnanensis可单独聚为一支;g.aspera能聚为一支,且与g.uralensis在一个大组群中。在亲缘关系方面,g.uralensis和g.aspera的亲缘关系较近,再与g.inflata和g.glabra聚为一大支,而非药用甘草物种g.pallidiflora和g.yunnanensis的亲缘关系较近,与其它4个物种相比,单独成为一支,亲缘关系较远。由此可见,issr荧光分子标记技术能较好的将各个不同的物种进行聚类,并能较好的表现出其亲缘关系的远近。
序列表
<110>贵阳中医学院
<120>甘草issr荧光分子标记引物及其应用
<130>2018
<141>2019-01-08
<160>12
<170>siposequencelisting1.0
<210>1
<211>3
<212>dna
<213>甘草(glycyrrhizauralensisfisch)
<400>1
agt3
<210>2
<211>3
<212>dna
<213>甘草(glycyrrhizauralensisfisch)
<400>2
agc3
<210>3
<211>3
<212>dna
<213>甘草(glycyrrhizauralensisfisch)
<400>3
gat3
<210>4
<211>3
<212>dna
<213>甘草(glycyrrhizauralensisfisch)
<400>4
gac3
<210>5
<211>4
<212>dna
<213>甘草(glycyrrhizauralensisfisch)
<400>5
agct4
<210>6
<211>4
<212>dna
<213>甘草(glycyrrhizauralensisfisch)
<400>6
agtt4
<210>7
<211>4
<212>dna
<213>甘草(glycyrrhizauralensisfisch)
<400>7
agtc4
<210>8
<211>4
<212>dna
<213>甘草(glycyrrhizauralensisfisch)
<400>8
agcc4
<210>9
<211>4
<212>dna
<213>甘草(glycyrrhizauralensisfisch)
<400>9
gatt4
<210>10
<211>4
<212>dna
<213>甘草(glycyrrhizauralensisfisch)
<400>10
gact4
<210>11
<211>4
<212>dna
<213>甘草(glycyrrhizauralensisfisch)
<400>11
actg4
<210>12
<211>4
<212>dna
<213>甘草(glycyrrhizauralensisfisch)
<400>12
accg4
- 还没有人留言评论。精彩留言会获得点赞!
- 兔中型艾美耳球虫荧光定量pcr检测引物和试剂盒的制作方法
- 基于dpo引物的实时荧光pcr检测屎肠球菌的dpo引物、方法及试剂盒的制作方法
- 荧光定量pcr法检测top2a基因表达的引物、探针及试剂盒的制作方法
- 对虾tsv和imnv荧光定量检测引物和探针及试剂盒的制作方法
- 牛乳中沙门氏菌的直接荧光定量pcr的检测引物、探针及检测方法
- 一种鉴定光慈菇的方法及其专用引物对的制作方法
- 基于dpo引物的实时荧光pcr检测植物乳杆菌的方法、引物及试剂盒的制作方法
- 基于dpo引物的实时荧光pcr检测鼠李糖乳杆菌的方法、引物及试剂盒的制作方法
- 一种貉的荧光pcr检测方法及其扩增引物和探针的制作方法
- 鉴定白木香的荧光定量pcr方法、引物和探针及其应用
- 兔中型艾美耳球虫荧光定量pcr检测引物和试剂盒的制作方法
- 基于dpo引物的实时荧光pcr检测屎肠球菌的dpo引物、方法及试剂盒的制作方法
- 荧光定量pcr法检测top2a基因表达的引物、探针及试剂盒的制作方法
- 对虾tsv和imnv荧光定量检测引物和探针及试剂盒的制作方法
- 牛乳中沙门氏菌的直接荧光定量pcr的检测引物、探针及检测方法
- 一种鉴定光慈菇的方法及其专用引物对的制作方法
- 基于dpo引物的实时荧光pcr检测植物乳杆菌的方法、引物及试剂盒的制作方法
- 基于dpo引物的实时荧光pcr检测鼠李糖乳杆菌的方法、引物及试剂盒的制作方法
- 一种貉的荧光pcr检测方法及其扩增引物和探针的制作方法
- 鉴定白木香的荧光定量pcr方法、引物和探针及其应用