基于乳液PCR的一步法将单链抗体库重排为全长抗体库的方法与流程
本发明属于生物技术领域,具体涉及一种基于乳液pcr的一步法将单链抗体库重排为全长抗体库的方法。
背景技术:
现有的噬菌体展示抗体库筛选方法得到的单链抗体通常需要重排为全长的抗体,而通常的做法是针对淘选到的单链抗体分别单独进行重排,这种方法需要繁复的工作。而且更重要的是,由于真核细胞中蛋白的折叠修饰与原核细胞中不同,大部分重排后的全长抗体会丧失或减弱其结合抗原的能力。因此,通过结合噬菌体展示与哺乳动物细胞展示来直接筛选最终的全长抗体成为一个更优的方案,而这个过程需要将单链抗体文库重排为全长抗体文库,而重排过程的关键点在于抗体轻重链原始配对的保持。
现有的较为成功的单链抗体文库重排为全长抗体文库的技术是基于反向pcr的原理,将抗体轻链可变区(vl)与重链可变区(vh)保持在同一个载体上,然后将需要的其它片段通过分子克隆插入,再以其为模板进行pcr获得全长抗体序列,并进一步克隆到目的载体中。由于整个过程中没有轻重链的分离,因此可以获得维持原始轻重链配对的全长文库。但是该方法有很大局限性,比如轻重链方向只能维持为原来的方向,同时该过程由于需要进行两步pcr,以及两步分子克隆建库,复杂的过程使得原始库的多样性和特征很难维持。
技术实现要素:
本发明的目的在于提供一种基于乳液pcr的一步法将单链抗体库重排为全长抗体库的方法,能够简化操作过程,有效维持轻重链的原始配对以及原始库的多样性特征。
本发明将单链抗体库重排为全长抗体库的方法,包括将单链抗体模板、引物序列组、连接片段在乳液pcr条件下进行扩增反应的步骤;所述单链抗体模板包括重链可变区(vh)和轻链可变区(vl);所述引物序列组包括目的片段为重链可变区(vh)的5’端引物或引物组(vh-fw)、目的片段为重链可变区(vh)的3’端引物或引物组(jh-rv)、目的片段为轻链可变区(vl)的5’端引物或引物组(vl-fw)、目的片段为轻链可变区(vl)的3’端引物或引物组(jl-rv);其中一个目的片段(vh或vl)的5’端引物或引物组(vh-fw或vl-fw)与另一个目的片段的3’端引物或引物组(jl-rv或jh-rv)上设有分别与所述连接片段的两端重叠延伸的重叠片段;设有重叠片段的引物或引物组数量少于未设有重叠片段的引物或引物组;未设有重叠片段的引物或引物组(一个目的片段的vl-fw或vh-fw与另一个目的片段的jh-rv或jl-rv)不能匹配单链抗体模板上同时包含重链可变区(vh)和轻链可变区(vl)的原始序列。
其中,所述单链抗体模板来源于体外展示的单链抗体库,展示系统可以任选自噬菌体展示系统、核糖体或mrna展示系统、酵母展示系统、哺乳动物细胞展示系统、细菌展示系统(如大肠杆菌外膜展示或大肠杆菌内膜展示)等,优选最为成熟的噬菌体展示系统。
其中,在单链抗体模板上表达方向可以为重链可变区(vh)在前,也可以为轻链可变区(vl)在前,或者重链可变区(vh)和轻链可变区(vl)头头相接或者尾尾相接;重链可变区(vh)和轻链可变区(vl)中间一般连接有一段linker。
本发明技术方法中,当单链抗体模板上表达方向为重链可变区(vh)在前、轻链可变区(vl)在后时,重排为全长抗体库后则轻链可变区(vl)在前、重链可变区(vh)在后,这是由数量相对较多的未设有重叠片段的引物或引物组不能匹配单链抗体模板上同时包含重链可变区(vh)和轻链可变区(vl)的原始序列所决定的,由于数量相对较少的设有重叠片段的引物或引物组在pcr的前期循环被耗尽,多余的未设有重叠片段的引物或引物组启动后续的pcr循环,使得重链可变区(vh)和轻链可变区(vl)的前后顺序交换,并以重叠延伸pcr的方式将连接片段插入重链可变区(vh)和轻链可变区(vl)之间,从而形成重排后的全长抗体片段(pcr目的片段);基于同样的原因,当单链抗体模板上表达方向为轻链可变区(vl)在前、重链可变区(vh)在后时,重排为全长抗体库后则重链可变区(vh)在前、轻链可变区(vl)在后;当重链可变区(vh)和轻链可变区(vl)头头相接或者尾尾相接时,重链可变区(vh)和轻链可变区(vl)任一在前均可。
其中,所述引物序列组中:未设有重叠片段的引物或引物组上可设有酶切位点、蛋白标签序列、蛋白间隔或连接序列、调控序列等功能序列,可用于重排后全长抗体片段的编辑、纯化等操作。
其中,所述连接片段能够使重排后全长抗体片段上的重链可变区(vh)和轻链可变区(vl)分离开各自表达;可以包括:i)与在前的重链可变区(vh)或轻链可变区(vl)构成重链或轻链的部分或全部恒定区序列;例如当重链可变区(vh)在前时,连接片段上具有与重链可变区(vh)连接的重链恒定区(ch1-fc),当轻链可变区(vl)在前时,连接片段上具有与轻链可变区(vl)连接的轻链恒定区(cl);ii)用于终止在前的重链可变区(vh)或轻链可变区(vl)表达的间隔序列;例如t2a切割系统、终止子等;iii)用于引导或启动在后的轻链可变区(vl)或重链可变区(vh)表达的引导或启动序列;例如人源白介素2的信号肽(il2ss)、启动子等。另外,所述连接片段上也可以根据需要引入酶切位点、蛋白标签序列、蛋白间隔或连接序列、调控序列等功能序列。
其中,所述乳液pcr包括两阶段pcr,第一阶段pcr用于引物序列组以单链抗体为模板分别克隆重链可变区(vh)和轻链可变区(vl)片段,第二阶段pcr用于克隆得到的重链可变区(vh)和轻链可变区(vl)片段通过重叠区域与连接片段相互搭配,在未设有重叠片段的引物或引物组启动下通过重叠延伸pcr获得重排后的全长抗体片段。设有重叠片段的引物或引物组在第一阶段pcr被耗尽,剩余的未设有重叠片段的引物或引物组不能匹配单链抗体模板上的原始序列,因此能够顺利启动重叠延伸pcr获得pcr目的片段。两阶段pcr所需的循环数、模板数量、引物数量能够等能够根据需要进行调节,这是本领域技术人员能够实现的。两阶段pcr的循环数量比优选为1:(3-6);设有重叠片段的引物或引物组与未设有重叠片段的引物或引物组优选的浓度比为1:(10-40)。
其中,重排后的全长抗体片段(pcr目的片段)能够进一步被连接构建到表达载体上进行表达,表达载体可以预先被改造为包括:i)用于引导或启动在前的轻链可变区(vl)或重链可变区(vh)表达的引导或启动序列;例如人源白介素2的信号肽(il2ss)、启动子等;ii)与在后的重链可变区(vh)或轻链可变区(vl)构成重链或轻链的部分或全部恒定区序列;例如当重链可变区(vh)在后时,表达载体上具有与重链可变区(vh)连接的重链恒定区(ch1-fc),当轻链可变区(vl)在后时,表达载体上具有与轻链可变区(vl)连接的轻链恒定区(cl)。
单链抗体库重排过程中,所述单链抗体模板能够独立分散于单个的乳液微滴中,由于通过控制模板数量能够使得单个乳液微滴中仅有一个单链抗体模板,两阶段pcr能够排除模板之间的相互干扰,有效保证了单链抗体序列轻重链配对的原始性,含有单链抗体的乳液微滴中仅含有一个单链抗体模板的理论数可达约90%,因此重排为全长抗体库的产物中正确率可达90%左右。
本发明的技术方法相对于现有的方法步骤极大简化,能有效的将单链抗体文库重排为全长抗体文库,由于重排过程只需要一步pcr便可完成,原始文库信息也更易保留,有效维持轻重链的原始配对以及原始库的多样性特征。
附图说明
构成本发明的一部分的附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
图1是乳液pcrkit梯度灰度分析。
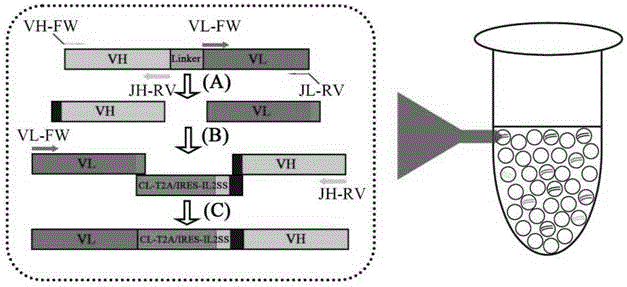
图2是本发明示例的方法原理图。
图3是vh和vl头头相接时重排后轻链在前的方法原理图。
图4是vh和vl头头相接时重排后重链在前的方法原理图。
图5重排全长抗体插入到蛋白载体后的结构示意图。
图6是将重排好的全长抗体3d9展示在细胞膜上后,用抗原tpor染色的流式图。
图7是将tpor展示在细胞膜上后,用重排好的全长分泌型抗体3d9进行染色的流式图。
具体实施方式
为了更好的理解本发明,下面以将人源的单链抗体库转化为全长igg1抗体库为例,详细描述本发明的方法过程。
一、原料
所选取的人源单链抗体库的关键特征为:该人源单链抗体库的载体为主要用于噬菌体筛选的pcgmt3,单链抗体的表达方向为重链可变区(vh)在前,轻链可变区(vl)在后,中间由一段固定的linker连接。本实例中因为单链抗体的重链可变区(vh)在前,所以重排后的全长抗体序列轻链可变区(vl)在前。
重链可变区(vh)与轻链可变区(vl)之间引入了cl-t2a-il2ss片段(连接片段)进行连接,cl-t2a-il2ss片段的dna序列见seqidno:1,序列中前16bp与vl片段重叠,后21bp与vh片段重叠。序列中cl片段为人的抗体igg1基因的cl片段,具体氨基酸序列为:rtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec,cl片段是5’端轻链恒定区,用于与vl组成完整的轻链(vl-cl)。t2a为t2a切割片段,可以将轻链与重链在翻译之后切割开来,其具体氨基酸序列为:gsgegrgslltcgdveenpgp。il2ss是人源白介素2的信号肽,用于引导后面重链的分泌其具体氨基酸序列为:myrmqllscialslalvtns。
引物序列组包括:
vh-fw:匹配单链抗体模板载体的一段序列,
jh-rv:匹配单链抗体模板的jh区的引物组,
vl-fw:匹配单链抗体模板中轻重链之间共同linker的一段序列,
jl-rv:匹配单链抗体模板的jκ和jλ区的引物组,
上述引物的具体序列见表1。
表1
二、乳液pcr适合模板量分析
乳液pcr技术是利用油包水结构也就是微滴作为pcr反应的微容器进行pcr扩增。根据泊松分布原理,在模板dna分子数量少于形成的液滴数量一定比例时,便可保证大部分液滴里面仅有一个模板dna分子进行扩增。因此需要确定一次乳液pcr产生的液滴个数,才能确定一次乳液pcr合适的模板量。
选用市购的乳液pcrkit,说明书声称可以获得10^10微滴,但是由于具体实验试剂、实验条件以及个人操作的不同,真实产生的微滴数需要自行根据所用说明书设计实验确定。本实例中根据所用乳液pcrkit说明书推荐设定了10^12到10^7,6个梯度,如图1,灰度分析估计10^9模板产物获得产物量约为最大产物量的1/5,依据泊松分布估计乳液个数为5*10^9,进而取用了10^9数量的模板。
可以根据泊松分布估算仅有一个模板的微滴占总的产生微滴以及总的含有模板的微滴的比例。比如实例中模板数是产生微滴数的1/5,便有18.1%的液滴含有模板,16.4%的微滴有且仅有一个模板,1.7%的微滴含有多个模板,也就是说90.6%的含有模板的微滴为仅含有一个模板的微滴,也就是理论上没有模板相互干扰的微滴。这样pcr产物的正确率应该在90%左右。
整个乳液pcr通过市售商业化乳液pcrkit进行pcr反应体系的乳化,在常规pcr仪中进行pcr,根据kit说明书进行随后的破乳、回收操作,然后在1%琼脂糖凝胶上电泳,可以回收获得pcr目的片段。
三、原理分析
本发明上述实例的原理如图2所示。加入适合量的引物序列组在第一阶段pcr中可以完成从单链抗体模板中克隆获得单独的轻链可变区(vl)和重链可变区(vh),该步pcr程序可以为94℃变性30秒,72℃退火延伸共40秒,共5个循环。第一阶段pcr完成后,带有重叠片段的引物vh-fw和jl-rv被耗尽。剩余引物vl-fw和jh-rv启动第二轮重叠延伸pcr,vl、vh与cl-t2a-il2ss通过重叠区互相搭配,获得pcr目的片段,该步pcr程序可以为94℃变性30秒,72℃退火延伸共75秒,共20个循环。
为了保证vh和vl能够在第一阶段pcr中顺利扩增,同时能在反应早期耗尽而不干扰第二阶段pcr中顺利重叠延伸,本例中可以设计引物vh-fw和jl-rv的浓度为30nm(每条浓度),引物vl-fw和jh-rv的浓度为600nm(每条浓度)。除上述引物外,pcr体系中还具体包括:cl-t2a-il2ss,200ng;单链抗体模板,10^9;dntp,200μm;pcr缓冲液;dna聚合酶;加ddh2o补齐50μl。
四、重排验证
为了验证在我们的实验条件下,乳液pcr能够有效的将单链抗体单独重排为原始配对的全长抗体,我们用一个含有16条已知序列的具有互不相同的轻重链的单链抗体组成的迷你单链抗体文库进行了一步法复合pcr重排。
(1)首先,我们将含有16条已知序列的pcgmt3载体(大小为4kb)按等摩尔混合,得到一个迷你单链文库,命名为16mix。
(2)然后我们以10^9数量的16mix(质量约为4ng)为模板,进行一步复合延伸乳液pcr,水相体系如下:
引物:600nmvl-fw;600nmjh-rv(每条浓度);30nmvh-fw;30nmjl-rv(每条浓度);
cl-t2a-il2ss:200ng;
16mix:4ng;
dntp:200μm;
dna聚合酶;
pcrbuffer;
加ddh2o补齐到50μl。
(3)油相按kit说明书配制,本实例所用kit是73%的emulsioncomponent1,7%emulsioncomponent2,20%emulsioncomponent3,配制300μl。
(4)50μl水相pcr体系加到300μl油相,在4度冷室中剧烈震荡5min实现乳化。
(5)350μl乳化好的乳液,分成90μl/pcr管,置于常规pcr仪中进行pcr,使用程序如下:
94℃预变性3分钟;
94℃变性30秒,72度退火延伸共40秒,共5个循环;
72度总延伸3分钟;
94度预变性3分钟;
94度变性30秒,72度退火延伸共75秒,共20个循环;
72度总延伸10分钟。
(6)将所得的pcr目的片段vl-(cl-t2a-il2ss)-vh回收后,通过常规酶切连接构建到改造好的含有ch1-fc的真核表达分泌载体上,化学转化到大肠杆菌感受态里。同时做一组常规pcr(非乳液pcr)的产物的对照。
(7)随机挑取50个克隆进行sanger测序分析,结果见表2,约90%的序列为正确配对的序列,而对照组则仅有一个正确配对的序列。
表2
五、活性验证
用培养基对表面展示有重排全长抗体的感受细胞进行孵育,再利用二抗进行染色,并通过流式验证该全长抗体对抗原的结合活性。
我们将已知的抗原tpor的抗体3d9的单链抗体形式,经过图2中pcr过程,重排为全长抗体形式后,插入到膜展示蛋白型的载体中(图5),在hek293t细胞中表达后,再利用生物素化的抗原bio-tpor进行孵育,然后利用亲和素偶联荧光素sa-pe对抗原进行染色,同时用针对fc的抗体对抗体进行染色,进行流式分析。如图6所示,pcdhcontrol为空载体对照组(双阳性比例:0.25%),而展示ires连接的全长抗体的细胞(双阳性比例:47.8%)和展示t2a连接的全长抗体的细胞(双阳性比例:63.5%),都能有效结合抗原。
同时,我们将通过图2中pcr反应重排好的t2a连接的全长抗体形式的3d9插入到分泌型蛋白的载体中(图5),通过转染表达获得了含有全长抗体形式的3d9的培养基,加入到过表达抗原tpor的细胞中,再利用二抗对抗体进行染色。如图7所示,分泌型的全长抗体3d9也可有效结合抗原(双阳性比例:5.38%)。
六、单链抗体模板上vh与vl其他排列方式的补充说明
当单链抗体模板上重链可变区(vh)和轻链可变区(vl)为头头相接时(轻重链的5’端相对),重排原理图可分别参见图3(重排后轻链在前)和图4(重排后重链在前)。其中,cl-t2a-il2ss片段的t2a可以替代为ires启动子,同时为隔开轻重链的表达,在cl和ires启动子之间再加入一个终止子,以分别表达vl-cl以及vh-ch;重排后重链在前的连接片段中,cl片段被ch片段(具体可为ch1-fc)替代;引物序列组做相应调整,具体过程不再赘述。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!