一株巨大芽孢杆菌P5-2及其分离方法和应用与流程
本发明属于微生物应该领域,具体涉及一株巨大芽孢杆菌p5-2及其分离方法和应用。
背景技术:
微生物脱氮技术就是在人为控制下利用微生物将污水中的no3-还原为n2清除废水中硝态氮的过程。如果废水中存在的含氮化合物是氨态氮,则先将氨态氮氧化为硝态氮即先进行硝化作用,然后再在厌氧条件下反硝化作用,进行脱氮,形成“硝化-反硝化”的脱氮过程与工艺。
而微生物脱氮法在实际应用中,因为是贫营养条件,因此所用菌株生长速度慢,脱氮效率较低,环境适应能力相对较弱。
技术实现要素:
有鉴于此,本发明所要解决的技术问题,就是提出一株巨大芽孢杆菌p5-2,此外,本发明还提出了该微生物的分离方法和应用。
为解决上述技术问题,本发明采用以下技术方案予以实现:
一株巨大芽孢杆菌p5-2,于2019年1月7日保藏在广东省微生物菌种保藏中心,保藏编号为gdmccno.60536。
相对地,该一株巨大芽孢杆菌p5-2,其16srrna基因测序结果如seqidno.1所示。
进一步地,巨大芽孢杆菌p5-2的生长条件为:25℃~40℃、ph5~9、盐度0~40‰,优选的最佳生长条件为:30℃,盐度为0或10‰,ph为7。
本发明的一株巨大芽孢杆菌p5-2的分离方法,包括如下步骤:
s1、取样
在罗非鱼工厂化循环水养殖车间,取养殖用水水样和生物填料共同置于4℃冰箱保存,备用于富集分离;
s2、初筛
在250ml锥形瓶中加入120ml的5号富集分离培养基,使用100ml量筒取20ml水样加入50ml的离心管中震荡约30s后放入5号富集分离固体培养基中(包含15个生物填料),置于32℃,180r/min的摇床中恒温培养5~7d,重复以上操作两次,取第三次富集的培养液进行梯度稀释将其稀释至10-3、10-4、10-5,取稀释液各150μl,涂布至5号富集分离固体培养基,每个稀释浓度各做2皿,置于32℃恒温培养箱中培养1~3d;使用接种环挑选单菌落,接种至5号富集分离固体培养基平板上进行纯化培养,经过多次划线纯化培养后获得纯种菌株;
s3、复筛
将上述获得纯种待测菌株分别接种于异养硝化培养基中,置于32℃,180r/min的恒温摇床中培养,24h后检测培养液中nh4+-n,选择nh4+-n含量最低的一株菌,即得巨大芽孢杆菌p5-2。
进一步地,所述的5号富集分离固体培养基包括如下含量的组分:0.7g/l的kno3、2.75g/l的葡萄糖、1.24g/l的kh2po4·2h2o、3.046g/l的k2hpo4·3h2o、4g/l的nacl,3ml的微量元素溶液以及15g/l的琼脂,该5号富集分离固体培养基的ph为7.5。
进一步地,所述的微量元素溶液包括如下含量的组分:3g/l的mgso4·7h2o、1.12g/l的h3bo3、3g/l的mnso4、0.3g/l的feso4·7h2o、3g/l的znso4·7h2o、0.6g/l的cacl2。
进一步地,所述异养硝化培养基包括如下含量的组分:0.4g/l的(nh4)2so4、5g/l的柠檬酸钠、0.01g/l的nacl、0.05g/l的mgso4·7h2o、0.2g/l的k2hpo4、0.01g/l的feso4·7h2o、0.01g/l的mnso4,该异养硝化培养基的ph为7.0。
本发明的一株巨大芽孢杆菌p5-2对水产品无害,且脱氮效果良好,因此,其可应用在水中或水产养殖水中的氨氮或亚硝酸盐氮的去除剂。
与现有技术相比,本发明具有的有益效果为:
本发明的巨大芽孢杆菌的生长速度快,脱氮效率高,环境适应能力强,对水产品无害,在贫营养条件下的氨氮去除率在60%以上,且不仅可以去除水中的氨氮也可以去除亚硝酸盐氮;本发明的巨大芽孢杆菌作为氮去除剂使用时,由于其对水产品无害,因此特别适合水产养殖水中去除氮。
附图说明
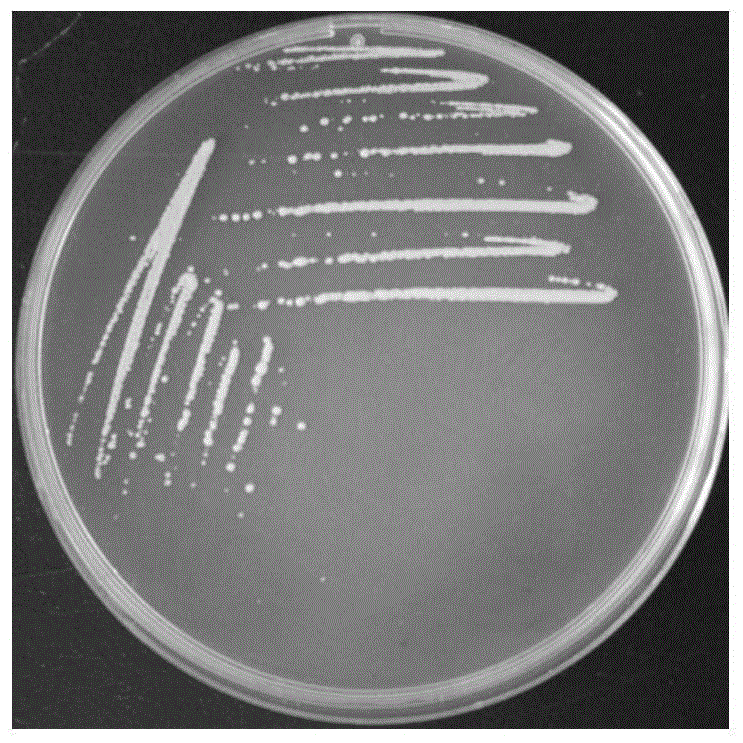
图1为本发明的巨大芽孢杆菌p5-2在lb固体培养基上的菌落形态;
图2为本发明的巨大芽孢杆菌p5-2的革兰氏染色(呈蓝紫色);
图3为本发明的巨大芽孢杆菌p5-2对淀粉(3-1)及水解酪蛋白(3-2)的水解结果图;
图4为本发明的巨大芽孢杆菌p5-2在不同温度(a)、盐度(b)和ph(c)条件下的生长曲线图;
图5为本发明的巨大芽孢杆菌p5-2的生长曲线和硝化性能曲线图;
图6为不同碳源(a)、碳氮比(b)、ph(c)、转速(d)对巨大芽孢杆菌p5-2生长及nh4+-n去除率的影响图。
具体实施方式
为让本领域的技术人员更加清晰直观的了解本发明,下面将结合附图,对本发明作进一步的说明。
实施例1
巨大芽孢杆菌p5-2的分离
s1、取样
在广州市番禺良种场罗非鱼工厂化循环水养殖车间,取养殖用水水样和生物填料共同置于4℃冰箱保存,备用于富集分离;
s2、初筛
在250ml锥形瓶中加入120ml的5号富集分离培养基,使用100ml量筒取20ml水样加入50ml的离心管中震荡约30s后放入5号富集分离固体培养基中(包含15个生物填料),置于32℃,180r/min的摇床中恒温培养5~7d,重复以上操作两次,取第三次富集的培养液进行梯度稀释将其稀释至10-3、10-4、10-5,取稀释液各150μl,涂布至5号富集分离固体培养基,每个稀释浓度各做2皿,置于32℃恒温培养箱中培养1~3d;使用接种环挑选单菌落,接种至5号富集分离固体培养基平板上进行纯化培养,经过多次划线纯化培养后获得纯种菌株;
s3、复筛
将上述获得纯种待测菌株分别接种于异养硝化培养基中,置于32℃,180r/min的恒温摇床中培养,24h后检测培养液中nh4+-n,选择nh4+-n含量最低的一株菌,即得巨大芽孢杆菌p5-2。
上述的5号富集分离固体培养基包括如下含量的组分:0.7g/l的kno3、2.75g/l的葡萄糖、1.24g/l的kh2po4·2h2o、3.046g/l的k2hpo4·3h2o、4g/l的nacl,3ml的微量元素溶液以及15g/l的琼脂,该5号富集分离固体培养基的ph为7.5;其中的微量元素溶液包括如下含量的组分:3g/l的mgso4·7h2o、1.12g/l的h3bo3、3g/l的mnso4、0.3g/l的feso4·7h2o、3g/l的znso4·7h2o、0.6g/l的cacl2。
上述异养硝化培养基包括如下含量的组分:0.4g/l的(nh4)2so4、5g/l的柠檬酸钠、0.01g/l的nacl、0.05g/l的mgso4·7h2o、0.2g/l的k2hpo4、0.01g/l的feso4·7h2o、0.01g/l的mnso4,该异养硝化培养基的ph为7.0。
菌株p5-2的16srrna基因
用细菌dna提取试剂盒提取待测菌株的细菌基因组dna,具体操作步骤参照说明书。以提取的细菌基因组dna作为模板,对细菌进行扩增,扩增16srrna的引物:
27f:5′–gtttgatcctggctcag–3′;
1492r:5′–tacggctaccttgttacgactt–3′。
反应体系(25μl)为:模板dna1μl,正反向引物各0.5μl,mix12.5μl,灭菌蒸馏水10.5μl,pcr扩增的反应条件:94℃3min;94℃30s,56℃30s,72℃90s,30个循环;72℃10min。pcr产物送至广州艾基生物技术有限公司进行测序,测的序列如seqidno.1所示。
该菌株已于2019年1月7日保藏在广东省微生物菌种保藏中心,保藏地址为广州市先烈中路100号大院59号楼5楼,菌种名称:巨大芽孢杆菌(bacillusmegaterium)p5-2,保藏编号为gdmccno.60536。
实施例2
分离纯化得到的高效脱氮的异养巨大芽孢杆菌(bacillusmegaterium)p5-2,在lb固体培养基上的菌落形态如图1所示,革兰氏染色显示呈阳性(图2);可水解淀粉(图3-1)及酪蛋白(图3-2);
实施例3
通过腹腔注射法和浸泡法来检测菌株p5-2对罗非鱼的安全性。注射实验结果表明,在给体重为(6.5±1.5)g罗非鱼注射100μl浓度分别为1.5×107cfu/ml、1.5×108cfu/ml和1.5×109cfu/ml的菌液的条件下,并没有出现死亡及其他异常情况;浸泡实验结果表明,水体中p5-2浓度在1.5×106cfu/ml及1.5×107cfu/ml的情况下,体重为(1.0±0.5)g的罗非鱼并没有出先死亡及其他异常现象。以上结果表明p5-2是一株安全性能好的菌株。
实施例4
菌株p5-2在25℃~40℃、ph5~9、盐度0~40‰条件下均可以正常生长,最佳生长条件:温度为30℃,盐度为0或10‰,ph为7(图4);
实施例5
菌株p5-2具有良好的脱氮能力,32h氨氮去除率达96.70%,总氮去除率达94.18%(图5);24h亚硝酸盐氮的去除率达99.94%(见表1);
表1菌株p5-2的好氧反硝化效果
菌株p5-2的脱氮效果会随着外界条件因素的改变而改变,当以柠檬酸钠为碳源,碳氮比为15,ph为7,转速为180r/min时,脱氮效果最佳,24h氨氮去除率达99.07%(图6)。
上述对实施例的描述是为便于该技术领域的普通技术人员能理解和应用本发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于这里的实施例,本领域技术人员根据本发明的揭示,对于本发明做出的改进和修改都应该在本发明的保护范围之内。
序列表
<110>中国水产科学研究院珠江水产研究所
<120>一株巨大芽孢杆菌p5-2及其分离方法和应用
<160>1
<170>siposequencelisting1.0
<210>1
<211>1436
<212>dna
<213>巨大芽孢杆菌(bacillusmegaterium)
<400>1
taatgcagtcgagcgaactgattagaagcttgcttctatgacgttagcggcggacgggtg60
agtaacacgtgggcaacctgcctgtaagactgggataacttcgggaaaccgaagctaata120
ccggataggatcttctccttcatgggagatgattgaaagatggtttcggctatcacttac180
agatgggcccgcggtgcattagctagttggtgaggtaacggctcaccaaggcaacgatgc240
atagccgacctgagagggtgatcggccacactgggactgagacacggcccagactcctac300
gggaggcagcagtagggaatcttccgcaatggacgaaagtctgacggagcaacgccgcgt360
gagtgatgaaggctttcgggtcgtaaaactctgttgttagggaagaacaagtacgagagt420
aactgctcgtaccttgacggtacctaaccagaaagccacggctaactacgtgccagcagc480
cgcggtaatacgtaggtggcaagcgttatccggaattattgggcgtaaagcgcgcgcagg540
cggtttcttaagtctgatgtgaaagcccacggctcaaccgtggagggtcattggaaactg600
gggaacttgagtgcagaagagaaaagcggaattccacgtgtagcggtgaaatgcgtagag660
atgtggaggaacaccagtggcgaaggcggctttttggtctgtaactgacgctgaggcgcg720
aaagcgtggggagcaaacaggattagataccctggtagtccacgccgtaaacgatgagtg780
ctaagtgttagagggtttccgccctttagtgctgcagctaacgcattaagcactccgcct840
ggggagtacggtcgcaagactgaaactcaaaggaattgacggggggcccgcacaagcggt900
ggagcatgtggtttaattcgaagcaacgcgaagaaccttaccaggtcttgacatcctctg960
acaactctagagatagagcgttccccttcgggggacagagtgacaggtggtgcatggttg1020
tcgtcagctcgtgtcgtgagatgttgggttaagtcccgcaacgagcgcaacccttgatct1080
tagttgccagcatttagttgggcactctaaggtgactgccggtgacaaaccggaggaagg1140
tggggatgacgtcaaatcatcatgccccttatgacctgggctacacacgtgctacaatgg1200
atggtacaaagggctgcaagaccgcgaggtcaagccaatcccataaaaccattctcagtt1260
cggattgtaggctgcaactcgcctacatgaagctggaatcgctagtaatcgcggatcagc1320
atgccgcggtgaatacgttcccgggccttgtacacaccgcccgtcacaccacgagagttt1380
gtaacacccgaagtcggtggagtaaccgtaaggagctagccgcctaagtgacgagc1436
- 还没有人留言评论。精彩留言会获得点赞!