一种含喹唑啉结构的EGFR抑制剂的制备方法及应用与流程
本发明涉及EGFR抑制剂制备技术领域,具体涉及一种含喹唑啉结构的EGFR抑制剂的制备方法及应用。
背景技术:
恶性肿瘤是当今世界严重威胁人类健康的重大疾病之一,也是人类主要致死疾病之一,由恶性肿瘤引发的人类死亡率在所有疾病中高居第二位。化学药物治疗是当今治疗肿瘤的主要手段之一,但化疗药物在作用于靶细胞时往往累及正常细胞,产生免疫功能低下、骨髓抑制、脏器受损等毒副作用,严重的副作用和多药耐药等问题使其应用受到很大的限制。
酪氨酸蛋白激酶(TPK)是控制细胞生长和分化的重要蛋白质,在正常细胞分裂和异常细胞增殖中起关键作用,是目前研究最为广泛且效果最为明显的靶点之一。表皮生长因子受体(EGFR)是一种受体酪氨酸激酶,介导胞外向胞内的信号转导,调节细胞增殖和分化。人类30%-50%的表皮肿瘤都表现出EGFR的过度表达或异常突变,比如子宫颈癌、乳腺癌、食道癌等,引起细胞更发达的信号传导,从而导致恶性肿瘤的形成和发展。因此可以选择EGFR作为表皮肿瘤治疗的重要靶点,致力于开发出一些新型的 EFGR酪氨酸蛋白激酶抑制剂。
目前研究中的EGFR抑制剂主要包括喹唑啉类和嘧啶类,喹唑啉是一种天然生物碱,其衍生物具有许多不同的生物学特性,比如催眠、镇痛、抗炎等。同时,喹唑啉衍生物已经被证明含有酪氨酸蛋白激酶抑制剂的活性,有抗癌、抑菌、抗病毒等功能,近年来在肿瘤药物的研究中得到广泛关注。已有多个以EGFR为靶点具喹唑啉衍生物结构的抗肿瘤药物上市,代表化合物为吉非替尼(Gefitinib)、拉帕替尼(Lapatinib)、达克米替尼(Dacomitinib)、阿法替尼(Afatinib)等。
现有含喹唑啉结构的EGFR抑制剂制备方法复杂,制备的肿瘤药物治疗效果不是很好。
技术实现要素:
针对现有技术中的缺陷,本发明提供一种含喹唑啉结构的EGFR抑制剂的制备方法及应用,以解决上述背景技术中提出的问题。
为实现上述目的,本发明采用了如下技术方案:
本发明提供了步骤i:将2mmol的4-羟基喹唑啉、2mmol的溴乙酸乙酯和10mL的溶剂丙酮依次加入到25mL圆底烧瓶中,加热至50℃回流,搅拌反应10h,反应结束后,将反应液倒至50mL蒸馏水中,将产生的固体过滤分离,水相用30mL×3的乙酸乙酯萃取3次,合并有机相,用无水硫酸钠干燥,减压除去溶剂得中间体,经重结晶得纯的中间体2;
步骤ii:将1mmol的中间体2、1mL的水合肼和10mL的溶剂无水乙醇依次加入到25mL圆底烧瓶中,80℃回流5h左右,TLC跟踪反应,反应结束后,将反应液倒入 50mL冰水混合液中,固体物质析出后,无水乙醇重结晶得纯的中间体3;
步骤iii:1mmol的中间体3再分别与1mmol的不同醛反应,10mL的无水乙醇作溶剂,滴3-4滴冰乙酸,室温下反应2-3h,TLC跟踪反应,反应结束后,减压除去溶剂得到固体物质,硅胶柱层析或无水乙醇重结晶得纯的终产物4a-4l;
其中4a中R为4b中R为4c中R为4d中R为 4e中R为4f中R为4g中R为4h中R为4i 中R为4j中R为4k中R为4l中R为
本发明还提供了一种含喹唑啉结构的EGFR抑制剂在抗癌药物中的应用。
优选地,含喹唑啉结构的EGFR抑制剂在抗癌药物中的应用,其结构如下式所示:
其中4a中R为4b中R为4c中R为4d中R为 4e中R为4f中R为4g中R为4h中R为4i 中R为4j中R为4k中R为4l中R为
与现有技术相比,本发明具有如下的有益效果:
本发明基于喹唑啉化合物在EGFR为靶点上的成功应用,本实验以4-羟基喹唑啉为母核,经过3步反应合成制备了十几个新型喹唑啉衍生物,根据抗癌活性评价结果,以期为今后喹唑啉衍生物在抗肿瘤药物的研究上提供理论基础,本发明对人肺癌细胞细胞(A549),人乳腺癌细胞(MCF-7),人宫颈癌细胞(Hela)有明显的抑制作用,与对照组相比,活性明显提高,尤其是对人宫颈癌细胞,因此本发明的喹唑啉衍生物可以应用于制备抗肿瘤药物。
附图说明
通过阅读参照以下附图对非限制性实施例所作的详细描述,本发明的其它特征、目的和优点将会变得更明显:
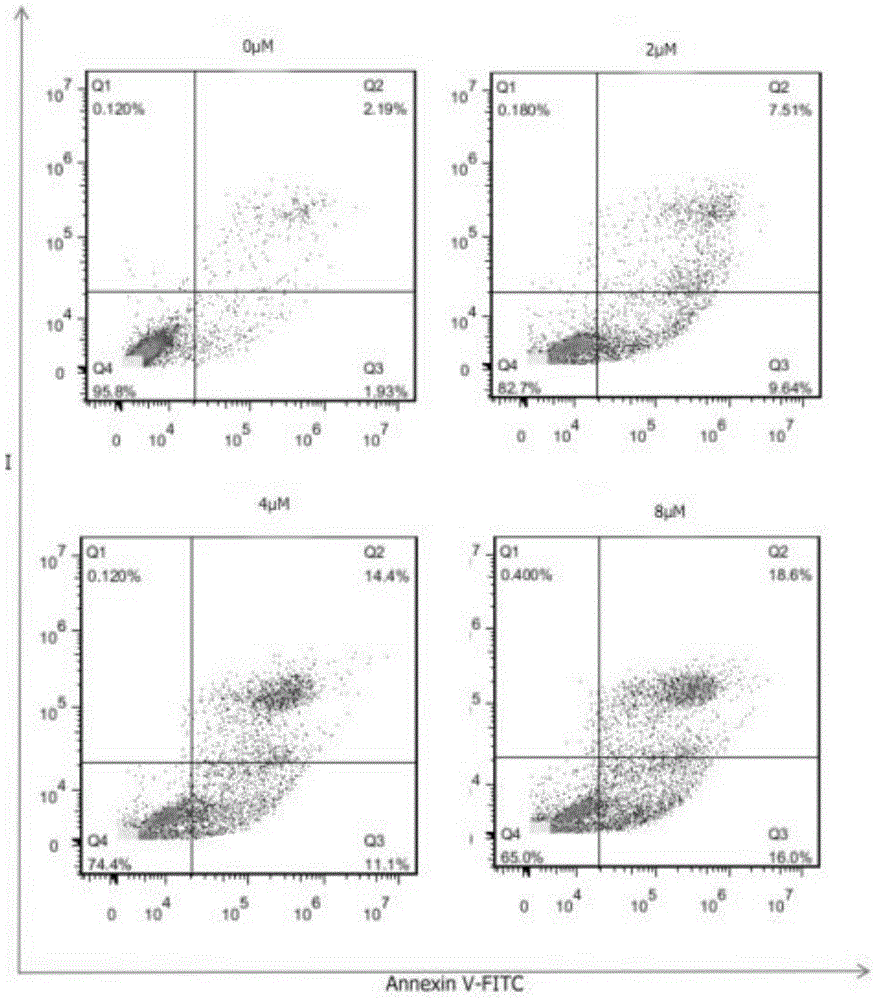
图1为本发明Hela细胞经不同浓度的化合物4a(0、2、4、8μM)处理24h后的细胞凋亡。
具体实施方式
下面结合附图及具体实施例,对发明中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
在某个具体的实施例中,本发明的制备过程和相关产物的结构式如下所述:
目标化合物4a-4l合成过程所需的实验试剂及条件:(i)溴乙酸乙酯,丙酮,50℃, 10h;(ii)水合肼,乙醇,80℃回流,5h;(iii)醛,乙醇,室温,2-3h。
含喹唑啉结构的EGFR抑制剂的结构如式所示:
其中,化合物4a-4l的结构:
实施例1:化合物4a的制备
将4-羟基喹唑啉(2mmol)、溴乙酸乙酯(2mmol)和溶剂丙酮(10mL)依次加入到25mL圆底烧瓶中,加热至50℃回流,搅拌反应10h。反应结束后,将反应液倒至50mL蒸馏水中,将产生的固体过滤分离。水相用乙酸乙酯(30mL×3)萃取3次,合并有机相,用无水硫酸钠干燥,减压除去溶剂得中间体,经重结晶得纯的中间体2;
将中间体2(1mmol)、水合肼(1mL)和溶剂无水乙醇(10mL)依次加入到25mL 圆底烧瓶中,80℃回流5h左右,TLC跟踪反应。反映结束后,将反应液倒入50mL 冰水混合液中,固体物质析出后,无水乙醇重结晶得纯的中间体3;
中间体3(1mmol)再分别与对甲氧基苯甲醛(1mmol)反应,无水乙醇(10mL) 作溶剂,滴3-4滴冰乙酸,室温下反应2-3h,TLC跟踪反应。反应结束后,减压除去溶剂得到固体物质,硅胶柱层析或无水乙醇重结晶得纯的终产物4a。
白色固体,产率:57%,熔点:126.8-127.7℃。1H NMR(DMSO-d6,600MHz)δ: 11.23(s,1H),11.12(s,1H),8.08(s,1H),7.92(s,1H),7.58-7.62(m,2H), 6.98-7(m,3H),3.79(s,3H),3.34(s,1H),2.17(s,2H),1.93(s,1H);13C NMR(100 MHz,CDCl3-d6)δ:176.92,170.53,165.87,165.68,150.72,150.59,147.63, 147.52,133.73,133.37,132.11,119.51,119.45,60.48,60.47,45.14,44.86, 44.30.
实施例2:化合物4b的制备
制备方法参考实施案例一。白色固体,产率:67%,熔点:135.3-135.7℃。1H NMR (DMSO-d6,600MHz)δ:11.61(s,1H),11.45(s,1H),8.53(s,1H),8.38(s,1H), 7.93-7.99(m,1H),7.50-7.52(m,1H),7.40-7.43(m,3H),3.34(s,1H),2.22(s, 2H),1.97(s,1H);13C NMR(100MHz,CDCl3-d6)δ:177.34,170.96,146.66,143.75, 143.71,138.20,136.75,136.24,135.09,132.77,131.94,131.73,45.15,44.73, 44.45,26.88,25.48.
实施例3:化合物4c的制备
制备方法参考实施案例一。白色固体,产率:70%,熔点:165.9-166.5℃。1H NMR (DMSO-d6,600MHz)δ:11.44(s,1H),11.31(s,1H),8.07(s,1H),7.90(s, 1H),7.66-7.68(d,J=11.4Hz,1H),7.55-7.59(m,1H),7.39-7.41(m,3H),3.28 (s,1H),2.15(s,2H),1.90(s,1H);13C NMR(100MHz,CDCl3-d6)δ:177.35,171.00, 149.14,146.12,141.86,138.35,135.88,134.67,131.43,131.20,130.65,45.00, 44.73,44.87,44.45,26.85,25.49.
实施例4:化合物4d的制备
制备方法参考实施案例一。白色固体,产率:72%,熔点:146.5-147.2℃。1H NMR (DMSO-d6,600MHz)δ:11.43(s,1H),11.31(s,1H),8.13(s,1H),7.97(s,1H), 7.67-7.71(m,2H),7.48-7.50(m,2H),3.34(s,2H),2.20(s,2H),1.95(s,1H); 13C NMR(100MHz,CDCl3-d6)δ:177.23,170.87,149.51,146.45,139.48,139.25, 138.55,138.46,134.08,133.78,133.47,45.01,44.87,44.73,44.45,26.86, 25.45.
实施例5:化合物4e的制备
制备方法参考实施案例一。白色固体,产率:61%,熔点:163.9-165.4℃.1H NMR (DMSO-d6,600MHz)δ:11.50(s,1H),11.36(s,1H),8.11(s,1H),7.95(s,1H), 7.88(s,1H),7.85(s,1H),7.65-7.68(m,1H),7.58-7.60(m,1H),7.37-7.41(m, 1H),3.34(s,1H),2.20(s,2H),1.96(s,1H);13C NMR(100MHz,CDCl3-d6)δ: 177.34,171.00,149.03,148.89,146.04,145.92,142.09,137.56,136.19,134.32, 133.97,131.23,127.32,45.01,44.73,26.85,25.51.
实施例6:化合物4f的制备
制备方法参考实施案例一。白色固体,产率:1%,熔点:151.8-152.6℃.1H NMR (DMSO-d6,600MHz)δ:11.44(s,1H),11.32(s,1H),8.12(s,1H),7.95(s,1H), 7.63(s,2H),7.61-7.62(d,J=2.52Hz,3H),3.34(s,1H),2.20(s,2H),1.95(s, 1H);13C NMR(100MHz,CDCl3-d6)δ:177.24,170.88,149.59,146.55,146.44, 138.89,136.98,134.02,133.71,128.25,128.00,45.01,44.87,44.59,44.45, 26.86,25.45.
实施例7:化合物4g的制备
制备方法参考实施案例一。黄色固体,产率:73%,熔点:159.5-160.7℃.1H NMR (DMSO-d6,600MHz)δ:11.15(s,1H),7.80-7.81(d,J=7.86Hz,1H),7.58-7.60 (d,J=7.32Hz,3H),7.36-7.39(m,3H),6.94-7.00(m,2H),3.35(s,1H),2.12(s, 3H),1.92(s,2H);13C NMR(100MHz,CDCl3-d6)δ:172.15,165.9,148.00,145.59, 138.95,138.63,136.40,129.29,129.20,129.14,127.45,126.10,125.74,40.26, 40.12,39.98,39.70,22.08,20.72.
实施例8:化合物4h的制备
制备方法参考实施案例一。白色固体,产率:67%,熔点:193.5-195.2℃.1H NMR (DMSO-d6,600MHz)δ:11.19(s,1H),8.33(s,1H),8.26(s,1H),8.33(s,1H), 7.49-7.50(d,J=8.82Hz,1H),7.22-7.29(m,1H),6.85-6.91(m,3H),3.33(s,1H), 2.18(s,2H),1.97(s,2H);13CNMR(100MHz,CDCl3-d6)δ:176.72,170.62,162.51, 161.56,151.42,146.10,145.97,136.41,134.63,131.96,125.21,124.50,123.80, 121.56,44.99,26.58,25.56.
实施例9:化合物4i的制备
制备方法参考实施案例一。黄色固体,产率:69%,熔点:238.3-239.9℃.1H NMR (DMSO-d6,600MHz)δ:11.04(s,1H),9.85(s,1H),7.88(s,1H),7.47-7.50(m, 3H),6.80-6.82(m,3H),3.35(s,1H),2.16(s,3H),1.91(s,1H);13C NMR(100 MHz,CDCl3-d6)δ:172.06,165.68,159.67,159.47,146.35,143.26,129.14, 128.76,125.77,116.11,116.08,40.24,39.96,39.82,39.68,22.07,20.70.
实施例10:化合物4j的制备
制备方法参考实施案例一。黄色固体,产率:57%,熔点:173.8-174.9℃.1H NMR (DMSO-d6,600MHz)δ:11.68(s,1H),11.56(s,1H),8.25-8.29(m,3H),8.08 (s,1H),7.91-7.95(m,3H),3.34(s,1H),2.24(s,2H),2.0(s,1H);13C NMR (100MHz,CDCl3-d6)δ:172.83,166.49,148.16,147.99,143.54,141.23,141.09, 140.59,128.30,127.98,124.48,40.25,39.97,39.83,39.69,22.15,20.69.
实施例11:化合物4k的制备
制备方法参考实施案例一。白色固体,产率:74%,熔点:133.4-134.9℃.1H NMR (DMSO-d6,600MHz)δ:11.37(s,1H),11.25(S,1H),8.14(S,1H),7.98(S,1H), 7.65-7.68(m,2H),7.40-7.44(m,4H),3.33(S,1H),2.20(S,2H),1.95(S,1H); 13C NMR(100MHz,CDCl3-d6)δ:177.17,170.80,150.83,150.70,147.75,147.63, 139.58,139.51,134.86,134.00,132.16,131.84,45.00,44.73,44.45,26.86, 25.46.
实施例12:化合物4l的制备
制备方法参考实施案例一。白色固体,产率:74%,熔点:132.1-134.3℃.1H NMR (DMSO-d6,600MHz)δ:10.56(s,1H),10.42(s,1H),7.47(s,1H),7.24(s,1H), 6.93-6.90(m,1H),6.51-6.4(m,1H),6.33-6.29(m,3H),1.55-1.54(m,2H),1.25 (s,1H),1.00(s,1H).13C NMR(100MHz,CDCl3-d6)δ:172.53,166.14,161.95, 161.84,160.30,138.73,135.78,131.97,126.71,126.52,125.34,122.32,116.46, 40.09,39.81,22.10,20.64.
实验例1:
实施例1-12喹唑啉衍生物的体外抗癌活性研究进展
采用MTT[3-(4,5)-双甲基-2-噻唑-(2,5)-苯基溴化四氮唑蓝]法来测定含含NO供体的二茂铁-吡唑衍生物对人肺癌细胞细胞(A549),人乳腺癌细胞(MCF-7),人宫颈癌细胞(Hela)抑制率达到50%时的药物浓度(half maximal inhibitory concentration, IC50)。
取处于对数生长期的细胞用胰蛋白酶消化直至大部分细胞处于半脱落状态,以1100 rpm离心5min后弃去上清液。用培养液重悬细胞,吹打均匀后取两滴细胞悬液使用台盼蓝(Trypan Blue)染色,于显微镜下计数活细胞数目(死细胞数目不得超过5%),用培养液调整细胞密度至1×105个/mL。于96孔细胞培养板中每孔加入100μL细胞悬液,同时外围四周孔用PBS缓冲液等体积填充。将96孔培养板置于37℃、5%CO2培养箱中,培养12h。
取出培养板后于每孔中加100μL含不同浓度化合物4a的溶液,使得药物终浓度分别为10,20,50,100μM,每个浓度设6组平行组,另设6孔非给药对照孔(培养液和细胞)、6孔空白对照组(仅培养液)、阳性对照组(培养液、细胞、阳性对照药 Gefitinib)。处理后于CO2培养箱中继续培养24h。
使用PBS盐酸缓冲溶液配制浓度为5mg/mL的MTT混合液,在培养板的每孔中加入 10μL制备的MTT溶液,振荡混匀后继续孵育4h。弃去孔中的液体后,加入150μL DMSO 溶液以溶解沉淀在孔中的沉淀,细胞内晶体完全溶解。用酶标仪测定各孔光吸收(OD 值),测定波长490nm,重复三次,根据各孔OD值计算药物对细胞增殖的抑制率。抑制率的计算:
生长抑制率=(1-存活率)×100%=[1-(OD实验-OD空白)/(OD对照-OD空白)] ×100%(OD实验表示实验组的平均光密度,OD对照表示对照组的平均光密度,OD空白表示空白组的平均光密度)。
根据药物浓度-细胞生长抑制率的标准曲线,求其IC50。
本发明所列喹唑啉衍生物对肿瘤细胞的抑制IC50值(μM)见下表:
表1 4a-4l化合物对3种癌细胞的体外抗增值活性
从上述实验可知:绝大多数化合物具有很显著的抗细胞增殖活性,总体而言化合物对Hela、MCF-7细胞的抗增殖活性要比A549细胞要好。12个化合物中,化合物4a对 Hela、MCF-7、A549均表现出较强的细胞抗增殖活性,IC50值分别为10.23、12.78、15.12 μM,与阳性对照药Gefitinib的值(8.84、7.12、9.44μM)接近。
实验例2:
实施例1-12喹唑啉衍生物的体外细胞凋亡检测
选取对数期的Hela细胞,调整细胞浓度1.0×105个/mL,于6孔板中每孔加入2mL 细胞悬液,在37℃、5%CO2培养箱中培养12h。每孔中加入化合物4a配制的溶液,药物终浓度分别为2,4,8μM,并设置非给药对照孔(培养液和细胞)。
在培养箱中孵育24h后,弃去培养基并将细胞用胰蛋白酶消化约1min,用PBS 磷酸盐缓冲溶液在1.5mL离心管中重新悬浮细胞,1100rpm离心5min后弃去上清液并用PBS磷酸盐缓冲溶液洗涤两次。将细胞重悬于200μL Binding Buffer中,加入 10μL Annexin V-FITC和5μL PI,混匀后避光室温反应15min。加入300μL Binding Buffer并在2h内通过流式细胞仪(FACScalibur)上机检测。每组样本收集至少10000 个细胞进行计数,使用FlowJo 7.6.1(FACSCA2BUR,Becton Dickinson,USA)进行数据分析并作图。
选取活性最好的化合物4a对被抑制效果最好的Hela细胞进行抗凋亡检测,使用 Annexin V-FITC/PI双染法进行了流式细胞凋亡实验,分别设计了药物浓度梯度变化以及药物时间梯度变化的实验组,用流式细胞仪分析凋亡标志物变化。
由图1可知,当分别用0μM、2μM、4μM、8μM浓度的化合物4a处理Hela 细胞并培养24h后,化合物4a可以诱导Hela细胞凋亡。对照组中(药物浓度为0μM) 细胞发生死亡和凋亡的数量很少(4.12%),经不同浓度的(2、4、8μM)化合物4a 处理细胞后,凋亡比例以剂量依赖的方式显著提升(凋亡比例依次为17.15%,25.5%、 34.6%)。说明化合物4a能有效的诱导肿瘤细胞Hela凋亡,表明化合物4a具有较好的凋亡诱导作用。
对于本领域技术人员而言,显然本发明不限于上述示范性实施例的细节,而且在不背离本发明的精神或基本特征的情况下,能够以其他的具体形式实现本发明。因此,无论从哪一点来看,均应将实施例看作是示范性的,而且是非限制性的,本发明的范围由所附权利要求而不是上述说明限定,因此旨在将落在权利要求的等同要件的含义和范围内的所有变化囊括在本发明内。不应将权利要求中的任何附图标记视为限制所涉及的权利要求。
此外,应当理解,虽然本说明书按照实施方式加以描述,但并非每个实施方式仅包含一个独立的技术方案,说明书的这种叙述方式仅仅是为清楚起见,本领域技术人员应当将说明书作为一个整体,各实施例中的技术方案也可以经适当组合,形成本领域技术人员可以理解的其他实施方式。
- 还没有人留言评论。精彩留言会获得点赞!
- SPNP‑I在制备Nav1.7通道工具试剂中的应用的制造方法与工艺
- SPNP‑I在制备Nav1.2通道工具试剂中的应用的制造方法与工艺
- SPNP‑IX在制备Nav1.3通道抑制剂中的应用的制造方法与工艺
- SPNP‑IX在制备Kv4.2通道工具试剂中的应用的制造方法与工艺
- SPNP‑IX在制备Kv4.3通道工具试剂中的应用的制造方法与工艺
- SPNP‑27在制备Nav1.5通道抑制剂中的应用的制造方法与工艺
- SPNP‑27在制备Nav1.3通道抑制剂中的应用的制造方法与工艺
- 一种多肽在制备Nav1.3钠通道工具试剂中的应用的制造方法与工艺
- SPKP‑XI在制备Kv4.2通道抑制剂中的应用的制造方法与工艺
- SGLT‑2糖尿病抑制剂及其中间体的制备方法与流程