短小蛇根草OpWRKY2转录因子的编码序列及其应用的制作方法
本发明属于基因工程
技术领域:
,涉及一种利用opwrky2转录因子提高短小蛇根草毛状根中喜树碱含量的方法。
背景技术:
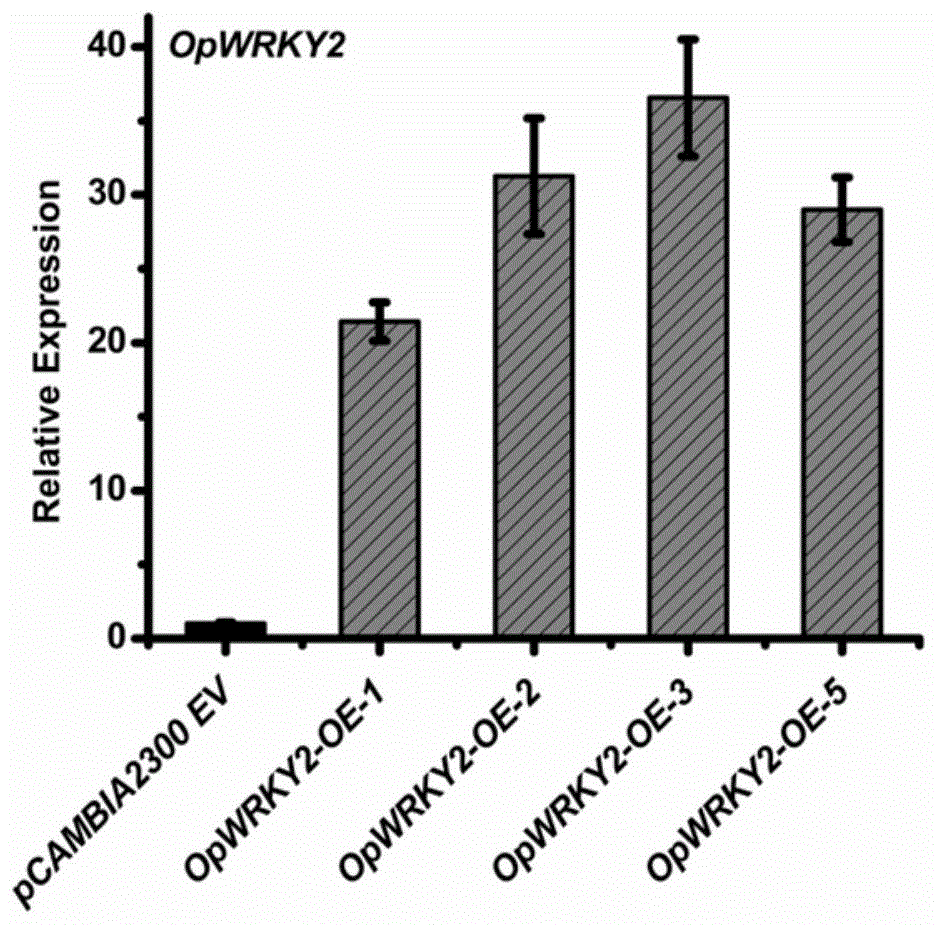
:短小蛇根草(ophiorrhizapumila)隶属于茜草科(rubiaceae)蛇根草属(ophiorrhiza),为双子叶多年生草本植物。全草均可入药,性味苦寒,具清热解毒之效,民间用来治疗高热、百日咳和外伤感染等。短小蛇根草是继喜树和青脆枝之后发现的喜树碱(camptothecin,cpt)药源植物。喜树碱类化合物是dna拓扑异构酶i(topoi)的特异性抑制剂,能够抑制细胞的复制、生长与繁殖,是一类广谱的抗癌药物。临床上被用来治疗结肠癌、直肠癌、卵巢癌等。然而单一的种植模式及匮乏的种质资源严重制约了喜树碱类抗癌药物的供应,无法满足逐年增长的市场需求。所以,提高喜树碱的产量成为了近些年的研究热点,通过代谢工程技术提高植物中次级代谢产物的含量是一个行之有效的方法。近些年来转录因子作为研究热点,被广泛的报道能够参与调控植物次级代谢。wrky转录因子是植物中最大的转录因子家族之一,其dna结合区包含一至两个wrky核心结构域,该结构域的n端含有七个高度保守的氨基酸序列,即wrkygqk,而其c端有一个特殊的锌指结构。锌指结构主要有两种形式:cx4-5cx22-23hxh和cx7cx23hxc。根据所含wrky结构域的数量和锌指结构类型的不同,wrky转录因子被划分为三类。wrky转录因子的生物学功能具有多样性,包括:响应生物胁迫与非生物胁迫、调控植物生长发育及调控植物代谢合成等。已有研究报道wrky转录因子在调控植物次生代谢调控过程中发挥重要作用。技术实现要素:本发明提供短小蛇根草opwrky2转录因子的编码序列及其应用,短小蛇根草的opwrky2可以促进短小蛇根草毛状根中喜树碱的积累;利用qrt-pcr分析转基因毛状根中喜树碱生物合成基因的表达,发现过量表达opwrky2基因可以明显提高optdc基因的表达;通过凝胶阻滞实验和双荧光素酶报告基因实验,发现opwrky2转录因子可以结合和瞬时激活喜树碱合成基因optdc的表达。本发明还提供了一种提高短小蛇根草毛状根中喜树碱含量的方法,并解析了opwrky2转录因子调控喜树碱生物合成的分子机制,为生产具有广谱抗癌疗效的喜树碱提供了一种新型优质药源,具有重要的理论意义和潜在的应用价值。本发明可以通过以下技术方案来实现:本发明从短小蛇根草中克隆得到opwrky2转录因子,所述opwrky2转录因子的核苷酸序列如seqidno.1所示,其基因编码框序列为1071bp;所述opwrky2转录因子的氨基酸序列如seqidno.2所示。构建过表达载体,遗传转化短小蛇根草茎段获得转基因毛状根;qrt-pcr分析opwrky2及喜树碱生物合成相关基因在毛状根中的表达;高效液相色谱测定转基因毛状根中喜树碱的含量;利用凝胶迁移实验及双荧光素报告基因检测实验证明opwrky2转录因子通过结合和激活喜树碱合成的基因optdc1来调控喜树碱的生物合成。本发明还提供了一种多肽,所述多肽的基酸序列如seqidno.2所示。本发明还提供了一种重组表达载体,所述重组表达载体包含如seqidno.1所示的核苷酸序列。重组表达载体可通过本领域常规方法制得,如通过将核苷酸序列构建至表达载体中获得,表达载体包括质粒等。本发明还提供了一种重组表达转化菌株,所述重组表达转化菌株包含如seqidno.1所示的核苷酸序列。重组表达转化菌株可通过将上述重组表达载体转入发根农杆菌中获得。本发明还提供了上述的短小蛇根草opwrky2转录因子的编码序列在提高短小蛇根草中喜树碱含量的应用。本发明还提供了一种利用opwrky2提高短小蛇根草毛状根中喜树碱含量的方法,包括以下步骤:步骤1、对短小蛇根草的转录组数据库进行分析,从短小蛇根草cdna文库中克隆得到短小蛇根草opwrky2基因的编码序列;步骤2、将所述opwrky2基因可操作性地连接于表达调控序列,形成含opwrky2基因的植物过表达载体;步骤3、将含opwrky2基因的植物过表达载体转化发根农杆菌,得到具有所述植物过表达载体的发根农杆菌菌株;步骤4、利用步骤3中构建的所述发根农杆菌菌株转化短小蛇根草,经抗生素筛选得到抗性毛状根,再经pcr检测为阳性的毛状根株系即为转基因短小蛇根草毛状根;步骤5、对步骤4中得到的所述转基因短小蛇根草毛状根进行喜树碱含量的测定,进而得到喜树碱含量提高的短小蛇根草毛状根株系。所述步骤3中,采用冻融法进行转入,所述发根农杆菌为c58c1菌株。本发明一个实施方式中,步骤2中将opwrky2基因构建至pcambia2300+获得含opwrky2基因的植物过表达载体,其中,所使用的植物表达载体为经过改造获得的pcambia2300+载体,包含camv35s启动子和nos终止子、多克隆位点、复制起始点及卡那霉素抗性位点。本发明一个实施方式中,步骤4所述pcr检测方法如下:设计发根基因rolb的特异引物,进行pcr扩增;设计camv35s启动子及插入基因opwrky2上、下游特异性引物,进行pcr扩增;琼脂糖凝胶电泳检测,出现目的条带则为阳性克隆。本发明一个实施方式中,步骤5中,采用高效液相色谱法进行转基因短小蛇根草毛状根喜树碱含量的测定,所述的高效液相色谱法如下:从各个转基因株系中取20μl喜树碱粗提物,注入高效液相色谱仪。所采用的色谱条件为:色谱柱采用c-18反相硅胶柱,以乙腈:水=35:65(v:v)比例为流动相,柱温设定为30℃,流速取1ml/min,检测波长为254nm。本发明一个实施方式中,采用qrt-pcr检测转基因短小蛇根草毛状根中opwrky2基因及喜树碱生物合成途径中关键酶基因的表达,所述qrt-pcr检测方法如下:对pcr鉴定为阳性的克隆进行总rna的提取,统一定量到0.5μg,反转录成cdna;设计opwrky2及喜树碱合成途径中关键酶基因、内参基因opactin的定量引物,以相同量的cdna为模板进行定量pcr分析;利用方法分析相关基因的表达情况。本发明一个实施方式中,利用凝胶迁移实验(emsa)检测opwrky2转录因子对optdc1基因启动子的结合能力,所述凝胶迁移实验(emsa)方法如下:设计opwrky2基因原核表达的引物,连接原核表达载体pcold-tf,并转化大肠杆菌(bl21);加入0.5mmiptg在16℃诱导构建成功的重组大肠杆菌,使其表达蛋白;将生物素标记的探针与纯化的融合蛋白his-opwrky2在25℃反应15分钟后进行聚丙烯酰胺凝胶电泳。本发明一个实施方式中,利用双荧光素报告基因检测实验(dual-luc)检测opwrky2转录因子对optdc1基因启动子的激活能力,所述双荧光素报告实验(dual-luc)实验方法如下:将optdc基因的启动子序列构建于pgreenii0800-fluc上,将opwrky2基因构建到phb-yfp表达载体上,将构建好的质粒分别转化到农杆菌gv3101菌株中;将含phb-opwrky2-yfp质粒的gv3101菌株与含pgreenii0800-poptdc1-fluc载体的gv3101菌株等体积混合,瞬时注射烟草叶片;3天后,收集叶片,利用发光检测仪检测luc与ren值,根据luc/ren比值检测opwrky2对基因启动子的激活情况。本发明公开了opwrky2转录因子提高短小蛇根草中喜树碱含量的代谢工程方法。本发明从药用植物短小蛇根草中克隆得到一条opwrky2转录因子,构建其亚细胞定位载体;通过构建植物过表达及抑制表达载体,遗传转化短小蛇根草茎段外植体,获得转基因毛状根;利用qrt-pcr分析转基因株系中喜树碱合成途径中关键酶基因的表达;凝胶迁移实验(emsa)和双荧光素报告基因检测实验(dual-luc)结果表明opwrky2可结合和激活optdc1基因的启动子。本发明中opwrky2可促进喜树碱生物合成途径中的关键酶基因optdc的表达,hplc结果分析喜树碱含量最高的株系为1.88mg/flask,为对照组的3.36倍。附图说明通过阅读参照以下附图对非限制性实施例所作的详细描述,本发明的其它特征、目的和优点将会变得更明显:图1为本发明实施例中荧光实时定量pcr检测opwrky2在过表达opwrky2基因短小蛇根草毛状根中的表达水平,显示opwrky2基因的表达量提高;图2为本发明实施例中荧光实时定量pcr检测喜树碱合成基因opg10h、opsls、opcpr、optdc和opstr在过表达opwrky2基因的短小蛇根草毛状根中的表达水平,显示optdc基因的表达量提高;图3为本发明实施例中利用hplc检测过表达opwrky2基因短小蛇根草毛状根中喜树碱的含量,显示喜树碱含量提高;图4为本发明实施例中利用emsa实验检测opwrky2转录因子对喜树碱生物合成基因optdc1的结合能力,显示opwrky2可以结合optdc1的启动子;图5为本发明实施例中利用dual-luc实验检测opwrky2转录因子对喜树碱生物合成基因optdc1的瞬时激活能力,显示opwrky2可以激活optdc1的表达。图中,opwrky2-oe-x表示过表达opwrky2基因短小蛇根草毛状根样本,x=1、2、3、5表示编号,pcambia2300ev表示转入pcambia2300+空载体的短小蛇根草毛状根样本。具体实施方式下面结合附图和具体实施例对本发明进行详细说明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明讲授的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落入本申请权利要求书所限定的范围。下列实施实例中未注明具体条件的实验方法,通常按照常规条件,例如分子克隆(sambrook等)中所述的条件,或按照制造厂商所提供的试剂或试剂盒所附带的说明书建议的条件。实施例1:短小蛇根草opwrky2基因的克隆1.短小蛇根草总rna的提取取少量短小蛇根草幼嫩叶片,用液氮速冻后,迅速用研钵研碎,加入盛有裂解液的1.5mleppendorf(ep)离心管中,充分振荡后,按照tiangen试剂盒的说明书抽提总rna。用琼脂糖凝胶电泳检测rna质量,然后在分光光度计上测定rna含量。2.短小蛇根草opwrky2基因的克隆以所提取的总rna为模板,反转录后合成cdna;根据opwrky2基因的序列设计基因特异性引物,如表1所示,通过pcr扩增从总cdna中扩增opwrky2基因,并测序。表1pcr引物引物名称引物序列(5'-3')opwrky2-fp(seqidno.3)atggaaaaggtgaatgctattgagcopwrky2-rp(seqidno.4)tcaggagatgtatgcaatggggtc通过上述步骤,获得了短小蛇根草中该转录因子的全长编码序列(seqidno.1)并推导出其蛋白编码序列(seqidno.2),其中,起始密码子为atg,终止密码子为tag。实施例2:含opwrky2基因的植物过量表达载体的构建将opwrky2基因构建在植物表达载体pcambia2300+上,为了方便表达载体的构建,正向引物中引入了spei的酶切位点,反向引物中引入了bsteii的酶切位点,引物如表2所示;表2pcambia2300+-opwrky2载体构建的pcr引物引物名称引物序列(5'-3')opwrky2-spei-fp(seqidno.5)actagtatggaaaaggtgaatgctattgopwrky2-bsteii-rp(seqidno.6)ggtcacctcaggagatgtatgcaat本实施实例将参与调控喜树碱合成的转录因子opwrky2可操作性地连接于表达调控序列,构建了含opwrky2基因的植物过量表达载体pcambia2300+-opwrky2,这个表达载体可用于通过代谢工程策略来提高短小蛇根草中喜树碱含量。实施例3:发根农杆菌介导的opwrky2过量表达载体遗传转化短小蛇根草获得转基因毛状根1.含opwrky2基因过量表达的发根农杆菌工程菌的获得将实施例2中含opwrky2基因的植物表达载体采用冻融法转入发根农杆菌(如c58c1,为市场有公开出售的生物材料),并进行pcr验证。2.发根农杆菌介导opwrky2基因遗传转化短小蛇根草2.1外植体的预培养从健壮的短小蛇根草无菌苗中剪取茎段,放置于b5培养基上进行预培养,在25℃条件下暗培养2天。2.2农杆菌与外植体的共培养将所述的短小蛇根草茎段外植体,转入带有活化好的所述含opwrky2基因过量表达载体的发根农杆菌的b5培养基悬液中浸泡10分钟,轻轻摇晃外使外植体与菌液充分接触,待侵染结束后,取出短小蛇根草茎段,将其放置在无菌吸水纸表面,吸干菌液,之后将其放置于b5培养基表面,28℃条件下暗培养2天。2.3毛状根的诱导和继代培养在上述材料暗培养2天后,将其转移至一级除菌固体培养基(b5+cb300mg/l)上,在25℃条件下暗培养,大约每隔2周左右更换一次培养基。在经过约14-20天左右后,上述外植体的伤口出会出现较小的愈伤组织,之后,在愈伤组织处,会陆续长出淡黄色的毛状根。此时,将已经长出毛状根的茎段进行转移,将其分批转移至二级除菌固体培养基(b5+cb200mg/l)上,在该培养基上,毛状根能较快的生长。在2-3周后,毛状根长至3-4㎝,并且开始出现分支,此时,将长势较好且带有分支的毛状根单克隆从愈伤组织上剪下,转移至三级除菌固体培养基(b5+cb100mg/l)上,仍旧25℃暗培养。在培养一段时间后,在三级除菌固体培养基上选择生长状态良好,并且没有出现溢菌现象的克隆株系,从这些克隆株系上剪下新长出的尖端2cm左右的毛状根,将其转入b5固体培养基中继续培养,培养条件为25℃暗培养。培养大约2周后,选择其中没有出现溢菌情况的株系进行独立编号。3.pcr检测转基因短小蛇根草毛状根根据目的基因所在表达盒上游的35s启动子区域和opwrky2分别设计正向引物和反向引物(如表3所示)对目的基因进行pcr检测;同时利用毛状根中表达的rolb基因的上、下游引物对rolb基因进行pcr检测。表3opwrky2转基因毛状根株系鉴定的pcr引物本实施例将所述的植物表达载体转化发根农杆菌,获得用于转化短小蛇根草的含opwrky2基因植物过量表达载体的发根农杆菌菌株,利用该发根农杆菌侵染短小蛇根草茎段,获得经pcr检测的转基因短小蛇根草毛状根。转基因短小蛇根草毛状根的获得为筛选获得较高喜树碱含量的短小蛇根草毛状根提供了直接素材。实施例4:利用qrt-pcr检测转基因短小蛇根草毛状根中相关基因的表达1.毛状根液体培养选择实施例3中生长状态良好的毛状根,剪取其中部和尖端,接种至100ml的b5液体培养基中,之后利用摇床进行扩大培养,在黑暗条件下,以25℃,100rpm条件培养。培养约45天后收取毛状根,由于喜树碱存在外排现象,因此收取时需要收取培养基及毛状根两个部分。第一部分:培养基的收获,从三角烧瓶中取出毛状根后,首先对培养基的体积进行测定,然后将培养基进行旋转蒸发,最后定容至2ml,保存于4℃用于后续喜树碱含量的测定;第二部分:毛状根的收获,将毛装根从培养容器中取出,然后用吸水纸吸干表面培养基,首先剪取3份毛状根,每份重量约为0.5-0.6g,锡箔纸包好并标记,置于液氮中速冻,然后放置于-80℃保存,用于后续rna的提取。余下的毛状根用吸水纸包住并标记,然后放置与50℃恒温箱中干燥,待重量没有变化后取出,用于后续进行喜树碱的提取及含量测定。2.转基因短小蛇根草毛状根的qrt-pcr检测提取转基因短小蛇根草毛状根的rna后反转录成cdna,利用qrt-pcr分析对opwrky2基因及喜树碱生物合成基因opg10h、opsls、opcpr、optdc和opstr(引物如表4所示)进行转录表达水平的检测。qrt-pcr分析结果显示:在过表达opwrky2基因短小蛇根草毛状根中,opwrky2基因的表达量提高(见图1),且喜树碱合成基因optdc的表达量也明显提高,而其他喜树碱合成基因表达变化不明显(见图2)。表4qrt-pcr引物实施例5:利用hplc测定转基因短小蛇根草毛状根中喜树碱含量1.毛状根中喜树碱的提取将上述烘干至恒重的毛装根取出,研磨成粉末,称取0.1g粉末,装入50ml离心管中;加入体积约20ml的色谱纯甲醇,盖紧离心管管盖,并用封口膜封住,涡旋振荡3min混匀,然后放置在超声仪超声水浴萃取1小时,然后将超声后的混合物置于50℃烘箱内,静置过夜;第二天在离心机中以12,000rpm转速离心10min,离心后取上清液,将上清液用真空旋转蒸发仪蒸干,蒸发时温度设为70℃,蒸发完成后用色谱纯甲醇重新溶解,最后定容为2ml,然后进行过滤,过滤用0.22μm的有机相滤膜过滤,过滤后得到喜树碱粗提物保存于-20℃备用。2.毛状根中喜树碱含量的hplc测定首先配置喜树碱标品,制作标准曲线。喜树碱标品配置方法如下:用分析天平称量1mg喜树碱标品,置于小烧杯中,在烧杯中加入10ml甲醇,之后将小烧杯在超声仪中水浴中超声10-20min,完全溶解后即为终浓度为100μg/ml的标准品溶液。在测量标品时,稀释为多个不同浓度梯度,从而做出标准曲线。从所述的喜树碱粗提物各取20μl,注入高效液相色谱仪中。所用的色谱柱为c-18反相硅胶柱(symmetryshieldtmc18,5μm,250x4.6mm,waters);色谱条件为:流动相乙腈:水=35:65;柱温30℃;流速设置为1ml/min;检测波长设定为220nm。在检测结束后,在hplc中记录各个样品的喜树碱组分的峰面积,将峰面积代入上述的标准曲线,计算得到的即为样品中喜树碱的含量。在本发明中,就总产量而言,相比对照,opwrky2过表达的转基因毛状根株系中喜树碱含量明显提高(见图3),其中喜树碱含量最高的株系为1.88mg/flask,为对照组的3.36倍。实验例6:emsa检测opwrky2对喜树碱生物合成基因optdc启动子的结合能力1.重组蛋白的表达与纯化将opwrky2基因构建到pcold-tf表达载体上,获得pcold-opwrky2重组表达载体,并转化大肠杆菌bl21中,菌液pcr检测获得阳性克隆菌株。将含有pcold-opwrky2的bl21菌株接种于lb培养基中,培养2-3小时(od600=0.4-0.5),加入0.5mm的iptg进行过夜诱导表达opwrky2蛋白后,对融合蛋白his-opwrky2进行纯化。2.凝胶迁移实验(emsa)分析喜树碱合成基因optdc1的启动子中w-box序列,设计含w-box序列的生物素标记dna探针(表5)。将生物素标记dna探针与纯化的融合蛋白his-opwrky2在25℃反应15分钟后进行聚丙烯酰胺凝胶电泳。结果表明,短小蛇根草opwrky2转录因子可以结合喜树碱合成基因optdc1启动子的w-box序列(见图4)。表5optdc1-w-box的dna探针实施例7:dual-luc检测opwrky2对喜树碱生物合成基因optdc启动子的激活能力1.载体构建和农杆菌转化将optdc基因启动子构建到pgreenii0800-fluc表达载体上,将opwrky2基因构建到phb-yfp表达载体上,将构建好的质粒分别转化到农杆菌gv3101菌株中,菌液pcr检测获得阳性克隆菌株。2.双荧光素酶报告基因检测(dual-luc)将含有目的载体的阳性菌株28℃扩大培养,离心去上清,用ms液体培养基重悬菌体至od600为0.6,按照每毫升2μl及20μl分别加入0.1m乙酰丁香酮和0.5mmes溶液(ph:5.7),混匀并室温静置3h。将含phb-opwrky2-yfp质粒的gv3101菌株与含pgreenii0800-poptdc1-fluc载体的gv3101菌株等比例混合,瞬时注射烟草。两天后用打孔器在烟草叶片打孔取样,之后迅速置于液氮中冻存,根据promega公司的荧光检测试剂盒和仪器测定luc/ren的比值。结果表明,短小蛇根草opwrky2转录因子可以激活喜树碱合成基因optdc1的表达(见图5)。实施例6-7结果表明,短小蛇根草opwrky2转录因子可以结合喜树碱合成基因optdc1的启动子,从而激活optdc1的表达并促进喜树碱的生物合成。以上详细描述了本发明的较佳具体实施例。应当理解,本领域的普通技术无需创造性劳动就可以根据本发明的构思作出诸多修改和变化。因此,凡本
技术领域:
中技术人员依本发明的构思在现有技术的基础上通过逻辑分析、推理或者有限的实验可以得到的技术方案,皆应在由权利要求书所确定的保护范围内。序列表<110>浙江中医药大学<120>短小蛇根草opwrky2转录因子的编码序列及其应用<141>2020-03-03<160>24<170>siposequencelisting1.0<210>1<211>1071<212>dna<213>短小蛇根草(ophiorrhizapumila)<400>1atggaaaaggtgaatgctattgagcaaaagactcttgtaattgagctaactcaaggtagg60gagatggcaaaccagctcaaaagccaacttgatcaagtgacgtctcctgagacttgtgaa120gcattggtcgagaagatactttctacgtatgataaagcactggccatgctaacttggaag180gccttgaaagcagaaactttgcctgaaattggcatgtcggagtcccctcaacctcattca240tccgttgccggcagccctgtaagtgaggtttccaatggcgtctccaaagatcaaaaatgc300cacagacaagtcttgaagaagagaaagatatcgacgaaatggagtgaacaagttcgagtc360tgctctaaaacgaggcatgatggttcctcccttgatgatggacatagttggagaaaatat420ggccagaaagacatcttaggggcaaatcatccaagggcatactatcgatgtactcatcga480aattcaagaggctgtttggcaaccaaacaagttcagaggacagatgaggattcatcaatc540tttgaggtcacctataaaggaaaacacagttgcattcaagcagcaaattcaaatttaata600atcttctcagatggaaaggaaaaatcaaaaccagagaagcccgagtcgaaagcaacagaa660gtagataaacaaatacaaccacagcaaccgttactcaaagttgaaactgacttcatgatg720tctaaggatgaaattttcccttcattttcctttcctttcacaggagttgaatctgaaaat780ctggaaagcaacatcttttgtgatgctatgagggaaaatgatatggtggatagttgttct840cccacatttttgtctccaacaacttcggagtccaactacttctcatccccatgccacaca900aacagctatggtataggcaacattctgcagagctcacagtatgatctaattgatatgatt960tcaactccaacttcagtcatgaattcgccatttggtgatcttgatttctcaattgatcaa1020ggggattttgctccaattttcccacttgaccccattgcatacatctcctga1071<210>2<211>356<212>prt<213>短小蛇根草(ophiorrhizapumila)<400>2metglulysvalasnalailegluglnlysthrleuvalilegluleu151015thrglnglyargglumetalaasnglnleulysserglnleuaspgln202530valthrserprogluthrcysglualaleuvalglulysileleuser354045thrtyrasplysalaleualametleuthrtrplysalaleulysala505560gluthrleuprogluileglymetsergluserproglnprohisser65707580servalalaglyserprovalsergluvalserasnglyvalserlys859095aspglnlyscyshisargglnvalleulyslysarglysileserthr100105110lystrpsergluglnvalargvalcysserlysthrarghisaspgly115120125serserleuaspaspglyhissertrparglystyrglyglnlysasp130135140ileleuglyalaasnhisproargalatyrtyrargcysthrhisarg145150155160asnserargglycysleualathrlysglnvalglnargthraspglu165170175aspserserilephegluvalthrtyrlysglylyshissercysile180185190glnalaalaasnserasnleuileilepheseraspglylysglulys195200205serlysproglulysprogluserlysalathrgluvalasplysgln210215220ileglnproglnglnproleuleulysvalgluthraspphemetmet225230235240serlysaspgluilepheproserpheserpheprophethrglyval245250255glusergluasnleugluserasnilephecysaspalametargglu260265270asnaspmetvalaspsercysserprothrpheleuserprothrthr275280285sergluserasntyrpheserserprocyshisthrasnsertyrgly290295300ileglyasnileleuglnserserglntyraspleuileaspmetile305310315320serthrprothrservalmetasnserpropheglyaspleuaspphe325330335serileaspglnglyaspphealaproilepheproleuaspproile340345350alatyrileser355<210>3<211>25<212>dna<213>人工序列(artificialsequence)<400>3atggaaaaggtgaatgctattgagc25<210>4<211>24<212>dna<213>人工序列(artificialsequence)<400>4tcaggagatgtatgcaatggggtc24<210>5<211>28<212>dna<213>人工序列(artificialsequence)<400>5actagtatggaaaaggtgaatgctattg28<210>6<211>25<212>dna<213>人工序列(artificialsequence)<400>6ggtcacctcaggagatgtatgcaat25<210>7<211>20<212>dna<213>人工序列(artificialsequence)<400>7gctcttgcagtgctagattt20<210>8<211>20<212>dna<213>人工序列(artificialsequence)<400>8gaaggtgcaagctacctctc20<210>9<211>21<212>dna<213>人工序列(artificialsequence)<400>9gaggacctaacagaactcgcc21<210>10<211>20<212>dna<213>人工序列(artificialsequence)<400>10agctctgcagaatgttgcct20<210>11<211>21<212>dna<213>人工序列(artificialsequence)<400>11ctccaacaacttcggagtcca21<210>12<211>20<212>dna<213>人工序列(artificialsequence)<400>12agctctgcagaatgttgcct20<210>13<211>20<212>dna<213>人工序列(artificialsequence)<400>13tgaggaagccgatgtttccc20<210>14<211>20<212>dna<213>人工序列(artificialsequence)<400>14tttcatcacgcccaattgcc20<210>15<211>20<212>dna<213>人工序列(artificialsequence)<400>15aagcatcccgaatggcaaga20<210>16<211>20<212>dna<213>人工序列(artificialsequence)<400>16gaagcatcaccgttggcatc20<210>17<211>20<212>dna<213>人工序列(artificialsequence)<400>17ccggcaatatgagcatttca20<210>18<211>19<212>dna<213>人工序列(artificialsequence)<400>18gttctcgccaagcagcaaa19<210>19<211>21<212>dna<213>人工序列(artificialsequence)<400>19taggctcaatccagggaaagg21<210>20<211>20<212>dna<213>人工序列(artificialsequence)<400>20tcccacagcaaacctcaaca20<210>21<211>21<212>dna<213>人工序列(artificialsequence)<400>21agccatggttgtgtcgattct21<210>22<211>21<212>dna<213>人工序列(artificialsequence)<400>22ttcaccatcggagtcaaaagc21<210>23<211>42<212>dna<213>人工序列(artificialsequence)<400>23cttcagtcaaggcccttcagtcaaggcccttcagtcaaggcc42<210>24<211>42<212>dna<213>人工序列(artificialsequence)<400>24ggccttgactgaagggccttgactgaagggccttgactgaag42当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1