一种用于检测呼吸道病原体核酸的质控物及其制备方法与流程
本发明属于医学检验
技术领域:
,具体涉及一种用于检测呼吸道病原体核酸的质控物及其制备方法。
背景技术:
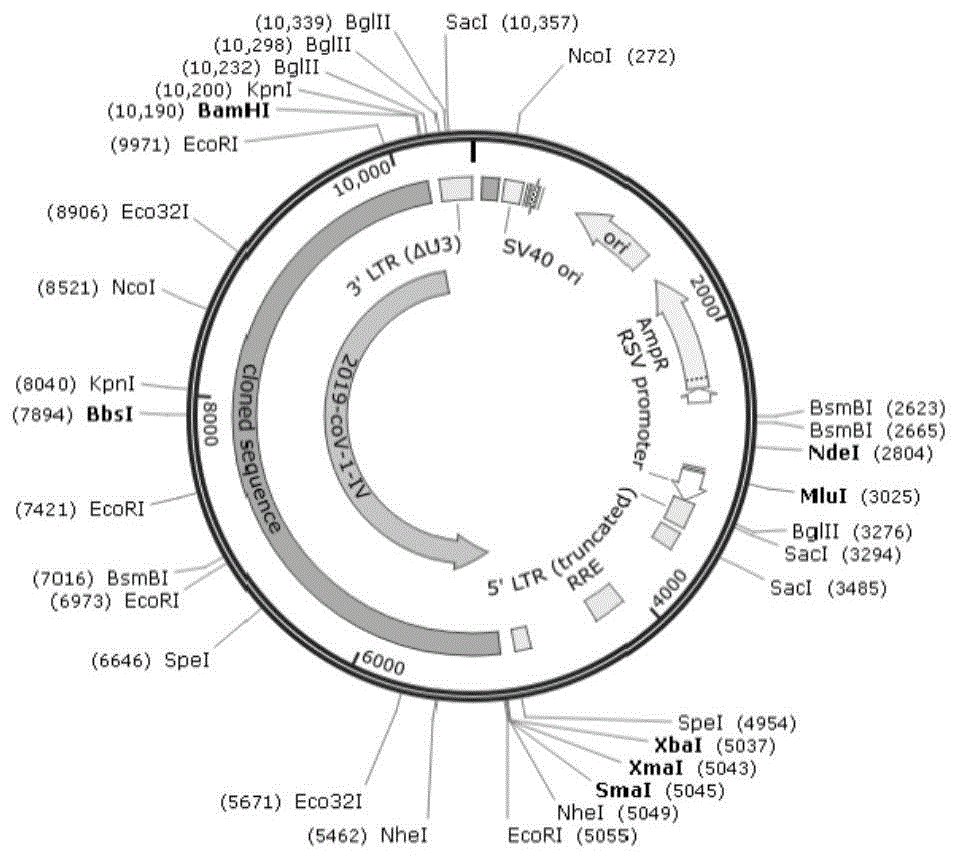
:呼吸道感染是最常见的感染性疾病,由呼吸道传染病病原体引起,主要是病原体通过感染鼻腔、气管等呼吸系统而导致呼吸道感染。呼吸道病毒是指一大类以呼吸道为侵入门户在呼吸道黏膜上皮细胞增殖引起急性呼吸道组织感染或其他组织器官病变的病毒。据统计90%以上原发急性上呼吸道感染是由呼吸道病毒引起的,而该种病毒引发下呼吸道感染的几率达62%。研究表明,一些呼吸道病原体,如中东呼吸综合征病毒、禽流感病毒等,由于这些病毒体经呼吸道途径传播的传染特性导致其传播速度快、流行范围广,人群中发病率高,极易引起流行及暴发,对社会影响较大。由于可引发呼吸道感染的病原体种类繁多,患者可能携带不止一种病原体,不同病毒之间以及病毒和细菌之间的临床体征和症状相互重叠,往往使得仅基于临床表现的病因诊断变得困难,无法确定致病原因,导致常规治疗无效,造成抗生素滥用以及医源性交叉感染,而对呼吸道病原体进行快速检测有助于诊断和准确用药,因此需要研制相应的质控物,可对快速检测过程进行质量控制,保证检测结果的准确性和可靠性。在病毒感染初期对病原学进行及时准确的诊断,有助于医护人员精准掌握患者病情,也是急性传染病防控工作顺利实施的重要保障。最先检出新的病原体的方法是下一代测序技术/高通量测序技术(ngs)技术,并且很快确定了新冠病毒的核酸序列。2020年3月3日,国家卫生健康委员会(卫健委)发布了新型冠状病毒肺炎诊疗方案(试行第七版),确诊病例要求同时具备以下病原学或血清学证据之一:实时荧光rt-pcr检测新型冠状病毒核酸阳性;病毒基因测序,与已知的新型冠状病毒高度同源;血清新型冠状病毒特异性igm抗体和igg抗体检测阳性。其中病毒核酸检测具有窗口期短,用时少,灵敏度高,特异性强等优点,能在病毒早期快速诊断和动态观察抗病毒治疗的效果。然而核酸检测也会存在一定的假阴性率和潜在的假阳性结果。实验室层面上的“假阴性”是指所采集的样本中病毒含量高于所用检测试剂的检测限(亦称分析敏感性),但实验室却没有检出。要想尽可能避免“假阴性”,实验室需满足:(1)选择可靠的体外诊断试剂;(2)规范的临床核酸检测(合理分区、有能力的检测人员和严格的质量管理体系)。数字pcr(digitalpcr,dpcr)技术是近年来引起重视并迅速发展起来的一种突破性的定量分析技术。1992年sykes等检测复杂背景下低丰度的igh重链突变基因时,利用样品的有限稀释,让每个孔中只获得单个模板分子,通过计算pcr后的扩增信号,以期准确地确定起始分子的数量,虽然没有明确提出“数字pcr”的概念,但是已经建立了数字pcr基本的实验流程,并且确定了数字pcr检测中一个极其重要的原则——以“终点信号的有或无”作为定量方法。这是数字pcr的雏形。1999年vogelstein和kinzler等在检测粪便中进行癌变组织脱离细胞的braf特异突变型基因时,因受到体细胞基因的干扰,而碰到检测灵敏度和检测分辨率的瓶颈,而采用了在384孔板中对每个反应孔的样品量进行极限稀释并增加反应孔数进行检测的方式,从而提出了数字式pcr的概念,同时也提出如果采用更多孔板其检测灵敏度会更高,从而指出了数字pcr系统的发展方向。目前,英国国家生物制品检定所作为who指定的国际标准品实验室,是目前全世界最主要的国际标准品和参考品生产者和分发者,生产超过95%的国际标准品。而我国的质控物数量虽然较多,但品种不全、门类欠缺、结构不合理。品种主要集中在钢铁、地矿和建材等领域,在生物工程、食品成分、临床化学以及新材料、新能源等一些重要发展领域内的质控物则相对比较缺乏。相关质控物的研制相对滞后,使得不少产品的检测无法实现,不得不靠国外进口来满足实验室检测要求。由于这些进口质控物的生产者执行的管理体系不同,量值准确性和溯源性也不同,难以确保我国测量结果的有效性和一致性。随着国家对体外诊断试剂监督管理力度的加大和对检验技术要求的不断提高,对体外诊断试剂质控物的需求和依赖也越来越强烈。因此,加强体外诊断试剂质控物建设,不仅有利于诊断结果的准确一致,使各医院的检测结果具有可比性,而且也是做好体外诊断试剂技术监督的有力保证。由于生物样本的活性较为复杂与多变,核酸极易受缓冲环境的影响而降解,特别是rna,容易受到无处不在的核酸酶的降解。同时,核酸检测试剂盒的性能验证实验,特别是检测限(灵敏度)、线性等的评估实验,常需要不同浓度的企业参考品、阳性对照、质控物进行有效的试剂盒性能验证评估。因此,研制一经济而质量稳定、量值可靠、又无生物危害的质控物,其定值和稳定性考察是必不可少的过程,也是研制质控物的重要环节,也是本发明的重要部分。技术实现要素:本发明要解决的第一个技术问题是提供一种用于检测呼吸道病原体核酸的质控物。本发明要解决的第二个技术问题是提供一种用于检测呼吸道病原体核酸的质控物的制备方法。为实现上述目的,本发明采用以下技术方案:一种用于检测呼吸道病原体核酸的质控物,包括以下呼吸道病原体核酸中的任意一种或多种:冠状病毒、流感病毒、呼吸道合胞病毒、腺病毒、鼻病毒、肺炎支原体、肺炎链球菌或/和嗜肺军团菌。本发明的质控物包含了主要的感染呼吸道病原体,涵盖的范围较广,且以真实病毒样本以及假病毒样本为原材料,具有更准确的检测靶点。优选地,所述冠状病毒的核酸为6个4000~5500bp核酸片段。本发明将冠状病毒的全长基因组序列划分为6个目的片段,每个片段的长度为4000~5500bp。由此,本发明的质控物覆盖了冠状病毒所有检测靶序列(或靶点),覆盖面广泛,检测靶点全面,不会出现漏检的现象;同时,在每个片段前后末端设计了overlap,可有效避免检测试剂的探针序列落在分段位置而影响最终的检测结果。优选地,所述冠状病毒包括:人冠状病毒hcov-nl63、人冠状病毒hcov-229e、人冠状病毒hcov-hku1、人冠状病毒hcov-oc43、srsa-cov、mers-cov或/和新型冠状病毒。优选地,所述流感病毒包括:甲型流感病毒h1n1、甲型流感病毒h5n1、甲型流感病毒h7n9、甲型流感病毒h9n2、乙型流感病毒(ivb)、呼吸道合胞病毒(rsv)或/和副流感病毒(piv)。优选地,所述稀释液包括以下组分:二甲基亚砜、乙二醇双(2-氨基乙醚)四乙酸、十二烷基硫酸钠、牛血清白蛋白、异硫氰酸胍、tris-hcl、乙二胺四乙酸和丙三醇;所述稀释液ph值为7.2~7.6。本发明的稀释液具有保护核酸的功效,提高核酸的稳定性。优选地,所述呼吸道病原体核酸的质控物中人冠状病毒hcov-nl63的标准值为1.2×104copies/μl,人冠状病毒hcov-229e的标准值为1.9×104copies/μl,人冠状病毒hcov-hku1的标准值为1.3×104copies/μl,人冠状病毒hcov-oc43的标准值为2.0×104copies/μl,严重急性呼吸综合征冠状病毒(srsa-cov)的标准值为2.0×104copies/μl,中东呼吸综合征冠状病毒(mers-cov)的标准值为1.8×104copies/μl,新型冠状病毒的标准值为1.6×104copies/μl,甲型流感病毒h1n1的标准值为1.1×104copies/μl,甲型流感病毒h5n1的标准值为1.9×104copies/μl,甲型流感病毒h7n9的标准值为1.5×104copies/μl,甲型流感病毒h9n2的标准值为1.3×104copies/μl,乙型流感病毒的标准值为2.3×104copies/μl,呼吸道合胞病毒的标准值为2.2×104copies/μl,副流感病毒的标准值为1.5×104copies/μl,腺病毒的标准值为1.3×104copies/μl,肺炎支原体的标准值为1.9×104copies/μl,肺炎链球菌的标准值为1.3×104copies/μl,鼻病毒的标准值为2.3×104copies/μl,嗜肺军团菌的标准值为2.1×104copies/μl。本发明的质控物由于包含了多种不同种类的病原体核酸,它们之间会相互影响,且核酸是及其不稳定的生物大分子,浓度越高则越容易降低,但本发明保护的产品作为质控品,需要具备一定的浓度值才具有参考的价值,所以,其标准值(即浓度)也不能太低。故,发明人经过大量的实验研究发现,当各个核酸的标准值(即浓度)为上述数值时,质控物的均匀性以及稳定性最好,能在低温条件下(-20±5℃)保存12个月不被降解。本发明还提供一种上述质控物的制备方法,包括以下步骤:s1制备呼吸道病原体培养物,提取病原体核酸;所述呼吸道病原体包括冠状病毒、流感病毒、呼吸道合胞病毒、腺病毒、肺炎支原体、肺炎链球菌、鼻病毒或/和嗜肺军团菌;s2采用荧光定量pcr方法检测步骤s1获得的核酸含量,获得每种病原体核酸的原始浓度值;s3用所述稀释液将步骤s2呼吸道病原体核酸稀释成所需的浓度值,获得所述含有浓度标准值的呼吸道病原体的质控物。本发明质控物中的冠状病毒通过逆转录病毒载体将目的基因整合到宿主基因组,并能持久性表达,其优势在于能够对核酸检测中样本处理、核酸提取和病毒逆转录、扩增的全部过程进行质量控制。同时,可以降低实验操作人员生物安全风险。本发明通过ncbi数据库中获得冠状病毒的靶基因序列,获得目的片段,通过人工构建获得表达载体,然后提取含有目的片段的核酸。优选地,所述步骤s1具体采用以下方法实现:(a)提取所述冠状病毒的核酸:首先,将所述冠状病毒的全长基因组序列划分为6个片段,分别与慢病毒表达载体质粒通过无缝克隆的方法连接,获得6个表达质粒,转染表达宿主菌;然后,将经过鉴定序列合格的表达质粒与慢病毒包装质粒转染包装细胞,获得冠状病毒液,此时,提取的冠状病毒的核酸,为6个含有部分全长基因组序列的核酸片段;(b)提取所述流感病毒、呼吸道合胞病毒、腺病毒与鼻病毒的核酸:将流感病毒液、呼吸道合胞病毒液、腺病毒液和鼻病毒液分别与感染的宿主细胞混合培养后,收获病毒,提取其核酸;(c)提取肺炎支原体、嗜肺军团菌与肺炎链球菌的核酸:分别将肺炎支原体、嗜肺军团菌与肺炎链球菌接种至培养基后,获得其培养液后,提取其核酸。优选地,所述冠状病毒包括:人冠状病毒hcov-nl63、人冠状病毒hcov-229e、人冠状病毒hcov-hku1、人冠状病毒hcov-oc43、srsa-cov、mers-cov或/和新型冠状病毒。优选地,所述流感病毒包括:甲型流感病毒h1n1、甲型流感病毒h5n1、甲型流感病毒h7n9、甲型流感病毒h9n2、乙型流感病毒(ivb)、呼吸道合胞病毒(rsv)或/和副流感病毒(piv)。优选地,所述提取核酸采用磁珠法核酸提取试剂盒提取。优选地,所述步骤s3的100ml的核酸稀释液包含以下参数的组分:体积分数为5%的二甲基亚砜(dmso)、浓度为0.5m的乙二醇双(2-氨基乙基醚)四乙酸(egta)、质量百分比为0.1%的十二烷基肌氨酸钠(sds)、质量百分比为1%的牛血清白蛋白(bsa)、质量百分比为1%的异硫氰酸胍、质量百分比为1.21%的tris-hcl、浓度为5mol/l的乙二胺四乙酸(edta)和体积分数为5%的丙三醇。本发明的有益效果为:本发明得到的质控物涵盖19种常见呼吸道病原体,以真实病毒样本以及慢病毒样本为原材料,采用绝对定量微滴式数字pcr方法对质控物进行定值,利用有机溶剂/去污剂(s/d)处理法进行灭活处理,并能有效提高该质控物的稳定性,特别是对低浓度样本的核酸起到保护作用,可在-20℃条件下保存12个月以上。本发明可适用于常见的核酸提取方法“煮沸碱裂解法”、过柱提取法、磁珠提取法和一步法(样本释放剂),其中添加的丙三醇、bsa和dmso可作为pcr扩增的增强剂,可以增强“一步法”“煮沸碱裂解法”pcr扩增的特异性和产率。本发明可用于实验室的室内/室间质量控制,有效监控仪器状态、人员操作、试剂盒有效性等,保证检测结果的准确性和可靠性,还可用于核酸试剂盒分析特异性、检测限(灵敏度)、线性等的评估实验。本发明的质控物具有以下优点:(1)模拟病毒的天然结构或者直接采用真实的灭活病毒,可对病毒颗粒核酸检测中样本处理,核酸提取和病毒逆转录、扩增的全部过程进行质量控制。(2)无生物安全问题,无传染危险性,采用有机溶剂/去污剂(s/d)处理法进行灭活处理。(3)量值稳定:样本稀释液可以保护其内rna/dna免于核酸酶的作用,防止核酸降解。(4)具有溯源性:通过数字pcr分子计数方法溯源至自然单位“1”。(5)可用于荧光定量pcr快速检测以及高通量测序实验过程的质量控制。(6)可用于呼吸道病原体核酸检测试剂盒的分析特异性性能验证。(7)适用范围广,可适用于市面上绝大多数核酸检测试剂盒。并有助于增强“一步法”“煮沸碱裂解法”pcr扩增的特异性和产率。附图说明图1载体质粒图谱示意图图2h1n1标准品扩增曲线图图3h1n1标准品标准曲线图图4h1n1质控物定值操作者1的微滴生成/分布图图5h1n1质控物定值操作者2的微滴生成/分布图图6h1n1质控物定值操作者3的微滴生成/分布图图7h1n1质控物定值操作者4的微滴生成/分布图具体实施方式为了更加简洁明了的展示本发明的技术方案、目的和优点,下面结合具体实施例和附图详细说明本发明的技术方案。实施例1获得冠状病毒培养物一、获得冠状病毒基因组序列1、从美国国立生物技术信息中心(nationalcenterforbiotechnologyinformation,ncbi)https://www.ncbi.nlm.nih.gov/下载人冠状病毒hcov-nl63基因序列;人冠状病毒hcov-229e基因序列;人冠状病毒hcov-hku1基因序列;人冠状病毒hcov-oc43基因序列;sars-cov基因序列;mers-cov基因序列;新型冠状病毒基因序列。2、将全长基因组序列划分为6个目的基因:根据已公开的冠状病毒基因序列,把全长序列分为6段,采用基因合成的方式,合成6个目的基因,在每个片段前后末端设计了overlap,长度约为70bp大小。6个目的基因信息如下表1:表16个目的基因信息二、冠状病毒慢病毒的构建1、依据无缝克隆连接技术将目的基因与表达载体连接,具体步骤如下:(a)将表达载体pcdh-cmv-mcs-ef1a-copgfp-t2a-puro进行酶切线性化,酶切产物进行琼脂糖凝胶电泳鉴定,并按照胶回收试剂盒说明书进行酶切产物的回收和纯化,获得线性化质粒载体。(b)将前述步骤一合成的6个基因片段分别插入上述载体,其质粒谱图如图1所示。使用多片段同源重组的方式,将载体和片段按计算到的最适使用量,与无缝克隆试剂盒(clonexpressultraonestepcloningkit)中的重组酶按体系比例混合,于50℃15min,完成定向克隆后,获得6个含有目的基因的表达质粒。2、阳性克隆的筛选与鉴定:6个表达质粒分别转化到stb13大肠杆菌感受态细胞后,涂布于含amp的2×yt固体培养基上,置于37℃恒温培养箱中倒置培养,次日挑取6个单菌落,分别于4ml含amp的2×yt液体培养基中扩菌,37℃250rpm恒温振荡14h-16h,得到扩增后菌液。提取菌液中的质粒,经过电泳测试后,选择合适高度的质粒送测序确认。对确认后的克隆大量扩增,提取慢病毒表达质粒。其中慢病毒载体病毒基因组中的自主复制的基因已被敲除,并可具有“自我失活”的能力,因此慢病毒不能在靶细胞内复制并感染其他细胞。3、慢病毒包装(a)准备293t细胞:转染前18-24小时,接种4.5×106个293t细胞到10cm2细胞培养瓶,加入细胞完全培养基,与37℃、5%co2的条件培养。定时取出放置在显微镜下观察,当细胞达到80%汇合度时,可进行细胞转染,弃去现有培养液,加入10ml病毒包装用培养液。(b)将无血清opti-mem培养液、慢病毒包装辅助质粒(含有hivgag,rev以及vsv-g等元件)和上述pcdh-cmv-m-ef1a-copgfp-t2a-puro质粒(含有上述目的基因片段)充分混合均匀。(c)另外加入无血清opti-mem培养液和lipo2000转染试剂,混合均匀。(d)然后把含有质粒dna的无血清opti-mem培养液加入到含lipo2000的无血清opti-mem培养液,轻轻颠倒混匀,室温孵育10分钟,得到转染复合物。(e)把转染复合物加到293t细胞中,轻轻地前后摇晃培养皿以混匀复合物。放置37℃,5%co2饱和湿度培养箱中培养;转导4-6个小时后更换新鲜培养基。(f)在转然后48小时和72小时收集培养液到无菌的50ml离心管中(此时培养液含有慢病毒颗粒),4℃、3000rpm离心5-10分钟去除细胞碎片,用0.45μm的滤器过滤至50ml离心管;根据滤液体积加入对应量的浓缩液,充分均匀混合液,放置于4℃沉淀过夜。(g)取出病毒液,4℃、3000rpm离心30分钟,去除上清,在管底可见白色的沉淀,以适当体积的hbss重悬病毒,按照每管200μl病毒液分装到0.5ml冻存管中(分装前,将标有病毒名称、批号的标签贴在冻存管外壁),放置于-80℃保存。实施例2获得其他呼吸道病原体的培养物一、制备甲型流感病毒h1n1(atccvr-1520)、甲型流感病毒h5n1、甲型流感病毒h7n9、甲型流感病毒h9n2、乙型流感病毒(atccvr-1931)、呼吸道合胞病毒(atccvr-1540)、副流感病毒(atccvr-3)、腺病毒(atccvr-846)、鼻病毒(atccvr-1177)培养物:(a)从液氮罐里将细胞株拿出来,立即将瓶子迅速放入37℃水浴中快速晃动,直至完全溶解,要在2min内完成复温;完全溶解后,迅速从水浴锅中拿出,瓶子用70%酒精擦拭灭菌。(b)把细胞株溶液转移到15ml离心管中,配平,1000rpm下离心悬浮细胞5min,弃上清;加入5-10ml培养液,轻轻吹匀,将细胞悬液移入t-25细胞培养瓶;37℃,5%二氧化碳培养箱中培养;在倒置显微镜下观察细胞的生长情况,也可观察培养基颜色变化。(c)获得生长良好的90%左右的单层细胞后,先把培养瓶内的培养基倒掉,然后加入1ml病毒液,摇动,让病毒液与细胞充分接触,37℃培养10min后,取出再摇匀;培养30mim后,加入9ml2%胎牛血清培养基(细胞维持液)。(d)37℃,5%二氧化碳培养箱中培养。培养一段时间后,在倒置显微镜下观察细胞病变情况。反复冻融3次收获病毒。二、肺炎支原体(atccvr-29085)培养(a)用巴斯德吸管或者1.0ml吸管,从含5ml液体的试管中吸出0.5—1.0ml,用于溶解肺炎支原体颗粒。(b)将溶解的肺炎支原体菌液在无菌条件下吸回试管中,混匀。(c)一系列梯度的稀释步骤。稀释是重要的,不仅是对滴定,还可以保持培养在不同的生长阶段。许多菌株会迅速死亡当到达一定的酸碱条件时。建议从原始管中稀释几个梯度的菌液,因为冷冻保护剂在冷冻干燥过程中经常抑制生长。(d)同时准备一管未接种菌液的试管作为控制管(对照管)。(e)平板接种可以观察菌落形态。将每个稀释度的菌液接种到平板上(每个稀释度接种4个或者更多平板),来确定菌落形成单位。(f)将所有的平板和试管放在建议的条件和适当的温度下培养,挑取单菌落制备纯培养培养液,获得肺炎支原体培养物。三、嗜肺军团菌(atccvr-33152)的培养(a)吸取0.5mlcye炭酵母抽提物肉汤培养基,加入瓶中将嗜肺军团菌冻干粉溶化,将全部内容物转移到含有5-6ml肉汤培养基的试管中,必须在无菌条件下操作。另外准备一管含有5-6ml肉汤培养基的试管,吸取第一管肉汤培养基0.5ml。(b)挑取第一管肉汤培养基接种到cye炭酵母抽提物平板上;置于37℃,5%co2培养箱中培养48-72小时,挑取单菌落制备纯培养培养液,获得嗜肺军团菌培养物。四、肺炎链球菌(atccvr-49619)的培养(a)吸取0.5ml脑心灌注肉汤培养基,加入瓶中将冻干粉溶化,将全部内容物转移到含有5-6ml肉汤培养基的试管中,必须在无菌条件下操作。另外准备一管含有5-6ml肉汤培养基的试管,吸取第一管肉汤培养基0.5ml。(b)挑取第一管肉汤培养基接种到胰蛋白酶大豆琼脂平板上。(c)置于37℃,5%co2培养箱中培养24小时,挑取单菌落制备纯培养培养液,获得肺炎链球菌培养物。实施例3病原体培养物的灭活处理将上述培养的病原体培养物进行灭活处理:1、物理灭活处理:先将病原体培养物放置56℃恒温水浴锅中,浸泡30分钟进行物理灭活处理;2、化学灭活处理:然后在上述病原体培养物中添加核酸稀释液进行化学灭活处理,其中的异硫氰酸胍和sds可使蛋白质变性而起到灭活作用。3、核酸稀释液的配制:(a)用量筒量取40ml灭菌纯水加入灭菌烧杯中;(b)吸取5mldmso加入烧杯中,并搅拌均匀;(c)称取0.19gegta加入烧杯中,并搅拌溶解;(d)称取0.1g的sds加入烧杯中,并搅拌溶解;(e)称取1gbsa加入烧杯中,并搅拌溶解;(f)称取1g的异硫氰酸胍加入烧杯中,并搅拌溶解;(g)称取1.21g的tris-hcl加入烧杯中,并搅拌溶解;(h)吸取10mledta(5mol/l)加入烧杯中,并搅拌均匀;(i)吸取5ml丙三醇加入烧杯中,并搅拌均匀;调ph值至7.2~7.6;将已经调好ph的溶液转移到100ml的容量瓶中,用灭菌纯水定容到100ml,密封后高压灭菌,室温备用。实施例4病原体培养物核酸的提取本发明采用磁珠法病毒dna/rna提取试剂盒(购自天根生化科技(北京)有限公司,货号:dp438)提取所述病原体培养物的核酸,具体操作如下:(1)向干净的1.5ml离心管中加入20μl蛋白酶k。(2)向离心管中加入200μl病毒液(该病液为上述制备的病原体培养液)。(3)向样本中加入400μlcarrierrna工作液(为缓冲液gb与carrierrna溶液的混合液,配制方法按400μl缓冲液gb加入6μlcarrierrna的比例进行配制)。盖上管盖,涡旋振荡10秒混匀。(4)在56℃或室温孵育10分钟,简短离心以收集附着在管壁及管盖的液体。(5)加入400μl无水乙醇,此时可能会出现絮状沉淀,盖上管盖并涡旋振荡10秒,彻底混匀。(6)加入15μl磁珠悬浮液g,盖上管盖并涡旋振荡10秒,彻底混匀。在室温(15-25℃)放置5分钟。(7)将离心管放置于磁力架上静置30秒,待磁珠完全吸附时小心去除液体。(8)将离心管从磁力架上取下,加入500μl漂洗液gd,涡旋混匀。(9)将离心管放置于磁力架上静置30秒,待磁珠完全吸附时小心去除液体。(10)将离心管从磁力架上取下,加入500μl漂洗液rw,涡旋混匀。(11)将离心管放置于磁力架上静置30秒,待磁珠完全吸附时小心去除液体。(12)重复步骤10、11,液体尽量去除干净。(13)离心管于磁力架上,室温晾干5-10分钟。(14)将离心管从磁力架上取下,加入50-100μlrnase-freeddh2o,涡旋混匀,室温孵育10分钟。(15)将离心管放置于磁力架上静置30秒,待磁珠完全吸附时小心将核酸溶液转移至新的离心管中,并于适当条件保存。实施例5本发明对质控物进行定值的方法本实施例以h1n1rna质控品的制备为例,说明本发明质控物的定值方法。一、h1n1rna质控品的制备1、针对h1n1设计引物和探针根据ncbi中h1n1基因序列相关资料,借助primerpremier5.0生物软件设计2对pcr引物探针,具体序列表如表2所示:表2:h1n1基质蛋白基因(m)pcr扩增的引物和探针2、h1n1rna质控物的制备以及q-pcr方法以h1n1流感病毒核酸为模板,使用引物进行扩增。将扩增产物连接至质粒载体,然后转化至transt1感受态细胞。筛选出含有阳性重组质粒的细菌,送测序鉴定。然后以纯化的spei酶切线性化产物为模板,应用nanodrop2000紫外分光仪测定浓度,计算其拷贝数,进行10倍梯度稀释。根据以下公式计算出每微升体积中dna的拷贝数。y(copies/μl)=[x(g/μl)dna/(transcriptlengthinnucleotides×340)]×6.02×1023。采用设计好的引物和探针建立q-pcr方法,q-pcr的反应体系为2*probeqpcrdutpmastermix10μl,10μm引物1μl,10μm探针0.5μl,水7.5μl,模板2μl。扩增条件为50℃15min;95℃15min;94℃15s→55℃45s;98℃10min;55℃45s,40个循环。将构建的质控品进行10倍梯度稀释用于绘制q-pcr标准曲线。扩增曲线拷贝数为:5.37×106~5.37×101copies/μl。3、h1n1流感病毒微滴式数字pcr的方法及其优化微滴式数字pcr反应包括四个步骤:反应体系配制、微滴生成、pcr扩增、微滴读取。通过比较ddpcr的微滴生成数,微滴分布状态、微滴荧光信号的强度等来确定优化的结果。(1)h1n1病毒核酸的提取:采用磁珠法病毒dna/rna提取试剂盒提取,具体方法参见实施例4.(2)配制体系将表2筛选得到的四条引物和两条探针进行随机组合,形成八对引物探针组合,如表3所示:表3:四条引物和两条探针随机组合一步法rt-ddpcr探针法预混液(20μl):10μl的2xprobeq-pcrdutpmastermix,10μm上、下游引物分别为1μl,20μm特异探针为0.5μl,以及无dnase酶蒸馏水7.5μl。rt-ddpcr反应液20μl配方为:一步法rt-ddpcr探针法预混液20μl,待测样品rna模板为2μl。pcr反应程序:50℃15min;95℃15min;94℃15s→5545s,40个循环;98℃10min;55℃45s。(3)微滴生成a.将一个新的dg8cartridge放入holder中。b.将20l反应体系加入到dg8cartridge中间一排的8个孔内。c.在dg8cartridge最底排8个孔中各加入70μl微滴生成油(dgoil)。d.盖上胶垫(gasket)。e.将以上holder轻轻地平稳放置于微滴生成仪中,开始生成微滴。f.吸取40μl顶端孔的微滴放进单行的96孔板中。g.转移微滴后立即用铝箔密封pcr板避免蒸发。将封板温度设为180℃,5sec。(4)检测结果:组合1的检测值为1770copies/μl,组合2的检测值为2000copies/μl,组合3的检测值为1894copies/μl,组合4的检测值为1822copies/μl,组合5的检测值为2006copies/μl,组合6的检测值为2818copies/μl,组合7的检测值为2454copies/μl,组合8的检测值为2158copies/μl。结果表明,反应体系中,最优的引物探针组合6为forward-1,reverse-1,probe-1。(5)最终确定微滴式数字pcr反应体系和反应条件如下:表4微滴式数字pcr反应体系表5微滴式数字pcr反应条件实施例6本发明质控物的定值以及不确定度评定试验本实施例以新型冠状病毒质控物的定值试验为例,说明本发明质控物各个病原体核酸的定值以及不确定度评定试验(1)抽取新型冠状病毒质控物5管,分别由四名不同检测人员在不同时间分别对原倍样本进行核酸提取以及标准数字pcr操作,每人检测5管,每管检测1次,最终得到20组实验数据。表6:四名不同检测人员的实验数据组内可疑值检验对每组独立测量结果,用适当的统计学方法,如格拉布斯法、狄克逊法、t检验法等,结合技术上的判断,剔除可疑值。表7:组内可疑值检验结果(3)组间数据等精度检验对各组数据的标准偏差用科克伦法或f检验法进行等精度检验,对有显著性差异的数据组在进行技术审查后再决定是否予以剔除。当各组数据等精度时,用t检验方法检验各组数据平均值是否有显著性差异。如平均值无显著性差异,先合并数据再用适当的方法检验数据分布的正态性,在符合正态分布的情况下,可将多个平均值再次计算平均值,求出总平均值,即为标准值。表8:方差齐性检验结果表9:多重比较(lsd)结果因变量:检测浓度表10a.lilliefors显著水平修正;*.这是真实显著水平的下限。由levene方差齐性检验的结果可知,levene统计量为2.972,显著性p值=0.063>0.05,故4组数据方差齐性。由多重比较的结果可知,lsd法的显著性均大于0.05,表示各组数据间无统计学差异。shapiro-wilk和kolmogorov-smirnov均可以进行正态性检验,由结果可知,sig:即p值均>0.05,说明数据分布符合正态分布。(4)标准值的计算(5)最终不确定度的确定总结上述构成质控物的不确定度u的各个部分:表11最终定值和不确定度:表12基于上述定值方法以及不确定度评定试验,获得本发明质控物的标准值,如表13所示:表13:本发明质控物的标准值本发明所述的标准值即为各个病原体核酸的浓度。表中严重急性呼吸综合征冠状病毒为sars-cov,中东呼吸综合征冠状病毒为mers-cov。实施例7本发明呼吸道病原体定值质控物的均匀性检测(1)吸取1ml定值的呼吸道病原体阳性样本加入499ml稀释液,充分混匀,获得呼吸道病原体定值质控物。(2)检测均匀性随机抽取30管上述质控物样本,每管样本检测3次,最小取样量为200μl,用实施例2的核酸提取方法和反应条件及反应体系进行检测,采用方差分析方法对质控物进行均匀性分析。采用的是随机顺序重复测量的方法,先将样品顺序编码,采用随机数表决定抽取样品的号码,作3次重复测定,测量方案如下:重复测定1:141-80-12-77-48-07-189-159-148-114-135-169-174-63-03-195-150-74-21-15-14-100-128-137-124-56-24-63-83-192重复测定2:83-141-15-195-74-14-63-114-159-07-48-03-128-24-148-174-124-21-12-80-192-77-63-56-137-100-150-169-135-189重复测定3:56-192-148-195-114-63-24-15-77-189-141-159-124-80-137-12-63-14-48-174-07-83-128-100-21-74-150-03-169-135检测结果如表14所示:表14均匀性检验的分析结果编号名称组间方差组内方差f值1人冠状病毒hcov-nl633.55e+061.15e+070.6832人冠状病毒hcov-229e3.60e+061.43e+070.5613人冠状病毒hcov-hku13.33e+068.83e+060.5914人冠状病毒hcov-oc432.74e+075.05e+071.215严重急性呼吸综合征冠状病毒1.76e+071.24e+080.3156中东呼吸综合征冠状病毒7.56e+062.22e+070.7567新型冠状病毒1.49e+073.52e+070.9418甲型流感病毒h1n12.45e+075.57e+070.9789甲型流感病毒h5n11.35e+072.22e+071.3510甲型流感病毒h7n98.58e+061.19e+071.5911甲型流感病毒h9n25.00e+061.31e+070.85612乙型流感病毒3.74e+075.23e+071.5813呼吸道合胞病毒4.55e+076.43e+071.5714副流感病毒5.67e+061.95e+070.64615腺病毒1.20e+071.67e+071.5816肺炎支原体1.17e+081.44e+081.8117肺炎链球菌3.84e+069.14e+060.93318鼻病毒1.78e+087.78e+080.50719嗜肺军团菌3.15e+081.05e+090.665由f分布临界值表查的f0.05(10,30)=2.39,而在均匀性实验中求得呼吸道病原体定值质控物的f值均小于f0.05(10,30),所以可认为组内和组间无显著性差异。因此该质控物的样品是均匀的,符合要求。实施例8本发明呼吸道病原体定值质控物的稳定性检测长期稳定性实验关注的是在特定贮存条件下呼吸道病原体定值质控物的稳定性状况。本研究贮存条件为-20±5℃,样品放置数量应足够检测至第14个月或更长时间,检测时间为第1、2、5、8、12、14......个月,每次抽取5管质控物,每管样品重复检测2次,计算均值,采用直线拟合法,进行稳定性监测。从第三次稳定性检测开始,每次稳定性实验后进行统计学分析,用x代表时间,以y代表标准物质的特性值(浓度对数值均值),拟合成一条直线,计算其斜率b1和截距b0。其中自由度为n-2,显著水平p=0.95(95%置信水平)的t因子数值:表15:t因子数值表16:12个月稳定性实验结果(-20±5℃环境)结果与分析:对呼吸道病原体定值质控物的-20±5℃贮存条件下稳定性结果进行分析,结果均小于对应的t0.05n-2因子的分位数,故认为斜率无显著差异,未观测到不稳定性,能满足实际测量的需要。考虑到运输条件等因素对质控物稳定性的影响,因此本质控物在-20±5℃下保存,可稳定12个月。实施例9本发明质控物特异性试验将本发明的组合一:人冠状病毒hcov-nl63、人冠状病毒hcov-229e、人冠状病毒hcov-hku1、人冠状病毒hcov-oc43、sars-cov、mers-cov、新型冠状病毒。组合二:甲型流感病毒h1n1、甲型流感病毒h5n1、甲型流感病毒h7n9、甲型流感病毒h9n2、乙型流感病毒(ivb)、呼吸道合胞病毒(rsv)、副流感病毒(piv);组合三:腺病毒、肺炎支原体、肺炎链球菌、鼻病毒、嗜肺军团菌,分别进行核酸提取,然后进行数字pcr检测,验证其特异性。检测结果如下:表17:组合一检测结果表18:组合二检测结果表19:组合三检测结果编号病毒名称缩写检测结果1人冠状病毒hcov-nl63hcov-nl63阴性2人冠状病毒hcov-229ehcov-229e阴性3人冠状病毒hcov-hku1hcov-hku1阴性4人冠状病毒hcov-oc43hcov-oc43阴性5严重急性呼吸综合征冠状病毒sars-cov阴性6中东呼吸综合征冠状病毒mers-cov阴性7新型冠状病毒2019-ncov阴性8甲型流感病毒h1n1h1n1阴性9甲型流感病毒h5n1h5n1阴性10甲型流感病毒h7n9h7n9阴性11甲型流感病毒h9n2h9n2阴性12乙型流感病毒ivb阴性13呼吸道合胞病毒rsv阴性14副流感病毒piv阴性15腺病毒adv阳性16肺炎支原体mp阳性17肺炎链球菌/阳性18鼻病毒rhv阳性19嗜肺军团菌/阳性实施例10本发明质控物与国内同类新型冠状病毒假病毒产品比对试验分别采用中山大学达安基因股份有限公司、圣湘生物科技股份有限公司,上海之江生物科技有限公司、华大生物科技(武汉)有限公司、广东凯普生物科技股份有限公司、上海伯杰医疗科技有限公司和北京卓诚惠生生物科技股份有限公司的新型冠状病毒2019-ncov核酸检测试剂盒(荧光pcr法)对中国计量科学研究院的新型冠状病毒核酸标准物质gbw(e)091090、gbw(e)091089【orf1ab基因片段,基因组坐标:14911-15910;n基因全长;e基因全长】、上海计量科学研究院的新型冠状病毒体外转录rna标准物质gbw(e)091111、gbw(e)091112【orf1ab基因片段,基因组坐标:13321-15540;n基因全长;e基因全长】和本发明进行检测,严格按试剂盒说明书操作。表20:对n基因的检测结果表21:对orf1ab基因的检测结果表22:对e基因的检测结果以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1