一种比率型荧光探针及其制备与检测谷胱甘肽的应用的制作方法
(一)技术领域
本发明涉及一种针对谷胱甘肽检测的快速可视化比率荧光探针的制备与检测方法。
(二)
背景技术:
谷胱甘肽(gsh)是一种具有重要生理功能的天然活性肽,由谷胱氨酸、半胱氨酸及甘氨酸组成,几乎存在于所有生物细胞中。谷胱甘肽上的半胱氨酸含有巯基为活性基团,能够有效地清除破坏dna和rda的自由基及其他毒素(碘乙酸,芥子气,铅、汞、砷等重金属)。研究发现,谷胱甘肽浓度在人体内的异常行为与人体疾病如癌症、肝病、艾滋及心脏疾病等有相关关联。虽然人体可以产生谷胱甘肽,但是据研究发现,谷胱甘肽的含量会随着年龄的增加而减少,而且,谷胱甘肽的减少还会受到周围环境的影响,比如疾病、药物、污染、辐射、压力等,这些都会导致谷胱甘肽的流失,所以,在日常饮食中,适量补充含有谷胱甘肽的食物对帮助保持正常的免疫系统功能具有重要意义,甚至防癌及保护肝脏就一定效果。随着技术的发展,测定谷胱甘肽含量的方法有:比色法、碘量法、毛细管电泳法和高效液相色谱法等。这些方法虽各有优点,但也都有不足之处。例如比色法、碘量法准确度较低;高效液相色谱法(hplc)、毛细管电泳法检测繁琐,成本较高。因此,寻找并建立简单、快速、灵敏的检测谷胱甘肽新方法引起人们的关注并成为研究重点。荧光探针技术是最近几年刚刚发展有效监测谷胱甘肽的新技术,例如,kong和qu等人(talanta,2017,169,1–7)报道了mno2纳米片辅助-aie修饰二氧化硅荧光微球,可以直接监测谷胱甘肽;jin等人(sensorsandactuatorsb,2016,227,108–116)采用mn-dopedznsqds来检测水果、蔬菜中的谷胱甘肽;yi等人(biosensorsandbioelectronics,2014,56,39–45)报道了采用碳量子点复合金团簇双模式技术监测人体血浆中的谷胱甘肽。但是以上荧光探针仍然存在毒性、荧光强度弱等问题。
针对以上问题,我们设计了一种比率探针微球,采用荧光淬灭再恢复技术检测谷胱甘肽的新方法。该技术量子点具有荧光强度高,毒性低、稳定性好,经修饰以后生物相容性较好,耐光性好,荧光寿命长,抗漂白能力强等优点,同时该方法操作简单、检测快速且灵敏度高,能进行溶液中谷胱甘肽的可视化识别。另外,采用该技术对常见食品如蔬菜、水果、饮品加以实际检测应用,效果良好。
(三)
技术实现要素:
本发明目的是克服目前检测谷胱甘肽探针的不足,提供一种制备简单,成本低廉,检测方便,选择性较好的检测谷胱甘肽的比率型荧光探针,实现对谷胱甘肽的选择性、快速、可视化检测。
本发明采用的技术方案是:
本发明提供一种比率型荧光探针,所述荧光探针以绿色量子点为核心并包埋于二氧化硅纳米微球中,再对二氧化硅纳米微球表面进行氨基化修饰,然后再在氨基化修饰后的表面共价偶联上红色量子点,得到比率型荧光探针;所述绿色量子点为硒化镉量子点,所述红色量子点为n-乙酰-l-半胱氨酸修饰的碲化镉量子点。
进一步,所述包埋绿色量子点后表面氨基化的二氧化硅纳米微球的粒径为30-80nm,优选40~60nm。
进一步,所述绿色量子点包埋于二氧化硅纳米微球中并在二氧化硅纳米微球表面进行氨基化修饰的方法为:将绿色量子点分散于乙醇中,5~45℃(优选20℃)搅拌5~30min,形成均一混合液;所述乙醇体积用量以绿色量子点重量计为10-80ml/mg,优选15-40ml/mg;将氨水(质量浓度25-28%),正硅酸四乙酯加入混合液中,5~45℃(优选20℃)搅拌12h;接着加入3-氨丙基三乙氧基硅烷,5~45℃(优选20℃)搅拌12h;离心,沉淀依次用无水乙醇、去离子水洗涤1~2次,得到包埋绿色量子点的表面氨基化修饰的二氧化硅纳米微球;所述氨水体积用量以绿色量子点重量计为0.1-1ml/mg,优选0.25-0.5ml/mg;所述正硅酸四乙酯体积用量以绿色量子点重量计为0.1-1ml/mg,优选0.25-0.5ml/mg;所述3-氨丙基三乙氧基硅烷体积用量以绿色量子点重量计为0.05-0.5ml/mg,优选0.05-0.2ml/mg。
进一步,所述红色量子点偶联的方法为:将红色量子点分散到去离子水中形成分散液,加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc),5-45℃(优选20-25℃)黑暗振荡活化10~30min,加入包埋绿色量子点的表面氨基化修饰的二氧化硅纳米微球,5-45℃(优选20-25℃)黑暗搅拌8~12个小时,离心,沉淀用去离子水洗涤,获得所述比率型荧光探针;所述红色量子点与包埋绿色量子点的表面氨基化修饰的二氧化硅纳米微球质量比为1:5-20,优选1:5~10,所述edc与红色量子点的质量比10-100:1,优选10-50:1,更优选10-30:1;所述分散液中去离子水用量以红色量子点重量计为1-10ml/mg,优选1-3ml/mg。
本发明还提供一种比率型荧光探针的制备方法,所述方法为:(1)将绿色量子点分散于乙醇中,5~45℃搅拌5~30min,形成均一混合液;所述乙醇体积用量以绿色量子点重量计为10-80ml/mg;(2)将氨水(质量浓度25-28%),正硅酸四乙酯加入步骤(1)混合液中,5~45℃搅拌12h;接着加入3-氨丙基三乙氧基硅烷,5~45℃搅拌12h;离心,沉淀依次用无水乙醇、去离子水洗涤1~2次,得到包埋绿色量子点的表面氨基化修饰的二氧化硅纳米微球;所述氨水体积用量以绿色量子点重量计为0.1-1ml/mg;所述正硅酸四乙酯体积用量以绿色量子点重量计为0.1-1ml/mg;所述3-氨丙基三乙氧基硅烷体积用量以绿色量子点重量计为0.05-0.5ml/mg;(3)将红色量子点分散到去离子水中形成分散液,加入edc,5-45℃黑暗振荡活化10~30min,加入步骤(2)制备的包埋绿色量子点的表面氨基化修饰的二氧化硅纳米微球,5-45℃黑暗搅拌8~12个小时,离心,沉淀用去离子水洗涤,获得所述比率型荧光探针;所述红色量子点与包埋绿色量子点的表面氨基化修饰的二氧化硅纳米微球质量比为1:5-20,所述edc与红色量子点的质量比为10-100:1;所述分散液中去离子水用量以红色量子点重量计为1-10ml/mg,优选1-3ml/mg。
进一步,步骤(1)所述所述乙醇体积用量以绿色量子点重量计为15-40ml/mg。
进一步,所述氨水体积用量以绿色量子点重量计为0.25-0.5ml/mg;所述正硅酸四乙酯体积用量以绿色量子点重量计为0.25-0.5ml/mg;所述3-氨丙基三乙氧基硅烷体积用量以绿色量子点重量计为0.05-0.2ml/mg。
进一步,步骤(3)所述红色量子点与包埋绿色量子点的二氧化硅纳米微球质量比为1:5-10,所述edc与红色量子点的质量比为10-30:1。
本发明所述n-乙酰-l-半胱氨酸修饰的碲化镉量子点的制备方法为:
(1)氯化镉溶于去离子水中,25℃搅拌,通氮气10min;去离子水体积用量以氯化镉物质的量计为200ml/mmol;
(2)向步骤(1)中加入修饰剂n-乙酰-l-半胱氨酸,1mol/l氢氧化钠水溶液调节溶液ph=11,加入柠檬酸三钠,亚碲酸钠,加入还原剂硼氢化钠,之后100℃加热回流12h,得到发射红色荧光的n-乙酰-l-半胱氨酸修饰的碲化镉(cdte)量子点溶液(即n-乙酰-l-半胱氨酸修饰的红色量子点溶液),将n-乙酰-l-半胱氨酸修饰的cdte量子点溶液离心,取沉淀,即n-乙酰-l-半胱氨酸修饰的cdte量子点;所述n-乙酰-l-半胱氨酸、柠檬酸三钠、亚碲酸钠、硼氢化钠与氯化镉物质的量之比为1.37:0.92:0.1:2.63:0.5。
此外,本发明还提供一种所述比率型荧光探针在检测谷胱甘肽中的应用,具体方法为:将1mg/ml比率型荧光探针的去离子水悬浮液、ph为8.5的磷酸盐缓冲液、(0.1mm)汞离子水溶液、待测样品混合作为检测液,静置10分钟后,在激发波长为380nm、激发光和发射光的狭缝宽度均为5nm、扫描范围从450nm到720nm进行荧光检测,获得的荧光强度谱图,根据谷胱甘肽标准曲线即可获得待测样品中谷胱甘肽的浓度;所述检测液中,比率型荧光探针的去离子水悬浮液体积浓度为2.5%-10%,所述缓冲液体积用量为检测液体积的1/3,所述汞离子终浓度以检测液体积计为0.6-2.4μm;
所述谷胱甘肽标准曲线制备方法为:将1mg/ml比率型荧光探针的去离子水悬浮液、ph为8.5的磷酸盐缓冲液、(0.1mm)汞离子水溶液、谷胱甘肽混合作为检测液,同待测样品检测方法,以谷胱甘肽浓度为横坐标,以荧光强度为纵坐标制作标准曲线,所述检测液中,比率型荧光探针的去离子水悬浮液体积浓度为5%,所述缓冲液体积用量为检测液体积的1/3,所述汞离子终浓度以检测液体积计为1.2μm,谷胱甘肽终浓度以检测液体积计为0.1-10μm。
为了进一步探究本发明所述比率型荧光探针在检测中的选择性,我们在探针的分散液中加入一系列的金属离子和氨基酸,包括半胱氨酸,na+,k+,酪氨酸,苯丙氨酸,色氨酸,组氨酸,甲硫氨酸,脯氨酸,并进行荧光光谱检测,相比之下,na+,k+,甲硫氨酸,脯氨酸,酪氨酸,苯丙氨酸,色氨酸,组氨酸,对荧光基本无影响,半胱氨酸在高出谷胱甘肽3倍的情况下对荧光有略微恢复,因此,我们合成的比率探针可以很好地选择性地检测gsh。
与现有技术相比,本发明的有益效果主要体现在:
1、利用
2、相比其它的比率探针,本探针在检测gsh时,不仅具有低的检出限,又能进行特异性检测,并且探针具有制备简单、稳定性好等优点,对谷胱甘肽的检测限低至45nm,对快速可视化检测提供了方便。
(四)附图说明
图1为实施例1中绿光发射的包埋量子点的表面氨基化修饰的二氧化硅纳米微球的tem图。
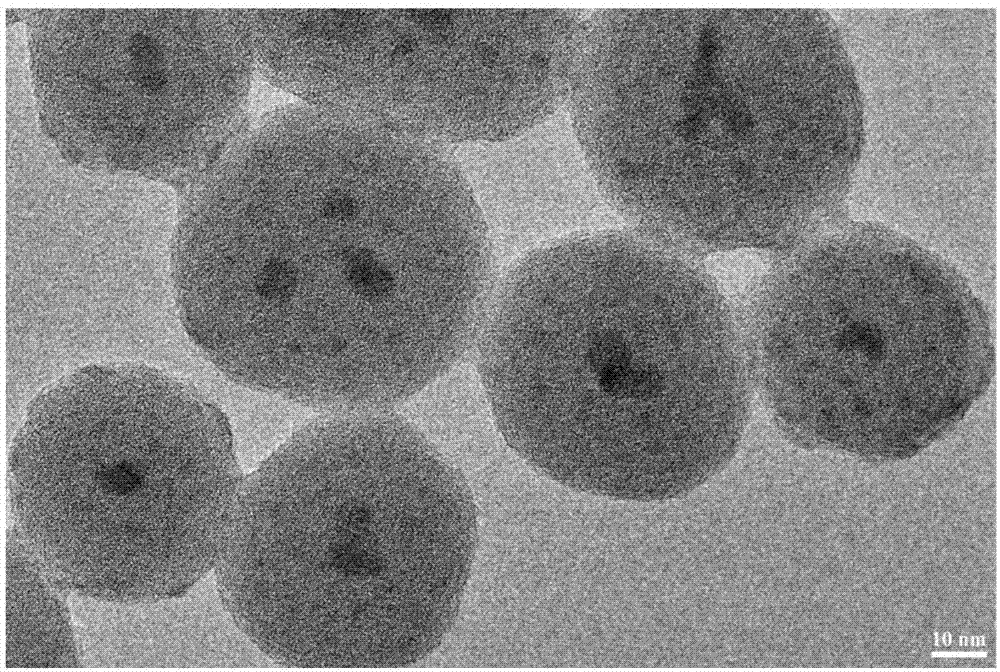
图2为实施例1中比率探针的tem图。
图3为实施例1产物的荧光光谱图,a,b,c分别为绿色量子点,绿光发射的包埋量子点的表面氨基化修饰的二氧化硅纳米微球,红色量子点。
图4为实施例1产物的荧光照片,a,b,c分别为绿色量子点,绿光发射的包埋量子点的表面氨基化修饰的二氧化硅纳米微球,红色量子点。
图5为实施例5中探针被hg2+猝灭以及被谷胱甘肽恢复的机理图。
图6为实施例5中探针被hg2+猝灭的荧光光谱图。
图7为实施例5中探针被谷胱甘肽恢复的荧光光谱图。
图8为实施例5中365nm紫外灯下相应的荧光照片,从左至右谷胱甘肽浓度依次为0、0.1、0.5、1、2、3、5、7、10、15、20、30μm。
图9为实施例8中各物质对荧光恢复的柱状图。
图10为实施例8中365nm紫外灯下相应的荧光照片,从左至右依次为空白、谷胱甘肽,半胱氨酸,na+,k+,酪氨酸,苯丙氨酸,色氨酸,组氨酸,甲硫氨酸,脯氨酸,其中,谷胱甘肽的浓度为10μm,na+,k+为5000μm,半胱氨酸30μm,其他氨基酸均为50μm。
图11为实施例5中荧光曲线,a为gsh浓度与荧光强度线性关系图,b为gsh浓度与荧光强度标准曲线。
(五)具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
实施例1:
1、绿色量子点的制备
将三口烧瓶中加入50ml去离子水,并开启搅拌,依次加入0.80ml浓度为0.20m的cdcl2水溶液,72.5mg六偏磷酸钠(shmp,0.12mmol)和34.6μl3-巯基丙酸(mpa,0.32μmol)。接着用1.0m的naoh水溶液将ph调至9.0,然后加入0.80ml浓度为0.020m的na2seo3水溶液,在100℃条件下回流10分钟后,加入3.70ml水合肼(n2h4·h2o,0.072mol),继续回流9h后,停止加热,得到绿色荧光的cdse量子点溶液(即绿色量子点溶液),发射峰在522纳米,浓度为9.21×10-6mol/l。
取10mlcdse量子点溶液,加入12ml无水乙醇,静置,离心,沉淀用无水乙醇洗涤1~2次,获得固相硒化镉量子点(cdse,粒径3-5nm)2mg,即绿色量子点,荧光光谱图见图3中曲线a,荧光照片见图4中a。
2、包埋绿色量子点的二氧化硅纳米粒子
将上述所得绿色量子点2mg分散于40ml乙醇中,20℃搅拌10min,形成均一混合液;将氨水0.5ml,正硅酸四乙酯0.5ml加入混合液中,20℃搅拌12h;之后加入3-氨丙基三乙氧基硅烷100μl,20℃搅拌12h;离心,沉淀依次用无水乙醇、去离子水洗涤2~3次,得到包埋绿色量子点的表面氨基修饰的二氧化硅纳米微球(即cdse@sio2-nh2)0.090g,粒径40~60nm(形貌tem图见图1,荧光光谱图见图3中曲线b,荧光照片见图4中b)。将cdse@sio2-nh2分散在去离子水中,备用。
3、红色量子点的制备
(1)氯化镉固体0.5mmol溶于100ml水中,25℃搅拌,通氮气10min。
(2)加入修饰剂n-乙酰-l-半胱氨酸1.37mmol,1mol/l氢氧化钠调节溶液ph=11,加入柠檬酸三钠0.92mmol,亚碲酸钠0.1mmol,加入还原剂硼氢化钠2.63mmol,之后100℃加热回流12h,得到发射红色荧光的n-乙酰-l-半胱氨酸修饰的碲化镉(cdte)量子点溶液(即n-乙酰-l-半胱氨酸修饰的红色量子点溶液),荧光光谱图见图3中曲线c,荧光照片见图4中c,发射峰在608纳米,浓度为2.53×10-6mol/l。
4、比率荧光探针的制备
将步骤3制备的n-乙酰-l-半胱氨酸修饰的cdte量子点溶液离心,取沉淀(即n-乙酰-l-半胱氨酸修饰的cdte量子点)0.7mg,加入10mgedc,再加入去离子水2ml,25℃黑暗下搅拌30min,接着加入步骤2制备的包埋绿色量子点的表面氨基化修饰的二氧化硅纳米微球12mg,在25℃黑暗条件下搅拌8h。反应结束后,离心,取沉淀并用去离子水洗涤3次,除去多余的量子点,得到cdse@sio2@cdte比率探针固体12mg,加入12ml去离子水,得1mg/ml的cdse@sio2@cdte比率探针分散液,365nm紫外灯下,荧光呈红色(形貌图见图2)。最后将得到的cdse@sio2@cdte比率探针分散液保存在4℃的冰箱中,备用。
实施例2:
1、包埋绿色量子点的二氧化硅纳米粒子
将实施例1方法所得绿色量子点2mg分散于40ml乙醇中,25℃搅拌30min,形成均一混合液;将氨水0.7ml,正硅酸四乙酯0.5ml加入混合液中,20℃搅拌12h;之后加入3-氨丙基三乙氧基硅烷100μl,25℃搅拌12h;离心,沉淀依次用无水乙醇、去离子水洗涤2~3次,得到包埋绿色量子点的表面氨基修饰的二氧化硅纳米微球(即cdse@sio2-nh2)0.120g,粒径40~60nm(形貌tem图同图1,荧光光谱图同图3中曲线b)。将cdse@sio2-nh2分散在去离子水中,备用。
2、比率荧光探针的制备
将实施例1方法制备的n-乙酰-l-半胱氨酸修饰的cdte量子点溶液离心,取沉淀(即n-乙酰-l-半胱氨酸修饰的cdte量子点)1mg,加入15mgedc,再加入去离子水2ml,25℃黑暗下搅拌30min,接着加入步骤1制备的包埋绿色量子点的表面氨基化修饰的二氧化硅纳米微球16mg,在25℃黑暗条件下搅拌8h。反应结束后,离心,取沉淀并用去离子水洗涤3次,除去多余的量子点,得到cdse@sio2@cdte比率探针固体14mg,加入16ml去离子水,得1mg/ml的cdse@sio2@cdte比率探针分散液,365nm紫外灯下,荧光呈红色。最后将得到的cdse@sio2@cdte比率探针分散液保存在4℃的冰箱中,备用。
实施例3:
1、包埋绿色量子点的二氧化硅纳米粒子
将实施例1方法所得绿色量子点2mg分散于40ml乙醇中,25℃搅拌10min,形成均一混合液;将氨水1ml,正硅酸四乙酯1ml加入混合液中,25℃搅拌12h;之后加入3-氨丙基三乙氧基硅烷200μl,25℃搅拌12h;离心,沉淀依次用无水乙醇、去离子水洗涤2~3次,得到包埋绿色量子点的表面氨基修饰的二氧化硅纳米微球(即cdse@sio2-nh2)0.150g,粒径40~60nm。将cdse@sio2-nh2分散在去离子水中,备用。
2、比率荧光探针的制备
将实施例1方法制备的n-乙酰-l-半胱氨酸修饰的cdte量子点溶液离心,取沉淀(即n-乙酰-l-半胱氨酸修饰的cdte量子点)2mg,加入20mgedc,再加入去离子水2ml,25℃黑暗下搅拌30min,接着加入步骤1制备的包埋绿色量子点的表面氨基化修饰的二氧化硅纳米微球20mg,在25℃黑暗条件下搅拌10h。反应结束后,离心,取沉淀并用去离子水洗涤4次,除去多余的量子点,得到cdse@sio2@cdte比率探针固体20mg,加入20ml去离子水,得1mg/ml的cdse@sio2@cdte比率探针分散液,365nm紫外灯下,荧光呈红色。最后将得到的cdse@sio2@cdte比率探针分散液保存在4℃的冰箱中,备用。
实施例4:
1、包埋绿色量子点的二氧化硅纳米粒子
将实施例1方法所得绿色量子点2mg分散于40ml乙醇中,25℃搅拌10min,形成均一混合液;将氨水0.5ml,正硅酸四乙酯0.5ml加入混合液中,25℃搅拌12h;之后加入3-氨丙基三乙氧基硅烷200μl,25℃搅拌12h;离心,沉淀依次用无水乙醇、去离子水洗涤2~3次,得到包埋绿色量子点的表面氨基修饰的二氧化硅纳米微球(即cdse@sio2-nh2)0.090g,粒径40~60nm。将cdse@sio2-nh2分散在去离子水中,备用。
2、比率荧光探针的制备
将实施例1方法制备的n-乙酰-l-半胱氨酸修饰的cdte量子点溶液离心,取沉淀(即n-乙酰-l-半胱氨酸修饰的cdte量子点)0.9mg,加入15mgedc,再加入去离子水2ml,25℃黑暗下搅拌20min,接着加入步骤1制备的包埋绿色量子点的表面氨基化修饰的二氧化硅纳米微球12mg,在25℃黑暗条件下搅拌10h。反应结束后,离心,取沉淀并用去离子水洗涤3次,除去多余的量子点,得到cdse@sio2@cdte比率探针固体12mg,加入12mll去离子水,得1mg/ml的cdse@sio2@cdte比率探针分散液,365nm紫外灯下,荧光呈红色。最后将得到的cdse@sio2@cdte比率探针分散液保存在4℃的冰箱中,备用。
实施例5:缓冲液中谷胱甘肽的检测
取样管12支,分别加入150μl浓度为1mg/ml的实施例1制备的比率探针去离子水悬液,1ml浓度为100mm、ph=7.4的磷酸盐缓冲液,以及36μl浓度为0.1mm的氯化汞水溶液(使检测液中汞离子的最终浓度为1.2μm),接着加入不同终浓度的谷胱甘肽(0,0.1,0.5,1,2,3,5,7,10,15,20,30μm),最后用去离子水稀释到3ml即为检测液,并摇匀。10分钟后将检测液转移到10mm比色皿中进行荧光光谱检测(见图7),根据图7谷胱甘肽浓度和恢复的荧光强度绘制谷胱甘肽浓度和荧光强度关系曲线(图11中a),并从中选取谷胱甘肽(0,0.1,0.5,1,2,3,5,7,10μm)作为标准曲线(见图11中b)。根据取样管中颜色的对比,可以判断不同取样管中谷胱甘肽的浓度,谷胱甘肽的浓度越大,荧光越偏向于红色(加入谷胱甘肽前的荧光图见图6,机理图见图5,加入谷胱甘肽后的荧光图见图7,365nm紫外灯下相应的荧光照片见图8)。所有的操作均在室温下进行,荧光检测的条件如下:激发波长为380nm,激发光和发射光的狭缝宽度均为5nm,扫描范围从450nm到720nm。
实施例6:实际蔬菜样品中谷胱甘肽的检测
为了评估比率探针的实用性,我们用蔬菜(西红柿、黄瓜)来进行谷胱甘肽的检测实验。在实验前对蔬菜进行前处理,包括清洗、切块、研磨、纱布过滤得蔬菜汁,然后用0.22μm滤头过滤蔬菜汁2次,以除去滤液中的悬浮物。实际检测时,将150μl浓度为1mg/ml的实施例1制备的比率探针去离子水分散液,1ml浓度为100mm、ph=7.4的磷酸盐缓冲液,以及36μl浓度为0.1mm的汞离子水溶液加入到取样管中,然后加入1ml含有不同浓度的谷胱甘肽的蔬菜样品(蔬菜样品在使用之前先过滤掉其中的固体悬浮物,然后各自加入一定量的谷胱甘肽,使样品含谷胱甘肽浓度分别为2.0、4.0和6.0μm),最后用去离子水稀释到3ml作为检测液,10分钟后在与实施例5相同的检测条件下进行荧光测试,得到荧光强度,根据实施例5所述的标准曲线(图11中b),结合紫外光照下的荧光颜色,即可判断谷胱甘肽的浓度,由表1可以看出,该方法可以很好的检测蔬菜样品中的谷胱甘肽,且谷胱甘肽的浓度越大,荧光越偏向于红色。
表1加标法对实际样品谷胱甘肽含量测定
实施例7:实际水果样品中谷胱甘肽的检测
为了评估比率探针的实用性,我们用水果(紫葡萄、凤梨)来进行谷胱甘肽的检测实验。在实验前对水果进行前处理,包括清洗、切块、研磨、纱布过滤得水果汁,然后用0.22μm滤头过滤水果汁2次,以除去滤液中的悬浮物。实际检测时,将150μl浓度为1mg/ml的实施例1制备的比率探针分散液,1ml浓度为100mm、ph=7.4的磷酸盐缓冲液,以及36μl浓度为0.1mm的汞离子水溶液加入到取样管中,然后加入1ml含有不同浓度的谷胱甘肽的水果样品(水果样品在使用之前先过滤掉其中的固体悬浮物,然后各自加入一定量的谷胱甘肽,使样品含谷胱甘肽浓度分别为2.0、4.0和6.0μm),最后用去离子水稀释到3ml作为检测液,10分钟后在与实施例5相同的检测条件下进行荧光测试,得到荧光强度,对照实施例5所述的标准曲线(图11中b),结合紫外光照下的荧光颜色,即可判断谷胱甘肽的浓度,谷胱甘肽的浓度越大,荧光越偏向于红色。
表2加标法对实际样品谷胱甘肽含量测定
实施例8:荧光比率探针的选择性
为了进一步探究谷胱甘肽荧光比率探针的选择性,我们在探针的分散液中加入一系列的金属离子和氨基酸,包括半胱氨酸,na+,k+,酪氨酸,苯丙氨酸,色氨酸,组氨酸,甲硫氨酸,脯氨酸,并通过荧光光谱,记录下荧光比率的变化情况。
取11只取样管,在取样管中分别加入150μl浓度为1mg/ml的实施例1制备的比率探针去离子水悬液,1ml、0.01m、ph=7.4的磷酸盐缓冲液和36μl浓度为0.1mm的氯化汞水溶液,接着以第一只取样管为空白对照,其他取样管中分别加入谷胱甘肽10μm,半胱氨酸30μm,na+与k+为5000μm,酪氨酸,苯丙氨酸,色氨酸,组氨酸,甲硫氨酸,脯氨酸均为50μm,最后用去离子水稀释到3ml作为检测液,并摇匀。10分钟后将混合液转移到4ml的比色皿中进行荧光检测(荧光光谱图见图9,365nm紫外灯下相应的荧光照片见图10),通过相应的荧光照片,可以看出只有加了谷胱甘肽的样品,荧光才由绿色变到红色,也相应证明了该荧光比率探针对谷胱甘肽的选择性。
- 还没有人留言评论。精彩留言会获得点赞!