一种金属有机骨架纳米复合材料的合成方法及其应用与流程
本发明属于先进纳米材料与纳米技术领域,具体涉及一种金属有机骨架(MOF)纳米复合材料的合成方法及其应用,尤其涉及一种用于磷酸化肽富集以及糖肽富集与MALDI-TOF MS以及LC-MS/MS检测的磁球表面包覆聚多巴胺和氨基修饰的以锆为中心金属离子的金属有机骨架(MOF)纳米复合材料的合成方法及其双向应用。
背景技术:
蛋白质的糖基化以及磷酸化是生命过程中两种重要且普遍的翻译后修饰,它们与细胞间信号传递、细胞分裂、增殖、分化和相互作用等许多重要的复杂生物过程息息相关。一些研究表明,糖肽或磷酸化肽的表达水平异常,可作为很多疾病的生物标志,尤其是癌症等人类重大疾病。所以对糖肽以及磷酸化肽的研究对疾病的早期诊断有着重要的意义。然而糖肽和磷酸化肽的丰度往往非常低,并且它们的质谱响应会受到高丰度非磷酸化肽/糖肽和蛋白质的压制,样品中的盐分和表面活性剂同样也会对其质谱行为产生干扰,使得其电离效率非常低,质谱检测相对较为困难。因此在使用质谱方法分析复杂生物样品中的糖肽和磷酸化肽段之前,对样品中的肽段进行选择性富集是十分必要的。
自19世纪80年代以来,一系列新的软电离技术如快原子轰击电离、基质辅助激光解吸电离、电喷雾电离等发现后,生物质谱技术迅速发展。由于质谱技术(Mass Spectrometry,MS)具有高准确性、高灵敏度和自动化操作的特点,并且它能够准确测量肽段和蛋白质的相对分子量和氨基酸序列等,快速、精确地获得多种蛋白质属性参数,结合生物信息学工具,可迅速进行蛋白质的鉴定,从而为蛋白质的结构解析提供可靠依据。因此质谱技术无可争议地成为当前蛋白质组学研究中不可或缺的平台,质谱数据的信息质量直接决定了蛋白质鉴定的可靠性和鉴定数量。
随着近年来研究的不断深入,许多方法都被用来选择性分离富集糖基化蛋白和多肽,比如硼酸亲和色谱、肼化学、亲水相互作用色谱(HILIC)、色谱分析法、体积排阻法等。其中HILIC方法应用最为广泛,效果也较其他方法更好,HILIC方法中,例如金属有机骨架材料、纳米材料等等,都在糖肽富集方面引起了广泛的重视。
此外,许多方法也都被用来选择性分离富集磷酸化蛋白和多肽,比如免疫沉淀法、固相萃取法、超滤法、强阳离子交换色谱法、固定金属离子亲和层析法(IMAC)、金属氧化物亲和层析法(MOAC)等等。其中IMAC方法应用广泛,效果也较好。通过金属离子与磷酸化多肽上的磷酸基团间发生配位相互作用,从而起到富集磷酸化多肽的效果,MOF作为IMAC的一种,受到了广泛的重视。
因此,本发明将HILIC与IMAC技术相结合,设计了一种磁球表面包覆聚多巴胺和氨基修饰的以锆为中心金属离子的金属有机骨架(MOF)纳米复合材料,通过锆离子与磷酸化肽的紧密结合,以及亲水相互作用与糖肽的紧密结合,达到一种材料双向应用的效果。这种材料由于具有磁性,操作简便、易于制得、且具备MOF的一管优异性能,在糖肽以及磷酸化肽富集方面有着很好的应用前景。
金属-有机骨架材料是指由有机官能团为支架、金属离子或金属簇为中心节点,通过自组装形成的具有规则纳米孔道的三维周期性的网格结构多孔材料。具有非常大的比表面积、稳定的纳米级孔道、可调控的孔道结构、良好的热稳定性等优异性能,且不饱和的配位金属可能与含有羧基、氨基等官能团的被分析物质发生配位作用,MOFs材料已成为有机化学、无机化学、物理化学领域的研究热点。MOFs如今在气体分离、苯及其同系物的选择性吸附、药物研发等发挥了其不小的作用。近年来,MOFs材料已初步应用于蛋白质/肽的分离富集,并显示MOFs材料在蛋白质组研究中,如低丰度肽富集等有很好的潜力。
技术实现要素:
本发明的目的在于提供一种金属有机骨架(MOF)纳米复合材料的合成方法,尤其提出一种磁球表面包覆聚多巴胺和氨基修饰的以锆为中心金属离子的金属有机骨架(MOF)纳米复合材料的合成方法及其在糖肽以及磷酸化肽富集与MALDI-TOF MS以及LC-MS/MS检测中的应用。
本发明提出一种金属有机骨架(MOF)纳米复合材料的合成方法,具体步骤如下:
(1)将FeCl3•6H2O溶于乙二醇中,磁力搅拌至澄清,加醋酸钠充分搅拌,超声后,转移至反应釜中,在200℃条件下反应16小时后,冷却,用去离子水及乙醇充分洗涤所生成的四氧化三铁磁球,在50℃下真空干燥;
(2)将步骤(1)所得的四氧化三铁磁球分散于三羟甲基氨基甲烷(Tris)缓冲液中,超声15分钟左右,加入多巴胺盐酸盐,在室温下机械搅拌反应6-20小时,制得聚多巴胺包覆的磁球,用磁铁分离产物后,用去离子水和无水乙醇充分洗涤,在50℃下真空干燥,得到聚多巴胺包覆的磁球;
(3)在二甲基甲酰胺中分散步骤(2)所得产物聚多巴胺包覆的磁球,超声数分钟,充分分散后加入氯化锆,搅拌均匀,在反应温度100-140℃下,反应15-45分钟;
(4)在步骤(3)所得产物中加入配体2-氨基对苯二甲酸,在120℃下继续加热约15分钟;
(5)步骤(4)所得产物用磁铁分离后,用二甲基甲酰胺、蒸馏水和无水乙醇充分洗涤,在50℃下真空干燥,即得所需的金属有机骨架(MOF)纳米复合材料。
本发明中,步骤(1)中FeCl3•6H2O和乙二醇的配比范围为(0.9-1.8)g:(50-100)mL。
本发明中,步骤(1)中FeCl3•6H2O和乙二醇的配比为1.35g:75mL。
本发明中,步骤(2)中Tris缓冲液的溶剂为去离子水和乙醇,体积比为1:1,pH值为8.5。
本发明中,步骤(2)中四氧化三铁磁球和多巴胺盐酸盐的质量比为2.4:1。
本发明中,步骤(3)中聚多巴胺包覆的磁球和氯化锆的质量比为(75-125):(120-200)。
本发明中,步骤(3)中聚多巴胺包覆的磁球和氯化锆的质量比为5:8,反应温度为120℃,反应时间为30分钟。
本发明中,步骤(2)中所得产物聚多巴胺包覆的磁球和步骤(4)中的2-氨基对苯二甲酸的质量比范围为(75-125):(90-150),反应温度为100-140℃,反应时间为10-20分钟。
本发明中,步骤(2)中所得产物聚多巴胺包覆的磁球和步骤(4)中的2-氨基对苯二甲酸的质量比为5:6,反应温度为120℃,反应时间为15分钟。
本发明还提出一种所述合成方法得到的金属有机骨架(MOF)纳米复合材料在糖肽富集与质谱鉴定中的应用,具体为:将金属有机骨架(MOF)纳米复合材料以超纯水为溶剂配置成为10 mg/mL的材料分散液,将该材料分散液与目标糖肽溶液加入90%乙腈/1%三氟乙酸缓冲液中,混合并在酶解仪中孵育;通过离心分离出纳米复合材料,用90%乙腈/1%三氟乙酸以及80%乙腈/1%磷酸缓冲液洗涤材料,随后用30%乙腈/0.1%甲酸洗脱;取1μL洗脱液直接在MALDI-TOF MS进样靶板上点靶,干燥后再点加1μL浓度为30mg/mL的2,5-二羟基苯甲酸(DHB)溶液于该液滴上,形成基质结晶,进行质谱分析。
本发明还提出一种所述合成方法得到的金属有机骨架(MOF)纳米复合材料在内源性磷酸化肽富集与质谱鉴定中的应用,具体为:将金属有机骨架(MOF)纳米复合材料配置成为10 mg/mL的材料分散液(溶剂为超纯水),将该材料分散液与目标磷酸化肽段溶液加入50%乙腈/0.1%三氟乙酸缓冲液中,混合并在酶解仪中孵育;通过离心分离出纳米复合材料,用50%乙腈/0.1%三氟乙酸缓冲液洗涤材料,随后用0.4M氨水洗脱;取1μL洗脱液直接在MALDI-TOF MS进样靶板上点靶,干燥后再点加1μL浓度为20mg/mL的2,5-二羟基苯甲酸(DHB)溶液于该液滴上,形成基质结晶,进行质谱分析。
本发明的有益效果在于:首次合成了结合传统IMAC材料和HILIC(MOF)材料优点的纳米复合材料,并成功应用于糖肽和磷酸化肽的分离富集。本发明提出的合成方法合成的磁球表面包覆聚多巴胺和氨基修饰的以锆为中心金属离子的金属有机骨架(MOF)纳米复合材料,合成方法简单快速,锆离子对磷酸化肽具有高灵敏度和高选择性,氨基和糖肽可通过亲水相互作用紧密结合,MOF提高了有效表面以及较好的体孔道结构。此纳米复合材料可用于选择性地富集生物样品中的低丰度的糖肽和磷酸化肽,并用于MALDI-TOF MS以及LC-MS/MS检测。由于MOF较高的表面积以及锆离子与磷酸基团间的亲和作用和氨基与糖肽间的亲水相互作用,使得该纳米复合材料可以对复杂生物样品中的糖肽和磷酸化肽进行选择性富集,大大提高了其质谱信号,本发明所提供的材料对磷酸化肽检测限达20 amol/μL,糖肽检测限达200 amol/μL,对非磷酸化肽段的选择性达1:500(质量比),对非糖肽的选择性达1:100(质量比),可直接从人体血清中检测到4条内源性磷酸化肽,以及307条氮端糖肽对应于121种不同的糖蛋白。被富集肽段信噪比放大倍数高,具有较好的选择性和高灵敏度,对复杂生物样品中的糖肽和磷酸化肽的检测有很好的。
附图说明
图1为实施例1制得的金属有机骨架(MOF)纳米复合材料的扫描电子显微镜照片以及透射电子显微镜照片;其中:SEM: a)为Fe3O4@PDA,b)为Fe3O4@PDA@UiO-66-NH2,TEM: c)为Fe3O4@PDA@UiO-66-NH2,d)为Fe3O4@PDA@UiO-66-NH2(放大图);
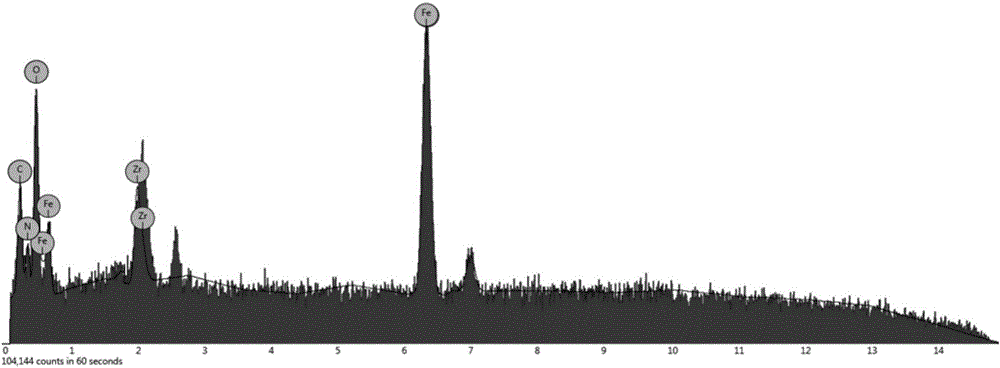
图2为实施例1制得的金属有机骨架(MOF)纳米复合材料的能量色散X射线光谱及元素含量分布图;
图3为实施例1制得的金属有机骨架(MOF)纳米复合材料的氮吸附曲线;附图:孔径分布曲线;
图4为实施例1制得的金属有机骨架(MOF)纳米复合材料的磁滞回曲线;
图5为实施例1制得的金属有机骨架(MOF)纳米复合材料的亲水性测试图,其中(a)为5分钟后,(b)为10分钟后,(c)为30分钟后,(d)为磁性分离3秒钟后;
图6为实施例1制得的金属有机骨架(MOF)纳米复合材料的红外表征谱图;
图7为实施例1制得的金属有机骨架(MOF)纳米复合材料的拉曼表征谱图;
图8为实施例1制得的金属有机骨架(MOF)纳米复合材料的X射线衍射图;
图9为实施例1制得的金属有机骨架(MOF)纳米复合材料的Zeta电势图;其中:a) Fe3O4,b) Fe3O4@PDA,c) Fe3O4@PDA@UiO-66-NH2;
图10为实施例2中经金属有机骨架(MOF)纳米复合材料富集前后的质谱图,其中;a)是250 fmol/μL 的HRP酶解液富集前原液的质谱图;b) 是250 fmol/μL 的HRP酶解液经金属有机骨架(MOF)纳米复合材料富集后洗脱液的质谱图;c)1 pmol/μL 的IgG酶解液富集前原液的质谱图;d)是1 pmol/μL 的IgG酶解液经金属有机骨架(MOF)纳米复合材料富集后洗脱液的质谱图;e)是200 fmol/μL 的β-Casein酶解液富集前原液的质谱图;f)是200 fmol/μL 的β-Casein酶解液经金属有机骨架(MOF)纳米复合材料富集后洗脱液的质谱图;
图11为实施例2中250 fmol/μL 的HRP酶解液经过金属有机骨架(MOF)纳米复合材料质谱图,a)新鲜制得材料所得富集后洗脱液的质谱图,b)材料循环使用5次后所得富集后洗脱液的质谱图;200 fmol/μL 的β-Casein酶解液经过金属有机骨架(MOF)纳米复合材料,c)新鲜制得材料所得富集后洗脱液的质谱图,d)材料循环使用5次后所得富集后洗脱液的质谱图;
图12为实施例2中250 fmol/μL 的HRP酶解液经过金属有机骨架(MOF)纳米复合材料质谱图,a)新鲜制得材料所得富集后洗脱液的质谱图,b)材料在-20℃保存1个月后所得富集后洗脱液的质谱图;200 fmol/μL 的β-Casein酶解液经过金属有机骨架(MOF)纳米复合材料,c)新鲜制得材料所得富集后洗脱液的质谱图,d)材料在-20℃保存1个月后所得富集后洗脱液的质谱图;
图13为实施例2中HRP酶解液经过金属有机骨架(MOF)纳米复合材料富集后质谱图,HRP酶解液浓度为:a) 25 fmol/μL; b) 5 fmol/μL; c) 1 fmol/μL;d) 0.2 fmol/μL;β-Casein酶解液经过金属有机骨架(MOF)纳米复合材料富集后质谱图,β-Casein酶解液浓度为:e) 25 fmol/μL; f) 1 fmol/μL;
图14为实施例3中质量比为1:50的HRP和BSA酶解液的混合溶液a)富集前的质谱图;b) 经过金属有机骨架(MOF)纳米复合材料富集后质谱图;质量比为1:100的HRP和BSA酶解液的混合溶液c)富集前的质谱图;d) 经过金属有机骨架(MOF)纳米复合材料富集后质谱图;质量比为1:500的β-Casein和BSA酶解液的混合溶液e)富集前的质谱图;f) 经过金属有机骨架(MOF)纳米复合材料富集后质谱图;
图15为实施例4中未经过酶解处理的健康人血清质谱图,a)原液质谱图,b)经过金属有机骨架(MOF)纳米复合材料富集后上清液质谱图。
具体实施方式
下面的实施实例是对本发明的进一步说明,而不是限制本发明的范围。
实施例1:一种磁球表面包覆聚多巴胺和氨基修饰的以锆为中心金属离子的金属有机骨架(MOF)纳米复合材料的合成。
(1)用乙二醇作为溶剂合成四氧化三铁磁球,将1.35g FeCl3•6H2O溶于75mL乙二醇,磁力搅拌(手套封口)至澄清,后加3.6g压碎醋酸钠搅拌至溶解并继续搅拌0.5h(手套封口)。超声5min后,转移至反应釜,200℃,16h。取出反应釜,冷却过夜。倒出磁球,水洗5次(每次超声5min)。用去离子水及乙醇充分洗涤磁球,到洗涤液清澈纯净,在50℃下真空干燥;
(2)配置三羟甲基氨基甲烷(Tris)缓冲液(溶剂为去离子水和乙醇,体积比1:1,pH=8.5),将步骤(1)所得的四氧化三铁磁球120 mg分散于80mLTris缓冲液(内含0.05g Tris、40mL水、40mL乙醇)中,超声15分钟左右,加入0.32g多巴胺盐酸盐,室温搅拌反应16h。磁铁分离产物,用去离子水和无水乙醇充分洗涤,在50℃下真空干燥;
(3)在75 mL二甲基甲酰胺中分散步骤(2)所得产物100 mg,超声一段时间,充分分散;加入氯化锆160mg,搅拌均匀,120℃加热搅拌30分钟;
(4)在步骤(3)所得体系中加入配体2-氨基对苯二甲酸120mg,搅拌均匀,120℃加热搅拌15分钟,磁铁分离产物,用二甲基甲酰胺、去离子水和无水乙醇充分洗涤,在50℃下真空干燥。
图1为实施例1的扫描电子显微镜照片及透射电子显微镜照片。扫描电子显微镜图可以看出在磁球外包覆了一层较薄的聚合物层,在修饰MOF后,表面的结晶形貌与聚合物的光滑层不同;透射电子显微镜图可以看出聚合物@MOF层约为70纳米厚;扫描电镜型号为Philips XL30,将纯化后的磁球表面包覆聚多巴胺和氨基修饰的以锆为中心金属离子的金属有机骨架(MOF)纳米复合材料均匀涂抹在导电胶上,喷金后进行SEM表征;透射电镜型号为JEM-2100F(J0EL),将纯化后的磁球表面包覆聚多巴胺和氨基修饰的以锆为中心金属离子的金属有机骨架(MOF)纳米复合材料的乙醇分散液滴在覆有碳膜的铜网上,干燥后进行透射电子显微镜观察并拍照;
图2为实施例1的元素分析,其中Zr元素的质量分数占8.0%,与预期一致,表如下;
图3为实施例1的氮吸附曲线及孔径分布曲线,由图中可以看出,该纳米复合材料具有较大的比表面积,且孔的大小为3.11纳米左右;
图4为实施例1的磁滞回线,虽然包覆了聚合物及MOF层之后,材料的磁响应有所下降,但仍保持着较高的磁响应强度,约为45.6emu·g-1;
图5为实施例1的亲水性测试图,将材料分散在水溶液中形成稳定均一的水溶液,并在5分钟、10分钟、30分钟后仍保持分散均一;而用磁铁吸引后,则立刻变成澄清溶液与材料分离;
图6为实施例1的红外表征谱图,该纳米材料出现了较多的特征峰,如3400cm-1处的羧基特征峰、1500-1600cm-1处的苯环特征峰、560cm-1处的Fe-O-Fe振动峰;
图7为实施例1的拉曼表征谱图,<500cm-1处出现磁球的特征峰、1500-1600cm-1处在包覆多巴胺层后出现苯环特征峰,说明材料的成功合成;
图8为实施例1的X射线衍射图样,2θ= 5.2, 7.0, 12.3, 18.2,22.3°是来自于MOF,而2θ= 30.3, 35.4, 43.2, 57.2,63.0°是来自于磁球内核,这也就说明磁性MOF材料的成功合成;X射线衍射仪型号为Bruker D4 X-ray diffractometer;
图9为实施例1的Zeta电势图,Zeta电势经过一层层包覆后先降后升是由于磁球表面被带负电的邻二酚羟基所占据导致电势的下降,而之后MOF层的进一步修饰使表面带正电导致电势的上升,进一步说明材料表面的成功修饰。
实施例2:将实施例1得到的磁球表面包覆聚多巴胺和氨基修饰的以锆为中心金属离子的金属有机骨架(MOF)纳米复合材料作为固相微萃取吸附分离介质用于低浓度HRP酶解液以及β-Casein酶解液的富集与MALDI-TOF MS检测。
(1)标准蛋白酶解液的制备:准确称取2 mg HRP标准蛋白,用25 mM碳酸氢铵溶液配成浓度为 2 mg/mL的标准蛋白溶液,pH大约为8.3,煮沸十分钟。按照质量比为1:50的胰蛋白酶与标准蛋白的比例,加入胰蛋白酶(trypsin),37°C孵育16小时,可得到2 mg/mL的HRP胰蛋白酶解液;准确称取4 mg IgG标准蛋白,用25 mM碳酸氢铵溶液配成浓度为 4 mg/mL的标准蛋白溶液,pH大约为8.3,煮沸十分钟。按照质量比为1:50的胰蛋白酶与标准蛋白的比例,加入胰蛋白酶(trypsin),37°C孵育16小时,可得到4 mg/mL的IgG胰蛋白酶解液;准确称取2.5 mg β-Casein标准蛋白,用25 mM碳酸氢铵溶液配成浓度为 2.5mg/mL的标准蛋白溶液,pH大约为8.3,煮沸十分钟。按照质量比为1:50的胰蛋白酶与标准蛋白的比例,加入胰蛋白酶(trypsin),37°C孵育16小时,可得到2.5 mg/mL的β-Casein胰蛋白酶解液。
(2)样品的富集:
糖肽富集:用超纯水配制10 mg/mL磁球表面包覆聚多巴胺和氨基修饰的以锆为中心金属离子的金属有机骨架(MOF)纳米复合材料的溶液。取20 μL的材料溶液于0.6 mL的离心管,用体积分数为90%乙腈和1%TFA的缓冲溶液洗涤2次后去除上清,加入用缓冲溶液稀释后不同浓度的HRP酶解液(总体积为100μL),混匀,在37°C下震荡富集30分钟;离心分离材料,吸去上清液,用90%乙腈1%TFA溶液洗涤材料一遍,再用80%乙腈/1%磷酸溶液洗涤材料两遍,然后加入10 μL的30%乙腈/0.1%甲酸溶液,37℃震荡洗脱20分钟,离心分离材料,吸出洗脱液备后用。
磷酸化肽富集:用超纯水配制10 mg/mL磁球表面包覆聚多巴胺和氨基修饰的以锆为中心金属离子的金属有机骨架(MOF)纳米复合材料的溶液。取20 μL的材料溶液于0.6 mL的离心管,用体积分数为50%乙腈和0.1%TFA的缓冲溶液洗涤2次后去除上清,加入用缓冲溶液稀释后不同浓度的β-Casein酶解液(总体积为100μL),混匀,在37°C下震荡富集30分钟;离心分离材料,吸去上清液,用50%乙腈0.1%TFA溶液洗涤材料三遍,然后加入10 μL的0.4 mol/L的氨水,37℃震荡洗脱20分钟,离心分离材料,吸出洗脱液备后用。
(3)点靶:取1 μL步骤(2)所述的洗脱液点到MALDI-TOF MS进样靶板上,干燥后再点加1 μL浓度为30 mg/mL(糖肽)或20 mg/mL(磷酸化肽)的2,5-二羟基苯甲酸(DHB)溶液于该液滴上,形成基质结晶,干燥后再进行质谱分析。
(4)质谱分析以磁球表面包覆聚多巴胺和氨基修饰的以锆为中心金属离子的金属有机骨架(MOF)纳米复合材料作为固相微萃取吸附分离介质富集得到的糖肽和磷酸化肽并与富集前的原液质谱图作对比。
浓度为250 fmol/ μL的HRP酶解液经过磁球表面包覆聚多巴胺和氨基修饰的以锆为中心金属离子的金属有机骨架(MOF)纳米复合材料富集后,质谱图中出现了十九条归属于HRP的糖肽峰(m/z=1843.0, m/z=2541.4, m/z=2591.4, m/z=2611.4, m/z=3074.5, m/z=3087.7, m/z=3222.9, m/z=3321.8, m/z=3353.7, m/z=3369.7, m/z=3605.0, m/z=3672.1, m/z=3894.1, m/z=4056.2, m/z=4222.4, m/z=4719.6, m/z=4821.7, m/z=4838.7, m/z=4984.7)。
浓度为1 pmol/ μL的IgG酶解液经过磁球表面包覆聚多巴胺和氨基修饰的以锆为中心金属离子的金属有机骨架(MOF)纳米复合材料富集后,质谱图中出现了二十一条归属于IgG的糖肽峰(m/z=2399.3,m/z=2431.3,m/z=2457.3,m/z=2488.3,m/z=2561.4,m/z=2602.4,m/z=2618.4,m/z=2634.4,m/z=2650.4,m/z=2764.5,m/z=2781.5,m/z=2796.5,m/z=2805.5,m/z=2837.5,m/z=2853.5,m/z=2926.6,m/z=2958.6,m/z=2967.6,m/z=3000.0,m/z=3130.0,m/z=3161.7)
浓度为200 fmol/ μL的β-Casein酶解液经过磁球表面包覆聚多巴胺和氨基修饰的以锆为中心金属离子的金属有机骨架(MOF)纳米复合材料富集后,质谱图中出现了六条归属于β-Casein的磷酸化肽段的峰(m/z=1031.4,m/z=1279.1,m/z=1561.2, m/z=2061.9,m/z=2556.2,m/z=3122.5),四条去磷酸化峰(m/z=1963.9,m/z=2458.0,m/s=2927.3,m/z=3024.2)以及两条来源于α-Casein的磷酸化肽段的峰(m/z=1466.7,m/z=1660.9,)。
实施例3:将实施例1得到的磁球表面包覆聚多巴胺和氨基修饰的以锆为中心金属离子的金属有机骨架(MOF)纳米复合材料作为固相微萃取吸附分离介质用于HRP酶解液或β-Casein酶解液和牛血清白蛋白(BSA)酶解液的混合溶液的富集与MALDI-TOF MS检测。
(1)标准蛋白酶解液的制备:准确称取2 mg 标准蛋白HRP、2.5 mg 标准蛋白β-Casein和5 mg标准蛋白BSA,用25 mM碳酸氢铵溶液配成浓度为2 mg/mL、2.5 mg/mL和5 mg/mL的标准蛋白溶液,pH大约为8.3,煮沸10分钟。按照质量比为1:50的胰蛋白酶与标准蛋白的比例,加入胰蛋白酶(trypsin),37°C孵育16小时,可得到2 mg/mL的HRP胰蛋白酶解液、2.5 mg/mL的β-Casein酶解液和5 mg/mL的BSA酶解液。
(2)样品的富集:
糖肽富集:用超纯水配制10 mg/mL磁球表面包覆聚多巴胺和氨基修饰的以锆为中心金属离子的金属有机骨架(MOF)纳米复合材料的溶液。取20 μL的材料溶液于0.6 mL的离心管,用体积分数为90%乙腈和1%TFA的缓冲溶液洗涤2次后去除上清,先加入1 μL的2 mg/mL的HRP胰蛋白酶解液,分别按照HRP和BSA的质量比为1:50、1:100加入BSA酶解液,随后加入相应体积的体积分数为90%乙腈/1%TFA的水溶液使体系配成总体积为100 μL的体系,混匀,在37°C下震荡富集30分钟;离心分离材料,吸去上清液,用90%乙腈1%TFA溶液洗涤材料一遍,再用80%乙腈/1%磷酸溶液洗涤材料两遍,然后加入10 μL的30%乙腈/0.1%甲酸溶液,37℃震荡洗脱20分钟,离心分离材料,吸出洗脱液备后用。
磷酸化肽富集:用超纯水配制10 mg/mL磁球表面包覆聚多巴胺和氨基修饰的以锆为中心金属离子的金属有机骨架(MOF)纳米复合材料的溶液。取20 μL的材料溶液于0.6 mL的离心管,用体积分数为50%乙腈和0.1%TFA的缓冲溶液洗涤2次后去除上清,先加入1 μL的2.5 mg/mL的β-Casein酶解液后,按照β-Casein和BSA的质量比为1:1:500加入BSA酶解液,随后加入相应体积的体积分数为50%乙腈和0.1%TFA的水溶液使体系配成总体积为100 μL的体系,混匀,在37°C下震荡富集30分钟;离心分离材料,吸去上清液,用50%乙腈0.1%TFA溶液洗涤材料三遍,然后加入10 μL的0.4 mol/L的氨水,37℃震荡洗脱20分钟,离心分离材料,吸出洗脱液备后用。
(3)点靶:取1 μL步骤(2)所述的洗脱液点到MALDI-TOF MS进样靶板上,干燥后再点加1 μL浓度为30 mg/mL(糖肽)或20 mg/mL(磷酸化肽)的2,5-二羟基苯甲酸(DHB)溶液于该液滴上,形成基质结晶,干燥后再进行质谱分析。
(4)质谱分析以磁球表面包覆聚多巴胺和氨基修饰的以锆为中心金属离子的金属有机骨架(MOF)纳米复合材料作为固相微萃取吸附分离介质富集得到的糖肽和磷酸化肽并与富集前的原液质谱图作对比。
质量比为1:50的HRP和BSA的酶解混合液经过磁球表面包覆聚多巴胺和氨基修饰的以锆为中心金属离子的金属有机骨架(MOF)纳米复合材料富集后,从质谱图中可以清楚地看到十二条来源于HRP的糖肽峰(m/z=2541.4, m/z=2591.4, m/z=2611.4, m/z=3222.9, m/z=3321.8, m/z=3353.7, m/z=3369.7, m/z=3672.1, m/z=4056.2, m/z=4222.4, m/z=4838.7, m/z=4984.7)
质量比为1:500的β-Casein和BSA的酶解液混合液经过磁球表面包覆聚多巴胺和氨基修饰的以锆为中心金属离子的金属有机骨架(MOF)纳米复合材料富集后,从质谱图中可以清楚地看到五条来源于β-Casein的磷酸化肽段的峰(m/z=1031.4,m/z=1561.2,m/z=2061.9,m/z=2556.2,m/z=3122.5),四条去磷酸化峰(m/z=1952.0,m/z=2433.2,m/z=2927.6,m/z=3024.6)。
实施例4:将实施例1得到的磁球表面包覆聚多巴胺和氨基修饰的以锆为中心金属离子的金属有机骨架(MOF)纳米复合材料作为固相微萃取吸附分离介质用于健康人血清样品中糖肽和磷酸化肽的富集与MALDI-TOF MS和LC-MS/MS检测。
(1)样品准备:
糖肽富集准备:2μL人体血清分散于198μL 25 mM碳酸氢铵溶液,煮沸10分钟进行变形。后在60℃加入10 mM 二硫苏糖醇(DTT)进行30分钟还原反应,后在37℃在暗处加入20 mM 吲哚-3-乙酸(IAA)进行1小时烷基化反应。之后按照质量比为1:50的胰蛋白酶与蛋白浓度的比例,加入胰蛋白酶(trypsin),37°C孵育16小时,冻干待用。
磷酸化肽富集准备:用体积分数为50%乙腈和0.1%TFA的水溶液稀释健康人血清样品十倍。用体积分数为50%乙腈和0.1%TFA的水溶液配制10 mg/mL磁球表面包覆聚多巴胺和氨基修饰的以锆为中心金属离子的金属有机骨架(MOF)纳米复合材料的溶液。
(2)样品的富集:
糖肽富集:用超纯水配制10 mg/mL磁球表面包覆聚多巴胺和氨基修饰的以锆为中心金属离子的金属有机骨架(MOF)纳米复合材料的溶液。取40 μL的材料溶液于0.6 mL的离心管,用体积分数为90%乙腈和1%TFA的缓冲溶液洗涤2次后去除上清,加入100μL用90%乙腈和1%TFA的缓冲溶液稀释的血清酶解冻干液,混匀,在37°C下震荡富集30分钟;离心分离材料,吸去上清液,用90%乙腈1%TFA溶液洗涤材料一遍,再用80%乙腈/1%磷酸溶液洗涤材料两遍,然后加入10 μL的30%乙腈/0.1%甲酸溶液,37℃震荡洗脱20分钟,离心分离材料,吸出洗脱液冻干后备用。(LC-MS/MS)
磷酸化肽富集:用超纯水配制10 mg/mL磁球表面包覆聚多巴胺和氨基修饰的以锆为中心金属离子的金属有机骨架(MOF)纳米复合材料的溶液。取20 μL的材料溶液于0.6 mL的离心管,用体积分数为50%乙腈和0.1%TFA的缓冲溶液洗涤2次后去除上清,在0.6 mL的离心管内加入10 μL的稀释过的健康人血清,加入190 μL的体积分数为50%乙腈和0.1%TFA的水溶液,混匀,在37°C下震荡富集30分钟;离心分离材料,吸去上清液,用50%乙腈0.1%TFA溶液洗涤材料三遍,然后加入10 μL的0.4 mol/L的氨水,37℃震荡洗脱20分钟,离心分离材料,吸出洗脱液备后用。(MALDI-TOF MS)
(3)糖肽质谱分析:
LC-MSMS:由步骤(2)所得的冻干液分散在10 μL A相(H2O/0.1%FA)中。该仪器为EASY-nLC 1000 system并连有Orbitrap Fusion mass spectrometer。4 μL分散液根据线性梯度在110分钟内从2% B相(乙腈/0.1%FA)到40% B相进样入分析柱(C18, 75 μm x 50 cm)。色谱柱在最初状态回稳10分钟,柱流速为200 nL/min。激光电压为 2.0 kV。Orbitrap质谱软件在MS和MS/MS模式间自动切换。可达到m/z=200的分辨率。由质谱得到的数据基于2015年3月11日发布的Uniprot-SwissProt数据库进行搜库,碎片离子质量数容忍偏差度为0.050 Da,错误率(FDR)小于1%。
健康人血清经过磁球表面包覆聚多巴胺和氨基修饰的以锆为中心金属离子的金属有机骨架(MOF)纳米复合材料富集后,可辨识到307条氮端糖肽对应于121种不同的糖蛋白。
(4)磷酸化肽质谱分析:
点靶:取1 μL步骤(2)所述的洗脱液点到MALDI-TOF MS进样靶板上,干燥后再点加1 μL浓度为20 mg/mL的2,5-二羟基苯甲酸(DHB)溶液于该液滴上,形成基质结晶,干燥后再进行质谱分析。
MALDI-TOF MS:质谱分析以磁球表面包覆聚多巴胺和氨基修饰的以锆为中心金属离子的金属有机骨架(MOF)纳米复合材料作为固相微萃取吸附分离介质富集得到的磷酸化肽并与富集前的原液和富集后的上清液的质谱图作对比。
健康人血清富集前,由于受到严重的烦扰,无法看到内源性磷酸化肽的质谱峰,而经过磁球表面包覆聚多巴胺和氨基修饰的以锆为中心金属离子的金属有机骨架(MOF)纳米复合材料富集后,质谱图中可以看到四条健康人血清中的内源性磷酸化肽的峰(m/z=1389.4,m/z=1460.5,m/z=1545.5,m/z=1616.5)。
- 还没有人留言评论。精彩留言会获得点赞!