具有高催化活性的氮掺杂多孔碳膜及其制备方法和应用与流程
本发明属于新能源材料技术领域,具体为一种可自支撑的氮掺杂多孔碳膜及其制备方法和应用。
背景技术:
氨气(nh3)无论作为农业肥料、新的能量载体,在人类社会中都充当着一个相当重要的角色[1-4],是人们生活当中不可或缺的化学原料。仅在2015年全世界的nh3总产量甚至已经达到了1.46亿吨[1]。氮气(n2是工业合成nh3的主要原料,虽然空气中n2的含量高达78%,但是由于n2分子中n≡n具有极高的键能(940.95kjmol-1)和缺乏永久的偶极距,其在常温常压下异常稳定。因此工业利用n2制备nh3的方法非常苛刻。目前,哈伯法(haberprocess)是工业生产nh3的主要方法,其过程是n2与h2在高温高压(400–500℃,200–250大气压)的作用下生成氨气。哈伯法制备nh3每年所需的能量总值约占全世界能量总产值的1%-3%[4]。此外,利用哈伯法制备nh3过程中,h2的生产更是需要燃烧大量的化石燃料(ch4+2h2o→4h2+co2),排放出大量的温室气体co2,严重污染环境。
随着世界人口增长对粮食的需求也日趋增大,再加上工业发展和军事上的迫切需要,使人工固氮在本世纪初成了世界性的重大研究课题。无论是节约成本,还是环境保护,若能将空气中的n2在常温常压下转化为高附加值的氨气,那么这对优化我国能源结构具有重大的战略意义,同时也将产生巨大的经济效益。
电催化技术具有效率高、操作简便、易实现自动化等优点[5-6],而水是一种来源广、环境友好的绿色溶剂,因此在水溶液中电催化转化n2具有很强的实际应用前景。实现大规模n2电催化转化应用的核心技术是研发高效、稳定可大规模生产的电催化剂。
由于杂原子掺杂的碳材料价廉易得,具有独特的抗氧化性、高的比表面积、可调控电化学活性及在酸碱条件下高的稳定性,其在电化学催化领域有着非常巨大的发展前景[7-10],但是杂原子掺杂的碳作为n2还原的新型材料在国内外目前还没有文献报道。
技术实现要素:
本发明目的是针对目前工业合成方法的缺点,比如:苛刻的反应条件(高温高压),排放出大量的温室效应气体,以及巨大的能源消耗等问题,提供一种价廉易得、易大规模制备、具有高的电催化活性和稳定性的多孔氮掺杂碳膜及其在氮气固定中的应用。该碳膜可以在常温常压下,水溶液中高效的将氮气转化为氨气,为环境友好、低能耗的制备氨气提供一种技术支撑。
本发明提供的制备氮掺杂多孔碳膜的原料之一聚离子液体为含有氮原子的离子聚合物,其具有以下的结构:
其中r为碳原子数为1~14的烷基链或ch2cn。x为cl、br、i、bf4、pf6、clo4、cf3coo、cf3so3、(cf3so2)2n、alcl4、etso4、meso4、h2po4、hso4、al2o7、n(cn)2、ch3coo、b(cn)4、bf3cf3或scn。
本发明提供的制备氮掺杂多孔碳膜的原料之二为聚丙烯酸,其具有以下结构:
聚丙烯酸的分子量为1800~1250000kda。
本发明提供的氮掺杂多孔碳膜的制备方法,包含以下四个步骤:
(1)将上述聚离子液体和聚丙烯酸按照1:1~1:3的摩尔比混合,加入10~500ml的二甲基甲酰胺或二甲基亚砜,在25℃到70℃条件下加热溶解。然后将0.1~10g量的碳纳米管或者氧化石墨烯或者炭黑超声分散在上述聚合物溶液中。
(2)将步骤(1)所制备的聚合物溶液倾倒在玻璃板上,在25℃~120℃加热2~48小时,烘干溶剂。
(3)将步骤(2)所制备的聚合物复合膜在0.1wt%~28wt%的氨水溶液中浸泡1~10小时,可得多孔聚合物膜。
(4)将步骤(3)所制备的多孔聚合物膜在惰性气氛中,在300~1200℃,1.5torr~常压的条件下,碳化1~10小时,可得多孔氮掺杂碳膜。
本发明原料价廉易得,制备方法简单,易于工业化生产。该氮掺杂多孔碳膜在室温具有很高的电导率,其室温电导率高达134scm-1。
所述氮掺杂多孔碳膜的厚度为20nm到10cm。且具有梯度分布的多级孔结构。
所述的聚离子液体的制备方法是:
卤代化合物与乙烯基咪唑在0℃~60℃反应制备离子液体单体;然后通过活性自由基聚合制备得到阴离子为卤素的聚离子液体;然后以甲醇、乙醇、丙酮、乙腈或者水为溶剂,加入等摩尔量相应的无机盐,在0~70℃反应12~72小时,得阴离子相应的目标聚离子液体。
本发明同时提供了氮掺杂多孔碳膜作为电极在电催化领域的应用;
例如将氮掺杂多孔碳膜作为电极应用于n2还原,具体做法为:将所制备的多孔氮掺杂碳膜直接作为工作电极,ag/agcl为参比电极,铂丝为对电极,盐酸水溶液为电解质,其电催化还原氨气的法拉第效率为6%,并且其具有非常高的稳定性,连续测试192小时,其可以持续的将氮气转化为氨气,产率为每平方米碳膜每个月可制备86.4g氨气。
本发明的优点和积极效果:
本发明制备的碳膜在室温具有很高的电导率,其室温电导率高达134scm-1,并且,该碳膜具有从大孔到介孔再到微孔的多级孔结构在催化反应中,大孔可以作为反应底物快速进入碳膜的通道,介孔和微孔则提供大的比表面积和催化反应活性位点,可以显著提高反应效率;
相比较目前工业生产氨气的方法(高温高压,且在生产氨气的过程中排放出大量的温室气体二氧化碳,严重污染环境,能量消耗非常大),本发明原料价廉易得,制备方法简单,易大规模制备。该方法所制备的多孔碳膜在常温常压、水溶液中通过电催化反应将氮气高效的转化为氨气,每平方米碳膜每小时可以生产0.09g氨气,长期稳定性测试发现,连续测试8天,其性能未见降低。氨气生产过程环境友好,低能耗,易于工业化生产,有望大规模应用。
附图说明
图1为制备多孔氮掺杂碳膜的流程图;
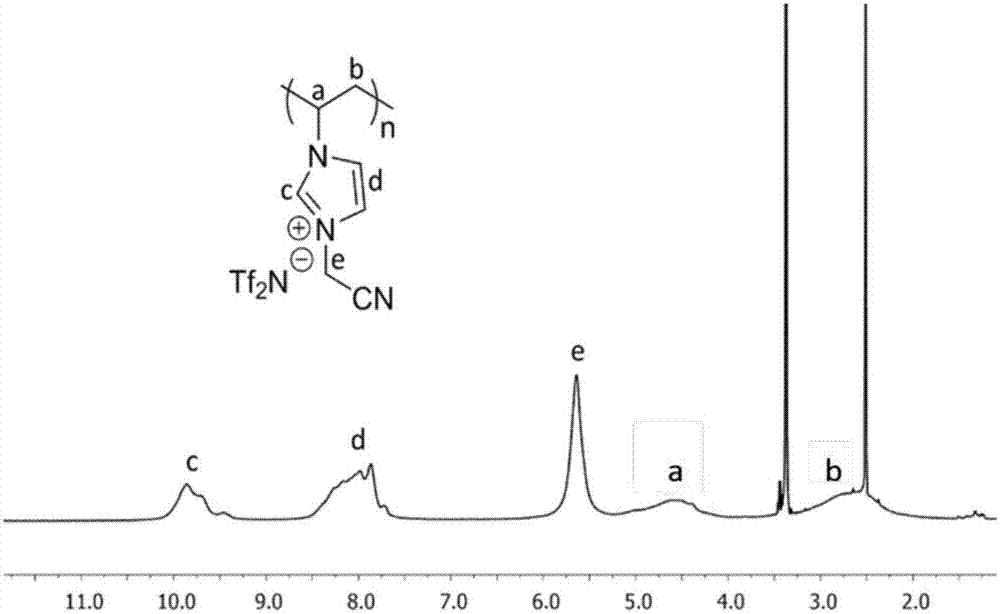
图2为聚乙烯基咪唑三氟甲磺酰亚胺离子液体的核磁谱图;
图3为碳纳米管在聚离子液体/聚丙烯酸的二甲基甲酰胺溶液中均匀分散的数码照片;
图4为聚离子液体/聚丙烯酸/碳纳米管的照片和扫描电镜照片;
图5为多孔氮掺杂碳膜的照片和扫描电镜照片;
图6为氮气电催化转化为氨气的性能测试结果,(a)是不同电压下氨气的法拉第效率,(b)不同电压下氨气的产率,(c)在-0.1伏特(相对氢标准电极电势)下,制备氨气的稳定性测试。
具体实施方式
下面通过一些实施例,示例性的说明及帮助进一步理解本发明。
实施例1:
(1)制备聚离子液体:
在250ml的圆底烧瓶中,9.4g乙烯基咪唑,12g溴乙腈溶于100ml的乙醇溶液,40℃反应24小时,可得灰色的乙烯基咪唑离子液体单体,产率:95%。取将上述制备的乙烯基咪唑离子液体单体10g,将其溶解于二甲基甲酰胺中,加入0.2g偶氮二异丁腈,70℃反应48小时可得白色的聚乙烯基咪唑溴离子液体。称取10g聚乙烯基咪唑溴离子液体,将其溶解于1000ml的去离子水中,加入13g三氟甲磺酰亚胺锂,室温搅拌4小时,可得目标聚离子液体,聚乙烯基咪唑三氟甲磺酰亚胺离子液体。
(2)制备聚合物/碳纳米管复合膜:
将1g上述制备的聚乙烯基咪唑三氟甲磺酰亚胺离子液体,0.18g分子量为100,000kda的聚丙烯酸以及0.1g碳纳米管超声溶解,分散在10ml的二甲基甲酰胺中,然后将其倾倒在玻璃板上,在80℃干燥5小时。而后,浸入0.1%的氨水溶液,放置2小时,可得聚合物/碳纳米管复合膜。
(3)制备氮掺杂多孔碳膜:聚合物/碳纳米管复合膜在氮气保护下,900℃,碳化2小时,可得多孔氮掺杂碳膜。
实施例2:制备聚合物/碳纳米管复合膜:
(1)将5g聚乙烯基咪唑三氟甲磺酰亚胺离子液体,1g分子量为1800kda的聚丙烯酸以及0.5g碳纳米管超声溶解,分散在100ml的二甲基甲酰胺中,然后将其倾倒在玻璃板上,在80℃干燥10小时。而后,浸入1%的氨水溶液,放置4小时,可得聚合物/碳纳米管复合膜。
(2)制备氮掺杂多孔碳膜:聚合物/碳纳米管复合膜在氮气保护下,300℃,碳化10小时,可得多孔氮掺杂碳膜。
实施例3:
(1)制备多孔聚合物/氧化石墨烯复合膜:将2g聚二烯丙基二甲基化三氟甲磺酰亚胺铵,0.4g分子量为450,000kda的聚丙烯酸以及0.5g氧化石墨烯超声溶解,分散在10ml的二甲基亚砜中,然后将其倾倒在玻璃板上,在90℃干燥36小时。而后,浸入0.3%的氨水溶液,放置6小时,可得聚合物/氧化石墨烯复合膜。
(2)制备多孔氮掺杂碳膜:聚合物/氧化石墨烯复合膜在氮气保护下,500℃,碳化4小时,可得多孔氮掺杂碳膜。
实施例4:
制备多孔聚合物/炭黑复合膜:将2g聚二烯丙基二甲基化三氟甲磺酰亚胺铵,0.4g分子量为1,250,000kda的聚丙烯酸以及1g炭黑超声溶解,分散在50ml的二甲基亚砜中,然后将其倾倒在玻璃板上,在90℃干燥36小时。而后,浸入1%的氨水溶液,放置6小时,可得聚合物/炭黑复合膜。
制备多孔氮掺杂碳膜:聚合物/炭黑复合膜在氮气保护下,1200℃,碳化4小时,可得多孔氮掺杂碳膜。
实施例5:
氮气电催化还原:以上述实施例2制备的氮掺杂多孔碳膜作为工作电极,ag/agcl作为参比电极,pt作为对电极,0.1m的盐酸溶液作为电解质,组装成电解池。将氮气直接通入0.1m的盐酸水溶液,在-0.1v(对标准氢电极电势)下将n2催化转化为氨气。
实验测试表明,上述制备的多孔氮掺杂碳膜转化n2的法拉第效率为6%,并且其具有非常高的稳定性,连续测试192h,其可以持续的将氮气转化为氨气,产率为每平方米碳膜每小时可制备0.09g氨气。与目前工业哈勃法制备氨气相比较,本发明工艺简单,原料价廉易得,氨气的制备在常温常压下进行,产率高,节约能源,有望用于大规模氨气的制备。
参考文献:
[1]bao,d.,zhang,q.,meng,f.,etal.,adv.mater.,2017,29:1604799.
[2]chen,g.-f.,cao,x.,wu,s.,etal.,j.am.chem.soc.,2017,139:9771–9774.
[3]shi,m.-m.,bao,d.,wulan,b.-r.,etal.,adv.mater.2017,29:1606550.
[4]li,s.-j.,bao,d.,shi,m.-m.,etal.,adv.mater.2017,1700001.
[5]costentin,c.;robert,m.;saveant,j.-m.chem.soc.rev.2013,42:2423-2436.
[6]y.li,q.sun,adv.energymater.2016,1600463.
[7]fellinger,t.-p.;thomas,a.yuan,j.,etal.,adv.mater.,2013,25:5838-5855.
[8]dai,l.;xue,y.,qu,l.;choi,h.-j.,etal.,chem.rev.,2015,115:4823-4892.
[9]jiao,y.,zheng,y.,davey,k.,qiao,s.-z.,nat.energy,2016,1:16130.
[10]li,y.,zhou,w.,wang,h.,etal.,nat.nanotechnol.2012,7:394-400.。
- 还没有人留言评论。精彩留言会获得点赞!