微流控芯片及检测装置的制作方法
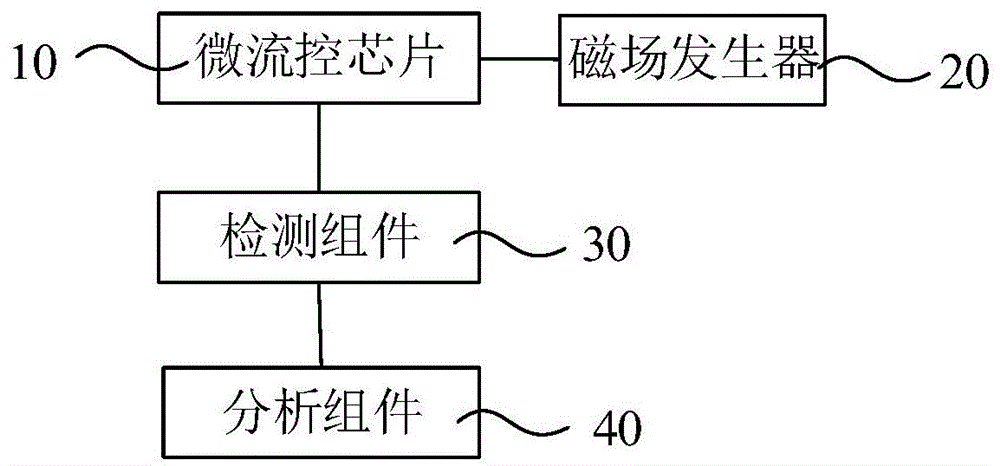
本发明涉及检测设备
技术领域:
,特别是涉及一种微流控芯片及检测装置。
背景技术:
:循环肿瘤细胞是指恶性肿瘤在发展过程中播散并存活于外周血中的肿瘤细胞,与肿瘤的转移和预后密切相关。循环肿瘤细胞检测是指对肿瘤患者外周血中的循环肿瘤细胞进行分析的方法,有助于肿瘤转移患者的诊断、监测术后患者肿瘤的复发与转移、评估抗肿瘤药物的敏感性与选择个体化治疗的策略。循环肿瘤细胞在肿瘤患者外周血中数量稀少,一般在106个~107个细胞中仅含有1个循环肿瘤细胞。循环肿瘤细胞检测在乳腺癌、肺癌、结直肠癌以及前列腺癌等转移性实体瘤的微转移、监测术后复发、疗效评估与个体化靶向治疗等方面有着重要作用。目前,常用的循环肿瘤细胞的检测设备的灵敏度较低,不能满足实际需求。技术实现要素:基于此,有必要提供一种灵敏度较高的微流控芯片。此外,还有必要提供一种检测装置。一种微流控芯片,包括微流控单元,所述微流控单元包括:反应池,能够容置待测样品;捕获池,设有第一抗体包被的磁微粒,所述捕获池与所述反应池连通,且能够向所述反应池输送所述第一抗体包被的所述磁微粒;及标记池,设有发光物质标记的第二抗体,所述标记池与所述反应池连通,且能够向所述反应池输送所述发光物质标记的所述第二抗体,且所述第二抗体与所述第一抗体能够结合循环肿瘤细胞的不同表位。上述微流控芯片包括微流控单元,微流控单元中捕获池与反应池连通,且能够向反应池中输送第一抗体包被的磁微粒,标记池与反应池连通,且能够向反应池中输送发光物质标记的第二抗体,第二抗体与第一抗体能够结合循环肿瘤细胞的不同表位,使得能够通过第一抗体包被的磁微粒捕获待测样品中的循环肿瘤细胞而形成第一复合物(即循环肿瘤细胞-第一抗体包被的磁微粒),且使得发光物质标记的第二抗体能够与第一复合物形成双夹心抗体复合物(即发光物质标记的第二抗体-循环肿瘤细胞-第一抗体包被的磁微粒),以能够通过发光物质的发光强度对循环肿瘤细胞进行定性定量检测。上述微流控芯片设计合理,检测灵敏度较高。在其中一个实施例中,所述微流控单元还包括用于容置样本稀释液的稀释池,所述稀释池与所述反应池连通,且能够向所述反应池中输送所述样本稀释液以稀释所述待测样品;及/或,所述微流控单元还包括用于容置清洗液的清洗池,所述清洗池与所述反应池连通,且能够向所述反应池中输送所述清洗液。在其中一个实施例中,所述微流控单元还包括用于容置预激发液的储液池,所述储液池与所述反应池连通,且能够向所述反应池中输送所述预激发液。在其中一个实施例中,所述微流控单元还包括用于容置激发液的存储池,所述存储池与所述反应池连通,且能够向所述反应池中输送所述激发液。在其中一个实施例中,所述微流控单元还包括微通道组件,所述微通道组件用于将所述捕获池、所述标记池分别与所述反应池连通;及/或,所述微流控单元还包括驱动器,所述驱动器用于将所述第一抗体包被的所述磁微粒、所述发光物质标记的所述第二抗体输送至所述反应池中。在其中一个实施例中,所述微流控芯片包括壳体,所述微流控单元设在所述壳体内。在其中一个实施例中,所述壳体开设有加样口,所述加样口与所述反应池连通,所述微流控芯片还包括收容于所述壳体的过滤器,所述过滤器与所述加样口、所述反应池均连通。在其中一个实施例中,所述壳体包括壳本体和盖体,所述盖体盖设于所述壳本体上,且与所述壳本体形成收容腔,所述微流控单元收容于所述收容腔中,且设在于所述壳本体内,所述加样口设于所述盖体上,所述过滤器与所述盖体固接,且与所述加样口对应连通。一种检测装置,包括上述微流控芯片。在其中一个实施例中,包括磁场发生器,所述磁场发生器能够向所述微流控芯片提供磁场以吸附所述磁微粒。附图说明图1为一实施方式的检测装置的结构示意图;图2为图1所示的检测装置中微流控芯片的结构示意图;图3为图2所示的微流控芯片省略盖体、过滤器后的结构示意图;图4为实施例1的微流控芯片的标准曲线;图5为实施例2的微流控芯片的标准曲线;图6为最低检测线测定过程中发光强度和循环肿瘤细胞浓度的拟合曲线。具体实施方式为了便于理解本发明,下面将参照相关附图对本发明进行更全面的描述。附图中给出了本发明的较佳的实施例。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的
技术领域:
的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。如图1所示,一实施方式的检测装置包括微流控芯片10。该微流控芯片10能够检测循环肿瘤细胞,且检测的灵敏度较高。微流控芯片10是将生物和化学领域所涉及的基本操作单位集成在一块几平方厘米的芯片上,由微通道网络连接而成,能够极大地缩短样本处理了时间,并通过精密控制液体流动,实现低试剂损耗、低样本量。微流控技术具有高度自动化、高度集成化、消耗样本和试剂量少、污染小等优点。请一并参阅图2~3,微流控芯片10包括壳体100和微流控单元。微流控单元收容于壳体100中。壳体100为微流控芯片10的外壳。在其中一个实施例中,壳体100包括壳本体110和盖体120。壳本体110和盖体120相对设置,且壳本体110和盖体120形成收容腔。微流控单元收容于收容腔中,且固定于壳本体110上。在图示实施例中,壳本体110大致为板状。微流控单元收容于壳本体110中。盖体120大致为板状。盖体120盖设于壳本体110上,且与壳本体110围成收容腔。进一步地,壳本体110和盖体120为密封连接。更进一步地,壳本体110和盖体120为可拆卸地固接且密封连接。在图示实施例中,壳本体110和盖体120密封粘接。需要说明的是,壳本体110和盖体120不限于上述连接方式,也可以为一体成型结构。在其中一个实施例中,壳体100采用加工成型方法制备。进一步地,壳体100采用如下方法制备:模具注塑法、模具热压法、激光刻蚀法或软光刻蚀法等。进一步地,壳体100采用模具注塑法制备。采用模具注塑法加工制备,能够得到结构稳定、精密度高且成本低的微流控芯片10。需要说明的是,壳体100的制备方法不限于上述指出的方法,还可以为其他的常见的制备方法。微流控单元包括反应池210、捕获池220和标记池230。反应池210能够容置待测样品。捕获池220设有第一抗体包被的磁微粒。捕获池与反应池210连通,且能够向反应池210输送第一抗体包被的磁微粒。标记池230设有发光物质标记的第二抗体。标记池230与反应池210连通,且能够向反应池210输送发光物质标记的第二抗体。且第二抗体与第一抗体能够结合循环肿瘤细胞的不同表位。微流控单元中捕获池220与反应池210连通,且能够向反应池210中输送第一抗体包被的磁微粒,第一抗体能够结合循环肿瘤细胞的表位,使得能够通过第一抗体包被的磁微粒捕获待测样品中的循环肿瘤细胞,得到第一复合物(即循环肿瘤细胞-第一抗体包被的磁微粒),同时,标记池230与反应池210连通,且能够向反应池210中输送发光物质标记的第二抗体,第二抗体与第一抗体能够结合循环肿瘤细胞的不同表位,使得发光物质标记的第二抗体能够与第一复合物形成双夹心抗体复合物(即发光物质标记的第二抗体-循环肿瘤细胞-第一抗体包被的磁微粒),以能够通过发光物质的发光强度对循环肿瘤细胞进行定性定量检测。在其中一个实施例中,待测样品为全血样本。在其中一个实施例中,反应池210为中空长方体、中空正方体或者中空圆柱体。进一步地,反应池210的体积为100μl~500μl。在其中一个实施例中,反应池210的材质为亲水性材质。此种设置,使得能够促进反应池210中液体的流动性,以更好地控制反应池210内的反应。进一步地,反应池210由聚二甲基硅氧烷(pdms)制作而成,并在pdms表面涂有聚n,n-二甲基丙烯酰胺(pdma)。此种设置,使得反应池210具有良好的吸附改性作用,能够有效的抑制电渗流和样品的吸附,从而提高了分离效率和速度,同时大大的减少了试剂的消耗,降低了成本。在图示实施例中,反应池210为一个。壳体100开设有加样口130。加样口130与反应池210连通。微流控芯片10还包括收容于壳体100的过滤器300。过滤器300与加样口130、反应池210均连通。此种设置,使得待测样品能够经加样口130加入,经过滤器300过滤后流入反应池210中。进一步地,加样口130设于盖体120上。过滤器300与盖体120固接,且过滤器300与加样口130相对且连通。此种设置,使得待测样品能够经加样口130加入,且能够在重力的作用下进入过滤器300中进行过滤。在图示实施例中,过滤器300为滤血膜。过滤器300收容于加样口130中,且与盖体120固接。此种设置,使得对全血样本进行检测时能够滤去红细胞等物质以富集循环肿瘤细胞,且能够避免红细胞等物质对循环肿瘤细胞检测的干扰。进一步地,过滤器300为非对称滤血膜。传统的分离方式需要使用离心机进行离心,且离心需要较长的时间,会加大溶血的可能。而采用非对称滤血膜进行分离,只需将待测样本滴加在膜上即可进行分离,无需额外装置,方便携带和使用,且分离血浆的速度快,而且溶血的可能性较小。在其中一个实施例中,微流控单元还包括微通道组件。微通道组件包括第一微通道(图未示)。第一微通道两端分别连通加样口130和反应池210。第一微通道为毛细管通道。此种设置,能够通过第一微通道对待测样品的过滤提供毛细管作用力,在重力和毛细管作用力的双重作用下,过滤效率较高,能够实现高效的分离和提纯。在其中一个实施例中,第一微通道为圆形管状通道或者矩形管状通道。在其中一个实施例中,第一微通道为圆形管状通道,第一微通道的内径为0.5mm~1mm。进一步地,第一微通道的内径为0.5mm~5mm。更进一步地,第一微通道的内径为0.5mm~2mm。具体地,第一微通道的内径为0.5mm~1mm。在其中一个实施例中,第一微通道为矩形管状通道,第一微通道的高度为0.01mm~2mm,第一微通道垂直于第一微通道的延伸方向上的截面的尺寸为:宽度为0.1mm~5mm,长度为5mm~40mm。进一步地,第一微通道垂直于第一微通道的延伸方向上的截面的尺寸为:宽度为0.3mm~2mm,长度为5mm~20mm。进一步地,微通道组件还包括第一微阀(图未示)。第一微阀设置于第一微通道上,以能够控制第一微通道的开启和关闭。更进一步地,第一微阀为电磁阀。在图示实施例中,第一微通道为一条。第一微阀为一个。在其中一个实施例中,微流控单元还设有驱动器240。驱动器240收容于壳本体110中,且与反应池210连接。驱动器240能够提供动力,以使待测样品从加样口130经过滤器300和第一微通道输送至反应池210中。更进一步地,驱动器240为气泵。气泵能够提供净化的压缩气体,以避免动力气体在与试剂和样本接触过程中对试剂和样本产生干扰。在本实施例中,驱动器240为负压泵。驱动器240为一个。捕获池220设置有第一抗体包被的磁微粒。捕获池220与反应池210连通,且能够向反应池210输送第一抗体包被的磁微粒。第一抗体能够结合循环肿瘤细胞的抗原表位。微流控单元中捕获池220与反应池210连通,且能够向反应池210中输送第一抗体包被的磁微粒,使得能够通过第一抗体包被的磁微粒捕获待测样品中的循环肿瘤细胞。在其中一个实施例中,第一抗体为epcam(上皮细胞粘附分子)、cks(上皮角质蛋白)、上皮细胞膜特异性抗原、tag(肿瘤相关糖蛋白)、循环肿瘤细胞的特异性标志物中的至少一种。进一步地,上皮细胞膜特异性抗原为epcam2及psa中的至少一种。tag为ca72-4及ca50中的至少一种。循环肿瘤细胞的特异性标志物为her2(人表皮生长因子受体-2)及抗乳球蛋白中的至少一种。在其中一个实施例中,磁微粒为超顺磁性核壳结构。磁微粒的磁核为fe3o4或γ-fe3o4。磁微粒的外壳为聚苯乙烯化合物。磁微粒携带有功能基团。功能基团选自羧基、醛基、氨基、生物素及链酶亲和素中的一种。在其中一个实施例中,磁微粒的粒径为0.1μm~10μm。进一步地,磁微粒的粒径为0.5μm~10μm。更进一步地,磁微粒的粒径为0.5μm~5μm。具体地,磁微粒为顺磁性的fe3o4磁微粒。磁微粒的粒径为0.5μm~5μm。此种设置的磁微粒能够保证抗体包被的量以及抗体与抗原结合时的空间位点,能够节省物料,保证抗原和抗体的充分结合。检测装置还包括磁场发生器20。磁场发生器20能够向微流控芯片10提供磁场,以吸附磁微粒。在其中一个实施例中,磁场发生器20能够使磁微粒悬浮,以搅动含有磁微粒的液体。磁场发生器20能够通过吸附磁微粒而使磁微粒固定。磁场发生器20能够移动,以携带磁微粒在微流控芯片10中移动。进一步地,磁场发生器20的运动方式选自匀速运动及加速运动中的至少一种。更进一步地,磁场发生器20的运动速度为0.2mm/s~80mm/s。此种设置能够保证磁微粒跟随磁场运动且能够达到较大的速度,以节省时间。在本实施例中,磁场发生器20为永磁铁。需要说明的是,磁场发生器20不限于为磁铁,还可以为磁性线圈。在其中一个实施例中,捕获池220为中空长方体、中空正方体或者中空圆柱体。进一步地,捕获池220的体积为100μl~300μl。在图示实施例中,捕获池220为一个。在其中一个实施例中,微通道组件能够连通捕获池220与反应池210。微通道组件包括第二微通道222。第二微通道222两端分别连通反应池210和捕获池220。第二微通道222为毛细管通道。在其中一个实施例中,第二微通道222为圆形管状通道或者矩形管状通道。在其中一个实施例中,第二微通道222为圆形管状通道,第二微通道222的内径为0.5mm~1mm。进一步地,第二微通道222的内径为0.5mm~5mm。更进一步地,第二微通道222的内径为0.5mm~2mm。具体地,第二微通道222的内径为0.5mm~1mm。在其中一个实施例中,第二微通道222为矩形管状通道,第二微通道222的高度为0.01mm~2mm,第二微通道222垂直于第二微通道222的延伸方向上的截面的尺寸为:宽度为0.1mm~5mm,长度为5mm~40mm。进一步地,第二微通道222垂直于第二微通道222的延伸方向上的截面的尺寸为:宽度为0.3mm~2mm,长度为5mm~20mm。进一步地,微通道组件还包括第二微阀224。第二微阀224设置于第二微通道222上,以能够控制第二微通道222的开启和关闭。更进一步地,第二微阀224为电磁阀。在图示实施例中,第二微通道222为一条。第二微阀224为一个。在其中一个实施例中,驱动器240能够提供动力,以将捕获池220中的物质经第二微通道222输送至反应池210中。标记池230设有发光物质标记的第二抗体。标记池230与反应池210连通,且能够向反应池210输送发光物质标记的第二抗体。且第二抗体与第一抗体能够结合循环肿瘤细胞的不同表位。由于第二抗体与第一抗体能够结合循环肿瘤细胞的不同表位,使得发光物质标记的第二抗体能够与循环肿瘤细胞、第一抗体包被的磁微粒形成双夹心抗体复合物,而能够通过发光物质的发光强度对循环肿瘤细胞进行定性定量检测。在其中一个实施例中,第二抗体为epcam(上皮细胞粘附分子)、cks(上皮角质蛋白)、上皮细胞膜特异性抗原、tag(肿瘤相关糖蛋白)、循环肿瘤细胞的特异性标志物中的至少一种。进一步地,上皮细胞膜特异性抗原为epcam2及psa中的至少一种。tag为ca72-4及ca50中的至少一种。循环肿瘤细胞的特异性标志物为her2(人表皮生长因子受体-2)及抗乳球蛋白中的至少一种。在其中一个实施例中,发光物质选自吖啶酯、吖啶磺酰胺、鲁米诺及鲁米诺的衍生物中的一种。其中,鲁米诺的衍生物为芳香基团鲁米诺及bola型鲁米诺中的至少一种。在其中一个实施例中,标记池230为中空长方体、中空正方体或者中空圆柱体。进一步地,标记池230的体积为100μl~300μl。在图示实施例中,标记池230为一个。微通道组件能够连通标记池230与反应池210。进一步地,微通道组件还包括第三微通道232。第三微通道232两端分别连通反应池210和标记池230。第三微通道232为毛细管通道。在其中一个实施例中,第三微通道232为圆形管状通道或者矩形管状通道。在其中一个实施例中,第三微通道232为圆形管状通道,第三微通道232的内径为0.5mm~1mm。进一步地,第三微通道232的内径为0.5mm~5mm。更进一步地,第三微通道232的内径为0.5mm~2mm。具体地,第三微通道232的内径为0.5mm~1mm。在其中一个实施例中,第三微通道232为矩形管状通道,第三微通道232的高度为0.01mm~2mm,第三微通道232垂直于第三微通道232的延伸方向上的截面的尺寸为:宽度为0.1mm~5mm,长度为5mm~40mm。进一步地,第三微通道232垂直于第三微通道232的延伸方向上的截面的尺寸为:宽度为0.3mm~2mm,长度为5mm~20mm。进一步地,微通道组件还包括第三微阀234。第三微阀234设置于第三微通道232上,以能够控制第三微通道232的开启和关闭。更进一步地,第三微阀234为电磁阀。在图示实施例中,第三微通道232为一条。第三微阀234为一个。在其中一个实施例中,驱动器240能够提供动力,以将标记池230中的物质经第三微通道232输送至反应池210中。微流控单元还包括用于容置样本稀释液的稀释池250。稀释池250与反应池210连通,且能够向反应池210中输送样本稀释液,以稀释待测样品。进一步地,稀释池250设有样本稀释液。在其中一个实施例中,样本稀释液包括ph为7.4的磷酸盐缓冲液、质量百分含量为0.2%~2%的bsa(牛血清蛋白)及质量百分含量为0.1%~1%的tritonx-405。进一步地,样本稀释液包括ph为7.4的磷酸盐缓冲液、质量百分含量为1%的bsa(牛血清蛋白)及质量百分含量为0.9%的tritonx-405。在其中一个实施例中,稀释池250为中空长方体、中空正方体或者中空圆柱体。进一步地,稀释池250的体积为100μl~300μl。在图示实施例中,稀释池250为一个。在其中一个实施例中,微通道组件能够连通反应池210和稀释池250。微通道组件包括第四微通道252。第四微通道252两端分别连通反应池210和稀释池250。第四微通道252为毛细管通道。在其中一个实施例中,第四微通道252为圆形管状通道或者矩形管状通道。在其中一个实施例中,第四微通道252为圆形管状通道,第四微通道252的内径为0.5mm~1mm。进一步地,第四微通道252的内径为0.5mm~5mm。更进一步地,第四微通道252的内径为0.5mm~2mm。具体地,第四微通道252的内径为0.5mm~1mm。在其中一个实施例中,第四微通道252为矩形管状通道,第四微通道252的高度为0.01mm~2mm,第四微通道252垂直于第四微通道252的延伸方向上的截面的尺寸为:宽度为0.1mm~5mm,长度为5mm~40mm。进一步地,第四微通道252垂直于第四微通道252的延伸方向上的截面的尺寸为:宽度为0.3mm~2mm,长度为5mm~20mm。进一步地,微通道组件还包括第四微阀254。第四微阀254设置于第四微通道252上,以能够控制第四微通道252的开启和关闭。更进一步地,第四微阀252为电磁阀。在图示实施例中,第四微通道252为一条。第四微阀254为一个。在其中一个实施例中,驱动器240能够提供动力,以将稀释池250中的样品稀释液经第四微通道252输送至反应池210中。微流控单元还包括用于容置清洗液的清洗池260。清洗池260与反应池210连通,且能够向反应池210中输送清洗液。清洗液能够对反应池210进行清洗。进一步地,清洗池260设有清洗液。在其中一个实施例中,清洗液包括ph为7.4的磷酸盐缓冲液、质量百分含量为1%的bsa(牛血清蛋白)及质量百分含量为0.9%的tritonx-405。需要说明的是,清洗液不限于上述清洗液,还可以为其他细胞清洗液,例如生理盐水等。在其中一个实施例中,清洗池260为中空长方体、中空正方体或者中空圆柱体。进一步地,清洗池260的体积为100μl~500μl。在图示实施例中,清洗池260为一个。在其中一个实施例中,微通道组件能够连通反应池210和稀释池250。进一步地,微通道组件包括第五微通道262。第五微通道262两端分别连通反应池210和稀释池250。第五微通道262为毛细管通道。在其中一个实施例中,第五微通道262为圆形管状通道或者矩形管状通道。在其中一个实施例中,第五微通道262为圆形管状通道,第五微通道262的内径为0.5mm~1mm。进一步地,第五微通道262的内径为0.5mm~5mm。更进一步地,第五微通道262的内径为0.5mm~2mm。具体地,第五微通道262的内径为0.5mm~1mm。在其中一个实施例中,第五微通道262为矩形管状通道,第五微通道262的高度为0.01mm~2mm,第五微通道262垂直于第五微通道262的延伸方向上的截面的尺寸为:宽度为0.1mm~5mm,长度为5mm~40mm。进一步地,第五微通道262道垂直于第五微通道262的延伸方向上的截面的尺寸为:宽度为0.3mm~2mm,长度为5mm~20mm。进一步地,微通道组件还包括第五微阀264。第五微阀264设置于第五微通道262上,以能够控制第五微通道262的开启和关闭。更进一步地,第五微阀264为电磁阀。在图示实施例中,第五微通道262为一条。第五微阀264为一个。在其中一个实施例中,驱动器240能够提供动力,以将清洗池260中的清洗液经第五微通道262输送至反应池210中。微流控单元还包括用于容置预激发液的储液池270。储液池270与反应池210连通,且能够向反应池210中输送预激发液。进一步地,储液池270内设有预激发液。在其中一个实施例中,预激发液为过氧化氢。在其中一个实施例中,储液池270为中空长方体、中空正方体或者中空圆柱体。进一步地,储液池270的体积为100μl~500μl。在图示实施例中,储液池270为一个。在其中一个实施例中,微通道组件能够连通反应池210和储液池270。进一步地,微通道组件包括第六微通道272。第六微通道272两端分别连通反应池210和储液池270。第六微通道272为毛细管通道。在其中一个实施例中,第六微通道272为圆形管状通道或者矩形管状通道。在其中一个实施例中,第六微通道272为圆形管状通道,第六微通道272的内径为0.5mm~1mm。进一步地,第六微通道272的内径为0.5mm~5mm。更进一步地,第六微通道272的内径为0.5mm~2mm。具体地,第六微通道272的内径为0.5mm~1mm。在其中一个实施例中,第六微通道272为矩形管状通道,第六微通道272的高度为0.01mm~2mm,第六微通道272垂直于第六微通道272的延伸方向上的截面的尺寸为:宽度为0.1mm~5mm,长度为5mm~40mm。进一步地,第六微通道272道垂直于第六微通道272的延伸方向上的截面的尺寸为:宽度为0.3mm~2mm,长度为5mm~20mm。进一步地,微通道组件还包括第六微阀274。第六微阀274设置于第六微通道272上,以能够控制第六微通道272的开启和关闭。更进一步地,第六微阀274为电磁阀。在图示实施例中,第六微通道272为一条。第六微阀274为一个。在其中一个实施例中,驱动器240能够提供动力,以将储液池270中的预激发液经第六微通道272输送至反应池210中。微流控单元还包括用于容置激发液的存储池280。存储池280与反应池210连通,且能够向反应池210中输送激发液。进一步地,存储池280内设有激发液。在其中一个实施例中,激发液为氢氧化钠。在其中一个实施例中,存储池280为中空长方体、中空正方体或者中空圆柱体。进一步地,存储池280的体积为100μl~500μl。在图示实施例中,存储池280为一个。在其中一个实施例中,微通道组件能够连通反应池210和存储池280。进一步地,微通道组件包括第七微通道282。第七微通道282两端分别连通反应池210和存储池280。第七微通道282为毛细管通道。在其中一个实施例中,第七微通道282为圆形管状通道或者矩形管状通道。在其中一个实施例中,第七微通道282为圆形管状通道,第七微通道282的内径为0.5mm~1mm。进一步地,第七微通道282的内径为0.5mm~5mm。更进一步地,第七微通道282的内径为0.5mm~2mm。具体地,第七微通道282的内径为0.5mm~1mm。在其中一个实施例中,第七微通道282为矩形管状通道,第七微通道282的高度为0.01mm~2mm,第七微通道282垂直于第七微通道282的延伸方向上的截面的尺寸为:宽度为0.1mm~5mm,长度为5mm~40mm。进一步地,第七微通道282道垂直于第七微通道282的延伸方向上的截面的尺寸为:宽度为0.3mm~2mm,长度为5mm~20mm。进一步地,微通道组件还包括第七微阀284。第七微阀284设置于第七微通道282上,以能够控制第七微通道282的开启和关闭。更进一步地,第七微阀284为电磁阀。在图示实施例中,第七微通道282为一条。第七微阀284为一个。在其中一个实施例中,驱动器240能够提供动力,以将存储池280中的激发液经第七微通道282输送至反应池210中。微流控单元还包括废液池290。废液池290与反应池210连通,反应池210中的废液能够流入废液池290中。在其中一个实施例中,废液池290为中空长方体、中空正方体或者中空圆柱体。进一步地,废液池290的体积为100μl~500μl。在图示实施例中,废液池290为一个。在其中一个实施例中,微通道组件能够反应池210和废液池290。进一步地,微通道组件包括第八微通道292。第八微通道292两端分别连通反应池210和废液池290。第八微通道292为毛细管通道。在其中一个实施例中,第八微通道292为圆形管状通道或者矩形管状通道。在其中一个实施例中,第八微通道292为圆形管状通道,第八微通道292的内径为0.5mm~1mm。进一步地,第八微通道292的内径为0.5mm~5mm。更进一步地,第八微通道292的内径为0.5mm~2mm。具体地,第八微通道292的内径为0.5mm~1mm。在其中一个实施例中,第八微通道292为矩形管状通道,第八微通道292的高度为0.01mm~2mm,第八微通道292垂直于第八微通道292的延伸方向上的截面的尺寸为:宽度为0.1mm~5mm,长度为5mm~40mm。进一步地,第八微通道292道垂直于第八微通道292的延伸方向上的截面的尺寸为:宽度为0.3mm~2mm,长度为5mm~20mm。进一步地,微通道组件还包括第八微阀294。第八微阀294设置于第八微通道292上,以能够控制第八微通道292的开启和关闭。更进一步地,第八微阀294为电磁阀。在其中一个实施例中,驱动器240能够提供动力,以将反应池210中的废液经第八微通道292输送至废液池290中。在图示实施例中,第八微通道292为一条。第八微阀294为一个。驱动器240设置于第八微通道292远离第八微阀294的一侧上,且靠近反应池210设置。在其中一个实施例中,微流控单元还包括检测池(图未示)。检测池与反应池210连通。反应池210中的双夹心抗体复合物能够在磁场发生器20的作用下输送至检测池中以待检测。在其中一个实施例中,微流控芯片10的组装过程如下:将含有第一抗体包被的磁微粒、发光物质包被的第二抗体、样品稀释液、清洗液、预激发液和激发液分别置于捕获池220、标记池230、稀释池250、清洗池260、储液池270和存储池280中;将壳本体110与盖体120固接,得到微流控芯片10。其中,固接的方式为胶水粘接。进一步地,胶水为高温胶。具体地,胶水为omega高温胶。在图示实施例中,微流控单元为一个。需要说明的是,微流控单元不限于为一个,还可以为多个。微流控单元为多个时,多个微流控单元均收容于壳体100中,且相邻的微流控单元间隔设置。检测装置还包括检测组件30。检测组件30能够检测检测池中双夹心抗体复合物的发光信号。进一步地,检测组件30为光学探测器。检测组件30检测的发光信号为单峰,则说明待测样品中含有循环肿瘤细胞。检测装置还包括分析组件40。分析组件40与检测组件30电连接。分析组件40能够接收检测组件30中的发光信号,以分析该信号,而对待测样品中的循环肿瘤细胞进行定量分析。上述检测装置的操作过程至少包括如下步骤:开启第一微阀,将待测样品经加样口130加入微流控芯片10中,待测样品在重力作用和毛细管作用下经过滤器300过滤而流入反应池210中。关闭第一微阀并开启第二微阀224,开启驱动器240,第一抗体包被的磁微粒流入反应池210中,开启磁场发生器20,使得第一抗体包被的磁微粒与过滤后的待测样品混合,以使第一抗体包被的磁微粒与循环肿瘤细胞结合形成第一复合物。关闭第二微阀224,开启第三微阀234,发光物质标记的第二抗体流入反应池210中与第一复合物混合,且与第一复合物中的循环肿瘤细胞结合形成双夹心抗体复合物。需要说明的是,若待测样品需要稀释的话,可以在开启第二微阀224使第一抗体包被的磁微粒流入反应池210中的步骤之前,开启第四微阀254,使样品稀释液流入反应池210中对反应池210中过滤后的待测样品进行稀释。关闭第三微阀234,调节磁场发生器20,以使双夹心抗体复合物固定于反应池210中,开启第八微阀294,使反应池210中的废液流入废液池290中,关闭第八微阀294。开启第五微阀264,使清洗液流入反应池210中。调节磁场发生器20,以使清洗液与双夹心抗体复合物混合,对双夹心抗体复合物进行清洗。关闭第五微阀264,开启第八微阀294,使反应池210中的废液流入废液池290中,关闭第八微阀294。可以重复清洗操作,以对双夹心抗体复合物进行多次清洗。开启第六微阀274和第七微阀284,使激发液和预激发液流入反应池210中,且与双夹心抗体复合物混匀,以激发发光物质,得到激发后的双夹心抗体复合物。调节磁场发生器20,在磁场发生器20的作用下,携带激发后的双夹心抗体复合物至检测池中。通过检测组件30检测激发后的双夹心抗体复合物的发光信号,以检测待测样本中是否存在循环肿瘤细胞,从而对待测样品中的循环肿瘤细胞进行定性检测。通过分析组件40接收检测组件30中的发光信号,以分析该信号,而对待测样品中的循环肿瘤细胞进行定量分析。上述检测装置中,微流控芯片10包括微流控单元,微流控单元中捕获池220与反应池210连通,且能够向反应池210中输送第一抗体包被的磁微粒,标记池230与反应池210连通,且能够向反应池210中输送发光物质标记的第二抗体,第二抗体与第一抗体能够结合循环肿瘤细胞的不同表位,使得能够通过第一抗体包被的磁微粒捕获待测样品中的循环肿瘤细胞,且使得发光物质标记的第二抗体能够与循环肿瘤细胞、第一抗体包被的磁微粒形成双夹心抗体复合物,以能够通过发光物质的发光强度对循环肿瘤细胞进行定性定量检测。上述微流控芯片10设计合理,检测灵敏度较高。一般地,循环肿瘤细胞检测方法张红,样本前处理复杂,成本较高;样本富集困难,效率低。上述微流控芯片10使用非对称滤血膜,能够使全血样本快速分离,以实现对循环肿瘤细胞的快速富集,并且富集后的样本在重力和毛细管作用力的双重作用下进入微通道,进一步加快对循环肿瘤细胞的检测。免疫分析法是临床上常用的检测方法,可测定各种抗原或抗体,具有特异性强、灵敏度高等优点。微流控芯片10与免疫分析法的结合,显著改善了常规免疫测定的分析性能,在临床上的初步应用,显示出较好的应用前景。化学发光是利用化学反应释放的自由能激发中间体,使其从激发态回到基态的过程中释放的光子进行定量分析反推待测物浓度的方式进行测定。化学发光具有荧光的特异性同时不需要激发光,避免了荧光分析中激发光杂散光的影响,从而提高了灵敏度。上述微流控芯片10将磁微粒化学发光是将磁性分离技术、化学发光技术、免疫分析技术和微流控芯片10结合起来,快速易自动化,灵敏度较高,特异性较高,以及免疫分析的高特异性,在生物分析领域具有广泛的应用。上述检测装置包括微流控芯片10,使得即便是少量的待测样本也能够进行有效地检测。以下为具体实施例部分。以下实施例中,epcam抗体为市售epcam抗体,购于abcam公司,且货号为ab223582;k-ras抗体为市售的k-ras抗体,购于abcam公司,且货号为180772;生物素为市售生物素,购于thermofisher公司,且货号为b-2763;链酶亲和素磁微粒为市售的链酶亲和素磁微粒,购于thermofisher公司,且货号为21848)。实施例1(1)epcam抗体包被的羧基化磁微粒(即第一抗体包被的磁微粒)的制备:取含有50mg、浓度为10mg/ml、粒径为1μm的羧基化的磁微粒(magnabind21353)悬浮液,磁分离弃去上清。用0.02m、ph5.5的mes缓冲液重悬。加入1ml新配制的10mg/ml的edc水溶液,活化磁珠表面羧基,加入4mg的epcam抗体,在室温下混悬6h,磁分离弃去上清。用0.1m、ph8.0的tris缓冲液(该缓冲液含有质量百分含量为2%的bsa)重悬到磁微粒浓度为1mg/ml,得到epcam抗体包被的磁微粒工作液。每瓶分装5ml,并保存于4℃备用。(2)吖啶酯标记的k-ras抗体(即发光物质标记的第二抗体)的制备:取1.25mg的k-ras抗体,加入150μl的0.1m、ph9.2的碳酸盐缓冲液,混匀。加入1.5μl的5mg/ml的吖啶酯水溶液混匀,室温下避光反应1.5h。反应结束后,用2ml的zeba离心脱盐柱脱盐处理。脱盐过程中,先用纯净水对zeba离心脱盐柱脱盐进行处理,再用tbs缓冲液对zeba离心脱盐柱脱盐进行处理,最后加入得到的吖啶酯标记的k-ras抗体进行脱盐处理,得到浓度为40μg/mg的吖啶酯标记的k-ras抗体工作液。每瓶分装5ml,保存于4℃备用。(3)循环肿瘤细胞定标品的制备:用标准品缓冲液(40mm的tris-hcl,质量百分含量为0.5%的bsa,质量百分含量为1%的nacl,ph8.0)将循环肿瘤细胞标准品配制成浓度为0u/l、10u/l、100u/l、500u/l、1000u/l、2000u/l,每瓶分装0.5ml冻干,4℃保存备用。(4)微流控芯片的结构如图1~3所示。100μl的epcam抗体包被的磁珠的工作液、300μl的k-ras抗体包被的吖啶酯工作液、400μl的清洗液、200μl的预激发液与200μl的激发液分别置于捕获池、标记池、清洗池、预激发池和激发池中,并将盖体盖设于壳本体上,并使用胶水进行密封,得到微流控芯片。(5)标准曲线的绘制:(a)开启第一微阀,将不同浓度的标准品分别经加样口滴入微流控芯片中,待测样品在重力作用和毛细管作用下经过滤器过滤而流入反应池中。关闭第一微阀并开启第二微阀,开启驱动器,第一抗体包被的磁微粒流入反应池中,开启磁场发生器,使得第一抗体包被的磁微粒与过滤后的待测样品混合,以使第一抗体包被的磁微粒与循环肿瘤细胞结合,形成第一复合物,即循环肿瘤细胞-第一抗体包被的磁微粒。关闭第二微阀,开启第三微阀,发光物质标记的第二抗体流入反应池中与第一复合物混合,且与第一复合物中的循环肿瘤细胞结合,形成双夹心抗体复合物,即发光物质标记的第二抗体-循环肿瘤细胞-第一抗体包被的磁微粒。需要说明的是,若待测样品需要稀释的话,可以在开启第二微阀使第一抗体包被的磁微粒流入反应池中的步骤之前,开启第四微阀,使样品稀释液流入反应池中对反应池进行稀释。(b)关闭第三微阀,调节磁场发生器,以使双夹心抗体复合物固定于反应池中,开启第八微阀,使反应池中的废液流入废液池中,关闭第八微阀。开启第五微阀,使清洗液流入反应池中。调节磁场发生器,以使清洗液与双夹心抗体复合物混合,对双夹心抗体复合物进行清洗。关闭第五微阀,开启第八微阀,使反应池中的废液流入废液池中,关闭第八微阀。可以重复清洗的操作,以对双夹心抗体复合物进行多次清洗。(c)开启第六微阀和第七微阀,使激发液和预激发液流入反应池中,且与双夹心抗体复合物混匀,以激发发光物质,得到激发后的双夹心抗体复合物。调节磁场发生器,在磁场发生器的作用下,携带激发后的双夹心抗体复合物至检测池中。通过检测组件检测激发后的双夹心抗体复合物的发光信号,以检测待测样本中是否存在循环肿瘤细胞,从而对待测样品中的循环肿瘤细胞进行定性检测。通过分析组件接收检测组件中的发光信号,以分析该信号,根据不同浓度的标准品对应的发光值绘制循环肿瘤细胞浓度和发光信号强度的标准曲线。经测定,实施例1的微流控芯片的标准曲线如图4所示,且标准曲线的方程为y=67.343x-203.13,r2=0.9982。实施例2(1)epcam抗体包被的磁微粒的制备(a)生物素标记epcam抗体的制备:将200μg的epcam抗体与80μg的生物素加入5ml的ph7.4的pbs缓冲液中,在室温下混匀,去除上清,用0.1m、ph7.4的pbs缓冲液(该缓冲液含有质量百分含量为2%的bsa)稀释至到40μg/ml,得到生物素标记的epcam抗体的工作液,保存于4℃备用。(b)链酶亲和素磁微粒工作液制备:将1ml、10mg/ml的链酶亲和素磁微粒,加入到30ml、ph为7.5的tris-hcl缓冲液中,得到链酶亲和素磁微粒工作液,并置于4℃保存备用(c)3ml的生物素标记的epcam抗体的工作液、3ml的链酶亲和素磁微粒工作液混合,得到epcam抗体包被的磁微粒工作液,保存于4℃备用。(2)吖啶酯标记的k-ras抗体的制备:本实施例的吖啶酯标记的k-ras抗体的制备过程与实施例1的步骤(2)相同。(3)循环肿瘤细胞定标品的制备:本实施例的循环肿瘤细胞定标品的制备过程与实施例1的步骤(3)相同。(4)本实施例的步骤的操作过程与实施例1的步骤(4)相同。(5)标准曲线的绘制:本实施例的标准曲线的绘制过程与实施例1的步骤(5)相同。经测定,实施例2的微流控芯片的标准曲线如图5所示,且标准曲线的方程为y=212.23x-2516.3,r2=0.9992,y为发光强度,x为循环肿瘤细胞浓度。测试:1、对实施例1~2的微流控芯片、对比例的市售循环肿瘤细胞检测试剂盒(货号为(cellsearch7900001))的灵敏度、假阳性率和特异性进行检测。具体地,采用实施例1~2的微流控芯片和对比例的循环肿瘤细胞检测试剂盒对500份经临床测定含有循环肿瘤细胞的全血样本进行循环肿瘤细胞的检测,计算灵敏度、特异性、假阳性率。检测结果详见表1。表1表示的是实施例1~2的微流控芯片、对比例的循环肿瘤细胞检测试剂盒的灵敏度、假阳性率和特异的检测结果。表1实施例1实施例2对比例灵敏度60.000%75.000%50.000%特异性99.798%99.597%99.597%假阳性率0.202%0.404%0.404%从表1可以看出,实施例1~2的微流控芯片的灵敏度和特异性均优于对比例,实施例1~2的微流控芯片的假阳性率均低于对比例,说明上述实施方式的微流控芯片具有较高的灵敏度和特异性,较低的假阳性率。其中,实施例2的微流控芯片的灵敏度为75.000%,特异性为99.597%,说明使用生物进行标记能够增加系统的空间臂,提高待测样品的富集率,有利于提高微流控芯片的灵敏度和特异性。实施例1的微流控芯片的灵敏度和特异性与实施例2的大致相当,但是实施例1的微流控芯片的假阳性率低于实施例2,说明实施例1的微流控芯片更有利于降低循环肿瘤细胞检测的假阳性率,保证检测的准确性。2、对实施例1微流控芯片的性能进行检测,具体测试过程如下:(1)线性范围根据ws/t124《临床化学体外诊断试剂盒质量检验总则》要求,在试剂盒下限(或0)、中间值及上限范围内选取六个点,每个点重复测定3次吸光度。根据公式计算出直线方程y=a+bx和回归系数。依据方程y=a+bx就可以在线性范围内计算出待测样品的浓度。所以,线性范围对于检测试剂的准确度、检测限等性能尤为重要。其中,六个点分别是指含有循环肿瘤细胞的浓度为0u/l、10u/l、100u/l、500u/l、1000u/l、2000u/l的样本。测定结果详见图4。从图4中可以看出,实施例1的微流控芯片在循环肿瘤细胞的浓度为0~2000u/l范围的线性曲线的方程为标准曲线的方程为y=67.343x-203.13,r2=0.9982,实施例1的微流控芯片在循环肿瘤细胞的浓度为0~2000u/l范围内具有较好的线性。(2)精密度精密度也是考察试剂性能的重要指标,通过重复多次测量同一样本计算标准差和变异系数(cv),变异系数越小表示试剂的精密度越高。采用实施例1微流控芯片和对比例的市售循环肿瘤细胞检测试剂盒(购于cellsearch公司,货号为7900001)对含有0.2mg/l的循环肿瘤细胞的样本1、含有0.8mg/l的循环肿瘤细胞的样本2进行循环肿瘤细胞浓度的检测,每个样本测20次,计算平均值标准差以及变异系数,结果如下表2所示。其中,平均值、最大值和最小值是指20次检测过程中发光信号强度的平均值、最大值和最小值。表2精密度测试从表2可以看出,实施例1对样本1进行检测的变异系数为1.06%,低于对比例对样本1检测的变异系数(6.57%),实施例1对样本2进行检测的变异系数为2.23%,低于对比例对样本2检测的变异系数(7.99%),说明上述实施方式的微流控芯片的精密度较高。(3)准确度通过标准曲线计算得到的理论值作为靶值来评估测量时,测量结果与靶值的偏差得来评价试剂测试的准确性。采用实施例1微流控芯片和对比例的市售循环肿瘤细胞检测试剂盒(购于cellsearch公司,货号为7900001)对已知循环肿瘤细胞的浓度为3.00coi(临界指数)的全血样本进行循环肿瘤细胞浓度的检测,三次重复测试。测试结果如表3所示。表3准确度测试实施例1对比例测试次数(次)33最大值(coi)3.023.21最小值(coi)2.962.96平均值(coi)2.983.12靶值(coi)3.003.00从表3可以看出,实施例1的微流控芯片的三次检测得出的循环肿瘤细胞的浓度范围为2.96coi~3.02coi,浓度范围的宽度小于对比例(2.96coi~3.21coi),实施例1的微流控芯片的三次检测得出的循环肿瘤细胞浓度的平均值为2.98coi,与对比例得出的平均值相比,更接近于靶值(3.00coi)更接近,说明上述实施方式的微流控芯片的准确度较高。(4)检测限采用实施例1微流控芯片和对比例的市售循环肿瘤细胞检测试剂盒(购于cellsearch公司,货号为7900001)将发光值为本底(即样本稀释液,包括ph为7.4的磷酸盐缓冲液、质量百分含量为1%的bsa及质量百分含量为0.9%的tritonx-405)的稀释液进行测试,测试次数20次,计算其平均值(m)、标准差(sd),得出m+2sd,根据所测得本底的发光强度和循环肿瘤细胞浓度和相邻样本(包括1coi的循环肿瘤细胞、ph为7.4的磷酸盐缓冲液、质量百分含量为1%的bsa及质量百分含量为0.9%的tritonx-405)的发光强度和循环肿瘤细胞浓度拟合得出一次方程(即y=4574.7x+445,r2=1,y为发光强度,x为循环肿瘤细胞浓度,一次方程对应的直线详见图6),将m+2sd的rlu值带入该一次方程中,得出对应的浓度值,即为最低检测限。结果如表4所示。其中,平均值、最大值和最小值是指20次检测过程中发光信号强度的平均值、最大值和最小值。表4最低检测限测试实施例1对比例测试次数2020平均值(m/rlu)4451114最大值(rlu)4921249最小值(rlu)402914标准差(sd)29.6729.67m+2sd504.341173最低检测限(coi)0.010.19从表4中可以看出,上述实施方式的微流控芯片的最低检测线为0.01coi,检测灵敏度较高。综上所述,上述实施方式的微流控芯片能够检测待测样品中的循环肿瘤细胞,检测灵敏度较高,准确性较高,特异性较好,假阳性率低,对循环肿瘤细胞的临床检测具有较好的指导意义。以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1