用于细胞分离的微流体方法和盒与流程
本发明涉及根据所关注蛋白质的表达(优选为展示,更优选为分泌)水平使用磁珠从异源表达细胞的群体中选择细胞的方法。此外,本发明还涉及基于所关注蛋白质的表达(优选为展示,更优选为分泌)水平来进行细胞选择的微流体基(优选为一次性)无菌盒(cartridge),以及用于处理微流体反应室内的磁珠的方法。
背景技术:
构建用于高效生产治疗性蛋白质的哺乳动物细胞系已经通过构建更高效的dna载体和改造细胞系而得到极大的改善(girodetal.,2007,galbeteetal.,2009,leyetal.,2013;lefournetal.,2014)。然而,人工筛选细胞系是耗时且劳动密集的,其通常仍在实施以识别具有最佳性质的那些,例如具有最高生产率的那些。因此,本领域需要设计从大量稳定转染的细胞群体中筛选顶级生产型细胞系(由此是生产最高水平的转基因的细胞系)的自动化过程。具体而言,需要研发用于快速识别选择和/或分选cho和其他重组细胞的方法,其中所述cho和其他重组细胞表达(优选为展示,更优选为分泌)高水平的例如治疗性蛋白质。
在一些学术试验室中具有一些公开文献,其证明使用磁珠/颗粒(例如使用人工操作的管和磁体)分选细胞的可行性。大部分所述方法是缓慢且笨重的,并且具有有限的生产量和功效。此外,人工过程难以适用于gmp(良好的操作规范)或glp(良好的试验室规范)设备,因此它们通常不能用于生物技术或医药企业中。本发明提出了磁珠在微流体背景中的用途,从而基于给定转基因表达产物的不同表达水平优选达到完全自动化的哺乳动物细胞分离。
尽管miltenyi
发明概述
在一个实施方案中,本发明涉及细胞分选方法,其中所述细胞展示所关注的蛋白质,在某些实施方案中,所述细胞优选地以高水平并且可任选地由复合的克隆群体产生所关注的转基因,例如治疗性蛋白质。
在某些实施方案中,本发明可以使用磁珠在易于使用的微流体系统中以相对短的时间(例如少于36或24小时)识别高生产型细胞系。在其他的实施方案中,使用单次使用(一次性)的盒在持续无菌的环境中分选活细胞(例如高生产型细胞),如达到gmp相容性细胞分选所需。
本发明还涉及使用磁珠根据所关注蛋白质的表达水平从异源表达的细胞群体中选择细胞的方法。
本发明还涉及识别以及优选地选择在其表面上展示所关注蛋白质的细胞的方法,该方法包括:
(a)提供包含所述细胞的样品;
(b)提供包含一个或多个亲和基团的官能化磁珠,以及可任选的载体珠,其中所述亲和基团适用于结合在其表面上展示所述蛋白质的细胞;
(c)将所述细胞与所述官能化磁珠以及可任选的所述载体珠混合;
其中珠的所述亲和基团与在其表面上展示所述蛋白质的细胞结合,从而产生具有磁性标记的磁性标记细胞(mlc);
(d)例如在至少一个洗涤步骤中,将非磁性标记的细胞与所述mlc分离;以及
(e)识别以及优选地选择在其表面上展示所述蛋白质的细胞。
所关注蛋白质可以为标志物蛋白或转基因表达产物(tep)。
细胞可以是重组细胞,样品可以包括使用转基因转染的重组细胞,其中所关注蛋白质可以是转基因表达产物(tep);并且其中mlc可以在与亲和基团结合后的一定时间间隔内失去其磁性标记,并且可以基于时间间隔来识别以及优选地选择mlc。
分泌tep的重组细胞可以从基于所述时间间隔展示但不分泌tep的重组细胞中分离得到。
可以选择结合后少于1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23小时内,在结合后少于24小时、少于36小时、少于48小时、少于36小时、少于60小时、少于72小时、少于84小时或少于96小时内失去磁性标记的mlc。
所关注蛋白质可以是识别干细胞,特别是癌症干细胞(csc)或循环肿瘤细胞的标志物蛋白。
磁珠的亲和基团可以直接结合蛋白质。
至少一个连接分子可以结合亲和基团和蛋白质,从而将磁珠与蛋白质连接。连接分子可以为抗体或其片段,其可以被生物素化。
细胞可以在高于20、24、26、28、30、32、34或36度的温度下混合。
所述混合物可以为官能化珠(捕获珠)和载体珠的混合物,并且所述混合物可以处于反应室中。
所述方法可以进一步包括将具有振幅和极性的外部磁场施加于所述反应室,其中在所述外部磁场中,可以通过所述载体珠促进捕获珠与展示所述蛋白质的细胞的混合。
可以使用极性和振幅随时间改变的磁场来操纵磁珠。磁场的改变可以包括频率范围的改变(0.1至1000周数/秒)。可以通过控制施加磁场的频率和振幅来进行细胞选择。还可以通过控制磁珠和细胞混合的时间来进行细胞选择。可以通过多个参数中的一个参数来控制细胞的选择,包括洗涤步骤的数量、磁珠的本性以及在洗涤步骤过程中细胞混合的时间。
所选的细胞可以具有比在原始群体中存在的细胞高至少10%的蛋白质表达、展示或分泌水平,所选细胞的蛋白质表达、展示或分泌水平优选地可以比在原始群体中存在的细胞高20%、40%、60%、80%,或者更优选地高90%以上。还可以根据较低的蛋白质表达来选择细胞,并且所选细胞可以具有比在原始群体中存在的细胞低至少10%的蛋白质表达水平。所选细胞的蛋白质表达水平优选地比在原始群体中存在的细胞低20%、40%、60%、80%,或者更优选地低90%以上。
捕获珠可以为超顺磁珠,载体珠可以为铁磁珠。
捕获珠与载体珠的比例可以为2:1至50:1,5:1至25:1,优选地为8:1至12:1,或者大约10:1。
可以改变振幅和/或极性,以限定连续操作模式,其中可以以混合模式实施(c)中的所述混合,并且可以以珠分离模式实施(d)中的所述分离。
细胞可以为重组细胞,而在表面上表达的蛋白质可以为tep,并且(e)中的识别可以通过在结合后少于48小时,优选地少于36或24小时内从反应室中洗脱失去其磁性标记(由此与磁珠分离)的细胞来实施。
在混合模式和珠分离模式中,磁性装置(多个)可以在1hz-1000hz及0.1至10000ma(优选为40至500hz及200-500ma)下以循环或交替的模式操作。
混合模式和/或珠分离模式均可以持续少于60秒。
本发明还涉及用于基于蛋白质(例如tep)的展示以及优选地分泌(从细胞表面释放;脱落)水平从细胞群体中选择细胞的盒,其中所述细胞群体包含展示,优选地分泌所述蛋白质的细胞,所述盒包含:
a.微流体通道;
b.用于在悬浮液中混合磁珠的反应室,其中所述反应室具有至少一个输入通道和至少一个输出通道,其分别用于将流体引入所述反应室中和将流体从反应室中移出;
c.细胞样品容器,其通过输入通道与所述反应室形成流体连通;
d.至少一个洗涤试剂容器,其通过输入通道与所述反应室形成流体连通;
e.废物容器,其通过输出通道与所述反应室形成流体连通。
其中c至d的各容器还通过一个微流体通道与包含空气过滤元件的排气孔形成流体连通。
本发明还涉及基于在细胞表面上所表达蛋白质(例如tep)的展示以及优选地分泌(由细胞表面释放;脱落)水平从细胞群体中选择细胞例如重组细胞的整合系统,其中所述细胞群体包含展示,优选地分泌所述蛋白质的细胞,其中所述系统包括盒,其包含:
a.微流体通道;
b.用于在悬浮液中混合磁珠的反应室,其中所述反应室具有至少第一输入通道和至少第二输出通道,用于将流体引入所述反应室中以及将流体从反应室中移出;
c.细胞样品容器,其通过输入通道与所述反应室形成流体连通;
d.至少一个洗涤试剂容器,其通过输入通道与所述反应室形成流体连通;
e.废物容器,其通过输出通道与所述反应室形成流体连通,其中c至d的各容器还通过一个微流体通道与包含空气过滤元件的排气孔形成流体连通;
f.在所述反应室周围或在所述反应室处排布的一个或多个装置,具体而言为一个或多个磁体,其创建可控的磁场(磁场装置=mfd);
g.数据处理设备(例如计算机),其被构造用于通过频率和/或振幅调节从而调节反应室内由mtd创建的磁场,其中各频率和/或振幅调节限定了反应室内的操作模式。
数据处理设备可以被构造用于设定一连串的所述操作模式,包括混合模式、捕获模式、固定模式、珠分离模式和/或回收模式。
所述数据处理设备可以适用于设定mfd以在以下条件下运行:
-在混合模式和珠分离模式的过程中,在1-1000hz,优选为40hz-500hz以及在0.1至10,000ma,优选为200-500ma下的循环或交替模式,其中例如所述循环模式可以在顺时针和逆时针之间转换;
-在捕获模式过程中,在低于混合模式的频率和振幅下的循环或交替模式,例如0.5至40hz以及300至600ma;
-在固定模式过程中,在0hz和一定振幅下,例如300至600ma;以及
-在回收模式过程中,在相对于固定模式增加的频率(例如40hz-500hz)以及降低的振幅(例如30-300ma)下。
所述系统或盒的反应室可以包含载体和珠捕获珠的混合物。
所述盒可以进一步包含用于从反应室中接收磁性标记细胞,优选为磁性标记的重组细胞的回收容器。
所述盒或系统可以进一步包含至少一个第二输入通道和至少一个第二输出通道,它们与所述反应室形成流体连通,其中所述第二输入通道与至少一个第一输出通道分离,而所述第二输出通道与至少一个第一输入通道分离,其中所述回收容器通过所述第二输入通道与反应室形成流体连通,所述第二输出通道与包含空气过滤元件的另一个排气孔连接。
回收容器的空气排气孔可以与泵连接,以通过经回收容器的排气孔泵入空气而回收反应室内的磁性标记细胞,以使反应室的内容物通过输入通道而涌入回收容器中。
所述反应室的体积可以为10μl至500μl。
所述盒可以是自容式的和/或一次性的。
本发明还涉及试剂盒,其在一个容器中包含本发明所述盒,其中反应室可以包含捕获珠和载体珠(其可以可选地包含在另一个容器中);以及在分开的容器中,包含如何使用盒中的捕获珠和载体珠的说明书。
捕获珠可以为超顺磁珠,载体珠可以为铁磁珠,其中超顺磁珠与铁磁珠的比例为2:1至50:1。
本发明还涉及通过本发明所述方法、系统和/或盒识别以及优选地选择的细胞。
本发明还涉及分离的细胞群体,其优选地包含以超过20、40、60、80pcd的水平分泌转基因表达产物的重组细胞,其中权利要求书中的分离的群体不包含超过40%的原始细胞群体,其中所述分离的细胞群体由该原始细胞群体分离得到。
本发明还包括本发明公开的哺乳动物细胞作为治疗细胞的用途,其包括但不限于基因治疗或再生性医学用途。
所分泌的转基因可以为治疗性蛋白质。
将细胞与所述官能化磁珠以及可任选地所述载体珠混合,和识别以及优选地选择在其表面上展示蛋白质的细胞之间的时间间隔可以少于1小时、少于30分钟、少于20分钟、少于15分钟或少于10分钟。
权利要求书的主题和所有要求权益的组合以引用方式并入本说明书中并且保留作为本发明公开的一部分,即使权利要求被放弃。
附图简述
本发明的目的和特征与特性列于所附的权利要求书中。通过参照以下说明书并连同附图可以最佳地理解本发明的操作机构和模式以及其他的目的和益处,其中:
图1为示意图,其示出具有可变的免疫球蛋白生产水平的细胞的制备。用免疫球蛋白γ(igg)和抗生素选择标志物的表达载体以及编码ebfp2的质粒共转染cho-m细胞。通过facs基于bfp和表面igg展示将稳定表达不同水平igg的多克隆群体分选出来。通过elisa证明所选细胞克隆子的igg分泌。
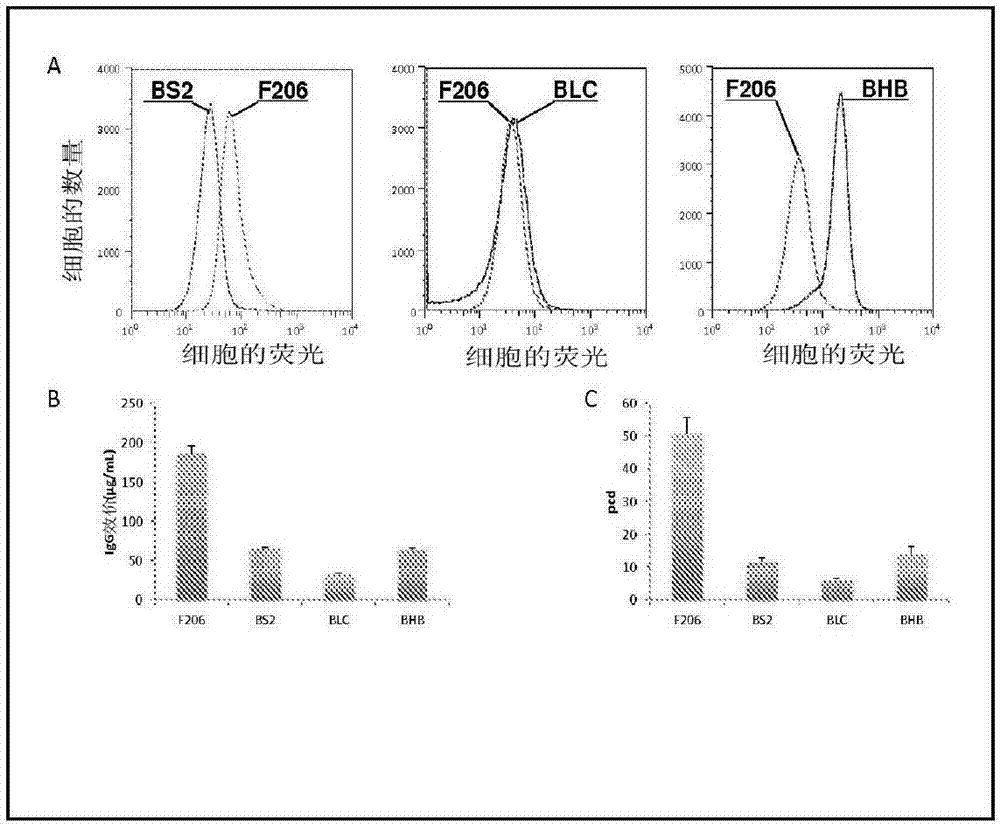
图2示出介导不同igg展示和分泌水平的gfp-或bfp-标记的参照细胞的图:通过facs选择cho-m-衍生的细胞克隆子作为参照细胞群体,其展示不同水平的细胞表面igg,但是具有可变水平的igg分泌。将bfp标记的中等展示型bs2细胞、高展示型blc细胞和极高展示型bhb细胞与gfp-标记的f206极高生产型细胞克隆子比较。使用apc-缀合的抗igg抗体标记细胞表面上展示的igg,然后实施流式细胞仪分析(a)。通过对分泌至细胞培养基中的igg进行elisa测试来测定由所示细胞克隆子的平行培养物生产的igg效价(b)或其特定生产率(皮克/细胞/天)(c)。
图3为示出混合细胞群体的人工捕获原理的示意图。将表达igg和不表达igg的细胞群体的混合物以1×107细胞/ml与kpl生物素缀合的抗人igg抗体(至最终浓度为5mg/ml)温育20min。在使用1×pbs进行5min洗涤然后在1000rpm下离心细胞后,随后将预标记的细胞与涂覆链霉亲和素的超顺磁珠温育30min。手持式磁体允许将珠捕获的展示igg的细胞与不表达的细胞分离。整个过程均是在室温下实施的。
图4为示意图,其示出从不表达的细胞的混合群体中人工富集表达细胞的说明。将人工捕获的回收的细胞在各次洗涤后置于细胞培养物中,并且在未选择的情况下生长10天,然后进行igg展示评估。3次洗涤足以除去大部分不表达的细胞,由此仅保留igg阳性细胞。
图5为盒的示意图,其被设计用于使用magphasetm设备从混合的细胞群体中自动化地富集高表达的细胞。示出了盒的示意图(a)以及实际照片(b)以说明一些元件的排布。
图7为示意图,其示出用于从混合细胞群体中自动化富集表达细胞的磁性微粒的类型。
图6为用于从混合细胞群体中自动化富集表达细胞的磁性微粒的选择的示意图。
图7为使用2.8μm超顺磁珠进行人工细胞捕获的图。将表达igg的f206细胞(1×107细胞/ml)的悬浮液与kpl生物素化的抗人igg抗体温育20min,然后与30μl超顺磁珠温育30min。与超顺磁珠结合的cho细胞如图所示。
图8为使用2.0μm铁磁珠进行人工细胞捕获的图。将表达igg的f206细胞(1×107细胞/ml)的悬浮液与kpl生物素化的抗人igg抗体温育20min,然后与30μl超顺磁珠温育30min。与超顺磁珠结合的cho细胞如图所示。与铁磁珠结合的cho细胞不能被释放至细胞培养物中,因为它们形成了聚集体。
图9为使用超顺磁珠和铁磁珠的组合进行magphasetm自动化细胞捕获的示意图:混合模式。细胞捕获或洗涤步骤中使用高频混合模式。使2种类型的珠解离,并分别在以下条件下混合10s:100-150hz和200-300ma(取决于所用的微珠的类型)。以循环方式(1秒顺时针旋转(1-2-3-4),1s逆时针旋转(4-3-2-1),然后10s顺时针旋转)连续地活化电磁体,从而达到最佳的混合。铁磁珠(黑色)围绕室在壁的附近循环,而超顺磁珠(灰色)在室内分散,以温育用于结合的细胞或在洗涤缓冲剂中混合。
图10为使用超顺磁珠和铁磁珠的组合进行magphasetm自动化细胞固定的示意图:混合模式。以逆时针旋转模式使用极高磁力和低频率进行10s,使铁磁珠缓慢地围绕室循环,从而抓住超顺磁珠以及可能结合的细胞。
图11为使用超顺磁珠和铁磁珠的组合进行magphasetm自动化细胞固定的示意图:固定模式。在10s过程中,使结合的超顺磁微珠和铁磁微珠在极高的磁力(400ma)和零频率(0hz)下固定于室壁上,从而允许泵送处于悬浮状态的细胞或多种洗涤缓冲剂。在这种操作中,电磁体以固定的模式操作(例如1和4作为阴极,2和3作为阳极)。
图12为使用超顺磁珠和铁磁珠的组合进行magphasetm自动化细胞洗脱和回收的示意图:珠分离模式。首先通过滚转(tumbling)(100-150hz和200-300ma)分离超顺磁珠和铁磁珠,然后如混合模式中那样操作电磁体(参见图9中的捕获)。
图13为使用超顺磁珠和铁磁珠的组合进行magphasetm自动化细胞洗脱的示意图:回收模式。在之前步骤的珠分离(图12)后,施加3s的中等频率和磁力步骤(100hz和100ma),其中电磁体在“珠固定”的模式下操作(参见图11),不同之处在于阳性磁极和阴性磁极在100hz频率(待证实)下进行转换。这种磁力快速地使铁磁珠而非超顺磁珠处于室壁的角落。中等范围的频率使超顺磁珠保持在室的中间,从而可以将它们泵出以用于收集结合的细胞。通过在4.5s内以30μl/s的速率向室内泵入空气来洗脱超顺磁珠。
图14为识别magphasetm最佳磁场强度和场振荡频率以便使用超顺磁珠和铁磁珠来分离高(f206)和中等(bs2,blc)生产型细胞的图。微珠和magphasetm操作条件如图9-13所示,不同之处在于在回收模式之前,在所示条件下在不同的频率和磁场强度下实施3次洗涤步骤。这允许鉴定最佳条件,而增加的频率和/或磁场(分别以“快速”和“强”显示)产生较低富集的高表达f206细胞。输入群体中高与中等表达型细胞的比例设定为f206:bs2细胞大约为50:50(a),或者f206:blc细胞大约为30:70(b)。通过荧光显微镜定量所回收的细胞。
图15为识别用于细胞温育时间的magphasetm最佳背景的图。在120hz,300ma下将珠与细胞混合不同的时间(2s至5min)用于细胞捕获,并在120hz,300ma下实施3次洗涤步骤达10s。1μlchemicellsimag1.0mm珠和20μldynabeadsmyonet1珠预加载至混合室中。将f206和cho-m细胞以10:90比例混合,并使用生物素化的抗iggkpl抗体标记细胞混合物,然后进行magphasetm操作。在荧光显微镜下分析回收的细胞。
图16为对铁磁珠与超顺磁珠比例的magphasetm最佳设定进行鉴定的图。将1或2μlchemicellsimag1.0μm,以及5μl、10μl、20μl或30μlmyonet1dynabeads预加载至混合室中。将f206和cho-m细胞以10:90比例混合,并使用生物素化的抗体标记。在荧光显微镜下分析回收的细胞。
图17为采用magphasetm最佳的自动化背景,使用超顺磁珠和铁磁珠的组合进行表达igg的细胞的富集的图。将所示的细胞群体混合物与kpl生物素化的抗人igg抗体预温育,至最终浓度为5μg/ml。使用预加载至混合室中的20μl超顺磁珠(myonet1dynabeads,涂覆链霉亲和素,1.0μm)和2μl铁磁珠(chemicellfluidmag/mp-d,5.0μm,涂覆淀粉)实施magphase-基细胞分离。最佳的magphasetm步骤和参数为:1.在120hz,300ma下,用于细胞捕获的混合达10s;2.在1hz,400ma下,珠捕获达10s;3.在0hz,400ma下,珠固定达10s;4.实施3次洗涤循环;以及5.在100hz,100ma下回收。洗涤循环由以下过程组成:输入100μlpbs缓冲剂,然后进行上文所述混合模式、珠捕获和珠固定步骤。在荧光显微镜下分析回收的细胞。
图18为使用超顺磁珠和铁磁珠从中等(bs2)、高(blc)和极高(bhb)igg展示型细胞中magphasetm自动化分离高(f206)的图。微珠、细胞制备和magphasetm操作条件如同图17中所述。在荧光显微镜下分析回收的细胞。
图19为magphasetm自动化捕获和人工捕获的比较的图。将所示的细胞群体(f206和cho-m细胞混合至10/90比例(a);f206和bs2细胞混合至40/60比例(b))与kpl生物素化的抗人igg抗体预温育,至最终浓度5μg/ml。使用预加载至混合室中的20μl超顺磁珠(myonet1dynabeads,涂覆链霉亲和素,1.0μm)和2μl铁磁珠(chemicellfluidmag/mp-d,5.0μm,涂覆淀粉)实施magphase-基细胞分离。magphasetm过程和人工捕获过程分别如图17和图3中所实施。在荧光显微镜下分析回收的细胞。
图20描绘了使用第一代magphasetm对表达igg的细胞进行的无菌捕获和富集。将f206和cho-m输入细胞混合至比例10:90至20:80,并使用无菌的magphasetm盒如图17所述实施magphasetm捕获工艺。(a)在捕获后的第1天,使magphasetm捕获的细胞与洗脱的珠分离,并在未进行抗生素选择的条件下将它们在培养物中放置16天,然后进行igg展示分析,作为对照培养的输入细胞等分物也进行重复操作。(b)如同图a对细胞进行处理,不同之处在于在cb5供料存在下培养细胞,然后使用magphasetm分选,并且在分选后第3天回收在第1天未从珠上洗脱的细胞。使用apc缀合的抗igg抗体标记捕获的细胞和对照细胞,从而对表达并展示igg的f206细胞进行染色,随后通过流式细胞仪进行分析。(c)使用在cb5存在下培养的细胞或cb5不存在下培养的细胞重复进行人工和magphasetm-介导的分选,然后进行分选。通过荧光显微镜分析回收的细胞。这些结果表明由3次独立试验得到的f206细胞成倍富集的平均值。
图21描绘了对表达和分泌高水平igg的细胞进行的无菌magphasetm捕获和富集,所述细胞在magphasetm分离后第1天从磁珠上洗脱。在未进行抗生素选择的条件下,将图20b的magphasetm-捕获的细胞(在捕获后的第1天或第3天分离)以及作为对照的输入细胞等分物在培养物中放置10天,然后进行igg分泌分析。特定的生产率表示为每个细胞每天分泌的pgigg(pg/细胞/天)。
图22为从多克隆群体中对表达并分泌高水平igg的细胞进行的无菌magphasetm捕获和富集的图。使用magphasetm如图21所述在缺乏cb5供料的条件下对培养的多克隆细胞群体进行分选。将分选后第1天和第4天从磁珠洗脱的培养细胞以及作为对照的输入细胞等分物在含有cb5但未进行抗生素选择的培养物中放置14天,然后通过elisa测试评估细胞上清液中细胞表面igg展示和igg分泌。(a)igg阳性细胞的百分率,区分低、中等和高展示型细胞。(b)在分选后第1天或第4天洗脱的细胞的上清液中,igg分泌的特定生产率(pg/细胞/天)。
图23为使用不同的单克隆抗体(mab)进行无菌magphasetm分选以从多克隆群体中富集高表达和分泌治疗性igg的细胞的图。使用mabtech或acrismab标记的c_mf多克隆细胞作为输入,如图17所示进行magphasetm捕获。将捕获第1天分离的magphasetm捕获的细胞以及作为对照细胞的输入细胞等分物分别分成2份。每份细胞均在具有或不具有cb5并且未进行抗生素选择的培养物中放置14天,然后进行igg展示分析。在igg展示分析的同一天从细胞培养物上清液中取样。通过elisa分析上清液样品中igg的效价以用于进一步计算特定的生产率。(a)在不含有cb5的条件下进行培养时,igg阳性细胞的百分率。(b)在使用cb5进行培养时,igg阳性细胞的百分率。(c)igg的特定生产率(pg/细胞/天)。
图24为使用第二代和优化的magphasetm设备以及单次用途的无菌盒从不表达的细胞中富集表达igg的f206细胞的图。将f206和cho-m细胞作为输入以20:80的比例混合。如图17所述进行旧式magphasetm捕获。将160μl生物素化抗体标记的细胞与1360μl1×pbs溶液分别加载于新式magphasetm盒的样品管和洗涤溶液管中。在新式magphasetm上运行的脚本(script)具有与旧式magphasetm脚本相同的步骤,不同之处在于泵入液体的体积适用于新式magphasetm,并且电流强度为旧式magphasetm脚本的一半。在捕获的第1天和第6天分离magphasetm捕获的细胞,并且在未进行生物素选择的条件下将作为对照细胞的输入细胞等分物在培养物中放置6天。通过荧光显微镜分析回收的细胞和对照细胞。这些结果为3次独立试验获得的平均值。(a)使用kpl抗血清在捕获物中得到的igg阳性细胞的百分率。(b)使用mabtechmab在捕获物中得到的igg阳性细胞的百分率。
图25为根据图24中使用的本发明优选实施方案的流体盒的示意图。(盒(1),反应室(2),反应室具有输入(3入)和输出(3出)通道(用于将液体培养物引入所述反应室中以及从所述反应室除去液体培养基),细胞样品容器(4),洗涤试剂容器(5),空气排气孔(7),空气过滤元件,回收容器(9)(用于接收由反应室(2)得到的所选细胞),第二输入和输出通道(10入,10出)(分别为第一输出和输入(3出,3入)通道的分支;回收容器(9)通过第二输入通道(10入)和第二输出通道(10出)与反应室形成流体连通,所述第二输出通道(10出)与包含空气过滤元件(8)的排气孔(7回收)连接。
图26示出使用magphasetm装置分选的细胞群体的分析。使用clonepixtm成像设备进行分析,其中所述成像设备表明由各种分析的cho细胞集落(=克隆子)释放的曲妥单抗抗体的量。对具有极高生产率的克隆子的鉴定是可行的。
图27为微流体装置的连续操作模式的流程图,其中所述微流体装置在本发明中为包含盒的magphasetm装置,其通过本发明的数据处理设备执行。
发明详述及优选的实施方案
在本发明的多个实施方案中,使用磁敏感的珠(在本发明中称为“磁珠”、“磁颗粒”、“磁微珠”或仅是“微珠”)。磁珠可以由本领域已知的任何材料制备,该材料易于通过磁体移动(例如永久磁体,但是优选为电磁体)。当磁珠被外部磁场磁化时,其能够产生高磁场的组分。
在本发明的一些实施方案中,所述珠被完全或部分涂覆,因此被亲和基团官能化。此类亲和基团可以为直接附着在细胞表面蛋白质(例如对于干细胞而言,为受体/标志物蛋白)或另一个表面表达的基序上的配体,例如转基因产物,例如治疗性蛋白质。亲和基团还可以为聚合物材料,无机材料或蛋白质(例如链霉亲和素),其对于诸如维生素生物素之类的其他分子具有高亲和性,其中所述维生素生物素通常用作抗体的标记。所述珠可以包括铁磁材料、顺磁材料、超顺磁材料或这些材料的组合。所述磁珠可以包括铁氧体核心和涂层。但是,磁珠还可以包含fe、co、mn、ni中的一种或多种、包含一种或多种这些元素的金属、这些元素的有序合金、这些元素制备的晶体、磁性氧化铁结构(例如铁氧体)和它们的组合。在其他的实施方案中,所述珠可以由磁铁矿(fe3o4)、磁赤铁矿(y-fe2o3)或二价金属-铁氧体制备。
在本发明的某些实施方案中,磁珠包含例如由选自聚苯乙烯、聚丙烯酸和右旋糖酐中的材料(磁性涂层置于其上)形成的非磁性核心。具有不同类型的珠,其中珠的“类型”根据它们的磁性行为而不同:
“顺磁”珠表征为低的磁敏感性,并且一旦不再处于磁场中便快速丧失磁化强度。
“铁磁”珠具有高的磁敏感性并且能够在缺乏磁场的条件下保留磁性(永久磁性)。铁磁性例如在材料中未配对的电子包含在晶格中由此允许未配对的电子偶联时发生。优选的铁磁材料包括但不限于铁、钴、镍、它们的合金和它们的组合。
所谓的“超顺磁”珠表征为高的磁敏感性(即当它们置于磁场中时将成为强磁性),但是类似于顺磁材料,在缺乏磁场的条件下,它们会快速丧失它们的磁化强度。超顺磁性可以在晶体尺寸小于临界值时在铁磁材料中获得。超顺磁珠具有双重优点:能够经历磁体的强烈吸引,并且在缺乏磁场的条件下不会簇集在一起。具体而言,不会簇集在一起的性质可以优选地使细胞附着在所述珠上以保持活力。
根据周围环境而发挥不同类型作用的珠(例如铁磁和超顺磁的)已经在其他处有所公开,例如在美国专利8,142,892中,该文献以引用模式全文并入本文,并且在本发明的内容中可以用作磁珠的“类型”。其他类型的珠在例如美国专利申请2004/0018611中公开,该文献以引用方式全文并入本文。
在优选的实施方案中,磁珠极小,通常为大约0.1至500μm,优选为0.1至100μm,更优选为0.2至50μm、0.2至20μm、0.2至10μm以及0.2至5μm。粒径与颗粒响应于外部磁场而产生的磁力密度之间的关系通过以下等式给出:
fm=b0igradhi=b0m/a
其中fm为磁力密度,b0为外部磁场,igradhi为在磁珠表面上局部梯度的表达,m为基质元素的磁化强度,而a为珠的直径。因此,磁珠越小,磁场梯度越高。较小的珠将产生较强的梯度,但是它们的作用将是更加局部的。
在一个实施方案中,磁珠为不均匀的尺寸,在其他的实施方案中,磁珠为均匀的尺寸。通常,可以使用任何形状的珠,换言之,具有角度或曲度的任何形状都可以形成梯度。尽管较小的磁珠会产生较高的磁力密度,但是较大的珠会产生距其表面更远的磁场梯度。通常,这归因于较小珠的较大的曲率半径。由于这种较小的曲率半径,较小的珠在它们的表面上具有比较大的珠更强的梯度。较小的珠通常还具有随着距离更快速降低的梯度。此外,对于较小的珠而言,在一定距离的磁通量通常更低。因此,较小和较大磁珠的混合物将捕获弱磁化的材料(即,被较小的珠捕获)和强磁化的材料(即,被较大的珠捕获)(远离珠)。
在本发明的大部分实施方案中,磁珠足够小使得它们可以在微粒体装置中操作。
在一个有利的实施方案中,不同类型的珠的组合是优选的,例如2种、3种、4种或5种类型的珠。
在某些实施方案中,微流体装置中使用一种类型的磁珠(例如单独的铁磁珠)可以导致重组细胞由于例如细胞的聚集而发生细胞死亡。在本发明的一个实施方案中,铁磁珠用作载体珠,即其功能是优化细胞与捕获珠的混合,并且在某些实施方案中,优化细胞特别是活细胞的回收。在一个实施方案中,载体珠是非官能化的。载体珠的直径可以为0.1至500μm,优选为0.1至100μm,更优选为0.2至50μm、0.2至20μm、0.2至10μm以及0.2至5μm。在优选的实施方案中,直径为1至6μm。
捕获珠实际上捕获所关注的细胞。捕获珠通常是官能化的。捕获珠优选为超顺磁珠,如上文所述,其不会(或者不显著地)簇集在一起,因此可以使细胞附着在捕获珠上从而保持活力。载体珠的直径可以为0.1至500μm,优选为0.1至100μm,更优选为0.2至50μm、0.2至20μm、0.2至10μm以及0.2至5μm。在优选的实施方案中,直径为0.5至2.5μm。
载体珠与捕获珠的比例可以为1:1至1:50,优选为1:5至1:40、1:5至1:20、1:8至1:12、1:9至1:11或者大约1:10。如本领域的技术人员容易理解的那样,铁磁珠和/或非铁磁珠的绝对量将取决于反应室的体积、磁珠的类型、组成和尺寸,并且本领域的技术人员可以凭经验测定。每体积反应室中载体珠的体积可以为1μl/100μl至10μl/100μl。对于50μl反应室而言,载体珠的体积可以为例如1μl至5μl。
所关注蛋白质可以为识别干细胞特别是癌症干细胞(csc)的标志物蛋白,包括组织特异性csc,例如白血病干细胞或循环肿瘤/癌症或癌前细胞。
在一个实施方案中,标志物蛋白可以为选自以下干细胞标志物的一种或多种(例如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22或23种):lgr5、lgr4、epcam、cd24a、cdca7、axin、ck19、巢蛋白、生长激素抑制素、dcamkl-1、cd44、sord、sox9、cd44、prss23、sp5、hnf1.alpha.、hnf4a、sox9、krt7和krt19、tnfrsf19。干细胞标志物可以为组织特异性的。例如胰腺干细胞或类器官可以表征为天然表达以下一种或多种(例如1、2、3、4、5、6、7、8、9、10、11、12、13、14或15种,例如1、2、3或4种):ck19、巢蛋白、生长激素抑制素、胰岛素、胰高血糖素、ngn3、pdx1、neurod、nkx2.2、nkx6.1、pax6、mafa、hnflb、可任选的tnfrsfl9;胃部类器官可以表征为天然表达以下一种或多种(例如1、2、3或4种):dcamkl-1、cd44、可任选的tnfrsfl9;以及腺窝汇合点类器官(crypt-villusorganoid)可以表征为表达以下的一种、多种或全部(例如1或2种):sord和/或prss23。csc标志物包括cd19、cd34、cd44、cd90、aldh1、pl2l、sox-2和n-钙粘素,而它们可以耗尽或展示低量的其他标志物,例如cd21、cd24、cd38或cd133。白血病干细胞可以识别为cd34+/cd387cd19+细胞,乳腺癌干细胞可以识别为cd44+但是cd24低细胞,脑csc可以识别为cd133+细胞,卵巢csc可以识别为cd44+细胞、cd117+和/或cd133+细胞,多发性骨髓瘤csc可以识别为cd19+细胞,黑素瘤csc可以识别为cd20+细胞,室管膜瘤csc可以识别为cd133+细胞,前列腺csc可以识别为cd44+细胞,以及在其表面上分泌或展示已知由癌症干细胞表达的其他标志物蛋白的细胞。其他的csc标志物包括但不限于cd123、cll-1、slam的组合(信号传递淋巴细胞活化分子家族受体)以及它们的组合。其他的示例性标志物可以在美国专利申请2008/0118518中找到,该文献以引用模式并入本文。循环肿瘤细胞(包括但不限于得自实体肿瘤的细胞)可以得自原发肿瘤或转移瘤,并且它们可以通过任何标志物或肿瘤特异性标志物的组合来识别。
“所关注的基因”或“转基因”优选地编码蛋白质(结构蛋白或调节蛋白)。如本文所用,“蛋白质”通常是指具有超过大约10个氨基酸,优选为超过100个氨基酸的肽或多肽,并且包括诸如抗体或其片段的复合蛋白。所述蛋白质可以与宿主是“同源的”(即对于所用宿主细胞而言是内源的)或“异源的”(即对于所用宿主细胞而言是外来的)。尽管所述蛋白质可以是未取代的,但是它们还可以被加工,并且可以包含非蛋白质部分,例如糖。
哺乳动物细胞(在本发明的内容中,其包括根据本发明的未修饰或重组的细胞)包括但不限于csc、cho(中国仓鼠卵巢细胞)细胞、hek(人胚肾)293细胞、干细胞或祖细胞。
哺乳动物重组细胞(由此包含转基因的细胞)在本发明的范围内,其中所述哺乳动物重组细胞在其表面上表达和优选地展示并且在某些实施方案中分泌(脱落)高水平的转基因表达产物,例如治疗性蛋白质或用于治疗性分子的靶蛋白质。在某些实施方案中,分泌(脱落)转基因(除了表达并展示该基因以外)的重组细胞从表达并展示、表达但不展示或者甚至不表达所关注的转基因产物的细胞中识别出来/从所述细胞分离(参见美国专利公开20120231449,该文献以引用方式全文并入本文)。生产型细胞是指不仅展示而且还从多种细胞分泌转基因产物的细胞,即将转基因产物释放至其周围。仅这些细胞确实“生产”转基因产物,而许多其他的细胞可以只表达或展示转基因产物,但是不能高效地分泌蛋白质。因此,它们在延长的时期内(超过2天)可以在其表面上仅展示转基因蛋白质产物,而不会释放该产物,因此,不能归类为“生产型细胞”或“高分泌型细胞”。在一天内以超过10皮克(例如皮克/细胞/天(pcd))但少于20皮克蛋白质的量分泌转基因产物的重组细胞(“生产型细胞”)被认为是中等生产型,以超过20、超过40或超过60pcd的量分泌转基因产物的重组细胞被认为是高生产型,并且以超过80pcd的量分泌转基因产物的那些细胞被认为是极高生产型。极高生产型细胞可以优选地分泌超过100pcd的转基因产物。几乎不生产任何表达产物的细胞(低生产型细胞)分泌低于10pcd。在人工过程中,为了识别分泌转基因的高(包括极高)生产型细胞,通常例如通过温度调节对分泌、由此的释放进行干扰(在cho细胞中,例如保持环境温度低于20℃或4℃),从而允许分泌的蛋白质在细胞(在足量的时间内,蛋白质由该细胞上分泌)的表面上展示。有利地,由于展示高量转基因产物的细胞的快速捕获和释放,在本发明的内容中,此类温度调节通常是没必要的,从而允许操作温度在18-40℃或者20-37℃之间。
本发明的方法和装置优选地可以在少于1小时,优选地少于20分钟,甚至更优选地少于5分钟内分选超过100000,优选地超过1000000,更优选地20000000、30000000、40000000、50000000、60000000、70000000、80000000、90000000或100000000个重组细胞。生产型细胞,特别是高和极高生产型细胞(由此为表达和释放转基因产物的细胞,其根据本发明识别和/或分离)在识别和/或分选后优选地超过90%,更优选地超过95、96、97、98、99%或100%是活的细胞。在优选的实施方案中,如上文概括的那样,在无菌微流体装置中选择展示转基因产物的细胞。
在本发明的内容中,以高水平表达所关注转基因的哺乳动物细胞仅是一小部分。尽管大量的细胞在转染后表达并且甚至展示转基因产物,但是也仅一小部分是实际上的生产型细胞。由下文中模式细胞的列表可见,仅“f206细胞”是理想的,这是因为它们在1天内实际上生产,即释放/脱落转基因产物。具有相当的高表达或者甚至在其表面上展示的其他细胞是不理想的,这是因为它们实际上不是生产型细胞。
-cho-m(中国仓鼠卵巢细胞)悬浮细胞:这些细胞不表达igg,也不表达gfp。
-f206细胞:这些细胞表达igg(lgg+)和gfp(gfp+)。这些细胞是高的igg展示型和高的igg生产型,并且是极其理想的。
-bs2细胞:这些细胞表达igg(igg+)和bfp(bfp+)。这些是中等igg展示型和中等igg生产型,并且是不理想的。
-blc细胞:这些细胞表达igg(igg+)和bfp(bfp+)。这些是高igg展示型和中等igg生产型,并且是不理想的。
-bhb细胞:这些细胞表达igg(igg+)和bfp(bfp+)。这些是极高igg展示型和中等igg生产型,并且是不理想的。
如本领域的技术人员理解的那样,最有价值的细胞为以极高的速率表达和脱落/释放转基因产物的生产型细胞。通常,高生产型细胞为在给定的细胞样品(例如5000-10mil.细胞、优选为1-5mil细胞样品)中,高于40%、优选为高于30%或者高于25%(四分之一)的细胞表达和脱落/释放某种产物。在绝对术语中,这是指以超过20pcd、优选为40、60、80pcd或者甚至更优选地100pcd分泌转基因产物。
如果在其表面上展示但不必分泌的细胞被识别并且优选地被选择,有趣的是选择不仅高展示型细胞,还选择中等和/或低展示型细胞。理想的是选择一种蛋白质为高展示型、但是另一种蛋白质为低展示型的细胞。当使用荧光抗体标记时,高展示型细胞可以展示100-1000rlu(相对光单位),而中等展示型可以展示10-100rlu,而低展示型通常可以展示1-10rlu。rlu优选地可以保持超过48hr的时间。
如本文所用,“微流体装置”是指允许精确地控制和操作流体的任何装置,其中所述流体以几何图形局限于结构中,其中至少一个维度(宽度、长度、高度)可以小于1mm。通常,在微流体装置中,微流体通道与多个室形成相互连接。通常,微流体通道(在本发明中仅为“通道”)是真正的通道、沟槽或沟渠,其具有以微米(μm)计的或者小于103米(mm)级别的至少一个维度。如本文所用,“反应室”是指微流体装置内的空间,其中当细胞流动通过所述装置时,通常可以通过磁珠的捕获和释放将一个或多个细胞与较大量的细胞群体分离。在本发明的一个实施方案中,反应室为10-500μl,优选为20-200μl,30-100μl或者40-80μl或40-60μl,包括50μl的尺寸。反应室可以具有多种不同的形状,例如圆形、正方形或菱形。
尽管流体流动通过微流体通道可以通过以下定义的reynolds数(re)来表征:
re=lvavgρ/μ
其中l为最相关的长度规模,μ为流体粘度,p为流体密度,而vavg为流动的平均速度,反应室中这些流动特征被扰乱,并且反应室内的流动可以受到外部来源(例如一个或多个磁场)的操纵。由于通道的较小的维度,re通常远小于100,通常小于1.0。在这种reynolds数范围下,流动是完全层流状的,并且无湍流发生。过渡至湍流通常在reynolds数为2000的范围内发生。
反应室通常具有用于引入和排出流体的输入通道和输出通道。根据本发明的流体优选为包含细胞的液体培养基。微流体装置和反应室例如在美国专利申请公开us2013/0217144和us2010/0159556中公开(该文献以引用模式全文并入本文),其特别关于反应室的构造和反应室周围磁性装置(例如4个电磁体)的建立,或者以商标magphasetm(spinomix)购得。本发明的微流体装置还优选地包含或者与以下部分连接:至少一个细胞样品容器,其可以加载细胞,而该细胞有待针对它们生产蛋白质的能力进行评估,并且所述容器与反应室的输入连接;洗涤试剂容器,其也与反应室的输入连接;废物容器,其与反应室的输出连接;或者它们的组合。
本发明的微流体装置还可以为盒或芯片,其长可以为小于1cm,宽为0.5cm。微流体装置还可以包含控制装置内流体移动的部件,并且可以包括下文所述磁体、泵、阀、过滤器和数据处理系统部件。因此,包含盒的magphasetm(spinomix)装置可以被认为是微流体装置。
流体在微流体装置内的移动部分基于被动力,例如毛细管力。在本发明的内容中,额外地施加外部力,例如压力、吸力和磁力,从而运输或混合本发明的流体,例如移动反应室内磁珠和重组细胞的悬浮液。外部力可以通过包含计算机硬件的数据处理系统来驱动。
可以根据本发明提供的教导来使用和修改使用标准操作系统的容易获得的计算机硬件,例如像个人电脑(pc)那样简单的机器,例如用于本发明的集成系统的intelx86或pentium芯片相容的dostm、windows、linux、macintosh或sun。软件技术的现有技术足以在计算机系统上实施本发明教导的方法。因此,在具体的实施方案中,本发明可以包括用于执行本发明教导的一种或多种方法的一组逻辑指令(软件或硬件编码的指令)。例如任一技术人员可以使用标准的编程语言(例如isualbasic、fortran、basic、java等)来构建用于提供数据和/或统计分析的软件。还可以使用多种统计编程语言、工具或文库来构建此类软件。
如本领域的技术人员所理解的那样,微流体装置内、特别是反应室内的不同的操作模式可以通过数据处理系统测定。具体而言,数据处理系统可以测定决定操作模式的频率和磁力。为了选择所关注的细胞的一系列操作模式被称为操作循环。一个操作循环可以持续少于20min,少于15min,少于10min或者少于5min。本领域的技术人员将理解的是根据多个参数,例如反应室的尺寸和形状,磁珠的尺寸、形状和/或材料,或者磁性装置的设计,必须调节下文所述不同的操作模式。
混合模式:在本发明的内容中,混合模式描述了反应室内的操作模式,其中流体内所包含的颗粒最佳地混合,使得捕获珠捕获展示转基因产物的细胞。混合模式可以持续少于100、90、80、60、50或40秒。
可以混合超过一种类型的珠,优选为2种类型的珠,其中一种珠为载体珠,另一种类型的珠为官能化的捕获珠(例如铁磁珠和超顺磁珠)。
为了在反应室内进行均匀混合,可控的磁性装置(多个)(例如在微流体装置的反应室周围排布的电磁体,其被放置于例如
捕获模式:在本发明的内容中,捕获模式描述了在反应室内载体珠捕获捕获珠(其优选地展示附着于其上的细胞)的操作模式。在一种操作循环中,捕获模式可以持续少于100、90、80、60、50或40秒。
通过持续地以循环模式进行操作、但将频率降低至例如0.5至40hz(例如1hz)并将磁力增加至例如300至600ma(例如400ma),所述载体珠将全部围绕所述室缓慢地旋转。它们将“扫描”所述室的体积并捕获捕获珠。载体珠的剩余磁化强度使得它们起到小的永久磁体的作用,并且捕获珠以及可能附着的细胞将吸附并结合在载体珠上。在以下的步骤中将描述用于将所述复合物捕获至所述室的角落的这种制备过程。
固定模式:在本发明的内容中,固定方面描述了一种操作模式,在该操作模式中,载体珠、捕获珠和细胞的复合物位于反应室的多个位置处,例如在洗涤步骤中,所述位置允许其他流体移动通过反应室而不会使所述复合物由所述室移位。在一个操作循环中,固定模式可以持续少于100、90、80、60、50或40秒。
在0hz和高磁力(例如300至600ma,例如400ma)下,微流体装置的磁性装置(极性)现在作为永久磁体操作,例如2×2。结合的载体珠和捕获珠将保持在室的角落,从而使新的溶液(例如处于悬浮液或洗涤缓冲剂中的细胞)被泵送至室中,以及将存在于室中的溶液(例如不需要的细胞)泵出所述室。
珠分离模式:在洗涤步骤之后,对于步骤1中的混合模式实施珠的分离,同时高频率(例如40hz-500hz,例如100-150hz)使得载体珠由捕获珠上分离。所述珠优选地适用于与混合模式相同的或类似的空间分布,即,载体珠在所述壁的附近循环,而捕获珠在所述室的中间更缓慢地移动。
关于混合模式,一个操作循环的珠的操作模式可以持续少于100、90、80、60、50或40秒。
回收模式:在所述珠被分离后,采用“珠的固定”模式。在这种模式中,由所述反应室回收/洗脱包含所关注的细胞的捕获珠或仅仅所关注的细胞(在丧失它们的磁性标记后),同时将载体珠固定于所述室中。在一个操作循环中,回收模式可以持续少于80、60、50、40、30、20、10、5、4、3、2秒。
回收模式可以在例如40hz-500hz的高频率(例如100hz)和30-300ma的中等磁力(例如100ma)下完成。在短时间(1-50s,例如3s)内施加高频率和中等磁力,以确保仅载体珠具有足够的时间迁移至所述室的角落,这是由于它们对磁场具有强烈的应答。施加例如100hz频率使得捕获珠的内部磁矩响应于磁场的取向而转换方向,这防止捕获珠迁移至室的角落。然后,载体珠将保持悬浮在室的中间,从而通过将空气泵送至室中而对载体珠和所结合的细胞进行洗脱。
与捕获的细胞(例如磁性标记的细胞(mlc))结合的磁珠可以经过进一步的分离。在该分离过程中,当由于蛋白质由(其介导了在磁珠上的附着)所述细胞释放(分泌)而使得磁珠不再附着于蛋白质上时,所述细胞与磁珠分离。在少于48hr(优选为少于36hr或者甚至更优选地少于24hr)内不再附着于磁珠上的细胞此后与丧失磁珠的细胞分离。在少于48hr(少于36hr或者少于24hr)内丧失磁珠的细胞分选为高生产型/分泌型细胞或极高生产型/分泌型细胞/对此进行检验。
将表达蛋白质的治疗细胞分选的试验工作
本发明详细地描述了可以基于分泌型cho细胞的标记使用与荧光分子、生物素分子或磁性微粒缀合的抗体快速且高效地捕获哺乳动物细胞的方法的研发,从而说明本发明,其中所述哺乳动物细胞分泌高量的重组治疗剂。
之前已经显示将cho细胞置于20℃或4℃下会短暂地干扰分泌,这样分泌的蛋白质便在细胞表面上展示至多24小时。针对分泌的蛋白质的荧光抗体可以用于以与蛋白质展示潜力成比例地标记细胞(sen,huetal.1990,brezinsky,chiangetal.2003,pichler,hesseetal.2009)。
因此,评估类似的方法,由此标记不仅展示、而且实际上还分泌治疗性蛋白质的cho细胞:在themagphasetm选择性盒的反应室内使用磁颗粒标记细胞。该方法依赖于直径为1-10μm的磁颗粒。受控的磁场及其对磁颗粒混合的作用形成了themagphasetm系统的基础,该系统被设计用于混合所述细胞和颗粒,使得细胞与磁颗粒结合从而形成磁性标记的细胞,并分选和固定最高磁性标记的细胞。其他细胞通过magphasetm泵操作的通道洗走。然后,高表达的细胞和颗粒被磁场释放,最终高生产型细胞由themagphasetm反应盒洗脱至无菌且一次性的细胞培养皿中。感谢操作所述盒的微流体输入和输出的、计算机控制的磁场和泵,可以适应该工艺,并优化该工艺以达到快速自动化的细胞处理,从而可以在几分钟内(例如少于30分钟、少于20分钟或少于10分钟)处理超过100000、优选的一百万或几百万个细胞的群体。
1.作为参照的稳定转染的cho细胞系的生成
为了有利于方法的研发,以及评估细胞分选的性能,设计第一报告细胞,其表达治疗性蛋白质(即,免疫球蛋白)以及荧光报告蛋白质,从而更容易追踪分泌抗体的细胞。使用用于治疗免疫球蛋白γ(igg)和抗生素选择标志物的表达载体、以及编码荧光蛋白质(“增强的绿荧光蛋白质”或“增强的蓝荧光蛋白质2”(egfp或ebfp2))的质粒共转染cho细胞。通过facs,基于bfp和表面igg展示将稳定表达各种水平的免疫球蛋白的多克隆群体分选,随后针对igg的生产通过elisa评估(图1)。在重复试验中,通过有限稀释法来选择共表达gfp和igg、或者bfp和igg的单克隆cho细胞群体(例如细胞克隆子)。通过elisa测试来评估igg分泌。选择表达各种水平的表面igg、但具有低/中等水平的igg生产的克隆子作为参照细胞群体。
生成以下细胞系并用作参照(图2):
-cho-m悬浮细胞(无igg,无gfp);
-f206-igg+,gfp+:高igg展示型和high生产型,所需的克隆子;
-bs2-igg+bfp+:中等igg展示型,中等igg生产型,不需要的克隆子;
-blc-lgg+bfp+:高igg展示型,中等igg生产型,不需要的克隆子;
-bhb-lgg+bfp+:极高igg展示型,中等igg生产型,不需要的克隆子。
有趣地,这些克隆子的特征表明图2a中评估的那样,短暂展示蛋白质不能与实际分泌速率良好地相关,如通过效价和细胞的特定生产率所示(图2b和2c)。这表明所述分选方法应该能够区分合适的蛋白质分泌以及仅在重组细胞表面展示但不从表面释放(“脱落”)的蛋白质。
2.使用磁颗粒进行人工细胞捕获测试的证明
将既不表达igg也不表达多种已知水平的igg的细胞群体与得自f206克隆子的定义数量的细胞混合,其中所述f206克隆子分泌大量的曲妥单抗治疗igg和共表达gfp。将所述细胞与生物素缀合的二级抗体温育,其中所述二级抗体与人类igg的恒定部分结合,并且随后使磁性微颗粒与链霉亲和素(dynabeadsmyone
3.使用magphase微流体装置对表达抗体的细胞进行捕获的原理
一旦建立人工捕获工艺,则在themagphasetm装置中实施,从而试图捕获表达治疗人类igg的cho-m
themagphasetm设备必须适用于单次用途的盒,该盒被设计用于包含微通道以及加载磁珠的50μl反应室。图5显示了所用的盒设计,其针对无菌分选和活细胞回收进行了特定的优化。所述盒被设计成可以加载不同的溶液(处于悬浮剂、洗涤缓冲剂中的细胞);以及用于磁颗粒的混合,洗掉不表达的细胞,最终洗脱与磁珠结合的细胞。用于人工捕获的整个工艺适用于以完全自动化的模式工作,从而显著地减少试验时间和污染风险。
人工捕获方案使用超顺磁珠,其具有无剩余磁化强度以及一旦磁场被除去起到非磁性颗粒的优点(图6)。因此,在本发明的内容中,由于超顺磁珠可以完全再悬浮于溶液中,以及一旦抗体由细胞表面上脱离,则细胞便可以由所述超顺磁珠上释放(其可以在37℃下在大约24h后发生),所以对于细胞分选应用而言,超顺磁珠是优选的(图7)。
然而,使人工分选方案适用于themagphasetm装置提出了很多问题:在人工捕获方案中使用的超顺磁珠不能通过themagphasetm装置的电磁极操纵,这是因为其电磁体产生了比手持式永久磁体更低强度的磁场(图6)。由于铁磁珠的剩余磁化强度和对磁场的强烈应答,其良好地从事themagphasetm技术,并且它们可以在所述盒室中以多种操纵模式操作。
将已知发挥magphasetm作用的链霉亲和素涂覆的铁磁珠与表达并分泌igg的细胞混合,其中所述细胞已经使用生物素化的抗igg抗体标记,从而捕获表达igg的细胞。然而,铁磁性微珠的剩余磁化强度导致它们相互吸引,并形成诱陷细胞并杀死它们的聚集体(图8)。
此外,在将聚集体放置于培养物中后,所述细胞不能由所述珠上释放(数据未示出)。
因此,可以使用2种类型的磁珠的混合物。该方法可以在非官能化的铁磁珠存在下在magphasetm中处理官能化的超顺磁珠,如下文所示。
初步尝试不能进行最佳细胞的分选,但是可以不考虑蛋白质的表达水平而介导细胞的分选。因此,所述工艺必须改善,从而仅保留高表达的细胞。我们评价了改变多种参数,例如多种magphasetm操作模式的频率和磁场强度,细胞和颗粒的效价,高生产型与一般细胞群体的比例,二级抗体的选择,捕获条件,磁性混合速度和持续时间,以及磁性标记的细胞的洗脱条件。
4.适用于magphase操作的磁珠的识别
在这些研究中检验各种类型的市售可得的微珠和珠的比例,从而识别在通过magphasetm进行适当处理方面以及在与cho细胞发生特异性和非特异性相互作用方面给出最佳结果的条件。这些包括:
铁磁性微珠:
-chemicelltmfluidmag(直径为5.0μm);
-chemicelltmsimag(直径为1.0μm或2.0μm)。
超顺磁微珠:
-dynabeadstmm2802.8μm;
-dynabeadstmmyonet11.0μm;
-ademtechtm300nm。
可以视觉区分所述盒内的多种类型的微珠,这是因为它们展示不同的颜色,即,铁磁珠为黑色,而超顺磁dynabeadstm为浅褐色。在magphasetm操作过程中视觉检查微珠表明在设定条件下铁磁性微珠与超顺磁微珠的最佳体积比为大约1:10,从而用于所述室内超顺磁珠均匀的且温和的混合,并且铁磁珠的体积为1至5μl。使用更多的铁磁珠难以在超顺磁珠混合时保持它们接近所述壁。使用较少的铁磁珠难以高效地抓取超顺磁珠并且在洗涤过程中将它们固定在所述盒的壁上,导致超顺磁珠结合的cho细胞损失。
20-30μl包装的超顺磁珠的体积是基于我们用于人工细胞分离的方案。发现对于50μl室体积而言,合适的细胞密度为大约1.0x107细胞/ml。所述珠与所用的细胞的比例根据制造商的建议,例如在6.5x108珠/ml下使用2.8μmdynabeadstmm-280(invitrogen,#60210),而在9x109珠/ml下使用1.0μmdynabeadstmmyonet1(invitrogen,#65601)。由于themagphasetm室体积为50μl,并加载包含1x107细胞/ml的样品,因此对于m-280珠而言,20μl超顺磁珠给出珠:细胞的比例为26:1,而对于myonet1珠而言,20μl超顺磁珠给出珠:细胞的比例为360:1。考虑到大量珠的直径和差异,我们确定等量的myonet1珠具有m-280珠的接近2倍的表面,因此具有比m-280珠优异的能力。
使用0-400hz和0-500ma的magphasetm操作范围来检验珠。然而,对于通过magphasetm对磁性微珠进行适当的处理需要最佳的条件。例如在适当定义的条件下,铁磁珠围绕着所述室的壁循环并且不会定位于所述室的中心部位,而超顺磁珠以温和的模式在整个所述室中混合,并且具有覆盖整个室体积的广泛的空间分布。当这些优化的条件建立起来时,其在以下部分5中取得下文定义的“珠分离模式”。然而,发现最佳的条件根据微珠的类型和尺寸而改变,并且通过magphasetm进行适当的处理可以仅使用特定类型的微珠和操作条件而取得,如以下部分所述。
超顺磁珠:
dynabeadstmm-280和myonet1:二者均可以在多种magphasetm操作模式过程中在铁磁珠存在下操作。然而,由于myonet1珠显示更好的空间再分配,所以选择myonet1珠。与m-280相比,myonet1较弱的磁化强度有利于由铁磁珠上解离以及在工艺结束时的回收。还发现对于与cho细胞的结合而言,myonet1的1.0μm的尺寸可以比2.8μm微珠更特异性的相互作用。
ademtechtm300nm:这些珠不适用于自动化的分离,这是因为它们的磁化强度太弱,使得它们难以被铁磁珠抓取和固定化。
铁磁珠:
chemicelltmfluidmag5.0μm:它们比chemicelltmsimag磁性更弱,但是在定义范围的频率和磁力(例如100-200hz和200-300ma)下,它们提供了高效的混合。对于这些铁磁珠而言,如下文所述,最佳混合条件定义为150hz和200ma。在这种条件下,它们围绕室壁循环,并且在混合或细胞捕获模式下,提供超顺磁珠的均匀的且快速的空间再分配,如以下部分所述。然而,chemicellfluidmag必须涂覆一层淀粉,由此减少它们与不表达的cho细胞(其非特异性地与这些珠的二氧化硅表面结合)的结合。
chemicelltmsimag1.0μm和2.0μm比fluidmag具有更强的磁性,因此在更广泛的magphasetm参数范围(例如50-300hz和200-400ma)内可以进行高效的混合。然而,最佳条件定义为100hz和300ma,并且这些微珠为“珠分离模式”和“回收模式”中,如以下部分所述。在这种条件下,这些珠在混合室壁的附近循环,并且在所述室的角落中比fluidmag珠更快地重新组合,从而降低与铁磁珠一起诱陷和固定超顺磁珠的可能性,由此得到比fluidmag珠增加的细胞回收。
5.建立和优化magphase操作参数
可以在5个步骤中描述用于在分离高表达细胞的themagphasetm室中混合铁磁性颗粒和超顺磁颗粒的新方法的工艺:
混合模式(图9):在这种模式中,将2种类型的珠分别混合。为了均匀地混合,人们需要操作在循环模式下的4个magphasetm电磁体(中等至高频率(例如100hz),以及高磁力(例如300ma))。这确保铁磁珠围绕所述室在壁的附近旋转,同时超顺磁珠在所述室的中间以温和的模式分散和旋转。为了得到超顺磁珠的理想的空间再分配,按照以下模式连续地活化电磁体:顺时针旋转1s,然后逆时针旋转1s,接着顺时针旋转10s。这种混合模式用于温育捕获珠(在本发明中为具有细胞的超顺磁珠),从而捕获表达的细胞,以及还用于洗涤步骤。
捕获模式(图10):通过将themagphasetm操作模式保持为循环模式,但是将频率降低为1hz并增加磁力(例如400ma),铁磁珠均围绕所述室缓慢地旋转。它们“扫描”室体积并捕获超顺磁珠。铁磁珠的剩余磁化强度使得它们起到小的永久磁体的作用,并且超顺磁珠以及可能附着的细胞将被吸附并与它们结合。在下一步骤中描述用于将这些复合物保持在所述室的角落的这种制备方法。
固定模式(图11):在0hz和高磁力(例如400ma)下,magphasetm的电磁极现在作为2×2永久磁体操作。结合的铁磁珠和超顺磁珠保持在所述室的角落,从而将新溶液(处于悬浮液或洗涤缓冲剂中的细胞)被泵入以及将在所述室中存在的溶液(例如不需要的细胞)泵出。
珠分离模式(图12):在洗涤步骤之后,按照步骤1中的混合模式实施珠的分离,并且高频率(100-150hz)使得超顺磁珠由铁磁珠上解离。所述珠采用与混合模式相同的空间胚布,即,铁磁珠在壁的附近循环,而超顺磁珠围绕所述室的中间更缓慢地移动。
回收模式(图13):在所述珠经分离后,“珠的固定”模式采用100hz频率和100ma磁力。短时间内(3s)施加高频率和中等磁力,以确保仅铁磁珠具有足有时间迁移至所述室的角落,这是由于它们对磁场具有强烈的应答。施加100hz频率使得超顺磁珠的内部磁矩响应于磁场的取向而转换方向,这防止超顺磁珠迁移至所述室的角落。然后,超顺磁珠保持悬浮在所述室的中间,从而通过将空气泵送至所述室中而对超顺磁珠和其结合的细胞进行洗脱。
高效地富集表达igg的细胞需要特定的操作模式,其可以通过优化themagphasetm细胞捕获工艺的各个步骤和参数而凭经验来确定。本领域的技术人员将理解这些操作模式,这些操作模式一旦被确定,例如在反应室的尺寸或电磁体的构造被改变时,便可以容易地调节。
首先优化洗涤模式。f206细胞与bs2细胞以50:50的比例混合,或者与blc细胞以30:70的比例混合。将所述细胞混合物与生物素化的抗iggkpl抗体温育,并使标记的混合物经过magphasetm捕获以及不同的洗涤模式,即,在给定的整体条件和特定的设备下,所发现的是“最佳”模式(120hz,300ma),或者“快”(200hz)、“强”(400ma)或“快+强”(200hz,400ma)模式。将20μl超顺磁珠(myonet1dynabeadstm,链霉亲和素涂覆的,1.0μm)和2μl铁磁珠(chemicelltmfluidmag/mp-d,5.0μm,淀粉涂覆的)预加载至混合室中。所有其他的参数为图9至13种的缺省参数。最佳洗涤模式可以由bs2细胞中2倍富集f206细胞,以及由blc细胞中2.5倍富集f206细胞(图14b)。2个试验显示“快”和/或“强”的洗涤模式使得所需的f206细胞损失,由此得到较低的富集。这首次表明分泌高水平igg的细胞(f206)可以与以较低水平表达的bs2细胞分离,并且与在其表面上展示高水平igg、但是不高效地分泌igg的blc细胞分离(图2)。在以下测试中使用这种最佳的洗涤模式。
其次,在themagphasetm分选工艺中优化细胞的捕获时间。将1μlchemicelltmsimag1.0μm珠和20μlmyonet1dynabeadstm预加载于混合室中。将f206细胞与不表达的cho-m细胞以10:90的比例混合。使生物素化的抗igg标记的细胞混合物经过magphasetm捕获,并且温育不同的时间,2s至5min。就由cho-m细胞得到的回收的f206细胞的百分率而言,2s、5s和20s的温育时间均得到5倍的富集(图15a)。关于回收的f206细胞的产率,5s的温育显示在所有检验的条件中均得到最高的产率,其比例如2s的温育而得到的产率高2倍(图15b)。该测试还显示温育时间越长,f206富集的比例越低,这最可能是由于cho-m细胞的非特异性结合增多,如图15b所示。
最后,测定铁磁珠与超顺磁珠之间的最佳比例。如上文所述,将f206余cho-m细胞混合,并预标记。在混合室中,预加载1或2μlchemicelltmsimag1.0μm,以及5μl、10μl、20μl或30μlmyonet1dynabeadstm。如图16a所示,比例为1:30的铁磁珠与超顺磁珠显示由cho-m细胞最高地富集f206(即,5倍)。当铁磁珠增加至2μl时,与使用1μl铁磁珠获得的结果相比,f206细胞富集为一半(图16b)。这可能是由于之前检测的不表达的cho-m细胞与铁磁珠的非特异性结合。
6.使用magphase富集表达蛋白质的细胞
使用优化的magphasetm细胞捕获过程,我们进一步分析由不表达的细胞(cho-m细胞)以及由中等、高或极高的igg展示型细胞(即,分别为bs2、blc和bhb细胞,参见图2)得到的高展示型细胞(即,f206细胞)的富集潜力。
我们首先检验magphasetm对f206和cho-m细胞混合物的作用,其中f206:cho-m的比例为8:92。使用在混合室内预加载的20μl超顺磁珠(myonet1dynabeadstm,链霉亲和素涂覆的,1.0μm)和2μl铁磁珠(chemicelltmfluidmag/mp-d,5.0μm,淀粉涂覆的)的组合,与输入的细胞混合物相比,magphasetm在回收中能够富集6倍的f206细胞(图17a)。当对于输入物而言,将高生产型f206细胞与不表达的cho-m细胞的比例设定为40:60时,f206相比的产率在themagphasetm处理后增加至73%,而f206细胞的比例的增加的倍数降低至2倍(图17b)。该结果可以通过超顺磁珠被f206细胞饱和来解释,表明在这些条件下,捕获的上限相当于高表达细胞的大约70%。
使用相同的铁磁珠和超顺磁珠的比例以及magphasetm操作模式,我们接着检验magphasetm由中等或高展示bs2、blc和bhb细胞富集高分泌型/生产型f206细胞的能力。当将f206细胞与bs2细胞在输入物中以40:60的比例混合时,magphasetm得到2倍富集的f206细胞(图18a),这与在输入比例为40:60时由cho-m细胞富集的f206结果类似(图17b)。同样地,当f206细胞与blc细胞在输入物中以30/70的比例混合时,通过magphasetm由blc细胞2倍富集f206细胞(图18b),这与由f206细胞观察到的较高的分泌率良好地相关。当将高分泌型/生产型f206细胞与极高的展示型bhb细胞以40:60的输入比例混合时,magphasetm不能富集f206细胞(图18c)。这与以下事实良好地相关:即使bhb细胞不分泌较高量的igg,bhb细胞也比f206细胞展示高得多的量的igg,并由此为高展示型但非高分泌型细胞(图2)。总之,我们推断在中等或低生产型细胞中,magphasetm可以选择性地富集高分泌的细胞,并且这还促使我们进一步优化细胞分选工艺的选择性。
为了比较使用themagphasetm自动化捕获相对于人工捕获所获得的捕获效力,使生物素化的抗igg抗体标记的f206/cho-m细胞(10:90比例)和f206:bs2细胞(40/60比例)经历magphasetm或人工捕获。就输入物中f206细胞百分率增加的倍数而言,与通过人工捕获得到的9倍富集相比,magphasetm由cho-m细胞中5倍富集f206细胞(图19a)。然而,在较高生产型细胞与中等生产型细胞的混合物的更有用的情况(其可以由稳定的转染获得,为了分离高表达型细胞)中,magphasetm比用于由bs2细胞分选f206的人工捕获产生显著更好的性能(图19b)。这表明magphasetm除了需要更短的时间以及试验者更少的处理和努力以外,可以提供比人工工艺更有选择性的分选高生产型细胞。
7.magphase无菌捕获由单克隆细胞群体富集展示igg的且高分泌型的细胞
7.1magphase无菌捕获以及捕获的细胞/珠的分离定时优化
由于已经建立的是magphasetm能够由不表达的或中等表达的细胞富集抗体高表达型细胞,所以我们首先检验所述捕获是否是在无菌环境下实施的。为此,在层流罩下通过使用16ml8%javal溶液(reactoltmlab,#99412),16ml10%contrad90溶液(socochimtm,#decon90)和32ml无菌milli-q水洗涤,首先对初始magphasetm机器的内部流体处理微流体通道进行无菌处理。在后期阶段,以及当研发优化的工艺和一次性盒设计时,通过γ-辐射(24kgray)对所述盒进行无菌处理,然后进行捕获。
使用10:90至20:80比例的f206和cho-m细胞混合物的输入物,并使用图17所示的参数,使这些输入物经过magphasetm无菌捕获。由于我们之前的检验已经证明由magphasetm洗脱的细胞的活力通过cb5营养混合物增加,所以将由magphasetm捕获回收的细胞和珠、以及输入细胞的等分物作为对照,放置于具有5%cellboost5补充剂(cb5,hyclone,thermoscientifictm,#sh30865.01)的培养物中。使用手持式磁体,在捕获后的第1天将magphasetm捕获的细胞与释放的珠分离,从而仅回收在由magphasetm洗脱后的1天自发与所述珠解离的细胞。将回收的细胞放回至不具有抗生素选择而具有cb5的培养物中,达16天,然后分析在回收的细胞表面上展示的igg(图20a)。所述培养时间确保缺乏微生物污染,并由此意味着所述捕获在无菌条件下成功地实施。
7.2用于magphase无菌捕获的预培养条件的优化
当在使用magphasetm进行无菌捕获后使用cb5供料处理输入细胞时,与未经过magphasetm无菌捕获的输入细胞相比,在第1天回收的细胞5.6倍地富集f206细胞(图20a)。这种富集符合使用相似输入细胞混合物的组合物的magphasetm非无菌捕获所获得的结果(图17a)。然而,当在magphasetm分选之前在5%cb5补充剂存在下预温育输入的f206和cho-m细胞混合物时,在第1天分离的细胞仅2倍富集f206细胞(图20b)。当进一步培养细胞与珠的剩余混合物直至第3天时,在回收由所述珠解离的细胞之前,得到类似的发现。这表明当在细胞分选步骤之前加入供料时,其干扰了细胞的捕获。
通过在分选工艺之前重复实施人工或magphasetm装置介导的f206细胞的捕获来直接评价这种可能性,其中所述f206细胞是在培养物的培养基中加入cb5供料或未加入cb5供料的条件下培养的。此外,与无cb5情况下进行的预培养物相比,预培养物中cb5的存在显著地(p<0.01)降低了输出物中f206细胞的成倍增加,并且对于2种捕获方法而言均是如此(图20c)。这些结果表明预培养物中cb5的存在非常可能干扰f206细胞与磁珠的相互作用,因此,在themagphasetm捕获之前,应该在不具有cb5的条件下培养所述细胞。一种可能的解释可以是所述供料包含生物素,由于其会干扰细胞结合的生物素化的抗体与链霉亲和素涂覆的磁珠的相互作用。另一种结论在于细胞应该在具有一定的生物素浓度的培养物的培养基中培养,其中所述生物素的浓度不超过10μμ,并且优选地低于3μμ或0.1μμ的生物素(其包含在cdm4cho或本申请评价的定制细胞培养物的培养基中)浓度。
接着评估magphasetm介导的细胞捕获是否将洗脱的群体富集成分泌高量的治疗igg的细胞。进行如此评估是因为themagphasetm分选过程依赖于igg在细胞表面的短暂展示,但是这不是与高水平的igg的分泌必须相关的。事实上,图2的bhb和blc细胞与f206细胞相比不分泌极高水平的igg,但是通过细胞表面染色,它们确实展示高水平或极高水平的igg。通过培养在图20b的第1天或第3天回收的细胞以及未分选的细胞进行上述评估,然后在分选后的第10天在培养物上清液中定量分泌的igg。
igg阳性f206细胞的百分率类似于分选后的第1天或第3天,并且它们比未经过magphasetm处理的对照细胞高2-3倍(图21a)。然而,在第1天洗脱的细胞比对照细胞分泌3倍于以上的igg,而第3天的细胞仅分泌第1天分泌的igg的量的大约一半(图21)。这些结果表明第1天分离的细胞展示高量的igg,而且还快速地将其释放至培养基中,而第3天分离的细胞相当于在其表面上良好地展示igg、但未高效地释放igg的细胞,因此并非极其良好的分泌型细胞。因此,在本发明的背景下,在magphasetm捕获后的第1天进行细胞的洗脱是回收igg高分泌型细胞的最佳时机。因此,使用magphasetm分选高展示型细胞以及与细胞从磁珠释放的最佳时机可以用于选择具有所需性质的细胞,在这种情况下,所需性质是分泌高量的治疗性蛋白质。此外,本领域的任一技术人员显而易见的是magphasetm背景和操作模式可以适用于优选地回收中等、低或不表达的细胞。
8.magphase无菌捕获由多克隆群体富集分泌igg的细胞
上文中,已经针对表达igg的细胞的富集效力在参照单克隆细胞的混合上检验了themagphasetm装置和方法。我们接着想确定magphasetm是否还可以由包含许多广泛变化的表达水平的多克隆群体富集分泌大量igg的细胞。为此,进行无菌magphasetm捕获,从而由稳定表达治疗曲妥单抗抗体的细胞的多克隆群体捕获分泌大量igg的细胞。
如图22a所示,当在不具有cb5的情况下培养捕获的细胞时,与对照细胞相比,在第1天洗脱的细胞群体中,中等以及高igg展示型细胞增加3倍。但是,从第4天洗脱开始,中等或高展示型细胞未富集。如之前所述,在特定的生产率方面得到类似的结论,这是因为尽管在细胞的预培养物中不利地存在cb5补充剂,但是对于第1天分离的细胞而言,得到了最佳分泌的细胞,其比对照细胞分泌2.6倍以上的igg(图22b)。
综上,结论是在一次性和单次用途的盒的无菌环境下,magphasetm可以高效地分选细胞,并且能够由异源多克隆群体富集分泌高水平治疗性蛋白质的细胞。此外,在magphasetm细胞分选后,将cb5加入至捕获细胞的培养物中会进一步增加在捕获后第1天回收的最佳分泌型细胞。
9.使用单克隆抗igg抗体进行magphase无菌捕获
由于血清衍生的多克隆二级抗体的使用不适用于制药环境,所以我们进一步探索使用生物素化的抗igg单克隆抗体(mab)用于themagphasetm捕获工艺的可行性。如图23a所示,在themagphasetm细胞捕获工艺中可以检验2种不同的单克隆抗体。在不具有cb5的条件下培养捕获的细胞时,与对照细胞相比,使用themabtechtm单克隆抗体在第1天会2倍地富集中等和高的igg展示型细胞(图23a)。当在包含cb5的培养基中培养使用mabtechtmmab捕获的细胞时,在第1天分别获得增加1.4倍和1.6倍的中等和高的展示型细胞(图24b)。在细胞捕获过程中,使用acrismab获得较低富集的中等和高的展示型细胞。相应地,当使用mabtechtmmab时,捕获的细胞的igg特定生产率较高,产生了比在cb5供料存在下洗脱细胞时的对照细胞高2倍的生产率(图24c)。综上,这些测试表明单克隆抗体可以用于magphasetm基无菌捕获,并且由多克隆群体富集高分泌型细胞。
10.新的magphase富集表达抗体的细胞
已知形式的themagphasetm分选工艺涉及通过泵入去污溶液而进行的magphasetm的灭菌处理。在这些已知的工艺中,微流体通道并非单次用途的,由此具有污染风险,从而使它们不能与用于制药应用的细胞分选相容。此外,本发明提供了新一代magphasetm机器和盒,其用于活细胞的无菌分选,从而可以在单次用途的无菌盒所包含的且定义的环境中处理所有的液体和细胞处理过程。
在盒的构成材料和设计的多种尝试和改进后,我们发现使用聚甲基丙烯酸甲酯(pmma)制备的并具有聚碳酸酯pc覆盖薄膜的盒良好地发挥无菌细胞捕获工艺。最终的盒的设计示于图5和图25中。
当kpl多克隆抗体用于标记输入细胞群体时,与使用最初的magphasetm设计得到的2.4倍的富集相比,改进的magphasetm装置在第1天由cho-m细胞显著地富集f206细胞(增加5倍)(图24a)。第6天分离的细胞与第1天分离的细胞具有相似的富集patent。类似地,使用mabtechtmmab的改进的magphasetm也由cho-m细胞得到了显著富集的f206细胞,即,在第1天和第6天分离的细胞中分别富集2.8倍和3.6倍(图24b)。这些发现表明使用多克隆kpl抗血清或themabtechtm单克隆抗体的改进magphasetm设计的改进的性能。
综上,提出了包含结合的盒和操作工艺的新型微流体装置,其可以富集表达并分泌较大量治疗性蛋白质的细胞,这些细胞处于无菌、可内含、细胞活力相容的和一次性使用的管内,如处理生产人用治疗性蛋白质的细胞所需。考虑到之前利用以前可用的方法无法富集特别是高生产型细胞,由于以前报道的人工或半自动化非流体方法仅能够分离表达细胞和非表达细胞,因此,这些结果是出乎意料的。与现有技术相比,目前的magphasetm背景的另一个优点在于其为完全自动化的且极快速的工艺(采用magphase,大约5分钟自动化的操作;相比之下,至少45min实际动手操作用于人工分选),节省时间和操作者的努力,并且急剧降低与本领域已知的非包含在内的细胞分选环境有关的污染风险。
应该理解的是可以以多种实施方案的形式引入本发明的方法和装置,仅一些实施方案在本发明中公开。对于技术人员显而易见的是存在其他的实施方案,并且这些实施方案不脱离本发明的精神。因此,所述实施方案是示例性的,不应该解释为限定性的。
参考文献
[01].brezinsky,s.c,g.g.chiang,a.szilvasi,s.mohan,r.i.shapiro,a.maclean,w.siskandg.thill(2003)."asimplemethodforenrichingpopulationsoftransfectedchocellsforcellsofhigherspecificproductivity."jimmunolmethods277(1-2):141-155.
[02].caron,a.w.,c.nicolas,b.gaillet,i.ba,m.pinard,a.gamier,b.massieandr.gilbert(2009)."fluorescentlabelinginsemi-solidmediumforselectionofmammaliancellssecretinghigh-levelsofrecombinantproteins."bmcbiotechnol9:42.
[03].galbete,j.l,m.bucetaandn.mermod(2009)."marelementsregulatetheprobabilityofepigeneticswitchingbetweenactiveandinactivegeneexpression."molbiosvst5(2):143-150.
[04].girod,p.a.,d.q.nguyen,d.calabrese,s.puttini,m.grandjean,d.martinet,a.regamey,d.saugy,j.s.beckmann,p.bucherandn.mermod(2007)."genome-widepredictionofmatrixattachmentregionsthatincreasegeneexpressioninmammaliancells."natmethods4(9):747-753.
[05].lefournv,girodpa,bucetam,regameya,andmermodn.(2014).chocellengineeringtopreventpolypeptideaggregationandimprovetherapeuticproteinsecretion.metab.eng.,21:91-102.
[06].leyd,harraghyn,lefournv,bires,girodp-a,regameya,rouleux-bonninf,bigotyandmermodn.(2013).marelementsandtransposonsforimprovedtransgeneintegrationandexpression.plosone,8:e62784.
[07].pichler,j.,f.hesse,m.wieser,r.kunert,s.s.galosy,j.e.mottandn.borth(2009)."astudyonthetemperaturedependencyandtimecourseofthecoldcaptureantibodysecretionassay."jbiotechnol141(1-2):80-83.
[08].sen,s.,w.s.huandf.srienc(1990)."flowcytometricstudyofhybridomacellculture:correlationbetweencellsurfacefluorescenceandiggproductionrate."enzymemicrobtechnol12(8):571-576.
- 还没有人留言评论。精彩留言会获得点赞!