抗凝血酶活性检测试剂及其制备方法和应用与流程
本发明属于生物学检测技术领域,涉及一种抗凝血酶活性检测试剂及其制备方法和应用。
背景技术:
一、人体的止血(凝血)机制
止血(凝血)机制是人体的一项非常重要的自我保护功能,止血(凝血)机制包括凝血和抗凝两个方面,两者间的动态平衡是正常机体维持体内血液流动状态和防止血液丢失的关键,它能在血管受伤破损时通过血小板的凝聚来封闭血管的伤口从而防止大量的血液流失。止血(凝血)过程是一系列凝血因子被相继酶解激活的过程,止血(凝血)过程最终生成凝血酶,形成纤维蛋白凝块。尤其止血(凝血)过程是一个被精准调控的过程,血小板的凝聚既要有一定的量来保证封闭住血管的伤口又不能凝聚过多反而堵塞血管。机体的正常止凝血,主要依赖于完整的血管壁结构和功能、有效的血小板质量和数量,以及正常的血浆凝血因子活性。
这样一个复杂的精准调控的过程分为:初期止血、二期止血、三期止血,是由血小板、血管壁和一系列凝血因子和纤维蛋白溶解因子共同参与和相互作用完成的。初期止血涉及受损血管的收缩、内皮下胶原组织的暴露以及血小板在受损血管表面的粘附、聚集和形成初期止血栓。由于它们在强度上还不足以抵抗血液在血管中流动所产生的剪切力带来的冲击,故人体止血(凝血)机制还需要纤维蛋白凝聚物的进一步结合作用和稳定作用才能够完成封闭住血管的伤口的任务。二期止血是指在形成初期止血栓的部位进一步形成纤维蛋白凝块的过程。纤维蛋白凝聚物的产生是一个复杂的过程。血管壁受伤破损导致一系列凝血因子的活化,通过凝血瀑布的传递活化了因子(即凝血因子)X,活化因子X(以下简称FXa)进一步把凝血酶原活化为凝血酶。凝血酶是一种多功能的蛋白酶,它在止血过程中非常关键,是一个处于核心地位的凝血因子。它把纤维蛋白原转化为纤维蛋白,纤维蛋白随后多聚体化形成纤维蛋白凝聚物。纤维蛋白凝聚物通过和血小板凝聚物细胞膜表面上蛋白的进一步作用来稳定它们增加它们的强度。这样才能封闭住血管的伤口防止血液更多流失。当血管的伤口愈合修复时,血液中的纤维蛋白溶解过程启动来除去这些纤维蛋白凝聚物避免血管堵塞以及其它的危害。三期止血是由血小板聚合物、纤维蛋白丝和陷入的红细胞所组成的疏松的网状物,通过此过程形成了牢固的凝血块。在正常情况下,血管没有受伤时,血液系统中有一些机制来防止止血过程非正常启动从而引起纤维蛋白凝聚物形成甚至血栓。抗凝血酶(又称抗凝血酶III,英文缩写为ATIII)就是其中重要的一个。
二、血液中抗凝血酶测定的临床意义
抗凝血酶能抑制凝血酶以及其它一些凝血瀑布中的丝氨酸蛋白酶比如活化因子X(FXa),活化因子IX(FIXa)和活化因子XI(FXIa),这些蛋白酶的活性位点和抗凝血酶的反应中心会形成复合物从而这些蛋白酶的活性受到抑制。但是抗凝血酶抑制这些蛋白酶的效率并不高,而当人体内的一些葡萄糖胺聚糖,比如硫酸类肝素在血管壁和抗凝血酶结合时,则会引起抗凝血酶的构象变化导致抗凝血酶抑制这些蛋白酶的效率增加千倍左右。医疗上应用的肝素提取自牛或猪的肠,它被广泛的用作抗凝剂。它和抗凝血酶结合,具有和硫酸类肝素类似的作用,也会极大的增加抗凝血酶抑制这些蛋白酶的效率。
抗凝血酶在防止止血机制过度使用和血栓形成上有重要作用,且抗凝血酶缺失会导致静脉血栓或者肺栓塞症,而抗凝血酶含量或者活性低的个体患上易栓症和形成血栓的危险性也比较高。抗凝血酶缺失有遗传性的也有获得性的:遗传性抗凝血酶缺失症在1965年在一个经常发生血栓性栓塞的挪威家庭发现。正常人的抗凝血酶的活性被定义为100%,通常75%-125%是正常范围,而这类患者的抗凝血酶活性只有正常人的40-70%。获得性抗凝血酶缺失症的原因有多种,包括肝病引起的抗凝血酶合成减少,肾病引起的抗凝血酶流失,使用肝素等药物引起的抗凝血酶损失,以及弥散性血管内凝血引起的抗凝血酶消耗。抗凝血酶缺失症的治疗包括使用肝素、华伐令或者纯化抗凝血酶。无论是遗传性的还是获得性的抗凝血酶缺失症都给患者带来血栓的风险,给他们的健康和生命带来难以预测的威胁。而对抗凝血酶的准确检测则会对抗凝血酶缺失症、易栓症、静脉血栓以及肺栓塞症的及时的诊断和治疗具有重大的意义。
三、抗凝血酶测定的影响因素
据了解,现有的公开的对抗凝血酶的检测大致有三类方法,分别是凝固法、免疫法和以凝血酶为基础的发色底物法。凝固法主要是比较待测血浆和参考血浆在凝血瀑布被相应试剂激活后凝固时间来测定抗凝血酶的活性。虽然凝固法可以直接使用待测血浆也可以将待测血浆加热脱纤维蛋白然后使用,但其操作繁琐而且凝固时间变异较大,不利于准确测算。免疫类方法分为两种,第一种是酶联免疫法。这种方法是在微量滴定板的孔中包被上抗凝血酶的抗体,然后加入不同比例稀释的样本血浆和标准血浆孵育,清洗之后加入辣根过氧化物酶标记的抗抗凝血酶的抗体,再次清洗之后加入辣根过氧化物酶的底物,反应完全后读取吸光度,最后通过标准血浆的吸光度得到标准曲线再推算出标准血浆的抗凝血酶含量。免疫类方法中的另一种方法称为劳瑞尔火箭电泳法,是将抗抗凝血酶的抗体和融化的琼脂混合然后冷却成胶,加上样本血浆和标准血浆后进行电泳,电泳完成后抗原抗体复合物用考马斯蓝染色来检测。不同抗凝血酶含量的血浆形成的抗原抗体复合物具有不同的高度,而其含量和浓度是成正比的。据此可以得出标准曲线和样本血浆中抗凝血酶的含量。;由于上述免疫类方法是手工操作,故不同检测批次间的差异较大,步骤繁琐,准确度不高,且不能进行自动化操作。
第三类方法是以凝血酶为基础的发色底物法。此法是在待测血浆中加入肝素以及过量的凝血酶进行孵育,试剂中的凝血酶在肝素的存在下与待测血浆中的抗凝血酶形成凝血酶和抗凝血酶的复合物,使凝血酶的活性受到抑制。此后再加入凝血酶的发色底物进行孵育,这里的发色底物是由三到四个氨基酸和共价结合在末端的4-硝基苯胺(4-nitroaniline,pNA)组成,其可以被剩余的未被抑制的凝血酶裂解并释放出4-硝基苯胺,这种反应可引起在405纳米处吸光度的变化,而产生的4-硝基苯胺的量是和样品中抗凝血酶的活性成反比的。因此,利用测量405nm处吸光度的变化就可以制作标准曲线并推算出样品中抗凝血酶的活性。
由于该方法灵敏度高、准确性好、检测时间短,能够适用于多种自动化分析仪器,且在国产化检测试剂的发展下,大幅降低了临床检测费用,在临床应用中应用也越加广泛。实际上,虽然此法已在临床应用中广泛使用,但在其测定过程中大多还是有检测结果受血浆中多种干扰物质影响的情况发生。例如,采用以凝血酶为基础的发色底物法测定抗凝血酶活性,如果样品中含有凝血酶抑制剂(如水蛭素、阿加曲班等),将会使检测结果偏高;又如血液中自然存在的肝素辅因子II和肝素结合,可以抑制凝血酶活性,使此法测定抗凝血酶受到肝素辅因子II的影响从而高估样品中抗凝血酶的活性。因此,此法的使用范围受到了一定的限制。
四、现有技术的局限性
为了降低肝素辅因子II的影响,美国专利US5985582和中国专利CN102690862A中,公开了一种抗凝血酶III测定试剂盒(ATIII发色底物法),是以凝血酶为基础的发色底物法进行测定,试剂盒包含肝素衍生物、凝血酶和发色底物试剂;所述试剂在把肝素加入样本前将其进行酶解,裂解出一个或多个不饱和双糖而得到肝素衍生物。这种肝素衍生物仍然具有与肝素类似的和抗凝血酶结合来抑制凝血酶的能力,但是和肝素辅因子II结合来抑制凝血酶的能力却大大降低。这样在样本中加入肝素衍生物而不是肝素就可以将肝素辅因子II对检测抗凝血酶的活性的影响降到很低。但由于其采用了肝素衍生物和进口的凝血酶,且肝素衍生物需要从肝素的裂解得到,这就增加了试剂制作的成本,同时也使试剂制作的步骤变得比较繁琐。由于该技术成本高,因此减少了试剂的用量,体积的缩小可能会引起最后在比色的过程中部分的数值不能显示。并且该现有技术在全自动凝血仪上进行ATIII活性检测时需要更改很多参数,操作不方便,结果也容易出现误差。
另外,中国发明专利申请CN104714036A也公开了一种抗凝血酶III活性测定试剂盒,其也是采用了以凝血酶为基础的发色底物法进行测定,但以凝血酶为基础的发色底物法存在很大的缺陷。该法通过加入外源性凝血酶来分析待测血浆中抗凝血酶的活性,由于待测血浆中自然存在抗凝血酶之外的另一个凝血酶抑制剂——肝素辅助因子II(HCII),因此该法易受待测血浆中HCII的干扰而导致抗凝血酶的测定不准确。因为普通人群的血浆中都自然存在肝素辅助因子II,所以此法所测定的抗凝血酶活性是不准确的。更值得一提的是,此法不能用于使用水蛭素(Hirudin)、阿加曲班(Argatroban)或者达比加群(Dabigatran)的人,因为这些药物均为凝血酶的直接抑制剂,都会使抗凝血酶活性检测结果偏高。
技术实现要素:
针对现有技术存在的上述问题,本发明的目的之一是提供一种抗凝血酶活性检测试剂,可避开待测样本中肝素辅因子II、水蛭素、阿加曲班、达比加群等抗凝血因素的干扰,灵敏度高,稳定性和重复性好。
为实现上述发明目的,本发明提供的技术方案如下:
抗凝血酶活性检测试剂,包括试剂1和试剂2,其特征在于,试剂1为FXa的发色底物,试剂2为含有FXa和肝素的稀释液。
抗凝血酶活性检测试剂,包括试剂1、试剂4和试剂3,其中试剂1为FXa的发色底物,试剂4为FXa,试剂3为含有肝素的稀释液。
优选地,上述FXa的发色底物选自以下底物中的任一一种:
CH3SO2-D-Leu-Gly-Arg-p-nitroanilide·AcOH;
CH3OCO-D-CHG-Gly-Arg-p-nitroanilide·AcOH;
CH 3OCO-D-CHA-Gly-Arg-p-nitroanilide·AcOH;
Benzoyl-Ile-Glu-Gly-Arg-p-nitroanilide·HCl;
Suc-Ile-Glu(γ-Piperidyl)-Gly-Arg-p-nitroanilide·HCl;
N-α-Z-D-Arg-Gly-Arg-p-nitroanilide·2HCl;
Boc-D-Arg-Gly-Arg-p-nitroanilide·2HCl;
Acetyl-D-Arg-Gly-Arg-p-nitroanilide·2HCl;
4-Nz-D-Arg-Gly-Arg-p-nitroanilide·2HCl;
4-Mbs-D-Arg-Gly-Arg-p-nitroanilide·2HCl。
作为优选,上述抗凝血酶活性检测试剂还包括含有抗凝血酶的人血浆校准品。该校准品的制备是将正常健康人血浆收集之后混合,再经冷冻干燥制成。然后用WHO抗凝血酶国际标准品血浆对该校准品进行溯源性定值。此外,也可省略此标准品而提供标准曲线。
如上所述,由于肝素辅因子II和肝素结合后抑制凝血酶但不抑制FXa,且临床上常使用水蛭素、阿加曲班、达比加群或其它凝血酶直接抑制剂来抑制人体内的抗凝血酶,将影响检测结果。
本发明是以FXa为基础的发色底物法,利用抗凝血酶和肝素结合后发生构象变化,再直接和FXa结合后有效地抑制FXa的活性的特点,提供了一种抗凝血酶活性检测试剂,以使发色底物法在抗凝血酶活性检测方面得到更广泛的应用。其检测原理为:在待测血浆中加入肝素以及过量的FXa进行孵育,再加入FXa的发色底物进行孵育。其中,肝素和待测血浆中的抗凝血酶结合,引起抗凝血酶的构象变化后,抗凝血酶会直接和FXa结合,从而抑制FXa的活性。剩余的FXa裂解其发色底物并释放出4-硝基苯胺,而产生的4-硝基苯胺的量是和样品中抗凝血酶的活性成反比的。因此,利用测量405nm处吸光度的变化就可以制作标准曲线并推算出样品中抗凝血酶的活性。
优选地,所述肝素包括普通未分级肝素、低分子量肝素和磺达肝素。
优选地,上述试剂1、试剂2或试剂4为相应的溶液或冻干剂,优选为冻干粉剂。
优选地,上述试剂3为相应的溶液或冻干剂,优选为溶液。
优选地,上述发色底物的工作浓度为0.1~4mM,优选工作浓度为0.5~3mM,最佳工作浓度为2mM。
优选地,上述FXa的工作浓度为0.05~3μM,优选工作浓度为0.1~1.5μM,最佳工作浓度为0.5μM。
优选地,上述肝素的工作浓度为0.1~5IU/ml,优选工作浓度为0.5~3IU/ml,最佳工作浓度为2IU/ml。
工作浓度的定义:在用上述任一试剂检测样本活性的过程中,该试剂的冻干剂采用其复溶试剂复溶后,与稀释样本混合,所形成的分析混合物中各组分的浓度被定义为其工作浓度。
优选地,试剂1由包含发色底物、缓冲剂、无机盐、表面活性剂和防腐剂的混合试剂制成。
优选地,试剂2由包含FXa、肝素、缓冲剂、无机盐、表面活性剂和防腐剂的混合试剂制成。
优选地,试剂4由包含FXa、缓冲剂、无机盐、表面活性剂和防腐剂的混合试剂制成。
优选地,试剂3由包含肝素、缓冲剂、无机盐和防腐剂的混合试剂制成。
更优选地,缓冲剂选自三羟甲基氨基甲烷缓冲液(以下简称Tris缓冲液)或硼酸缓冲液,最佳为三羟甲基氨基甲烷缓冲液(Tris缓冲液)。
更优选地,无机盐选自氯化钠或氯化钾,最佳为氯化钠。
更优选地,表面活性剂选自聚乙二醇-8000或吐温-20,最佳为聚乙二醇-8000。
更优选地,防腐剂可选择本领域技术人员已知的防腐剂,如Proclin 300或叠氮钠,最佳为叠氮钠。
优选地,FXa选自人、牛、猪FXa中的任意一种,优选为牛FXa。
本发明的另一目的是提供上述的抗凝血酶活性检测试剂的制备方法,包括分别制备试剂1、试剂2、试剂4或试剂3;其中:
制备试剂1的步骤为:将发色底物溶于缓冲剂中;再加入盐酸,调节pH值至7~8;再依次加入无机盐和表面活性剂,室温下搅拌10分钟。
其中,试剂1中各组分的终浓度或百分含量分别为:发色底物0.5~3mM,缓冲剂
10~50mM,无机盐0.1~0.3M,表面活性剂0.5~1%。
制备试剂2的步骤为:依次将FXa和肝素溶于缓冲剂;加入盐酸,调节pH值至7~8;再依次加入无机盐和表面活性剂,室温下搅拌10分钟。
其中,试剂2中各组分的终浓度或百分含量分别为:FXa 0.1~1.5μM,肝素0.5~3IU/ml,缓冲剂10~50mM,无机盐0.1~0.3M,表面活性剂0.5~1%。
制备试剂4的步骤为:将FXa溶于缓冲剂;加入盐酸,调节pH值至7~8;再依次加入无机盐和表面活性剂,室温下搅拌10分钟。
其中,试剂4中各组分的终浓度或百分含量分别为:FXa 0.1~1.5μM,缓冲剂10~50mM,无机盐0.1~0.3M,表面活性剂0.5~1%。
制备试剂3的步骤为:将肝素溶于缓冲剂中;调节pH值至7~8;再加入无机盐,室温下搅拌10分钟。
其中,试剂3中各组分的终浓度或百分含量分别为:肝素0.5~3IU/ml,缓冲剂10~50mM,无机盐0.1~0.3M。
优选地,制备方法还可包括将试剂1、试剂2或试剂4的溶液制成冻干剂的步骤,具体可参考现有技术中的冻干粉剂的制备工艺,以获得稳定性更高的试剂1、试剂2或试剂4。
此外,上述试剂1、试剂2、试剂4和试剂3中还分别加入0.2%的防腐剂,可参考现有技术中提及的方法加入,在此不做赘述。
本发明的另一目的是提供上述抗凝血酶活性检测试剂的应用,即将上述试剂作为检测试剂用于制备检测抗凝血酶活性的检测试剂。
作为一种优选方案,该检测试剂可制备相应的检测试剂盒,包括盒体和装有上述试剂的试剂瓶,试剂瓶放置于所述盒体内。
作为一种优选方案,上述检测试剂盒分别包含试剂1、试剂2。该试剂盒检测待测样品中抗凝血酶活性时,将待测样品与试剂2混合并孵育,再加入试剂1混合并孵育后,读取待测样品中发色底物的信号强度;最后通过计算信号强度并和已知浓度标准品的标准曲线比对得到血液中抗凝血酶活性。
作为一种优选方案,上述检测试剂盒分别包含试剂1、试剂4或试剂3。该试剂盒检测待测样品中抗凝血酶活性时,将待测样品与试剂3混合并孵育,再加入试剂4混合并孵育,再加入试剂1混合并孵育后,然后读取待测样品中发色底物的信号强度;最后通过计算信号强度并和已知浓度标准品的标准曲线比对得到血液中抗凝血酶活性。
本发明的另一目的是提供一种检测抗凝血酶活性的方法,具体是通过发色底物法,将待测样品与上述抗凝血酶活性活性检测试剂混合并孵育后,检测发色底物的信号强度;而产生的吸光度信号是和样品中抗凝血酶的活性成反比的。最后通过计算信号强度并和标准曲线比对获得待测样品中抗凝血酶的活性。
上述检测方法包括以下步骤:
步骤a,标准曲线的制作:根据不同抗凝血酶活性的校准品及其相应的信号强度绘制标准曲线;
步骤b,待测样品处理:获得待测样品的血浆,与上述抗凝血酶活性检测试剂混合并孵育;
步骤c,检测待测样品中发色底物的信号强度;
步骤d,通过计算待测样品中信号强度并和标准曲线比对获得待测样品中抗凝血酶的活性。
优选地,步骤a是采用缓冲剂将已知浓度的含有抗凝血酶的人血浆校准品稀释至四种或以上的已知浓度,作为标准溶液;再根据人血浆校准品中不同抗凝血酶活性与测得的相应吸光值绘制标准曲线。
更优选地,步骤b中待测样品的血浆是将新鲜抽取的静脉血按9:1的比例与枸橼酸抗凝液混匀后离心,分离即得待测样品血浆。
更优选地,步骤b中待测样品处理的温度为37℃,孵育温度也为37℃。
作为一种优选方案,步骤b的具体操作为:将待测样品血浆与试剂2以1:24的体积比在37℃下混合并孵育2分钟,然后加入试剂1(待测样品血浆加试剂2与试剂1的体积比为1:1),在37℃下混合并孵育2分钟。
作为另一种优选方案,步骤b的具体操作为:将待测样品血浆与试剂3以1:24的体积比在37℃下混合并孵育2分钟,然后加入试剂4(待测样品血浆加试剂3与试剂4的体积比为1:1),在37℃下混合并孵育2分钟,最后加入试剂1(待测样品血浆加试剂3加试剂4与试剂1的体积比为2:1),在37℃下混合并孵育2分钟。
优选地,上述信号为405nm下的吸光度。
更优选地,步骤c中将待测样品放入分光光度计中检测吸光度,放置时间不少于5分钟。
上述抗凝血酶活性的检测方法应用于自动检测仪上(如血凝分析仪或生化分析仪)进行检测的具体条件为:
在自动监测仪上设定参数:反应温度:37℃;检测波长:405nm;检测方法:终点法或动态法。
应当注意的是,在使用不同的自动检测仪(血凝分析仪或生化分析仪)时,具体参数应根据仪器不同进行相应调整。
与现有技术相比,本发明的优势是:
本发明是以FXa为基础的发色底物法,避免了以凝血酶为基础的发色底物法中肝素辅因子II、水蛭素、阿加曲班、达比加群或者其它的凝血酶直接抑制剂带来的影响。本发明检测稳定性和重复性好,具有很高的灵敏度和准确度,能准确反应抗凝血酶活性,得到的结果准确可靠,并找到体内抗凝血酶活性异常的患者,从而为治疗提供依据。此外,本发明所使用的FXa十分稳定,非常适合用在自动化仪器如血凝分析仪或生化分析仪上,从而实现自动化,患者无需进行多次检测,有助于临床推广应用,具有操作简便,灵敏度高的特点,使用的范围更加广泛。因此,其应用前景广阔。
附图说明
图1为实施例1所用抗凝血酶活性的标准曲线;
图2为实施例2所用抗凝血酶活性的标准曲线;
图3为实施例3所用抗凝血酶活性的标准曲线;
图4为实施例4所用抗凝血酶活性的标准曲线。
具体实施方式
下面结合附图和实施例及对比例对本发明作进一步详细、完整地说明。以下所用试剂或设备均为市售品种,如无特殊说明,均按照说明书操作,在此不做赘述。
以下为结合具体实施例对本发明作进一步的说明,但不应视为对本发明的限定。
1、实验材料和试剂
Tris(三羟甲基氨基甲烷),生物超级纯,购自美国西格玛奥德里奇(Sigma-Aldrich,简称Sigma);
盐酸,超级纯,购自Sigma;
氯化钠,生物超级纯,购自Sigma;
聚乙二醇-8000,标准级,购自Sigma;
FXa和FXa的发色底物,购自Chromogenix;
肝素,USP肝素钠含量测定标准品,购自北京艾德豪克国际技术有限公司;
血红蛋白,冻干粉,购自Sigma;
胆红素,干粉,购自Sigma;
甘油三酯,标准级,购自Sigma;
肝素辅因子II,50%甘油溶液,购自Sigma;
水蛭素,冻干粉,购自Sigma;
阿加曲班,干粉,购自Sigma;
达比加群,标准级,购自Sigma。
2、试验仪器
血凝分析仪购自STAGO;
血浆来自合作医院。
实施例1
制备本发明提供的试剂盒一,包含试剂1,试剂4和试剂3,用于测定血液中抗凝血酶的活性。
具体为:试剂1为FXa的发色底物,其具体制备方法为:取CH3SO2-D-Leu-Gly-Arg-p-nitroanilide·AcOH溶于浓度为30mM的Tris缓冲液,再加入盐酸调节pH值至7.4;再加入氯化钠和聚乙二醇-8000,搅拌后制得试剂1,其终浓度分别为:CH3SO2-D-Leu-Gly-Arg-p-nitroanilide·AcOH 2mM,氯化钠0.2M,聚乙二醇-8000 1%。
试剂4为FXa,其具体制备方法为:取FXa溶于浓度为30mM的Tris缓冲液,再加入盐酸调节pH值至7.4;再加入氯化钠和聚乙二醇-8000,搅拌后制得试剂4,其终浓度分别为:FXa 0.5μM,氯化钠0.2M,聚乙二醇-8000 1%。
试剂3为含有肝素的稀释液,其具体制备方法为:取肝素溶于浓度为30mM的Tris缓冲液,再加入盐酸调节pH值至7.4;再加入氯化钠,搅拌后制得试剂3,其终浓度分别为:肝素2IU/ml,氯化钠0.2M。
标准曲线制作:
(1)取标准液与试剂3按1:24的比例混合均匀,并孵育2分钟,孵育和反应的温度均为37℃。
(2)然后取200μL上述混合物加入200μL试剂4,混合均匀,并孵育2分钟,孵育温度为37℃。
(3)然后加入200μL试剂1,混合均匀,放在分光光度计中在405纳米波长测量吸光度5分钟。
(4)根据抗凝血酶活性标准液梯度浓度与所对应吸光值,采用线性方程绘制标准曲线,请见附图1,其标准曲线公式为y=-0.0105x+1.5587(R2=0.9891)。
样品检测:
取3份按1:24比例混合好的血浆与试剂3混合,37℃孵育2分钟,然后取200μl混合物加入200μl试剂4,37℃孵育2分钟,最后加入200μl试剂1,37℃反应在405纳米波长测量吸光度5分钟。每份样品重复测量两次,记录试验结果,计算信号强度,和标准曲线比对得到抗凝血酶的活性。
检测所得试剂盒一的特异性、灵敏度、线性范围及稳定性见如下实验。
实施例2
在与实施例1相同环境下,制备本发明提供试剂盒二,包含试剂1和试剂2,用于测定血液中抗凝血酶的活性。
具体为:试剂1为FXa的发色底物,其具体制备方法为:取Suc-Ile-Glu(γ-Piperidyl)-Gly-Arg-p-nitroanilide·HCl溶于浓度为30mM的Tris缓冲液,再加入盐酸调节pH值至7.4;再加入氯化钠和聚乙二醇-8000,搅拌后制得试剂1,其终浓度分别为:Suc-Ile-Glu(γ-Piperidyl)-Gly-Arg-p-nitroanilide·HCl 2mM,氯化钠0.2M,聚乙二醇-8000 1%。
试剂2为含有FXa和肝素的稀释液,其具体制备方法为:依次取FXa和肝素溶于浓度为30mM的Tris缓冲液,加入盐酸调节pH值至7.4;再加入氯化钠和聚乙二醇-8000,搅拌后制得试剂2,其终浓度分别为:FXa 0.5μM,肝素2IU/ml,氯化钠0.2M,聚乙二醇-80001%。
标准曲线制作:
(1)取标准液与试剂2按1:24的比例混合均匀,并孵育2分钟,孵育和反应的温度均为37℃。
(2)然后取200μL上述混合物加入200μL试剂2,混合均匀,放在分光光度计中在405纳米波长测量吸光度5分钟,温度为37℃。
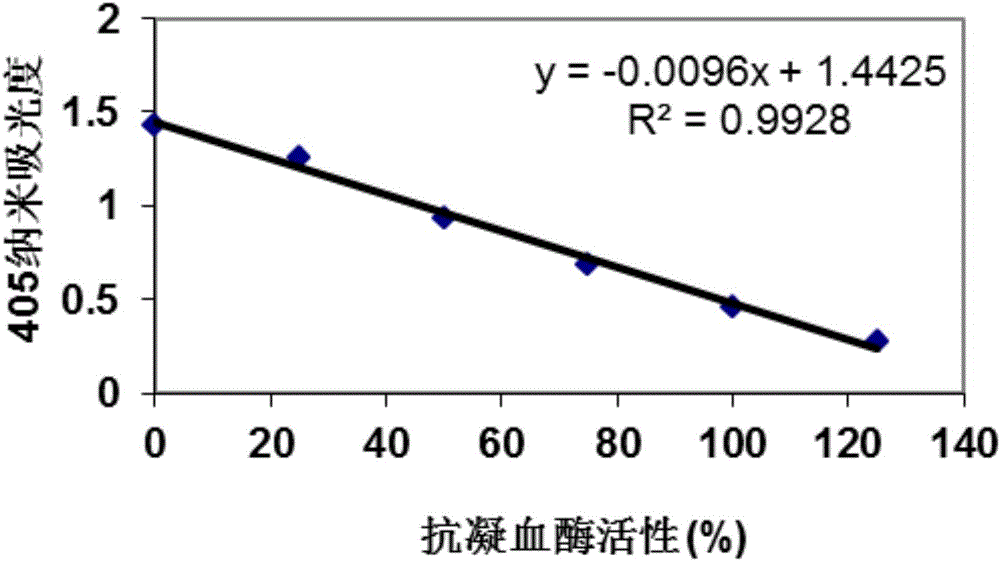
(3)根据抗凝血酶活性标准液梯度浓度与所对应吸光值,采用线性方程绘制标准曲线,请见附图2,其标准曲线公式为y=-0.0096x+1.4425(R2=0.9928)。
样品检测:
取3份按1:24比例混合好的血浆与试剂2混合,37℃孵育2分钟,然后取200μl混合物加入200μl试剂1,37℃反应在405纳米波长测量吸光度5分钟。每份样品重复测量两次,记录试验结果,计算信号强度,和标准曲线比对得到抗凝血酶的活性。
检测所得试剂盒二的特异性、灵敏度、线性范围及稳定性见如下实验。
实施例3
本实施例与实施例1的差别仅在于试剂1中发色底物为CH3O-CO-D-CHA-Gly-Arg-p-nitroanilide·AcOH。其他制备方法及检测操作与实施例1一致。
根据抗凝血酶活性标准液梯度浓度与所对应吸光值,采用线性方程绘制标准曲线,请见附图3,其标准曲线公式为y=-0.0088x+1.3884(R2=0.9898)。
检测所得试剂盒三的特异性、灵敏度、线性范围及稳定性见如下实验。
实施例4
本实施例与实施例2的差别仅在于试剂1中发色底物为4-Mbs-D-Arg-Gly-Arg-p-nitroanilide·2HCl。其他制备方法及检测操作与实施例2一致。
根据抗凝血酶活性标准液梯度浓度与所对应吸光值,采用线性方程绘制标准曲线,请见附图4,其标准曲线公式为y=-0.0107x+1.6526(R2=0.985)。
检测所得试剂盒四的特异性、灵敏度、线性范围及稳定性见如下实验。
实施例5
本实施例与实施例1的差别仅在于试剂1中发色底物为Benzoyl-Ile-Glu-Gly-Arg-p-nitroanilide·HCl。其他制备方法及检测操作与实施例1一致。
该试剂盒的特异性、灵敏度、线性范围及稳定性的检测结果与实施例1所得数据存在理论误差范围的一致性。
实施例6
本实施例与实施例2的差别仅在于试剂1中发色底物为N-α-Z-D-Arg-Gly-Arg-p-nitroanilide·2HCl。其他制备方法及检测操作与实施例1一致。
该试剂盒的特异性、灵敏度、线性范围及稳定性的检测结果与实施例2所得数据存在理论误差范围的一致性。
实施例7
本实施例与实施例1的差别仅在于试剂1中发色底物为Boc-D-Arg-Gly-Arg-p-nitroanilide·2HCl。其他制备方法及检测操作与实施例1一致。
该试剂盒的特异性、灵敏度、线性范围及稳定性的检测结果与实施例1所得数据存在理论误差范围的一致性。
实施例8
本实施例与实施例2的差别仅在于试剂1中发色底物为Acetyl-D-Arg-Gly-Arg-p-nitroanilide·2HCl。其他制备方法及检测操作与实施例2一致。
该试剂盒的特异性、灵敏度、线性范围及稳定性的检测结果与实施例2所得数据存在理论误差范围的一致性。
实施例9
本实施例与实施例1的差别仅在于试剂1中发色底物为4-Nz-D-Arg-Gly-Arg-p-nitroanilide·2HCl。其他制备方法及检测操作与实施例1一致。
该试剂盒的特异性、灵敏度、线性范围及稳定性的检测结果与实施例1所得数据存在理论误差范围的一致性。
实施例10
本实施例与实施例2的差别仅在于试剂1中发色底物为CH3OCO-D-CHG-Gly-Arg-p-nitroanilide·AcOH。其他制备方法及检测操作与实施例2一致。
该试剂盒的特异性、灵敏度、线性范围及稳定性的检测结果与实施例2所得数据存在理论误差范围的一致性。
实施例11
本实施例与实施例1的差别在于:
试剂1中各组分终浓度为:发色底物0.1mM,Tris缓冲液50mM,氯化钠0.1M,PEG-8000 0.5%;
试剂4中各组分终浓度为:FXa 0.05μM,Tris缓冲液50mM,氯化钠0.1M,PEG-8000 0.5%;
试剂3中各组分终浓度为:肝素0.3U/mL,Tris缓冲液50mM,氯化钠0.1M,PEG-8000 0.5%。其他制备方法及检测操作与实施例1一致。
该试剂盒的特异性、灵敏度、线性范围及稳定性的检测结果与实施例1所得数据存在理论误差范围的一致性。
实施例12
本实施例与实施例2的差别在于:
试剂1中各组分终浓度为:发色底物3mM,Tris缓冲液50mM,氯化钠0.1M,PEG-8000 0.5%;
试剂2中各组分终浓度为:FXa 1.5μM,肝素0.3U/mL,Tris缓冲液50mM,氯化钠0.1M,PEG-8000 0.5%。其他制备方法及检测操作与实施例2一致。
该试剂盒的特异性、灵敏度、线性范围及稳定性的检测结果与实施例2所得数据存在理论误差范围的一致性。
实施例13
本实施例与实施例1的差别在于:
试剂1中各组分终浓度为:发色底物1mM,Tris缓冲液50mM,氯化钠0.1M,PEG-8000 0.5%;
试剂4中各组分终浓度为:FXa 2μM,Tris缓冲液50mM,氯化钠0.1M,PEG-8000 0.5%;
试剂3中各组分终浓度为:肝素3U/mL,Tris缓冲液50mM,氯化钠0.1M,PEG-8000 0.5%。其他制备方法及检测操作与实施例1一致。
该试剂盒的特异性、灵敏度、线性范围及稳定性的检测结果与实施例1所得数据存在理论误差范围的一致性。
实施例14
本实施例与实施例2的差别仅在于:
试剂1中各组分终浓度为:发色底物1mM,Tris缓冲液50mM,氯化钠0.1M,PEG-8000 0.5%;
试剂2中各组分终浓度为:FXa 2μM,肝素3U/mL,Tris缓冲液50mM,氯化钠0.1M,PEG-8000 0.5%。其他制备方法及检测操作与实施例2一致。
该试剂盒的特异性、灵敏度、线性范围及稳定性的检测结果与实施例1所得数据存在理论误差范围的一致性。
试剂盒的特异性、灵敏度、线性范围及稳定性的检测
1.试剂盒特异性检测
表1检测抗凝血酶活性测定试剂盒特异性
结果表明:本发明提供的检测试剂盒的特异性高,与肝素辅因子II,水蛭素,阿加曲班,达比加群等多种因子没有交叉。
2.试剂盒灵敏度检测以及试剂盒线性范围检测:405nm波长下吸光度检测
表2检测抗凝血酶活性测定试剂盒灵敏度
结果表明:本发明试剂盒可检测到25%的抗凝血酶活性,该方法的检测灵敏度至少为25%。抗凝血酶活性在0%~125%时,线性≥0.98,检测的范围0%~125%。
3.试剂稳定性检测
表3检测实施例1制得的试剂稳定性
结果表明:本发明提供的抗凝血酶活性检测试剂在室温25℃时稳定至少5天,在4℃时稳定至少3个月。
由上述实验结果可知,本发明利用发色底物法来检测抗凝血酶的活性,检测稳定性和重复性好,具有很高的灵敏度和准确度。此外,本发明还可用在自动化仪器如血凝分析仪或生化分析仪上,实现自动化有助于临床推广应用。
最后有必要在此说明的是:以上实施例只用于对本发明的技术方案作进一步详细地说明,不能理解为对本发明保护范围的限制,本领域的技术人员根据本发明的上述内容作出的一些非本质的改进和调整均属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!