测定MPO卤化酶活性的方法与流程
本发明属于生物技术领域,特别涉及自然蛋白酶纯化方法。
背景技术:
髓过氧化物酶(Myeloperoxidase,MPO)又称过氧化物酶,是由中性粒细胞、单核细胞和某些组织的巨噬细胞分泌的糖基化并含血红素辅基的血红素蛋白酶,是血红素过氧化物酶超家族成员之一。人体粒细胞进入循环之前,在骨髓内合MPO成并贮存于嗜天青颗粒内,外界刺激可导致中性粒细胞聚集,释放MPO。在成熟的粒细胞(主要是中性粒细胞和单核细胞)中,MPO是含量最丰富的糖蛋白,约占外周血多形核中性粒细胞(PMNs)内总蛋白质含量的5%,血液中95%的MPO来源于PMNs
髓过氧化物酶(MPO)是由2个亚单位聚合而成的二聚体,每个亚单位又由一条重链(α链,466个氨基酸残基)和一条轻链(β链,108个氨基酸残基)所构成。2个亚单位在α链处由1个二硫键相连。重链具有亚铁卟啉基团,表明MPO是铁依赖性氧化物酶。
MPO基因位于染色体17q23q24,含有12个外显子和11个内含子,长约14638 bp,调控其基因表达的是生长因子。MPO的mRNA在早幼粒细胞的表达水平最高,其次是原始粒细胞、幼稚和原始单核细胞;当细胞分化到成熟时期,MPO基因表达水平迅速下降。现已知MPO基因首先表达是一条相对分子质量为84KDa前体MPO蛋白,经过翻译后加工,切割成α和β两种亚基,再聚合为成熟的MPO分子,加上糖链,最后形成糖基化,有酶活性MPO。MPO一个重要特征是等电点(pI)很高,为9.2。过氧化氢(H2O2)氧化MPO后,成为氧化型MPO,具有氧化酶和卤化酶活性,MPO酶活性最佳pH为4.5~5.5,当pH≥10,或≤2时,丧失MPO酶活性。
MPO的主要功能是在吞噬细胞内杀灭微生物,利用H2O2和氯离子(Cl-)产生次氯酸盐(HOCl),并形成具有氧化能力的自由基,构成MPO–H2O2–卤素系统。许多研究发现,MPO不仅能杀灭吞噬于细胞内的微生物,而且可释放到细胞外,破坏多种靶物质,如肿瘤细胞、血小板、NK细胞等,对机体产生和调节炎症反应等多方面发挥作用。然而,在特定条件下,MPO催化反应生成过量的氧化剂(HOCl等),超过局部抗氧化剂的防御反应时,就会导致氧化性组织损伤,如血管内皮层部位炎症反应和血管内皮层细胞损伤和死亡。
动脉粥样硬化是形成心脑血管疾病的重要病理基础。研究表明,动脉粥样硬化是一种慢性炎症反应性疾病,而MPO作为炎性因子,在动脉粥样斑块形成的起始、发展、破裂及脱落等过程中起着重要作用。
研究发现,血液中MPO,结合血管内皮细胞,侵润到血管内皮基下层,通过MPO酶氧化反应,直接消耗内皮细胞产生信号分子NO,降低激活鸟苷酸活化酶功能,从而引发血管内皮舒张功能障碍。
MPO在体内产生可扩散的氧化剂(HOCl),促进氧化LDL(oxLDL)产生,oxLDL更易被巨噬细胞吞噬,转化为泡沫细胞,沉积在血管内膜下,从而促进动脉粥样硬化斑块形成;HOCl可激活基质金属蛋白酶原(MMPs),使基质蛋白聚糖降解,导致动脉粥样硬化斑块纤维帽变薄,斑块表面腐蚀,破裂和血栓的形成,导致动脉粥样硬化斑块不稳定。HOCl能诱导血管内皮细胞产生P选择素和组织因子表达,促进血小板聚集,从而导致血栓的形成。
可见,MPO对血管内皮细胞功能障碍的早期,到粥样硬化斑块的形成,及随后斑块破裂和血栓的形成整个过程起了关键性作用,最终导致冠状动脉痉挛,心绞痛,甚至心肌梗死的发生。
研究发现,血液中MPO作为一种炎症标记物,测定血液中MPO酶活性或浓度;(1)能作为动脉粥样斑块不稳定性早期预测指标(1)能用于急性冠脉综合征(CVD)的早期诊断,评估CVD病情和预后:(3)能用于预测健康人群发生心脑血管疾病的危险性。
另外,人体血液中高浓度MPO与人类多种疾病的发生、发展密切相关,神经炎症疾病方面包括:多发性硬化症,阿尔茨海默氏症,帕金森氏症等。其它炎性疾病如:慢性阻塞性肺病,囊肿性纤维化,肾小球损伤和类风湿关节炎等。测定血液中MPO酶活性或浓度能对这些疾病的预防,诊断,和治疗有很大帮助。
在临床检验中,检测血液中MPO浓度方法主要是酶联免疫法(ELISA)及直接测定血液MPO酶活性方法,两个测定方法都需要纯化MPO作为校准品,此校准品要有MPO自然蛋白结构和酶活性。MPO基因首先表达出一条分子质量为84KDa前体MPO蛋白,经过翻译后加工,切割成α和β两种亚基,再聚合为成熟的MPO分子,进一步糖基化,最后形成有酶活性糖化MPO。
获得纯化MPO方法一是从人体血液分离出白细胞,再从这些细胞中大量提取自然MPO。这种方法缺点,一是血液来源受限制,二是血液中有多种感染因子,制备出MPO校准品不安全。另一方法是用基因工程法在人体细胞内表达MPO,但表达后MPO不能进行有效蛋白加工,不能进行正确糖基化,重组MPO蛋白有很弱酶活性,不宜作为MPO校准品。
目前,国内外已有检测血液中MPO的试剂盒,主要采用 ELISA,此法简单,易操作,得到广泛应用。 但这种方法测定血液中MPO的含量,间接表明血液中MPO酶活性,有时MPO 含量与MPO酶活性是不相关,如MPO基因变异人群及血液中有MPO抑制物的人群;另外,制备测定MPO ELISA 试剂盒需要几种MPO单克隆抗体,制备成本高,时间长;同时, ELISA法步骤多,需要时间较长,准确性差等缺点。而动脉硬化活动状况与血液中MPO卤化酶活性相关性最大,测定血液中MPO卤化酶活性最能代表动脉硬化活动状况。
技术实现要素:
本发明的目的是用离子层析法从HL-60细胞中分离出具有自然蛋白结构和酶活性MPO,建立测定MPO卤化酶活性方法,用纯化MPO作为校准品,测定人血清/浆中MPO卤化酶活性单位。
本发明测定的MPO卤化酶从HL-60细胞中分离的步骤是:
a、从HL-60细胞中分离出MPO:培养HL-60细胞, 离心收集细胞,用磷酸盐缓冲液溶解细胞,再进一步用Dounce homogenization 破裂细胞,离心,收集细胞沉积物,细胞沉积物中含MPO;
b、1% CTAB-磷酸盐缓冲液溶解上述细胞沉积物中MPO;
c、制备Q-Sepharose 层析柱: 用0.5% CTAB-磷酸盐缓冲液平衡Q-Sepharose 层析柱,上述MPO溶解液通过Q-Sepharose 层析柱,结合蛋白到Q-Sepharose 层析柱上,收集滤过液,滤过液含有pI=9.2的MPO;
d、制备SP-Sepharose 层析柱:用0.2% CTAB-磷酸盐溶液平衡SP-Sepharose 层析柱,上述含有MPO滤过液通过SP-Sepharose 层析柱,pI≥8.0蛋白结合到SP-Sepharose 层析柱上,用600mM K2PO4-磷酸盐缓冲液洗脱SP-Sepharose 层析柱结合蛋白,收集含有MPO的洗脱液;
e、放上述洗脱液至蛋白透析袋中,用150mM NaCl-磷酸盐缓冲液透析;
f、制备ConA-Sepharose4B 层析柱:用100mM NaCl-磷酸盐溶液洗涤ConA-Sepharose4B,再与透析后蛋白液混合,ConA-Sepharose4B结合糖化MPO,用500mM NaCl-磷酸盐缓冲液洗涤ConA-Sepharose4B 层析柱,用600mM a-D-methylmannoside -磷酸盐缓冲液洗脱ConA-Sepharose4B 层析柱结合糖化蛋白,收集含有MPO的洗脱液;
g、放上述洗脱液至蛋白透析袋中,用150mM NaCl-磷酸盐缓冲液透析, 收集蛋白液,分装,放-80°C 冻存。
本发明冻存的蛋白液采用银染法测定MPO纯度,
a、冻存蛋白液离心管放到37° 水浴中,快速溶化,放到冰块中;
b、10ul蛋白液,加4ul 4X蛋白加样液,100° ,3分钟,其中样液是50 mM Tris,pH 6.8,2% SDS,10% Glycerol,1% β-mercaptoethanol, 12.5mM EDTA,0.02% Bromophenol blue;
c、加10ul蛋白液样本液10% SDS-PAGE 凝胶孔中,进行电泳;
d、完成电泳后,获取SDS-PAGE 凝胶,进行银染色,步骤如下:
①加100ml 50% Methanol 到SDS-PAGE凝胶的容器中,室温下,缓慢摇动,15分钟,去除Methanol液体;
②加100ml 5% Methanol 到SDS-PAGE凝胶容器中,室温下,缓慢摇动,10分钟,去除Methanol液体,用水洗涤SDS-PAGE凝胶1次;
③加10ul DTT 到SDS-PAGE胶容器中,有200ml水,室温下,缓慢摇动,10分钟,去除DTT液体,用水洗涤SDS-PAGE凝胶1次;
④加100ml 0.1% AgNO3 到SDS-PAGE凝胶容器中,室温下,缓慢摇动,15分钟,去除AgNO3液体,用水洗涤SDS-PAGE凝胶2次;
⑤加100ml 3% Na2CO3 & 0.05% Formaldehyde 到SDS-PAGE凝胶容器中,室温下反应,看到清晰蛋白条带为止;
⑥加Critic Acid到SDS-PAGE凝胶容器中;终止反应;
⑦用水清洗SDS-PAGE胶后,干躁SDS-PAGE凝胶,判断MPO纯度。
本发明Bradford法测定纯化MPO浓度;
①取1ml浓缩染料试剂与4ml H2O 混合均匀,获得稀释染料试剂;
②制备BSA标准液, 浓度分别为 0, 0.25,0.5,1.0,1.5,2.0mg/ml;
③加78ul PBS 到微量滴定板孔中,加2ul不同浓度BSA标准液,2ul纯化MPO液,每个样本加3个孔;
④加80ul稀释染料试剂到微量滴定板孔中,室温,放置5分钟;
⑤放微量滴定板到生化分析仪中,选用波长495nm, 测定OD值;
⑥制备BSA浓度标准曲线,计算出纯化MPO浓度。
本发明测定纯化MPO卤化酶活性单位:
①加50ul工作液入微孔滴定板孔中;
②加50ul纯化MPO至相应微孔滴定板孔中;
③再加20ul H2O2溶液至每孔中,混均,反应5min;
④加入 20ul过氧化氢酶至每孔中,混均,反应5min;
⑤加入30ul底物液至每孔中, 混均;
⑥放微孔滴定板到生化分析仪中,选用650nm 波长, 测定0min OD值;
⑦持续反应5min后,用650nm 波长, 测定5min OD值;
⑧计算∆OD值=OD5min–OD0min。
本发明测定血清/浆标本中MPO卤化酶活性单位:
①加50ul工作液入微孔滴定板孔中;
②加50ul血清及MPO校准品至相应微孔滴定板孔中;
③再加20ul H2O2溶液至每孔中,混均,反应5min;
④加入 20ul Catalase至每孔中,混均,反应5min;
⑤加入30ul底物液至每孔中, 混均;
⑥放微孔滴定板到生化分析仪中,选用650nm 波长, 测定0min OD值;
⑦持续反应5min后,用650nm 波长, 测定5min OD值;
⑧计算∆OD值=OD5min–OD0min。
本发明建立NaI-TMB(3,3’,5,5’-tetramethylbenzidine,四甲基联苯胺)法,直接测定血清/浆中MPO卤化酶活性,用于预测心脑血管疾病发生可能性及疾病预后。本发明利用H2O2 氧化MPO后,卤化Cl-为HOCl,HOCl进一步氧化TauNH2为TauNHCl,再用I-催化剂作用,快速催化TauNHCl氧化TMB,形成氧化型TMB,为蓝色产物,用650nm波长,直接测定蓝色产物OD值,此OD值代表MPO卤化酶活性。
此方法优点为灵敏,快速,定量。重要特征是血液中MPO呈氧化酶和卤化酶活性,但血液中有多种氧化酶与MPO氧化酶活性相同,MPO氧化酶活性不特异;血液中只有MPO呈卤化酶活性,测定血液中卤化酶活性代表MPO卤化酶活性,特异性强,更好地预测心脑血管疾病发生可能性。简单,快速,定量检测人血清/浆中MPO卤化酶活性单位方法,用于临床评估心脑血管疾病发生的可能性。
附图说明
图1是BSA浓度曲线;
图2是HOCL浓度标准曲线;
图3是纯化MPO卤化酶活性标准曲线;
图4是MPO校准品卤化酶活性单位(U)标准曲线;
图5是NaI-TMB方法测定MPO卤化酶活性反应原理图;
图6是离子层析法分离MPO蛋白。
具体实施方式
本发明测定的MPO卤化酶从HL-60细胞中分离的步骤是:
a、从HL-60细胞中分离出MPO:培养HL-60细胞, 离心收集细胞,用磷酸盐缓冲液(pH8.0)溶解细胞,再进一步用Dounce homogenization 破裂细胞,离心,收集细胞沉积物,细胞沉积物中含MPO;
b、1% CTAB(Cetyltrimethylammonium bromide )-磷酸盐缓冲液(pH8.0)溶解上述细胞沉积物中MPO;
c、制备Q-Sepharose 层析柱: 用0.5% CTAB-磷酸盐缓冲液(pH8.0)平衡Q-Sepharose 层析柱,上述MPO溶解液通过Q-Sepharose 层析柱,结合蛋白(pI≤8.0)到Q-Sepharose 层析柱上,收集滤过液(含有MPO,pI=9.2);
d、制备SP-Sepharose 层析柱:用0.2% CTAB-磷酸盐溶液(pH8.0)平衡SP-Sepharose 层析柱,上述含有MPO滤过液通过SP-Sepharose 层析柱,pI≥8.0蛋白(包括MPO,pI=9.2)结合到SP-Sepharose 层析柱上,用600mM K2PO4-磷酸盐缓冲液(pH9.5)洗脱SP-Sepharose 层析柱结合蛋白,收集含有MPO的洗脱液;
e、放上述洗脱液至蛋白透析袋中,用150mM NaCl-磷酸盐缓冲液(pH7.5)透析;
f、制备ConA-Sepharose4B 层析柱:用100mM NaCl-磷酸盐溶液(pH7.5)洗涤ConA-Sepharose4B,再与透析后蛋白液混合,ConA-Sepharose4B结合糖化MPO,用500mM NaCl-磷酸盐缓冲液(pH7.5)洗涤ConA-Sepharose4B 层析柱,用600mM a-D-methylmannoside -磷酸盐缓冲液(pH7.5)洗脱ConA-Sepharose4B 层析柱结合糖化蛋白,收集含有MPO的洗脱液;
g、放上述洗脱液至蛋白透析袋中,用150mM NaCl-磷酸盐缓冲液(pH7.5)透析, 收集蛋白液,分装,放-80°C 冻存。
本发明冻存的蛋白液采用银染法测定MPO纯度,
a、冻存蛋白液离心管放到37° 水浴中,快速溶化,放到冰块中;
b、10ul蛋白液,加4ul 4X蛋白加样液,100° ,3分钟,其中样液是50 mM Tris,pH 6.8,2% SDS,10% Glycerol,1% β-mercaptoethanol, 12.5mM EDTA,0.02% Bromophenol blue;
c、加10ul蛋白液样本液10% SDS-PAGE 凝胶孔中,进行电泳;
d、完成电泳后,获取SDS-PAGE 凝胶,进行银染色,步骤如下:
①加100ml 50% Methanol 到SDS-PAGE凝胶的容器中,室温下,缓慢摇动,15分钟,去除Methanol液体;
②加100ml 5% Methanol 到SDS-PAGE凝胶容器中,室温下,缓慢摇动,10分钟,去除Methanol液体,用水洗涤SDS-PAGE凝胶1次;
③加10ul DTT 到SDS-PAGE胶容器中,有200ml水,室温下,缓慢摇动,10分钟,去除DTT液体,用水洗涤SDS-PAGE凝胶1次;
④加100ml 0.1% AgNO3 到SDS-PAGE凝胶容器中,室温下,缓慢摇动,15分钟,去除AgNO3液体,用水洗涤SDS-PAGE凝胶2次;
⑤加100ml 3% Na2CO3 & 0.05% Formaldehyde 到SDS-PAGE凝胶容器中,室温下反应,看到清晰蛋白条带为止;
⑥加Critic Acid到SDS-PAGE凝胶容器中;终止反应;
⑦用水清洗SDS-PAGE胶后,干躁SDS-PAGE凝胶,判断MPO纯度。
本发明Bradford法测定纯化MPO浓度;
①取1ml浓缩染料试剂(Bio-Rad Protein Assay Dye Reagent Concentrate)与4ml H2O 混合均匀,获得稀释染料试剂;
②制备BSA标准液, 浓度分别为 0, 0.25,0.5,1.0,1.5,2.0mg/ml;
③加78ul PBS 到微量滴定板孔中,加2ul不同浓度BSA标准液,2ul纯化MPO液,每个样本加3个孔;
④加80ul稀释染料试剂到微量滴定板孔中,室温,放置5分钟;
⑤放微量滴定板到生化分析仪中,选用波长495nm, 测定OD值;
⑥制备BSA浓度标准曲线,计算出纯化MPO浓度。
本发明测定纯化MPO卤化酶活性单位:
①加50ul工作液(20mM NaPO4,pH6.5,200mM NaCl,10mM TauNH2)入微孔滴定板孔中;
②加50ul(0, 50, 100, 200, 400, 800ng/ml )纯化MPO至相应微孔滴定板孔中;
③再加20ul H2O2溶液(2mM)至每孔中,混均,反应5min;
④加入 20ul过氧化氢酶(Catalase,购买 Sigma)(20ug/ml)至每孔中,混均,反应5min;
⑤加入30ul底物液(2mM TMB,100um NaI,400mM Acetate,10% DMF)至每孔中, 混均;
⑥放微孔滴定板到生化分析仪中,选用650nm 波长, 测定0min OD值;
⑦持续反应5min后,用650nm 波长, 测定5min OD值;
⑧计算∆OD值=OD5min–OD0min。
本发明测定血清/浆标本中MPO卤化酶活性单位:
①加50ul工作液(20mM NaPO4,pH6.5,100mM NaCl,5mM TauNH2)入微孔滴定板孔中;
②加50ul血清及MPO校准品(0,50,100,200,400,600U)至相应微孔滴定板孔中;
③再加20ul H2O2溶液(2mM)至每孔中,混均,反应5min;
④加入 20ul Catalase(20ug/ml)至每孔中,混均,反应5min;
⑤加入30ul底物液(2mM TMB,100um NaI,400mM Acetate,10% DMF)至每孔中, 混均;
⑥放微孔滴定板到生化分析仪中,选用650nm 波长, 测定0min OD值;
⑦持续反应5min后,用650nm 波长, 测定5min OD值;
⑧计算∆OD值=OD5min–OD0min。
本发明直接从HL-60细胞提取MPO,人体血液中主要是嗜中性粒细胞大量产生MPO,而HL-60细胞是急性嗜中性粒细胞性白血病细胞系,产生大量成熟MPO。HL-60细胞生长快,培养基要求低,能大量培养,降低成本低。重要是成熟MPO等电点(pI)为9.2,并且是糖基化蛋白,为离子层析法和糖基化蛋白结合法分离出MPO提供基础。本发明分离MPO实验过程用温和缓冲液,不改变MPO蛋白结构;用不含氧化剂和还原剂缓冲液,不干扰MPO酶活性,最终纯化出具有自然蛋白结构和酶活性MPO,能作为测定血液标本中MPO酶活性和浓度的校准品。
以下对本发明做进一步详细描述:
本发明第一步从HL-60细胞中分离出MPO:
1. 大量培养HL-60细胞, 离心收集细胞,用磷酸盐缓冲液(pH8.0)溶解细胞,再进一步用Dounce homogenization 破裂细胞,离心,收集细胞沉积物(含MPO)
2. 1% Cetyltrimethylammonium bromide(CTAB)-磷酸盐缓冲液(pH8.0)溶解上述细胞沉积物中MPO
3. 制备Q-Sepharose 层析柱,用0.5% CTAB-磷酸盐缓冲液(pH8.0)平衡Q-Sepharose 层析柱,上述MPO溶解液通过Q-Sepharose 层析柱,结合蛋白(pI≤8.0)到Q-Sepharose 层析柱上,收集滤过液(含有MPO,pI=9.2)
4. 制备SP-Sepharose 层析柱,用0.2% CTAB-磷酸盐溶液(pH8.0)平衡SP-Sepharose 层析柱,上述含有MPO滤过液通过SP-Sepharose 层析柱,pI≥8.0蛋白(包括MPO,pI=9.2)结合到SP-Sepharose 层析柱上,用600mM K2PO4-磷酸盐缓冲液(pH9.5)洗脱SP-Sepharose 层析柱结合蛋白,收集洗脱液(含有MPO)
5.放上述洗脱液至蛋白透析袋中,用150mM NaCl-磷酸盐缓冲液(pH7.5)透析
6. 制备ConA-Sepharose4B 层析柱,用100mM NaCl-磷酸盐溶液(pH7.5)洗涤ConA-Sepharose4B,再与透析后蛋白液混合,ConA-Sepharose4B结合糖化MPO,用500mM NaCl-磷酸盐缓冲液(pH7.5)洗涤ConA-Sepharose4B 层析柱,用600mM a-D-methylmannoside -磷酸盐缓冲液(pH7.5)洗脱ConA-Sepharose4B 层析柱结合糖化蛋白,收集洗脱液(含有MPO)
7. 放上述洗脱液至蛋白透析袋中,用150mM NaCl-磷酸盐缓冲液(pH7.5)透析, 收集蛋白液,分装,放-80°C 冻存
本发明第二步测定分离MPO蛋白纯度和浓度:
1.上述冻存蛋白液进行SDS-PAGE蛋白电泳,再做银染法,测定MPO纯度达到95%以上
2.用Bradford法测定MPO蛋白浓度
本发明第三步建立测定MPO卤化酶活性方法:
1.NaI-TMB方法测定MPO卤化酶活性原理:(见图5)
反应过程为H2O2氧化MPO蛋白中亚铁卟啉基团(Fe3+),转化为氧化型MPO(Fe4=O+),此MPO(Fe4=O+)氧化CL-,产生HOCl,HOCl进一步氧化TauNH2 ,形成TauNHCl,I-迅速催化TauNHCl氧化TMB,形成氧化型TMB,呈蓝色,有很强光吸收值,用650nm波长,直接测定蓝色产物OD 值。
2.建立测定纯化MPO卤化酶活性NaI-TMB方法,纯化MPO与Taurine(TauNH2)-磷酸盐缓冲液混合,用H2O2 氧化后MPO,转化Cl-为HOCl,HOCl再进一步氧化TauNH2为TauNHCl,加过氧化氢酶(Catalase)分解掉剩余H2O2,再加入NaI-TMB底物液后,I-快速/催化TauNHCl氧化TMB,形成氧化型TMB,转为蓝色,用650nm波长,直接测定蓝色产物OD值,此OD值代表纯化MPO卤化酶活性。
3. 建立MPO卤化酶活性单位(U),设定MPO卤化酶活性单位(U)为在本发明NaI-TMB法测定MPO卤化酶活性条件下,1分钟MPO氧化Cl-,产生等量HOCl (umol/ml/min,U)。本发明用纯HOCl溶液为标准品,制备出0, 40, 80, 120, 160, 200umol HOCl溶液标准品,HOCl氧化TauNH2,生成TauNHCl,在I-催化下,TauNHCl氧化MTB,形成蓝色产物,用波长650nm,测定OD值。测定出不同浓度HOCl标准品OD值,绘制出HOCl标准品浓度与OD值关系标准曲线,计算出曲线斜率(K):如K=( HOCl 120nmo -80umol)/(120umol OD值-80umolOD值)。进一步测定纯化MPO卤化酶活性单位(U)。
4.测定纯化MPO卤化酶活性单位(U),20ul纯化MPO(0,50, 100, 200, 400,800ng/ml)与酶底物(TauNH2,NaI,TMB)反应,产生氧化型TMB,呈蓝色反应,测定不同反应时间(0,5,10,15min),650nm 波长OD值,根据以下公式算出MPO卤化酶活性单位:如200ng/ml MPO卤化酶活性单位(umol/ml/min,U)=K(200ng/ml MPO OD5min-200ng/ml MPO OD0min)/5min/0.05ml。
5. 用纯化MPO作为校准品,测定用于检测血清/浆样品中MPO卤化酶活性单位,根据以往研究结果,人血液中MPO浓度在20-400ng/ml范围内,本发明选用 0至1000ng/ml 纯化MPO蛋白作为校准品,转化为相应MPO卤化酶活性单位(U)。用NaI-TMB法测定MPO校准品和血清/浆中MPO卤化酶活性后, 制备出MPO校准品卤化酶活性单位(U)标准曲线,用于计算检测血清/浆样品中MPO卤化酶活性单位(U)。
本发明实验过程:
一、从HL-60细胞中分离髓过氧化物酶(MPO)
1.用RPMI-1640(含18% FBS)培养HL-60细胞在150mm细胞培养皿中
2.收集HL-60细胞到250ml离心管中,4°C,离心,3000rpm, 10分钟
3.去除上清液,加150ml PBS到离心管中,混均HL-60细胞,4°C,离心,3000rpm, 10分钟,去除上清液,收集HL-60细胞
4.加30ml Buffer A (10mM NaPO4, pH8.0, 1.0mM MgCl2, 1.0mM CaCl2,0.5mM PMSF, 10ug/ml leupetine, 10ug/ml Aprotinin) 到有HL-60细胞离心管中, 吹吸,混均,放置在冰块中 5分钟
5.用Dounce homogenization 破裂细胞
6.在4°C条件下,离心,20000g, 10分钟,去除上清液
7.加30ml Buffer A到HL-60细胞沉淀物中,加Cetyltrimethylammonium bromide(CTAB,购买Sigma)到BufferA-细胞沉淀混合液中,浓度至1%;加NaCl浓度至100mM,在4°C条件下,摇动2小时
8.在4°C条件下,离心,20000g, 30分钟,收集上清液,到新50ml离心管中
9.制备Q-sepharose 层析柱(购买GE Healthcare Life Sciences),用Buffer B(20mM NaPO4,pH8.0, 100mM NaCl,0.5% CTAB)平衡Q-Sepharose 层析柱。
10.上述30ml上清液,加到Q-Sepharose 层析柱中,通过Q-Sepharose 层析柱,收集滤过液,再加到Q-Sepharose 层析柱中,反复四次后,收集滤过液
11.制备SP-Sepharose 层析柱(购买GE Healthcare Life Sciences),用Buffer C(50mM K2PO4, pH8.0,100mM NaCl,0.2% CTAB)平衡SP-Sepharose 层析柱。
12.上述滤过液,通过SP-Sepharose 层析柱,收集滤过液,再加到SP-Sepharose 层析柱中,反复四次
13.加100ml Buffer C到SP-Sepharose层析柱中,Buffer C缓慢通过SP-Sepharose层析柱
14.分别加10ml洗脱液(0.6M K2PO4, pH9.5, 200mM NaCl,0.2% CTAB)到SP-Sepharose层析柱中, 洗脱液缓慢通过SP-Sepharose层析柱,收集10ml洗脱液
15.把洗脱液转入到透析袋中 (Spectra/Pro) ,再放入透析液 (20mM NaPO4, pH7.5, 100mM NaCl, 5% Glycerol, 1mM DTT,1mM EDTA,1mM PMSF) 中,在4-8°C条件下,缓慢搅动,6小时
16.将透析袋中透析蛋白液移到离心管中,在4°C条件下,离心,20000g, 10分钟
17.取1.5ml ConA-Sepharose4B(购买GE Healthcare Life Sciences) 放到15ml离心管中
18.加10ml 洗涤液 (20mM NaPO4, pH7.5, 100mM NaCl, 5% Glycerol,0.01% NP-40, 1mM EDTA, 1mM DTT,1mM PMSF, 10ug/ml leupetine, 10ug/ml Aprotinin) 到ConA Sepharose4B离心管中
19.离心,3000g, 2分钟,吸出上清,重复洗涤2次
20.加15ml透析蛋白液到ConA-Sepharose4B离心管中
21.在4°C条件下,缓慢摇动离心管,2.0小时
22.在4°C条件下,转移反应后ConA-Sepharose4B 到Poly-prep column(0.8 X 4cm Pharmacia Biotech,731-1550),形成ConA-Sepharose4B层析柱
23.加20ml洗涤液 (20mM NaPO4, pH7.5, 500mM NaCl, 5% Glycerol,0.01% NP-40, 1mM EDTA, 1mM DTT,1mM PMSF, 10ug/ml leupetine, 10ug/ml Aprotinin)到ConA-Sepharose 4B层析柱中,洗涤液缓慢通过ConA-Sepharose 4B-层析柱
24.加2.0ml 洗脱液(20mM NaPO4,pH7.5 150mM NaCl, 600mM a-D-methylmannoside)到ConA-Sepharose 4B-层析柱中, 洗脱液缓慢通过层析柱,收集洗脱液
25.把洗脱液转入到透析袋 (Spectra/Pro) 中,放透析袋在透析液 (20mM NaHPO4, pH7.5, 150mM NaCl, 10% Glycerol, 1mM DTT,1mM EDTA,1mM PMSF) 中,在4°C条件下,缓慢搅动,过夜
26.将透析袋中蛋白液体移到微量离心管中,在4°C条件下,离心,13000rpm, 10分钟,分装蛋白液到不同微量离心管中,-80°C长期保存。
二、测定分离出MPO 蛋白纯度和浓度
(一)银染法测定MPO纯度
1.冻存蛋白液离心管放到37°C水浴中,快速溶化,放到冰块中,
2.10ul蛋白液,加4ul 4X蛋白加样液(50 mM Tris,pH 6.8,2% SDS,10% Glycerol,1% β-mercaptoethanol, 12.5mM EDTA, 0.02% Bromophenol blue), 100°C 3分钟
3.加10ul蛋白液样本液10% SDS-PAGE 凝胶孔中,进行电泳
4.完成电泳后,获取SDS-PAGE 凝胶,进行银染色,步骤如下:
a.加100ml 50% Methanol 到SDS-PAGE凝胶的容器中,室温下,缓慢摇动,15分钟,
去除Methanol液体
b.加100ml 5% Methanol 到SDS-PAGE凝胶容器中,室温下,缓慢摇动,10分钟,去除Methanol液体,用水洗涤SDS-PAGE凝胶1次
c.加10ul DTT 到SDS-PAGE胶容器中,有200ml水,室温下,缓慢摇动,10分钟,去除DTT液体,用水洗涤SDS-PAGE凝胶1次
d.加100ml 0.1% AgNO3 到SDS-PAGE凝胶容器中,室温下,缓慢摇动,15分钟,去除AgNO3液体,用水洗涤SDS-PAGE凝胶2次
e.加100ml 3% Na2CO3 & 0.05% Formaldehyde 到SDS-PAGE凝胶容器中,室温下反应,看到清晰蛋白条带为止
f.加Critic Acid到SDS-PAGE凝胶容器中,终止反应
用水清洗SDS-PAGE胶后,干躁SDS-PAGE凝胶,判断MPO纯度。
(二)Bradford法测定纯化MPO浓度
1.取1ml浓缩染料试剂(Bio-Rad Protein Assay Dye Reagent Concentrate)与4ml H2O混合均匀,获得稀释染料试剂
2.制备BSA标准液, 浓度分别为 0, 0.25, 0.5, 1.0, 1.5,2.0mg/ml
3. 加78ul PBS 到微量滴定板孔中,加2ul不同浓度BSA标准液,2ul纯化MPO液,每个样本加3个孔
4. 加80ul稀释染料试剂到微量滴定板孔中,室温,放置5分钟
5. 放微量滴定板到生化分析仪中,选用波长495nm, 测定OD值
6. 制备BSA浓度标准曲线,计算出纯化MPO浓度纯化MPO OD平均值为1.212,MPO浓度=1.6498 x 1.212 – 0.6059=1.393mg/ml
。
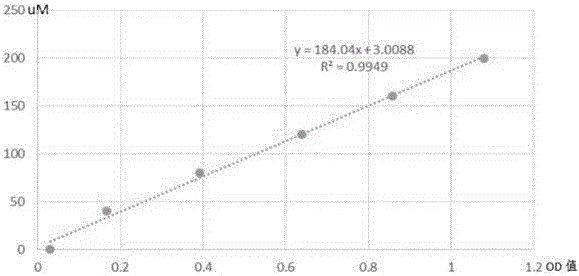
三.建立HOCl 浓度标准曲线
1.加50ul HOCl(购买NovaBay Pharmaceuticals, Inc ),浓度为0,40,80,120,160,200uM 和40ul PBS 到微孔滴定板相应孔中
2.加50ul工作液(20mM NaPO4,pH6.5,200mM NaCl,10mM Taurine(TauNH2)入每个孔中,反应5min
3.加入30ul底物液(2mM TMB,150um NaI,400mM Acetate,10% DMF) 至每孔中, 混均,反应5min
4.放微孔滴定板到生化分析仪中,选用650nm 波长, 测定OD值
5.绘制出HOCl浓度与OD值关系标准曲线,计算出曲线斜率(K):如K=( HOCl 120uM-80uM)/(OD120uM-OD180uM)=120-80/0.638667-0.3906=161
。
四.测定纯化MPO卤化酶活性单位(U)
1.加50ul工作液(20mM NaPO4,pH6.5,200mM NaCl,10mM TauNH2)入微孔滴定板孔中
2.加50ul(0, 50, 100, 200, 400, 800ng/ml )纯化MPO至相应微孔滴定板孔中
3.再加20ul H2O2溶液(2mM)至每孔中,混均,反应5min
4.加入 20ul过氧化氢酶(Catalase,购买 Sigma)(20ug/ml)至每孔中,混均,反应5min
5.加入30ul底物液(2mM TMB,100um NaI,400mM Acetate,10% DMF) 至每孔中, 混均
6.放微孔滴定板到生化分析仪中,选用650nm 波长, 测定0min OD值
7.持续反应5min后,用650nm 波长, 测定5min OD值
8.计算∆OD值=OD5min–OD0min
绘制出MPO浓度与∆OD值关系标准曲线,计算出MPO卤化酶活性单位(U)。如200ng/mlMPO卤化酶活性单位(U)=K(200ng/ml OD5min – 200ng/ml OD0min)/5min/0.05ml=161(0.321667 - 0.135667)/5/0.05=120uM/ml/min
。
五.测定血清/浆标本中MPO卤化酶活性单位(U)
1.加50ul工作液(20mM NaPO4,pH6.5,100mM NaCl,5mM TauNH2)入微孔滴定板孔中
2.加50ul血清及MPO校准品(0,50,100,200,400,600U)至相应微孔滴定板孔中
2.再加20ul H2O2溶液(2mM)至每孔中,混均,反应5min
3.加入 20ul Catalase(20ug/ml)至每孔中,混均,反应5min
4.加入30ul底物液(2mM TMB,100um NaI,400mM Acetate,10% DMF) 至每孔中, 混均
5.放微孔滴定板到生化分析仪中,选用650nm 波长, 测定0min OD值
6.持续反应5min后,用650nm 波长, 测定5min OD值
7.计算∆OD值=OD5min–OD0min
8.绘制出MPO校准品卤化酶活性单位(U)与∆OD值关系标准曲线,用此标准曲线计算出血清中/浆MPO卤化酶活性单位(U)
举例:血清1 MPO(U)= 910.38 X 0.208 – 45.686 = 143.67 U
。
- 还没有人留言评论。精彩留言会获得点赞!