一种低丰度激素检测方法及装置与流程
本发明涉及医疗设备领域,特别涉及一种低丰度激素检测方法及装置。
背景技术:
激素按化学结构大体分为四类,第一类为类固醇、第二类为氨基酸衍生物、第三类激素的结构为肽与蛋白质、第四类为脂肪酸衍生物。激素的分泌量极微少,为毫微克(即十亿分之一克)水平。目标激素检测时间长、需样量大,检测设备价格高,且需要特殊的专业技术,不适合临床常规激素监测。
以属于第一类的雌激素为例,雌激素在人体血液中含量极低,为pg/ml级别,女性生育年龄的早卵泡期的基础雌激素水平在40-60pg/ml,随月经周期发生波动性改变,当发生排卵时,雌激素可以高达200-2000pg/ml,而绝经后妇女雌激素水平急剧下降至20pg/ml以下甚至更低。
由于卵巢功能减退,绝经期的低雌激素状态会导致大量慢性疾病如骨质疏松,心血管疾病等的发生,由此所致的慢性疾病经济负担达58%以上,已成为严重威胁人类健康的重要公共卫生问题。《2013年中国骨质疏松骨折防治蓝皮书》中指出:中国50岁以上妇女脊椎骨折患病率为15%,伴随年龄增长,80岁以上出现骨折人数高达36.6];而且绝经后妇女,年龄每增加10岁,心血管的死亡率增加7倍,相对于未绝经同龄女性心血管的发生率增加2-6倍。因此针对女性绝经早期的有效治疗和干预对于控制和减少老年女性慢性病的发生非常重要。
对于绝经女性而言,最主要的变化是体内雌激素水平的急剧下降,因此适当的雌激素补充治疗是预防绝经女性发生慢性疾病的最重要的一线治疗方案。2001年由美国国立卫生院推动的一项旨在了解激素替代对心血管疾病影响的多中心、随机双盲对照研究由于出现不良反应而提前终止,使得激素替代治疗人群大幅减少,对于激素替代可能引发的乳腺癌发生率增高的疑惑使得人们不敢轻易使用。经过近10年的后续观察研究和对既往数据的重新清洗和分层分析,人们认识到,在绝经早期,低剂量,个体化的激素补充可以有效预防骨质疏松和心血管疾病的发生,降低激素替代治疗带来的潜在风险,但是用药过程中需要对血清中的雌激素浓度进行有效即时的监测,以避免由于血清雌激素过高而增加诱发乳腺肿瘤的风险。因此正确的激素补充剂量和有效的血清雌激素监测才是激素替代过程中风险评估的重要解决手段。但是,雌激素在体内的代谢存在明显个体差异,如何快速、动态、即时监测激素替代后体内的血清游离雌激素水平是目前面临的巨大挑战。
目前临床检测雌激素主要采用免疫学方法,比如基于免疫生化检测仪的酶联免疫吸附实验、化学发光、电化学发光等方法。全自动的免疫生化检测仪具有高灵敏度和高通量的特点,但是检测时间长,需样量大(需静脉血3-4ml),且免疫分析仪多为大型仪器,价格高,仅适于医院的检验科或中心实验室,无法实现即时检测和动态观察;作为金标准的液相色谱-串联质谱法,精度较高,可以检测雌激素的下限达5pg/ml,但是液体分离步骤复杂,仪器设备昂贵,需要特殊的专业技术,不适合临床常规激素监测。因此目前已有的检测手段对于需要动态监测血清雌激素浓度的患者,不仅会增加其反复就诊的经济负担、时间损失,重复静脉采血还会对身体造成多次损伤,同时,长达6-12小时的化验结果的等待也为医院的门诊带来巨大的负荷。
因此急需解决激素快速、灵敏、即时检测的临床需求。
技术实现要素:
根据本发明实施例提供的技术方案解决的技术问题是快速、灵敏、即时检测激素,以满足临床快速、动态、即时监测激素的实际需求。
根据本发明实施例提供的一种低丰度激素检测方法,执行检测的装置具有多层结构,每层结构的电泳通路区相互连通形成电泳通路,所述方法包括:
在所述装置的顶层的表面滴加尾随电解质和待测液体;
在所述装置的底层的表面滴加前导电解质;
通过在所述顶层和所述底层之间施加直流电压,开始电泳,使所述尾随电解质和待测液体沿着所述电泳通路向底层方向迁移,所述前导电解质沿着所述电泳通路向顶层方向迁移;
电泳期间,当所述待测液体中的待测激素迁移并聚集于所述装置的富集层时,通过解除在所述顶层和所述底层之间施加的直流电压,停止电泳;
将聚集于所述富集层的待测激素移动至所述装置的检测层的检测区,并通过对所述检测区进行电化学检测,确定所述待测激素的浓度。
优选地,所述顶层包括具有顶部电泳电极、顶部加样区、顶部连接通路和电泳通路区的顶部加样层,所述的在所述装置的顶层的表面滴加尾随电解质和待测液体的步骤包括:
将所述尾随电解质和所述待测液体滴加至所述顶部加样区,并使所述尾随电解质和所述待测液体经由所述顶部连接通路流动至所述顶部加样层的电泳通路区。
优选地,所述顶层还包括:
移动隔离层,其包括固定部分和能够在所述固定部分插入或抽出的移动部分;
第一微通路层,其具有用于构成电泳通路的多层结构;
其中,当所述移动隔离层的所述移动部分从所述固定部分抽出时,所述顶部加样层和所述第一微通路层之间的电泳通路断开;
其中,当所述移动隔离层的所述移动部分插入所述固定部分时,所述顶部加样层和所述第一微通路层之间的电泳通路导通。
优选地,根据待测激素的分子量和所能携带的电荷,确定所述第一微通路层的层数。
优选地,所述底层包括具有底部电泳电极、底部加样区、底部连接通路和电泳通路区的底部加样层,所述的在所述装置的底层的表面滴加前导电解质的步骤包括:
将所述前导电解质滴加至所述底部加样区,并使所述前导电解质经由所述底部连接通路流动至所述底部加样层的电泳通路区。
优选地,所述底层还包括:
第二微通路层,其具有用于构成电泳通路的多层结构。
优选地,根据待测激素的分子量和所能携带的电荷,确定所述第二微通路层的层数。
优选地,通过控制所施加的直流电压的强度和时间,使所述待测液体中的待测激素迁移并聚集于所述富集层。
优选地,所述富集层包括固定部分和能够在所述固定部分插入或抽出的移动部分,所述检测层包括电泳通路区和具有检测电极的检测区,所述的将聚集于所述富集层的待测激素移动至所述装置的检测层的检测区,并通过对所述检测区进行电化学检测,确定所述待测激素的浓度的步骤包括:
从所述富集层的固定部分抽出移动部分并移动至所述检测层的检测区上方,使富集于所述移动部分的待测激素流动到所述检测区的检测电极上;
通过检测所述检测区的电信号,得到检测电流;
根据所得到的检测电流,确定所述待测激素的浓度。
根据本发明实施例提供的一种低丰度激素检测装置,所述装置包括:
包括顶层、富集层、检测层和底层的多层结构,每层结构的电泳通路区相互连通形成电泳通路;
在所述顶层和所述底层之间施加或解除直流电压的直流电源;
其中,在所述顶层的表面滴加尾随电解质和待测液体,在所述底层的表面滴加前导电解质;
其中,在所述顶层和所述底层之间施加直流电压,开始电泳,使所述尾随电解质和待测液体沿着所述电泳通路向底层方向迁移,所述前导电解质沿着所述电泳通路向顶层方向迁移,并当所述待测液体中的待测激素迁移并聚集于所述富集层时,通过解除在所述顶层和所述底层之间施加的直流电压,停止电泳;
其中,将聚集于所述富集层的待测激素移动至所述检测层的检测区,并通过对所述检测区进行电化学检测,确定所述待测激素的浓度。
本发明实施例提供的技术方案具有如下有益效果:
本发明实施例为了满足,采用等速电泳分离富集和直接免疫电化学测量相结合的方式,能够快速、灵敏、即时的检测激素,满足临床快速、动态、即时监测低丰度蛋白的实际需求,且能够降低检测设备的成本。
附图说明
图1是本发明实施例提供的低丰度激素检测方法流程框图;
图2是本发明实施例提供的低丰度激素检测装置的爆炸图;
图3是图2中顶部加样层1的结构示意图;
图4a是图2中移动隔离层2的结构示意图;
图4b是图2中移动隔离层2的移动部分从固定部分抽出的示意图;
图4c是裁剪前的移动隔离层结构示意图;
图5是图2中第一微通路层3的结构示意图;
图6a是图2中富集层4的结构示意图;
图6b是图2中富集层4的移动部分从固定部分抽出的示意图;
图6c是裁剪前的富集层结构示意图;
图7是图2中检测层5的结构示意图;
图8是图2中第二微通路层6的结构示意图;
图9是图2中底部加样层7的结构示意图;
图10a至图10f是采用图2的装置进行激素检测的检测过程图;
附图标记说明:1-顶部加样层;2-移动隔离层;3-第一微通路层;4-富集层;5-检测层;6-第二微通路层;7-底部加样层;11-顶部加样层的疏水区;12-顶部加样区;13-顶部连接通路;14-顶部加样层的电泳通路区;15-顶部电泳电极;21-移动隔离层的固定部分;22-移动隔离层的移动部分;23-移动隔离层的疏水区;24-移动隔离层的电泳通路区;31-第一微通路层的疏水区;32-第一微通路层的电泳通路区;41-富集层的固定部分;42-富集层的移动部分;43-富集层的疏水区;44-富集层的电泳通路区;51-检测层的疏水区;52-检测层的电泳通路区;53-检测区;54-参比电极;55-工作电极;56-对电机;57-电极接线;61-第二微通路层的疏水区;62-第二微通路层的电泳通路区;63-第二微通路层的检测通路区;71-底部加样层的疏水区;72-底部加样区;73-底部连接通路;74-底部加样层的电泳通路区;75-底部电泳电极。
具体实施方式
以下结合附图对本发明的优选实施例进行详细说明,应当理解,以下所说明的优选实施例仅用于说明和解释本发明,并不用于限定本发明。
图1是本发明实施例提供的低丰度激素检测方法流程框图,执行检测的装置具有包括顶层、富集层、检测层、底层的多层结构,每层结构的电泳通路区相互连通形成电泳通路,如图1所示,步骤包括:
步骤S101:在所述装置的顶层的表面滴加尾随电解质和待测液体。
所述顶层包括上表面具有顶部电泳电极、用来滴加尾随电解质和所述待测液体的顶部加样区、顶部连接通路和电泳通路区的顶部加样层。顶部电泳电极的一端位于顶部加样区,顶部加样区与电泳通路区通过顶部连接通路连接。其中,所述顶部加样层的顶部加样区、顶部连接通道和电泳通路区为亲水区,所述顶部加样层的其它区域为疏水区。
步骤S101包括:将所述尾随电解质和所述待测液体滴加至所述顶部加样区,并使所述尾随电解质和所述待测液体沿着所述顶部连接通路流动至所述顶部加样层的电泳通路区。顶部加样层可采用Whatman公司的plasma separation膜LF1作为基材,从而在待测液体从顶部加样层的顶部加样区向电泳通路区流动期间,对待测液体中的红细胞和白细胞有效截流,减少血液对检测的干扰。
所述顶层还包括移动隔离层,移动隔离层包括固定部分和移动部分,固定部分的上表面与顶部加样层的下表面连接,移动部分能够从所述固定部分插入或抽出,电泳通路区位于移动部分。其中,移动隔离层的电泳通路区为亲水区,所述移动隔离层的其它区域为疏水区。
所述顶层还包括第一微通路层,第一微通路层为每层均具有电泳通路区的多层结构,层数可根据待测激素的分子量和所能携带的电荷而确定,该多层结构的上表面与移动隔离层固定部分的下表面连接,下表面与富集层固定部分的上表面连接。其中,第一微通路层的电泳通路区为亲水区,所述第一微通路层的其它区域为疏水区。
在执行步骤S101期间,移动隔离层的移动部分从固定部分抽出,使顶部加样层和第一微通路层之间的电泳通路断开。
步骤S102:在所述装置的底层的表面滴加前导电解质。
所述底层包括下表面具有底部电泳电极、用来滴加前导电解质的底部加样区、底部连接通路和电泳通路区的底部加样层。底部电泳电极的一端位于底部加样区,底部加样区与电泳通路区通过底部连接通路连接。其中,所述底部加样层的底部加样区、底部连接通道和电泳通路区为亲水区,所述底部加样层的其它区域为疏水区。
步骤S102包括:将所述前导电解质滴加至所述底部加样区,并使所述前导电解质沿着所述底部连接通路流动至所述底部加样层的电泳通路区。
所述底层还包括第二微通路层,第二微通路层为每层均具有电泳通路区的多层结构,层数可根据待测激素的分子量和所能携带的电荷而确定,该多层结构的下表面与所述底部加样层的上表面连接,上表面与所述检测层的下表面连接。其中,第二微通路层的电泳通路区和检测通路区为亲水区,所述第二微通路层的其它区域为疏水区。
步骤S103:通过在所述顶层和所述底层之间施加直流电压,开始电泳,使所述尾随电解质和待测液体沿着所述电泳通路向底层方向迁移,所述前导电解质沿着所述电泳通路向顶层方向迁移。
在顶层和底层之间施加直流电压之后,将移动隔离层的移动部分插入固定部分,使顶部加样层和第一微通路层之间的电泳通路导通,从而开始电泳。
步骤S104:电泳期间,当所述待测液体中的待测激素迁移并聚集于所述装置的富集层时,通过解除在所述顶层和所述底层之间施加的直流电压,停止电泳。
所述富集层包括固定部分和移动部分,固定部分的上表面与第一微通路层的下表面连接,固定部分的下表面与检测层连接,移动部分能够在所述固定部分插入或抽出,电泳通路区位于移动部分。其中,所述富集层的电泳通路区为亲水区,所述富集层的其它区域为疏水区。
其中,通过控制所施加的直流电压的强度和时间,使所述待测液体中的待测激素迁移并聚集于所述富集层。具体地说,通过有限次试验,可以得到待测激素在指定电压强度下迁移并聚集至富集层所用的时间,进而建立关于电压强度、施加电压时间、激素类型之间的对应关系表,在具体操作时,即可根据需要检测的激素类型,在指定时间内施加指定强度的电压,从而使待测激素聚集至富集区。
步骤S105:将聚集于所述富集层的待测激素移动至所述装置的检测层的检测区,并通过对所述检测区进行电化学检测,确定所述待测激素的浓度。
所述检测层包括电泳通路区和具有检测电极的检测区,检测层的上表面连接富集层的固定部分,检测层的下表面连接第二微通路层的上表面。其中,检测层的电泳通路区和检测区为亲水区,所述检测层的其它区域为疏水区。
步骤S105包括:从所述富集层的固定部分抽出移动部分并移动至所述检测层的检测区上方,使聚集于所述移动部分电泳通路区的待测激素流动到所述检测区的检测电极上;通过检测所述检测区的电信号,得到检测电流;根据所得到的检测电流,确定所述待测激素的浓度。
需要说明的是,本发明实施例采用的前导电解质和尾随电解质是用于完成等速电泳的液态离子介质,成分不同。
需要说明的是,本发明实施例采用等速电泳方法有效进行待测激素的预浓缩
待测激素的预富集是提高血清中低丰度蛋白浓度的重要方法,采用等速电泳方法有效进行样品的预浓缩,等速电泳方法是一种不连续介质电泳技术,在直流电作用下由于待测样品中不同物质粒子的有效淌度不同,在移动中发生富集,聚集在前导电解质和尾随电解质之间的不同位置,其中,电泳淌度是单位场强下离子的平均电泳速度,因为电泳速度与外加电场强度有关,因此在电泳中常用淌度而不用速度来描述荷电离子的电泳行为和特性。本发明实施例的电泳可以作用于血液中的全部有型物质,由于不同物质的涌动速度不同,会在前导电解质和尾随电解质之间分层,待检测激素会聚集在某一特定层(即富集层),将该特定层的待检测激素引导到检测的芯片(即检测层),以便完成后续免疫检测和信号放大工作。
直接免疫电化学测量是通过在电极表面电沉积技术定向修饰纳米复合材料和电活性物质,再通过自组装技术将抗体固定在纳米材料表面,通过抗体与被测物抗原高特异性结合产生电场变化,阻碍了电活性物质向电极表面的扩散,使得检测到的电流减小,从而使待测抗原浓度与检测到电流的大小成反比关系。因此,本发明实施例可以预先建立待检测激素的浓度与检测到的电流之间的关系表,后续进行激素检测时,即可根据检测到的电流的大小,确定引导到检测区的待检测激素的浓度。对检测区的电流进行检测时,可以采用三电极体系进行电化学检测,三电极体系为现有技术,本发明实施例在此不再赘述。
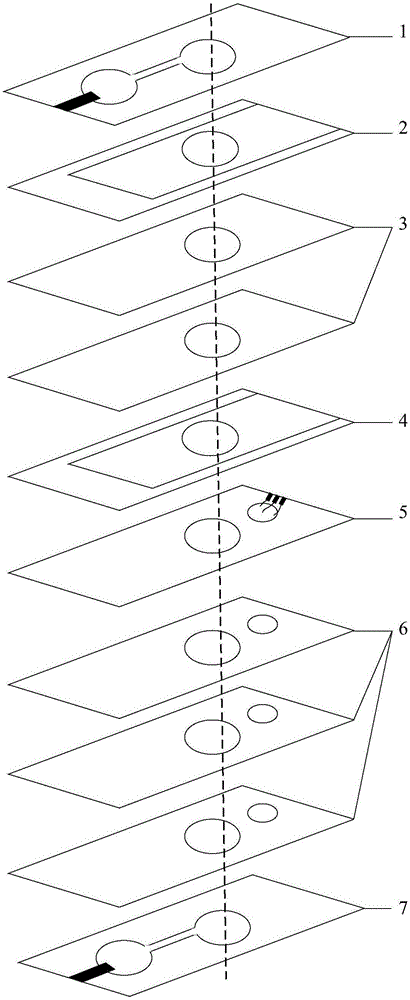
图2是本发明实施例提供的低丰度激素检测装置的爆炸图,如图2所示,所述装置采用多层结构,从上到下包括七个部分,依次为顶部加样层1、移动隔离层2、具有多层结构的第一微通路层3、移动富集层(即富集层)4、检测层5、具有多层结构的第二微通路层6和底部加样层7。其中,所述七个部分均具有电泳通路区,电泳通路区相互连通形成电泳通路。
其中,移动隔离层2包括移动部分和固定部分,且电泳通路区均位于移动部分。通过将移动部分从固定部分抽出,使移动隔离层2电泳通路区偏离电泳通路,从而断开电泳通路,停止电泳。通过将移动部分插入固定部分,使移动隔离层2电泳通路区回归电泳通路,从而导通电泳通路。
其中,移动富集层4均包括移动部分和固定部分,且电泳通路区(即电泳富集区)均位于移动部分。待测激素迁移并聚集至移动富集层4的电泳富集区之后,通过将移动部分从固定部分抽出并移动至检测层5的检测区的上方,将聚集至电泳富集区的待测激素引导至检测区,以便进行后续电化学检测。
需要说明的是,顶部加样层1、移动隔离层2、第一微通路层3和富集层4的形状大小相同;检测层5、第二微通路层6、底部加样层7的形状大小相同,且长度大于顶部加样层1、移动隔离层2、第一微通路层3和富集层4,在长度大于顶部加样层1、移动隔离层2、第一微通路层3和富集层4的部分具有检测区53和检测通路区63。
本装置可以检测包括血液中所有激素在内的物类固醇。
图3是图2中顶部加样层1的结构示意图,如图3所示。
基材:采用Whatman公司的plasma separation膜LF1作为基材,这种膜可以有效地截流血液中的红细胞白细胞,减小血液对检测的干扰。
结构:包括疏水区11,顶部加样区12,顶部连接通路13,电泳通路区14,顶部电泳电极15。其中,顶部电泳电极15的一端位于顶部加样区12内,顶部加样区12通过顶部连接通路13连接电泳通路区14,从而使滴加在顶部加样区12的液体沿着顶部连接通路13流动至电泳通路区14。
作用:1)在顶部加样区12滴加电泳液和待测样品的混合液,混合液经顶部连接通路13,流到电泳通路区14;2)在流动中,过滤待测样品中的红细胞和白细胞。
制备过程:1)采用喷蜡打印机对滤纸进行喷蜡打印。其中,顶部加样区12,顶部连接通路13,电泳通路区14三个部分为空白部分(即不做喷蜡处理),其它部分为喷蜡部分。2)喷蜡打印完成后,采用精确数控加热仪器加热处理打印好的滤纸,喷蜡部分的蜡融化形成疏水区11,空白部分为亲水区,分为顶部加样区12、顶部连接通路13、电泳通路区14。3)顶部加样区12采用丝印方式丝印碳浆电极,作为顶部电泳电极15。
图4a是图2中移动隔离层2的结构示意图,图4b是图2中移动隔离层2的移动部分从固定部分抽出的示意图,图4c是裁剪前的移动隔离层结构示意图,如图4a至图4c所示。
基材:Whatman 1号滤纸作为基地材料。
结构:分为两部分,固定部分21和移动部分22。其中固定部分21的大小尺寸与顶部加样层1相同;移动部分22包括疏水区23和亲水的电泳通路区24,电泳通路区的形状(例如圆形)和大小与顶部加样层1的电泳通路区14相同,在移动隔离层2上的位置与顶部加样层1的电泳通路区14相同,以保证上下可以导通。
作用:用于隔离电泳通路。
检测:检测时,首先将移动部分22抽出,如图4b所示,保障电泳通路不导通,电泳开始后,推回移动部分22,如图4a所示。
制备过程:1)采用喷蜡打印机对滤纸进行喷蜡打印,如图4c所示,电泳通路区24为空白部分(即不做喷蜡处理),其它部分为喷蜡部分,其中,空白部分的形状大小与顶部加样层1的电泳通路区14相同,在移动隔离层2上的位置与顶部加样层1的电泳通路区14相同,以保证上下可以导通。2)喷蜡打印完成后,采用精确数控加热仪器加热处理打印好的滤纸,喷蜡部分的蜡融化形成疏水区,空白部分为亲水区。3)将其裁剪为固定部分21和移动部分22。4)组装时,固定部分21两面分别通过双面胶和上下的隔层粘合,移动部分22不进行粘合置于中间,组装后可以左右移动。
图5是图2中第一微通路层3的结构示意图,如图5所示。
基材:采用Whatman 1号滤纸为基材。
结构:由多层滤纸粘合而成,层数一般为2-8层,具体层数根据所需检测蛋白质的分子量和所带电荷比确定。每层结构均包括疏水区31和电泳通路区32;电泳通路区32的形状(例如圆形)和大小与顶部加样层1的电泳通路区14相同,在第一微通路层3上的位置与顶部加样层1的电泳通路区14相同,以保证上下可以导通。
作用:用于构成电泳通路。
制备过程:1)采用喷蜡打印机对滤纸进行喷蜡打印,其中电泳通路区32为空白部分(即不做喷蜡处理),其它部分为喷蜡部分,。2)喷蜡打印完成后,采用精确数控加热仪器加热处理打印好的滤纸,使喷蜡部分的蜡融化形成疏水区,空白区为亲水区。3)将多层粘合组装形成第一微通路层3。
图6a是图2中富集层4的结构示意图,图6b是图2中富集层4的移动部分从固定部分抽出的示意图,图6c是裁剪前的富集层结构示意图,如图6a至图6c所示。
基材:Whatman 1号滤纸作为基地材料。
结构:如图6a和6b所示,分为两部分,固定部分41和移动部分42。其中固定部分41的大小尺寸与顶部加样层1相同;移动部分42包括疏水区43和亲水的电泳通路区(即电泳富集区)44,电泳富集区44的形状(例如圆形)和大小与顶部加样层1的电泳通路区14相同,在富集层4上的位置与顶部加样层1的电泳通路区14相同,以保证上下可以导通。
作用:电泳开始时,移动部分42保证电泳通路导通,如图6a所示,在等速电泳作用下,待测液体中的待测蛋白质富集移动,通过调节电泳电压和时间,保证待测蛋白质在本层电泳富集区44富集;电泳完成后,电泳富集区44附有高浓度待测物,将移动部分42抽出,如图6b所示,使移动部分42上的电泳富集区44和检测层5上的检测区53上下重合,在滤纸的毛细作用下,高浓度待测物流到检测电极上。
制备过程:1)采用喷蜡打印机对滤纸进行喷蜡打印,如图6c所示,电泳富集区44为空白部分(即不做喷蜡处理),其它部分为喷蜡部分,其中,空白部分的形状大小与顶部加样层1的电泳通路区14相同,在富集层4上的位置与顶部加样层1的电泳通路区14相同,以保证上下可以导通。2)喷蜡打印完成后,采用精确数控加热仪器加热处理打印好的滤纸,喷蜡部分的蜡融化形成疏水区,空白部分为亲水区。3)将其裁剪为固定部分41和移动部分42。4)组装时,固定部分41两面分别通过双面胶和上下的隔层粘合,移动部分42不进行粘合置于中间,组装后可以左右移动。
图7是图2中检测层5的结构示意图,如图7所示。
基材:Whatman 1号滤纸作为基地材料。
结构:检测层5包括疏水区51,电泳通路区52,检测区53,参比电极54,工作电极55,对电极56,电极连线(即电极接线)57。其中,参比电极54、工作电极55、对电极56的一端分别位于检测区53的不同位置,参比电极54、工作电极55、对电极56的另一端引出并分别连接一个电极接线57。
作用:1)检测区,采用经典的三电极电化学检测体系,对待测物进行检测该检测步骤为现有技术,在此不再赘述;2)电泳通路区52用于电泳过程。
制备过程:1)采用喷蜡打印机对滤纸进行喷蜡打印,电泳通路区52和检测区53为空白部分(即不做喷蜡处理),其它部分为喷蜡部分,其中,空白部分的形状大小与顶部加样层1的电泳通路区14相同,在富集层4上的位置与顶部加样层1的电泳通路区14相同,以保证上下可以导通。2)采用精确数控加热仪器加热处理打印好的滤纸,使喷蜡部分的蜡融化形成疏水区5-1,空白部分形成亲水通路,包括电泳通路区52和检测区53。3)采用丝印方式在检测区丝印作为工作电极55(碳浆),对电极56(碳浆),参比电极54(Ag/Agcl)。4)对工作电极表面修饰,固定待测物的特异性抗体,用于检测待测物。
图8是图2中第二微通路层6的结构示意图,如图8所示。
基材:采用Whatman 1号滤纸为基材。
结构:由多层滤纸粘合而成,层数一般为2-8层,具体根据所需检测蛋白质的分子量和所带电荷比确定;每层结构均包括疏水区61、电泳通路区62、检测通路区63,每层大小与检测层5相同,电泳通路区62、检测通路区63的大小和位置分别与电泳通路区52和检测区53相同。
作用:1)电泳通路区62保证上下可以导通;2)检测通路区63与检测区53相连,为液体流动提供毛细管力作用。
制备过程:1)采用喷蜡打印机对滤纸进行喷蜡打印,电泳通路区62和检测通路区63为空白部分,(即不做喷蜡处理),其它部分为喷蜡部分。2)喷蜡打印完成后,采用精确数控加热仪器加热处理打印好的滤纸,喷蜡部分的蜡融化形成疏水区61,空白部分为亲水区。3)将多层粘合组装。
图9是图2中底部加样层7的结构示意图,如图9所示。
基材:采用Whatman公司的Whatman 1号滤纸。
结构:底部加样层7的大小和第二微通路层6相同,结构包括疏水区71、底部加样区72、底部连接通路73、电泳通路区74、底部电泳电极75。其中,底部电泳电极75的一端位于底部加样区72内,底部加样区72通过底部连接通路73连接电泳通路区74,从而使滴加在底部加样区72的液体沿着底部连接通路73流动至电泳通路区74。
作用:1)在底部加样区72滴加电泳液,液体经底部连接通路73,流到电泳通路区74;2)为进行电泳,在底部电泳电极75和顶部电泳电极15之间施加电压,电压伏值在9-12V之间,具体由实验确定。
制备过程:1)采用喷蜡打印机对滤纸进行喷蜡打印,其中底部加样区72、底部连接通路73、电泳通路区74三个部分为空白部分(即不做喷蜡处理),其它部分为喷蜡部分。2)喷蜡打印完成后,采用精确数控加热仪器加热处理打印好的滤纸,喷蜡部分的蜡融化形成疏水区71,空白部分为亲水区,分为底部加样区72、底部连接通路73、电泳通路区74。3)在底部加样区72采用丝印方式丝印碳浆电极,作为底部电泳电极75。
按照图2中给出的次序,将图3至图9所示的7个部分依次通过胶水粘合在一起,形成本发明实施例的装置,其中,各层的电泳通路区不加胶水,保证通路的导通。
本发明实施例将以纸质基质为载体的微流控芯片与微型化的等速电泳装置进行整合,等速电泳装置可以用来对微量血液(现有技术中常规检测采用静脉采血3ml,而本发明实施例的装置仅需要手指血,即1-2滴血,约50ul-100ul)中的微量激素进行浓缩,以提高待测物质。在能够找到合适的抗体的基础上,均可以采用本实施例的装置对相应激素进行检测。具体的检测策略是采用直接电免疫化学方法,根据抗原-抗体反应进行待检测指标的免疫识别和信号放大,获得的免疫信号再转化成电信号,得到有效放大,获得检测结果。
本发明实施例能够对包括雌激素在内的各种激素进行有效的富集和灵敏的检测。
图10a至图10f是采用图2的装置进行激素检测的检测过程图,如图图10a至图10f所示。
1)如图10a所示,首先将移动隔离层2的移动部分22抽出,使移动隔离层2的疏水区23处于顶部加样层1的电泳通路区14和第一微通路层3的电泳通路区32之间,隔断电泳通路。
非移动部分(即固定部分)和移动部分是分开的,非移动部分粘合在一起,为移动部分提供可以活动的槽,移动部分可以在槽中来回移动。
2)如图10b所示,在顶部加样层1滴加待测液体样品(即手指血1-2滴血,约50ul-100ul),液体样品经过由plasma separation膜LF1制备的顶部加样层1,血液样品流动过程中,红细胞和白细胞被滤除,待测样品流动到电泳通路;之后在1顶部加样层滴加尾随电解质(Terminating Electrolyte,TE),TE液流到电泳通路。在底部加样层7滴加电泳前导电解质(Leading Electrolyte,LE),LE液经过底部连接通路73,流到电泳通路区74。但由于移动隔离层2的移动部分22已抽出,电泳通路被隔断,两种液体没有导通。
其中LE液有效淌度比样品中待测物大,TE液有效淌度比样品中待测物小。样品加在领先离子和终末离子之间,在外电场作用下,使各种离子进行移动,经过一段时间电泳后,达到完全分离。被分离的各离子的区带按迁移率大小依序排列在领先离子与终末离子的区带之间。也就是说,电泳开始后,在外电场作用下,使液体样品中的各种离子进行移动,经过一段时间电泳后,达到完全分离。被分离的各离子的区带按有效淌度大小依序排列在LE液与TE液的区带之间,以实现待测物的分离和富集。
3)如图10c所示,在顶部电泳电极15和底部电泳电极75之间,施加直流电压,电压在9-12V之间,具体大小根据不同待测物而确定。
4)如图10d所示,将移动隔离层2的移动部分22推入固定部分21,导通电泳通路,电泳开始。经过一段时间后,待测样品中的待测物富集在移动富集层4的电泳富集区44。
待测蛋白富集后会以一定的速度移动,该速度和电压的大小和通路的尺寸相关,可以通过控制其流速和加电的时间,保证富集后的待测蛋白移动到特定层,本实施例将待测蛋白富集并移动到富集层4。
5)如图10e所示,移动富集层4的电泳富集区44附有高浓度待测物,将移动部分42抽出,使移动部分42上的电泳富集区44和检测层5上的检测区53上下重合,在滤纸的毛细作用下,高浓度待测物流到检测区53的检测电极上。
6)如图10f所示,采用三电极体系对检测层5进行电化学检测。
电极表面具有待测蛋白的抗体,当待测蛋白流动到检测区53时,待测蛋白与抗体相互结合,将导致电流变化,通过检测电流,即可最终确定待测蛋白浓度。例如,参比电极54提供参比电压;工作电极55和对电极56之间产生电流;在工作电极55上固定待测蛋白的抗体,以进行不同种类的待测蛋白的电化学免疫测试,得到电流数据;根据电流数据与待测蛋白浓度的对应关系,得到待测蛋白浓度。
综上所述,本发明实施例具有以下有益效果:
1)本发明实施例采用纸质基材,价格低,降低了成本;
2)本发明实施例通过喷蜡打印,加热熔蜡的方式形成微沟道,加工简单,易于批量化制备;
3)本发明实施例采用具有过滤作用的滤纸作为加样层,可以滤掉体液中的有形成分(即血液中的血细胞,包括红细胞和白细胞),有利于体液样品检测;
4)本发明实施例将样品预富集的等速电泳方法用于电化学免疫检测为基础的纸质芯片中,通过提高待测指标浓度和优化电极检测灵敏度两种方法的有机结合,最大程度提高了低浓度待测物的检测灵敏度;
5)本发明实施例采用微加工工艺形成微沟道和反应区,有效减小用样量;通过双面胶粘合、热压塑封及加密封罩等手段进行芯片(即各层结构)组装避免加样后散溢;
6)本发明实施例采用多层组合3D设计,实现精准的流路控制,保证液体能均匀流向检测区,在芯片上一步完成,加样、分离、样品浓缩、免疫检测等功能,实现激素的即时、准确检测。
尽管上文对本发明进行了详细说明,但是本发明不限于此,本技术领域技术人员可以根据本发明的原理进行各种修改。因此,凡按照本发明原理所作的修改,都应当理解为落入本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!