评价结合抗A或者抗B抗体的层析介质的质量的方法与流程
本申请要求2015年9月8日提交的美国临时专利申请No.62/215,423的优先权,其全部内容都以整体援引加入本文。
发明背景
免疫球蛋白富集的人血浆用于治疗许多病征以及用于治疗某些先天性缺陷。通常,通过从具有不同血型的多个供血者汇集血浆而获得人血浆。血型可以分为四种主要的的类型。A血型–在红细胞上仅具有A抗原(以及血浆中具有B抗体);B血型–在红细胞上仅具有B抗原(以及血浆中具有A抗体);AB血型–在红细胞上具有A和B抗原(但在血浆中既不具有A抗体也不具有B抗体);和O血型–在红细胞上既不具有A抗原也不具有B抗原(A和B抗体都在血浆中)。
重要的是,具有特定血型抗原如A的红血细胞从来都不会与结合此抗原的抗体如抗A抗原抗体接触,因为与此类抗体接触会导致其红血细胞的凝集和/或溶血,这甚至会导致死亡。因此,具有A血型的受血者仅可接受来自具有A血型或AB血型的供血者的血浆;具有B血型的受血者仅可接受来自具有B血型或AB血型的供血者的血浆;具有AB血型的受血者仅可接受来自具有AB血型的供血者的血浆;而具有O血型的受血者被认为是万能受血者。不同血型的相容性对于安全的输血和器官移植的开发是重要的。然而,在血液衍生的治疗药物的情况中,其中依赖于汇集来自很多人的血浆以获得蛋白组分的恒定均值,此时确保受血者不会接受不相容的血浆将会是特别具有挑战性的。
已经开发了很多方法来选择性地从血浆中去除血型抗体,包括经福尔马林处理的热处理红细胞(Vox Sang.,1967,12,75-77)、经热处理的具有A和B抗原的大肠杆菌(Escherichia coli)O86:B7(Transfusion,1972,12,98-102)、红细胞基质粉末、源自免疫吸附剂的红细胞基质抗原(Chemical Soc.Rev.,1978,7,423-452)、和合成的血型A和B免疫吸附剂(Rev.Fr.Transfus.Immunohematol.1981,24,3,281-287)。
已经开发了固相层析免疫吸附剂作为商用层析介质,以用以处理源自产物的血液以及也用于在输血至ABO不相容受血者之前对于供血者的准备。利用合成的免疫吸附剂的一个关键优势在于,它们是合成构建的而不是源自天然来源因而在批次与批次之间会具有更一致的性质。
目前,一些具有血型A抗原(A-抗原)配体和/或血型B抗原(B-抗原)配体的商业可用的层析介质包括Glycosorb-ABO装置(Glycorex Transplantation AB)。此种Glycosorb装置用于将器官供者准备为用来移植至具有不相容血型的患者。所述Glycosorb-ABO装置中的血型抗原配体从器官供体的血液中结合并去除血型A抗原抗体(抗-A)和血型B抗原抗体(抗-B),由此降低器官排斥的风险。
利用层析介质纯化血液衍生品的一个主要挑战在于,缺少有效且可重复的方法来评价不同介质的相对质量,例如,不同批次的相同类型介质或者来自不同来源的介质或者随着时间的相同介质。
发明概述
本文所述的实施方案涉及用于评价含有血型A抗原配体或血型B抗原配体的层析介质的质量的方法。本文所述的方法特别可用于分析或评价不同批次的相同类型介质与批次之间的质量(在使用期间或者在使用之后)以及用于在开发期间将介质最优化。
在一些实施方案中,提供了用于比较两种或更多种亲和层析介质样品的质量的方法,其均含有附着至固体支持物的血型A抗原配体,其中所述方法包括以下步骤:(a)提供两种或更多种亲和层析介质样品,每种的体积为VR;(b)将每个样品与已知浓度C1和体积VM的纯化的单克隆IgM-A抗体溶液温育;(c)获得每种样品的上清,并测量每种上清中IgM-A抗体的浓度C2;使用以下方程式确定每种亲和层析介质样品的静态结合能力:
其中所述介质样品对于IgM-A的静态结合能力与其从样品中去除抗-A抗体的能力相关联,由此提供了两种或更多种不同的亲和层析介质样品质量的比较。
在其它实施方案中,提供了用于比较两种或更多种亲和层析介质样品的质量的方法,其均含有附着至固体支持物的血型B抗原配体,其中所述方法包括以下步骤:(a)提供两种或更多种亲和层析介质样品,每种的体积为VR;(b)将每个样品与已知浓度C1和体积VM的纯化的单克隆IgM-B抗体溶液温育;(c)获得每种样品的上清并测量每种上清中IgM-B抗体的浓度C2;使用以下方程式确定每种亲和层析介质样品的静态结合能力:
其中所述介质样品对于IgM-B的静态结合能力与其从样品中去除抗-B抗体的能力相关联,由此提供了两种或更多种亲和层析介质样品质量的比较。
相对于与其进行比较的其它样品,对于IgM-A或IgM-B具有较高结合能力的样品,则比其它介质样品有更好的质量。
在本文所述方法的一些实施方案中,所述固体支持物是多孔或非多孔聚合物固体支持物,其包含选自以下组的聚合物:聚乙烯醚、聚乙烯醇、聚甲基丙烯酸酯、聚丙烯酸酯、聚苯乙烯、聚丙烯酰胺、聚甲基丙烯酰胺和聚碳酸酯。在特定的实施方案中,所述固体支持物是基于聚乙烯醚的固体支持物。在一些实施方案中,所述固体支持物是珠的形式(例如,基于聚乙烯醚的珠).
在本文所描述的一些实施方案中,不同的亲和层析介质样品由不同批次的相同类型介质构成。
在其它实施方案中,不同的亲和层析介质样品由处于不同使用阶段的相同类型介质构成。
在一些实施方案中,所述介质能够从选自以下的组的样品中去除抗A或抗B抗体:血液、血液制品、血浆、血浆衍生物和IVTG。
在一些实施方案中,使用280nm处的光吸收测量上清中IgM-A或IgM-B抗体的浓度。
本文还提供了用于对含有附着至固体支持物的血型A抗原配体或血型B抗原配体的亲和层析介质的质量进行评价的方法(在亲和层析介质暴露于酸性或碱性条件后),所述方法包括以下步骤:(a)提供具有附着至固体支持物的血型A抗原配体或血型B抗原配体的层析介质;(b)测量所述介质对于纯化的IgM-A抗体(血型A抗原配体介质的情况)或者对于纯化的IgM-B抗体(血型B抗原配体介质的情况)的结合能力;(c)将所述介质暴露于酸性或者碱性环境至少5小时;以及(d)测量所述介质对于纯化的IgM-A抗体(血型A抗原配体介质的情况)或者对于纯化的IgM-B抗体(血型B抗原配体介质的情况)的结合能力;其中步骤(d)中介质的结合能力相对于步骤(b)有降低表明介质的质量在暴露于酸性或碱性环境后有降低。
本文所述的实施方案俺也可用于确定介质是否包含血型A抗原配体或血型B抗原配体,其中所述方法包括以下步骤:(a)提供介质,其中未知所述介质是否包含血型A抗原配体或血型B抗原配体;(b)测量该未知介质对于纯化的单克隆IgM-A抗体以及分别对纯化的单克隆IgM-B抗体的结合能力;和(c)比较该未知介质对于纯化的单克隆IgM-A抗体和对于纯化的单克隆IgM-B抗体的能力;其中如果所述未知介质对于单克隆IgM-A抗体具有比其对单克隆IgM-B抗体更高的结合能力,则确定该未知介质包含血型A抗原配体;而如果所述未知介质对于单克隆IgM-B抗体具有比其对单克隆IgM-A抗体更高的结合能力,则确定该未知介质包含血型B抗原配体。
在一些实施方案中,如果未知介质对于单克隆IgM-A抗体具有结合能力而对于单克隆IgM-B抗体无结合能力,则确定该未知介质包含血型A抗原配体。相反,如果未知介质对于单克隆IgM-B抗体具有结合能力而对于单克隆IgM-A抗体无结合能力,则确定该未知介质包含血型A抗原配体。
附图简述
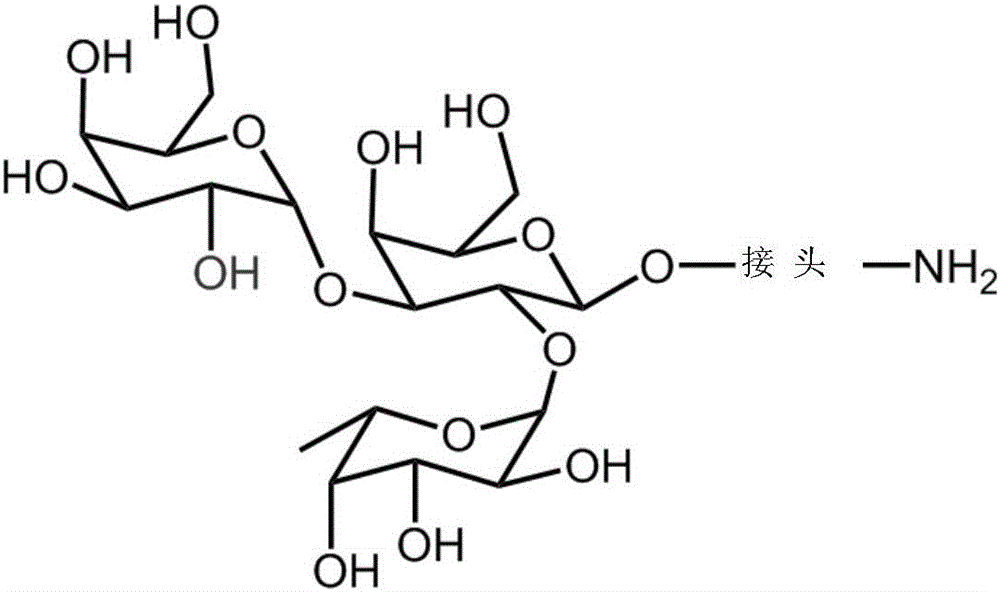
图1是代表性的寡糖配体,其结合抗A抗原抗体。
图2是代表性的寡糖配体,其结合抗-B抗原抗体。
发明详述
近来对于用来从静脉注射用免疫球蛋白(IVIG)中去除抗-A和抗-B IgG抗体的合成免疫吸附剂层析介质的应用有着日益增加的兴趣,所述注射用免疫球蛋白(IVIG)由提取自汇集的血浆的浓缩多价IgG抗体组成,所述汇集的血浆得自若干供血者,有时可多达上千或者超过上千的供血者。在从血浆纯化IgG的过程中,通常可以通过分馏而将较大的抗-A和抗-B IgM抗体从较小的IgG抗体分离出来。然而,一些百分比的抗-A和抗-B抗体通常是IgG的形式,其仅仅通过分馏不能与其它的IgG抗体区分开。因而,通常凝集测定来筛选IVIG治疗性浓缩物,以便监测抗-A和抗-B IgG抗体的浓度,从而防止施用具有高浓度抗-A和抗-B IgG抗体的IVIG。然而,虽然有此预警,可导致死亡的溶血反应依然已知会在那些具有A、B、或AB血型的受血者中发生(稿件"Strategies to address hemolytic complications of immune globulin infusions,"FDA Center for Biologics Evaluation and Research Public Workshop Washington,D.C.January 28-29,2014)。
常见凝集测定依赖于使用活的红血细胞,其具有有限的寿命并且细胞表面上的抗原密度在批次之间一般会有变化。凝集还需要系列稀释并且依赖于细胞凝集的定性评价(肉眼或者显微镜观察)。确定抗-A和抗-B抗体浓度的更准确的方法利用了流式细胞术。然而,流式细胞术方法也使用活的红血细胞并且显著比凝集测定更复杂且更耗时。也有报道ELISA测定用于测量抗-A和抗-B抗体的浓度,然而此技术需要相对复杂的多步骤过程以及专门的抗原试剂。
如上文所述,含有结合抗A或抗B抗体的配体的层析免疫吸附剂介质被认为可有效地从血液衍生制品(例如血浆和IVIG)中去除此类抗体。然而,目前还没有良好的方法可用于对此类介质进行定量和验证,以便评价其可重复性与可靠性。
重要的是评价血型抗原配体层析介质批次与批次之间的质量,以便确保所述介质在其整个有效期满足产品规定以及质量要求。另外,重要的还有在使用、清洗和消毒期间以及之后评价此类介质,以确保其在使用、清洗和消毒过程之后保留去除目标杂质的能力。血型抗原配体介质结合其目标分子的能力通常是直接通过测量血液衍生产品中(在与血型抗原配体介质接触之前和之后)多克隆血型抗原抗体浓度的降低来进行评价的。
如本文的实施例中所证明的,抗-A和抗-B抗原配体介质对于纯化的IgM单克隆抗体的能力与该介质去除血型A抗体或血型B抗体的能力相关联,根据情况可以是从IVIG添加物中去除。由于IgG和IgM分子的类型和大小之间固有的差异,此发现是相当出乎意料的。换句话说,IgM具有五聚体结构,而介质对于具有五聚体结构的IgM分子的结合能力,预期将不会与该介质去除具有单体结构的IgG分子的能力相关联。另外,如本文所述实施例中所证实的,介质对于鼠IgM抗体的结合能力可以推测其从样品(例如IVIG添加物)中去除一定百分比人类IgG分子的能力,也即从完全不同的物种去除,这也是出乎意料的。
测量含血型抗原配体的介质对于纯化的分子(例如,此情形中的IgM)的能力相对于此前描述的方法具有若干优势,此前所述的方法大大依赖于测量从血液制品中去除血型抗原抗体,这既耗时又难以重复。相反,本文所述的实施方案依赖于测量对纯化的分子的结合能力,这与现有技术已知的常规方法相比可以更加有效且可重复地进行。
具体而言,本文所述的方法不仅由于每个能力测量时可制备一致浓度的单克隆抗体而更容易重复,而且本文所述的方法还不需要任何专门的设备(例如,用于流式细胞术的)或者任何专门的血型抗原试剂(例如,用于基于ELISA的测定)。
为使本文公开的实施方案可以更容易地理解,首先对某些术语进行了定义。另外的定义在发明详述的各处进行说明。
I.定义
术语“结合能力”是指包装在柱中并在给定条件下运行的给定体积介质所结合的分子的量。本文所述的层析介质的结合能力是指所述层析介质每体积的介质在给定流速所结合的抗A或抗B抗体的量。
在本文所述的实施方案中,纯化的IgM单克隆抗体用于评价适宜去除抗A或抗B抗体的层析介质的结合能力;并且所述结合能力与此类介质去除抗A或抗B抗体的能力相关联。换句话说,层析介质对IgM的结合能力,视情况可以用作标记来确定介质去除抗A或抗B抗体的有效性。结合能力可以测量为静态结合能力或动态结合能力。
术语介质(例如,层析介质)的“静态结合能力”定义为由介质所结合的蛋白质的量除以所使用的介质的体积。用于测量层析介质静态结合能力的示例性方法如下。在将层析介质与已知浓度的蛋白溶液接触后,使该溶液与介质温育以促进蛋白质结合至层析介质。温育时间可以变化(例如,5分钟至72小时)并且可以由本领域技术人员容易地确定,例如,通过测量周期性地测量上清中蛋白的浓度(例如,通过在280nm处测量光吸收)直至上清中的浓度不再有可测量的变化。一旦结合至层析介质的蛋白质与溶液中的蛋白质达到平衡,再一次测量上清中蛋白溶液的浓度。继而通过蛋白的起始量(温育之前)减去上清中蛋白的量(温育之后)再除以所使用的介质的体积来测量静态结合能力。
特定层析介质的静态结合能力一般会受到蛋白溶液组成的影响,包括以下的一或多种因素:例如,蛋白质的浓度、所使用的层析介质的量、溶液中其它组分的浓度(盐、有机分子、缓冲液)、溶液的pH、和导电性。其也会受到蛋白溶液温度的影响。所有这些变量一般都会保持恒定,以便可以比较两种不同的层析介质的静态结合能力。术语“静态结合能力”也可以称为“饱和结合能力”或者“最大结合能力”。
在本文所描述的一些实施方案中,含有血型A抗原配体的介质或者含有血型B抗原配体的介质对于纯化的单克隆IgM抗体的静态结合能力被用作标记来预测或评价其去除抗A或抗B抗体的能力,视情况是从样品中去除(例如,IVIG添加物)。比较两个不同批次的介质或者随着时间的相同介质或者来自不同来源的介质的静态结合能力,是特别有用的,因为这提供了关于介质质量的信息。换句话说,由于对纯化的IgM抗体的结合能力与其去除抗A或抗B抗体的能力相关联,视情况结合能力可用于评价以及比较不同批次介质或者随着时间的相同介质或者来自不同来源的介质的性能。因此,使用本文所述的方法,本领域技术人员或者终端用户可以容易地确定某批次的介质是否相较于另一批次的介质、或者随着时间而展现出性能(也即,去除抗A或抗B抗体的能力)的损失,特别是在重复的清洗和消毒之后。另外,测量对于纯化的IgM的静态结合能力也可以用于在开发期间优化介质。
一般而言,静态结合能力可以如下进行计算。将体积VR的介质样品与已知浓度C1和已知体积VM的纯化单克隆IgM抗体(血型A抗原配体介质的情况下是IgM-A,而血型B抗原配体介质的情况下是IgM-B)的溶液温育;获得上清并测量上清中IgM抗体的浓度C2;使用以下方程式计算静态结合能力:
术语“动态结合能力”定义为,在层析柱中存在的蛋白质溶液的浓度达到某浓度(通常是起始浓度的预定的百分比)时的节点,层析柱在流动条件下所结合的蛋白质的量。在实践中,此预定百分比倾向为起始浓度的大约10%。继而将蛋白的此质量除以层析柱中介质的体积。
特定层析介质的动态结合能力一般会受到蛋白溶液组成的影响,包括以下的一或多种因素:例如,蛋白质的浓度、溶液中其它组分的浓度(盐、有机分子、缓冲液)、溶液的pH和导电性。动态结合能力还可以受到柱进行装载时的温度的影响以及受到蛋白溶液装载至柱上时的流速的影响。降低蛋白质溶液至层析柱中的流速会提高所测量的动态结合能力。相反,提高蛋白质溶液至层析柱中的流速会降低所测量的动态结合能力。动态结合能力不应超过静态结合能力,因为层析介质的动态能力受到质量迁移整体速度的限制。
术语“上清”定义为在沉淀的层析介质之上的液体。可以通过使浆液中的层析介质沉淀至容器或柱的底部而获得上清溶液。可以通过将层析介质的浆液离心或者通过震动来使所述沉淀过程加速。继而可以通过由移液管、注射器或者泵转移至分离的容器来将所述上清溶液与所述层析介质分离。另外,也可以通过膜或者多孔材料过滤层析介质的浆液来获得上清。
术语“样品”定义为含有至少一种要结合至本文所述层析介质的目标蛋白质(例如,在此情形中为抗A或抗B抗体)的溶液。在一些实施方案中,所述目标蛋白质是抗体或者免疫球蛋白。在一些实施方案中,所述免疫球蛋白是血型A抗原抗体(也即,抗-A抗体)。在其它实施方案中,所述免疫球蛋白是血型B抗原抗体(也即,抗-B抗体)。样品的实例包括但不限于:血液、血浆、血浆衍生物、血液制品、静脉注射用免疫球蛋白添加物(IVIG)。
术语“IgG”、"免疫球蛋白"、"Ig"或"抗体"(本文中可互换使用)是指具有两个重链和两个轻链组成的基础四个多肽链结构的蛋白质,所述链例如通过链间二硫键来稳定,其具有特异性地结合抗原的能力。术语"单链免疫球蛋白"或"单链抗体"(本文中可互换使用)是指具有重链和轻链组成的两个多肽链结构的蛋白质,所述链例如通过链间肽键来稳定,其具有特异性地结合抗原的能力。术语"结构域"是指包含肽环的重链或轻链的球形区(例如,包含3至4个肽环),其中例如是通过例如β-折叠片层和/或链间二硫键而稳定的。结构域在本文中进一步称作"恒定"或"可变",这是基于在"恒定"结构域情况中各个类别成员的结构域内相对缺乏的序列差异,或者在"可变"结构域的情况中各个类别成员的结构域内显著的差异。抗体或多肽"结构域"在本领域中常常可互选地称作抗体或多肽"区"。抗体轻链的"恒定"结构域可互换地称作"轻链恒定区"、"轻链恒定结构域"、"CL"区或"CL"结构域。抗体重链的"恒定"结构域可互换地称作"重链恒定区"、"重链恒定结构域"、"CH"区或"CH"结构域。抗体轻链的"可变"结构域可互换称作"轻链可变区"、"轻链可变结构域"、"VL"区或者"VL"结构域。抗体重链的"可变"结构域可互换地称作"重链可变区"、"重链可变结构域"、"VH"区或者"VH"结构域。
免疫球蛋白或抗体可以是单克隆的或多克隆的并且可以单体或者多聚体的形式存在。
术语“IgM”或“免疫球蛋白M”如本文所用是指具有五聚体结构的抗体,例如,血清中发现的IgM抗体。具有大约970kDa的分子量,IgM抗体要比具有单体结构以及大约150kDa的分子量的IgG大得多。与具有2个抗原结合位点的IgG抗体不同,IgM抗体具有10个抗原结合位点。IgM抗体主要在受血者从不相容的供血者接受输血时,负责红血细胞的凝集。例如,具有血型A以及具有抗-B IgM抗体的人在接受来自血型B供血者的输血时将会经历凝集。大的IgM抗体一般可通过分馏而与血浆中较小的IgG抗体分离。
术语“层析”如本文所用是指从样品中的其它分子分离或者去除分子(例如,在此情形中为抗A和/或抗B抗体)的动态分离技术。通常,在层析方法中,移动相(液体或气体)将含有待分离或待去除分子的样品转移穿过固定相(通常为固体)介质(例如,层析介质)。对于固定相的隔离性或亲和性的差异将分子从样品的其它组分分离出来。
术语“亲和层析”如本文所用是指层析的模式,其中待分离或者待去除的分子(例如,抗A和/或抗B抗体)是通过其与另外的分子(例如,固定至固体支持物上的血型A抗原配体或血型B抗原配体)的相互作用分离的,所述另外的分子特异性地与所述待分离或者待去除的分子相互作用。亲和层析中所使用的介质称作亲和层析介质。
术语“介质”或“层析介质”在本文中可互换使用,是指其上固定有血型A抗原配体和/或血型B抗原配体的固体支持物。
本文所述的方法可用于评价适宜于去除抗A和/或抗B抗体的任何层析介质的质量,包括2015年9月8日提交的美国临时专利申请No.62/215,401中所描述的那些。
在本文所述的实施方案中,纯化的IgM溶液用于评价包括附着至固体支持物的血型A抗原配体或血型B抗原配体的层析介质的结合能力。换句话说,纯化的IgM单克隆抗体被用作模型分子来研究适宜用于去除抗A或抗B抗体的层析介质的质量。
术语“抗-A”或“抗-A抗体”是指这样的抗体,其结合在具有A血型或AB血型的个体的细胞表面上发现的血型A抗原。因此,期望在血液衍生的样品中去除此类抗体(例如,血液、血液制品、血浆、血浆衍生物或IVIG添加物)。
术语“抗-B”或“抗-B抗体”是指这样的抗体,其结合在具有B血型或AB血型的个体的细胞表面上发现的血型B抗原。因此,期望在血液衍生的样品中去除此类抗体(例如,血液、血液制品、血浆、血浆衍生物或IVIG添加物)。
术语“介质的质量”如本文所用是指层析介质选择性地从样品(例如,血液、血液制品、血浆、血浆衍生物或IVIG添加物)中去除不期望实体(例如,抗A或抗B抗体)的能力。本文所提供的方法特别适用于评价和/或监测不同介质(例如,同类型介质的不同批次或者来自不同来源的同类型介质或者在开发或制造期间获得的介质样品或原型)的相对质量,其中是通过测量它们对纯化的IgM单克隆抗体的结合能力。换句话说,不同的介质或介质样品对于纯化的单克隆IgM抗体的相对结合能力表示该介质选择性地去除抗A或抗B抗体的能力(也即,该介质或介质样品的相对质量)。因此,介质对于特定IgM分子的结合能力可用于辨别该介质相对于不同批次的相同介质的整体质量或者相同介质随着时间的质量,例如,在制造、使用、清洗和消毒期间。
因此,设计用于去除抗-A抗体的某批次的介质,其对于纯化的IgM-A抗体的结合能力比起相同类型的介质之前制造的批次低,则其相对于之前的批次质量较差,因为其预期会从样品中去除较低百分比的抗-A抗体。相反,设计用于去除抗-A抗体的某批次的介质,其对于纯化的IgM-A抗体的结合能力比起相同类型的介质之前制造的批次高,则其相对于之前的批次质量较好,因为其预期会从样品中去除较高百分比的抗-A抗体。类似地,某批次的介质,其对纯化的IgM-B抗体的结合能力比起相同类型的介质之前制造的批次低,则其相对于之前的批次质量较差,因为其预期会从样品中去除较低百分比的抗-B抗体。相反,某批次的介质,其对纯化的IgM-B抗体的结合能力比起相同类型的介质之前制造的批次高,则其相对于之前的批次质量较好,因为其预期会从样品中去除较高百分比的抗-B抗体。
一般有需要在层析介质的使用期期间监测其质量,以确保该介质保留从样品中去除期望百分比的抗-A抗体或抗-B抗体的能力。例如,层析介质的质量在重复使用之后可受到不利影响,例如在暴露于严格的清洗和/或消毒条件之后,降低其从样品中去除特定百分比的抗-A抗体或抗-B抗体的能力。设计用于去除抗A或抗B抗体的某批次介质的质量可以通过以下方式进行监测:在重复使用该介质之前和之后或者将其暴露于严格清洗和/或消毒条件之前和之后,分别测量其对于纯化的IgM-A抗体或IgM-B抗体的结合能力。如果介质对于纯化的IgM-A或IgM-B的结合能力相对于之前时间测量时有降低,这表明该介质此时将会移除较低百分比的抗A或抗B抗体。
因此,本文所述的方法可用于评价层析介质用于去除抗-A或抗-B的随着时间的能力,以及比较两个分别批次的介质的质量。
另外,本文所述的方法还可用于在制造或者开发期间优化介质。换句话说,可以评价原型介质去除抗A或抗B抗体的能力,视情况可以简单地通过确定其对于纯化的IgM抗体的结合能力,并且如果需要的话,基于该介质对纯化的IgM抗体的结合能力,其可以被进一步改善或优化。例如,一旦制备了原型介质,可以使用本文所述的方法评价该介质的质量,以确定其是否需要进一步优化或者修改。以此方式,在开发期间可以容易地评价介质的各种迭代(iteration),得到最终版本的介质。
另外,本文所述的方法也可用于区分血型A抗原配体介质和血型B抗原配体介质。操作者或者终端用户在制造以及使用期间容易弄错两种介质的身份,因为该两种类型的介质经常在相同的位置制造和储存并且肉眼看起来基本一样。本文所述的方法提供了区分这样两种类型的介质的方法,也即,当不知道介质是否结合抗-A抗体或抗-B抗体时。例如,未知身份的介质(也即其是否含有血型A抗原配体或血型B抗原配体)可以通过比较其对于纯化的单克隆抗-A IgM和对于纯化的单克隆抗-B IgM的能力来进行鉴别(以所有用于纯化的单克隆抗-A IgM和纯化的单克隆抗-B IgM的可能的已知介质)。因此,含有血型A抗原配体的介质将预期会对纯化的IgM-A抗体显示出显著的结合能力而对于纯化的IgM-B抗体则是显著较低或者可忽略的结合能力。类似地,含有血型B抗原配体的介质将预期会对纯化的IgM-B抗体显示出显著的结合能力而对于纯化的IgM-A抗体是显著较低或者可忽略的结合能力。
在一些实施方案中,未知介质对于IgM-A或IgM-B的结合能力可以与相同类型的已知介质(例如来自不同批次)对于IgM-A或IgM-B的结合能力进行比较,以确定其是否包含血型A抗原配体或血型B抗原配体。
II.示例性的血型抗原介质
本文所述的方法可用于评价结合血型A抗原抗体或血型B抗原抗体的介质的相对质量。
本文所述的方法可用于评价任何商业可用的介质或正在开发的介质(其已知结合血型A抗原抗体或血型B抗原抗体)。另外,本文所述的方法也可以用于区分介质的类型(在未知该介质是否结合血型A抗原抗体或血型B抗原抗体的情况下)。
目前商业可用的或者曾经商业可用的介质的实例包括,例如,Glycosorn ABO A-柱和B柱,由Glycorex Transplantation AB(41,223 70Lund,Sweden)提供;血型A三糖Sepharose-4B-AFF201、血型A三糖Sepharose-FF-AFF101、血型B三糖Sepharose-4B-AFF202、和血型B三糖Sepharose-FF-AFF102,由Dextra Laboratories Ltd(Science and Technology Centre,Earley Gate,Whiteknights Road,Reading,RG6 6BZ,United Kingdom)提供;Synsorb A和B介质,由Chembiomed Ltd(Edmonton,Alberta,Canada)提供;以及Allotran A和B介质,由Lectinity Holding,Inc.(Moscow,Russia)提供。一般而言,任何介质都可以用本文所述的方法进行评价,其包括配体(通常是基于寡糖的配体),对应于直接或间接(经接头或者间隔序列)附着至固体支持物的A血型抗原或B血型抗原的表位。示例性的介质可参见2015年9月8日提交的美国临时申请62/215,401。示例性的基于寡糖的配体在下文给出。
结构中所使用的缩写定义如下:Gal=D-半乳糖,Fuc=L-岩藻糖,GalNAc=N-乙酰基-D-半乳糖胺,GlcNAc=N-乙酰基-D-葡萄糖胺,R=从配体至固体支持物的连接(但配体结构上其它未知的连接也会用到)。
A血型抗原配体的实例包括但不限于具有以下结构的分子:三糖抗原A(GalNAcα1,3[Fucα1,2]Galβ–R),、1型四糖抗原A(GalNAcα1,3[Fucα1,2]Galβ1,3GlcNAcβ1–R)、2型四糖抗原A(GalNAcα1,3[Fucα1,2]Galβ1,4GlcNAcβ1–R)、3型四糖抗原A(GalNAcα1,3[Fucα1,2]Galβ1,3GalNAcα1–R)、和4型四糖抗原A(GalNAcα1,3[Fucα1,2]Galβ1,3GalNAcβ1–R)。
B血型抗原配体的实例包括具有以下结构的分子:三糖抗原B(Galα1,3[Fucα1,2]Galβ–R)、1型四糖抗原B(Galα1,3[Fucα1,2]Galβ1,3GlcNAcβ1–R)、2型四糖抗原B(Galα1,3[Fucα1,2]Galβ1,4GlcNAcβ1–R)、3型四糖抗原B(Galα1,3[Fucα1,2]Galβ1,3GalNAcα1–R)、和4型四糖抗原B(Galα1,3[Fucα1,2]Galβ1,3GalNAcβ1–R)。
一或多种上述配体可以附着至适宜的固体支持物,由此得到适宜用于去除血型A和/或血型B抗原抗体的层析介质。
固体支持物的实例包括但不限于氧化铝、硅石、硅藻土、陶瓷、金属氧化物、多孔玻璃、可控孔径玻璃、碳水化合物聚合物、多糖、琼脂糖、交联琼脂糖、交联葡聚糖、葡聚糖、纤维素、淀粉、几丁质、沸石、合成聚合物、聚乙烯醚、聚乙烯、聚丙烯、聚苯乙烯、尼龙、聚丙烯酸酯、聚甲基丙烯酸酯、聚丙烯酰胺、聚马来酸酐、膜、空心纤维、以及纤维。在一些实施方案中,所述固体支持物是多聚体固体支持物且包含选自以下组的聚合物:聚乙烯醚、聚乙烯醇、聚甲基丙烯酸酯、聚丙烯酸酯、聚苯乙烯、聚丙烯酰胺、聚甲基丙烯酰胺和聚碳酸酯。在特定的实施方案中,所述固体支持物是基于聚乙烯醚的固体支持物。在一些实施方案中,所述固体支持物是珠的形式(例如,基于聚乙烯醚的珠)。
可以利用无数的官能团来促进配体附着至固体支持物。此类官能团的非限制性性实例包括胺、硫醇、呋喃、马来酰亚胺、环氧树脂、醛、烯、炔、叠氮、吖内酯、羧基、活性酯、三嗪、和磺酰氯。在特定的实施方案中,使用胺基作为官能团。
所述固体支持物也可以经修饰和/或激活以包括一或多个上文所述的官能团,以促进适宜的配体或多个配体固定至支持物。在特定的实施方案中,使用羧基和醛基作为官能团。
III.用于测量结合能力的测定法
本文所述的方法可用于评价介质(例如,在制造过程期间或之后或者在使用之后)的相对质量,所述介质结合或者预期会结合样品(例如,血液、血液制品、血浆、血浆衍生物、或IVIG添加物)中的血型A抗原抗体或血型B抗原抗体。本文所述的方法(至少部分地)依赖于测量介质对纯化的单克隆IgM-A或IgM-B抗体分子的结合能力,以便评价介质的相对质量(随着时间的、或者是当比较两种不同批次介质或者来自不同来源的介质时)。因此,本文所述的方法可用于区分相同类型介质的两个不同的批次或者随着其使用期的同一批次的介质或者来自不同来源的介质。
一般而言,介质对于特定分子(例如,IgM抗体)的结合能力可以如下进行测量。将含有所述分子的样品与在适当条件下与适宜的介质接触适于该分子结合至所述介质的时间。之后,将结合至介质的分子从剩余的样品溶液分离,并测量剩余样品溶液中该分子的浓度(也即未结合的分子的浓度)。溶液中分子的浓度可以通过若干本领域已知的不同方法来确定。例如,可以在特定的波长测量溶液的光吸收,而所述分子的浓度可以结合该分子(例如蛋白质)在此波长的消光系数来进行计算。可以测量荧光、UV、或拉曼光吸收来确定蛋白质的浓度。另外,溶液中分子的浓度也可以通过分析性层析来确定。检测的强度则与分子的浓度相关联。
在本文所述的实施方案中,测量了A血型配体介质或B血型配体介质对于纯化的单克隆IgM的结合能力,其视情况可以表示该介质可以如何进行对抗A或抗B抗体的实际去除。
通过以下实施例对实施方案进行进一步说明,所述实施例不应理解为限制。在本身请全文中引用的所有参考文献、专利和公开的专利申请的内容,以及附图都援引加入本文。
实施例
实施例1.含有血型A抗原三糖配体的层析介质的合成
此为示例性的方法,其可用于制造血型A抗原配体介质。含有血型A抗原三糖(TriA)配体的层析介质是通过将TriA配体固定至专有的基于聚乙烯醚的珠(也即,本文所用的固体支持物)之上来合成的。该TriA配体的具体结构在图1中示出。在此情况下,所述TriA配体还包括具有胺基的接头,其用于固定至基质珠上。所述珠经激活以包含反应基团,如环氧树脂、羧基、或者醛基,其能够与配体上的胺基反应。继而将TriA配体通过伯胺(-NH2)基的偶合反应而固定至珠上。
实施例2.含有血型B抗原三糖配体的层析介质的合成
在另一个实验中,如下制备血型B抗原配体介质。含有血型B抗原三糖(TriB)配体的层析介质是通过将TriB配体固定至专有的基于聚乙烯醚的珠(也即,本文所用的固体支持物)之上来合成的。该TriB配体配体的具体结构在图2中示出。在此情况下,所述TriB配体还包括具有胺基的接头,其用于固定至基质珠上。如上文TriA配体的情形中那样,所述珠经激活以包含反应基团,如环氧树脂、羧基、或者醛基,其能够与配体上的胺基反应。继而将TriB配体配体通过伯胺(-NH2)基的偶合反应而固定至珠上。
实施例3.鼠单克隆IgM-A抗体的纯化。
在本文所述的实施方案中,纯化的单克隆IgM抗体被用作模型分子来评价结合抗A或抗B抗体的层析介质的质量。此实施例描述了纯化单克隆IgM-A抗体的方法;虽然也可以使用其它方法或者此类抗体可以是商业途径获得的。
血型A抗原鼠单克隆IgM抗体(抗-A)从商业可获得的经分类的细胞培养物添加物中纯化,所述细胞培养物添加物含有从克隆BIRMA-1(Vox Sang.,1991,61:53-58)产生的抗-A IgM,其经透析进入10mM PBS缓冲液(产品号:JH-1L-BK,EMD Millipore,Billerica,MA,USA)。所述抗-A细胞培养物添加物经0.22微米的膜过滤,并在其上附着有血型A抗原三糖(TriA)配体的介质上经过层析结合/洗脱,如实施例1中所述。
用所述Tri-A配体介质包装直径10mm的柱至64mm。用10mM的PBS缓冲液平衡该柱(10倍柱体积(CV),以305.58cm/h,4.0mL/min),并随后装载10mM PBS中的含有抗-A的经分类细胞培养物添加物(40倍CV,229.18cm/h,3.0mL/min)。用10mM PBS缓冲液洗涤该柱(5倍CV,305.58cm/h,4.0mL/min),随后是10mM PBS缓冲液中的0.5M的氯化钠(10倍CV,305.58cm/h,4.0mL/min)。接着,用0.1M的甘氨酸pH 2.7洗脱抗-A IgM抗体(9倍CV,305.58cm/h,4.0mL/min)。随后用10mM的PBS缓冲液洗涤柱(10倍CV,305.58cm/h,4.0mL/min)并在进一步使用前用0.5M的氢氧化钠剥离(10倍CV,305.58cm/h,4.0mL/min)。
将1mL的2.0M Tris碱添加至45mL的所述抗-A IgM洗脱液以将其溶液pH提高至6-7。随后用透析管(Standard RC Dialysis Trial Kits,1-3,3.5K MWCO,54mm FLAT WIDTH,序列号:132725,Spectrum Laboratories,Inc.Rancho Dominguez,CA,90220USA)将洗脱液透析至10mM PBS中。在透析至10mM PBS后,基于在280nm的1.50的消光系数(根据IgM抗体的氨基酸组成确定)发现所得的单克隆抗-A IgM溶液具有大约1.1mg/mL的浓度。
实施例4.单克隆鼠IgM-B抗体的纯化
血型B抗原鼠单克隆IgM抗体(抗-B)从商业可获得的经分类的细胞培养物中纯化,所述细胞培养物含有从克隆LB-2产生的抗-B IgM,其经透析进入10mM PBS缓冲液(产品号:JM-1L-BK,EMD Millipore,Billerica,MA,USA)。所述抗-B细胞培养物添加物经0.22微米的膜过滤,并在其上附着有血型B抗原三糖(TriB)配体的介质上经过层析结合/洗脱,如实施例2中所述。
用所述Tri-B配体介质包装直径10mm的柱至64mm。用10mM的PBS缓冲液平衡该柱(10倍柱体积(CV),以305.58cm/h,4.0mL/min),并随后装载10mM PBS中的含有抗-A的经分类细胞培养物添加物(40倍CV,229.18cm/h,3.0mL/min)。用10mM PBS缓冲液洗涤该柱(5倍CV,305.58cm/h,4.0mL/min),随后是10mM PBS缓冲液中的0.5M的氯化钠(10倍CV,305.58cm/h,4.0mL/min)。接着,用0.1M的甘氨酸pH 2.7洗脱抗-B IgM抗体(9倍CV,305.58cm/h,4.0mL/min)。随后用10mM的PBS缓冲液洗涤柱(10倍CV,305.58cm/h,4.0mL/min)并在进一步使用前用0.5M的氢氧化钠剥离(10倍CV,305.58cm/h,4.0mL/min)。
将1mL的2.0M Tris碱添加至45mL的所述抗-B IgM洗脱液以将其溶液pH提高至6-7。随后用透析管(Standard RC Dialysis Trial Kits,1-3,3.5K MWCO,54mm FLAT WIDTH,序列号:132725,Spectrum Laboratories,Inc.Rancho Dominguez,CA,90220USA)将洗脱液透析至10mM PBS中。在透析至10mM PBS后,基于在280nm的1.44的消光系数(根据该蛋白的氨基酸组成确定)发现所得的单克隆抗-B鼠IgM溶液具有大约1.3mg/mL的浓度。
实施例5.作为介质质量量度的血型A抗原三糖配体层析介质对于纯化的鼠单克隆IgM-A抗体的结合能力
此为代表性的实施例,证明了血型A抗原三糖(TriA)配体介质对于纯化的单克隆IgM-A抗体的结合能力可以用于评价层析介质批次与批次之间质量的变化,例如,在制造期间或者之后。
TriA配体的浓度在与固体支持物偶合反应期间发生变化,所述固体支持物在此情形中为基于聚乙烯醚的珠。基质珠预期会具有不同量的TriA配体,其模拟在介质制造过程中可能发生的类型变化。
所使用的配体的浓度次序为:TriA介质#1<TriA介质#2<TriA介质#3。据推测IgM能力将至少为TriA介质#1、随后TriA介质#2、以及TriA介质#3更大。
在此实验中,测量了三种含TriA配体的层析介质对于抗-A IgM的静态结合能力。将此数值与从IVIG添加物Gammanorm 16.5%(165mg/mL,20×20mL,产品号:00 357 340,Octapharma AG)去除抗-A IgG抗体的百分比进行比较。
将一组2.0mL的微量离心管填充了0.35mL的10mM PBS缓冲液或者0.50mL的10mM PBS缓冲液作为对照。随后,将10mM PBS缓冲液中的0.15mL的介质(15μL介质体积)的10%悬液添加至微量离心管,除了对照以外,之后加入1.0mL的10mM PBS缓冲液中的1mg/mL抗-A IgM单克隆抗体溶液。使所述管在室温旋转4小时。随后,将微量离心管离心并用0.22微米的膜将所得的上清转移至离心过滤装置。将所述装置离心并继而在280nm测量了滤液的光吸收。每个样品的溶液光吸收继而被用于计算介质对抗-A IgM单克隆抗体的静态结合能力。基于280nm处1.50的消光系数(根据蛋白的氨基酸组成估计)而计算了抗-A IgM静态结合能力。
在另一实验中,通过已经建立的流式细胞术方法(Christensson,M.et al,Transfusion,1996,36,500-505),确定了代表性的IVIG添加物中血型A抗原多克隆IgG抗体(抗-A)的水平。将A型红血细胞与代表性的IVIG添加物温育预定的时间,随后深度洗涤。继而将细胞用荧光标记的抗-人IgG染色(Alexa488AffiniPure F(ab')2Fragment Goat anti-Human IgG(H+L),部件号:109-546-088,Jackson ImmunoResearch,West Grove,PA,USA),并继而进行流式细胞术(Guava 5HT,EMD Millipore)。净平均荧光强度(MFI)值被用于比较在与实施例1中合成的血型A三糖抗原配体介质接触之前和之后添加物中抗-A多克隆IgG的浓度。
继而将抗-A IgM单克隆抗体静态结合能力,与相同条件下用相同介质从IVIG添加物中去除抗-A抗体的百分比进行了比较。
如下表1中所总结的,此实验证明了各种TriA配体介质对于抗-A IgM单克隆抗体的静态结合能力在批次之间的差异,与静态结合条件下从IVIG添加物去除抗-A IgG百分比的批次间差异相关联。据发现,对单克隆抗-A IgM具有较高能力的TriA配体介质,从IVIG添加物去除更多的抗-A IgG抗体。还发现,对单克隆抗-A IgM具有较低能力的TriA配体介质,从IVIG添加物去除较少的抗-A IgG抗体。
由于两种分子的类型和来源的不同,这一结果是出乎意料的,也即IgM是单克隆、具有较大的五聚体结构、并且是鼠来源,而从IVIG添加物去除的IgG是多克隆、具有较小的单体结构、并且是人来源的。基于此结果,可以得到的结论是,TriA配体介质对于抗-A IgM单克隆抗体的静态结合能力可以用作标示来评价介质(从样品中去除或预期会去除一定百分比的抗-A抗体)质量批次间的差异,例如,在制造介质期间或者之后。
表1.三种不同的TriA介质对于单克隆抗-A IgM的静态结合能力以及从IVIG添加物去除抗-A IgG的百分比
实施例6.作为介质质量量度的血型B抗原三糖配体介质对于纯化的鼠单克隆IgM-B抗体的结合能力
此为代表性的实施例,证明了血型B抗原三糖(TriB)配体介质对于纯化的鼠单克隆IgM-B抗体的结合能力可用于评价介质质量在批次之间的差异,例如,在制造期间或者之后。
TriB配体的浓度在与固体支持物偶合反应期间发生变化,所述固体支持物在此情形中是基于聚乙烯醚的珠。所述珠因而预期会具有不同量的TriB配体,其模拟了在介质制造期间预期会有的类型的差异。
所使用的配体的浓度次序为:TriB介质#1<TriB介质#2<TriB介质#3。因而,预期IgM能力将会至少为TriB介质#1、随后TriB介质#2、以及TriB介质#3更大。
在此实验中,测量了各种TriB配体介质对于抗-B抗体的静态结合能力,并将此数值与从IVIG添加物Gammanorm 16.5%(165mg/mL,20×20mL,产品号:00 357 340,Octapharma AG)去除抗-B IgG抗体的百分比进行比较。
将一组2.0mL的微量离心管填充了0.35mL的10mM PBS缓冲液或者0.50mL的10mM PBS缓冲液作为对照。将10mM PBS缓冲液中的0.15mL的基于聚乙烯醚的珠(15μL介质体积)的10%上清添加至微量离心管,除了对照以外。随后,将10mM PBS缓冲液中的1.0mL的1mg/mL抗-B IgM单克隆抗体溶液添加至所有管。使所述管在室温旋转4小时。接着将微量离心管离心并继而用0.22微米的膜将上清转移至离心过滤装置。将所述装置离心并继而在280nm测量了滤液的光吸收。每个样品的溶液光吸收继而被用于计算介质对抗-B IgM单克隆抗体的静态结合能力。
基于280nm处1.44的消光系数(根据蛋白的氨基酸组成估计)而计算了抗-B IgM静态结合能力。随后将抗-B IgM单克隆抗体静态结合能力与静态条件下从IVIG添加物去除抗-B IgG抗体的百分比进行了比较。
通过已经建立的流式细胞术方法(Christensson,M.et al,Transfusion,1996,36,500-505),确定了代表性的IVIG添加物中血型B抗原多克隆IgG抗体(抗-B)的水平。将B型红血细胞与代表性的IVIG添加物温育预定的时间,随后深度洗涤。继而将细胞用荧光标记的抗-人IgG染色(Alexa488AffiniPure F(ab')2Fragment Goat anti-Human IgG(H+L),部件号:109-546-088,Jackson ImmunoResearch,West Grove,PA,USA),并继而进行流式细胞术(Guava 5HT,EMD Millipore)。净平均荧光强度(MFI)值被用于比较在与实施例2合成的血型B三糖抗原配体介质接触之前和之后添加物中抗-B多克隆IgG的浓度。
如下表2中所总结的,此实验证明了各种TriB配体介质对于抗-B IgM单克隆抗体的静态结合能力在批次之间的差异,与静态结合条件下从IVIG添加物去除抗-B IgG百分比的批次间差异相关联。据发现,对单克隆抗-B IgM具有较高能力的TriB配体介质,从IVIG添加物去除更多的抗-B IgG抗体。还发现,对单克隆抗-B IgM具有较低能力的TriB配体介质,从IVIG添加物去除较少的抗-B IgG抗体。
此数据证明了这样的出乎意料的发现:TriB配体介质对于纯化的抗-B IgM单克隆抗体的静态结合能力可用于评价介质质量在批次之间的差异,例如,在制造期间或者之后。
表2.三种不同的TriB介质对于单克隆抗-B IgM的能力以及从IVIG添加物去除抗-B IgG的百分比
实施例7.血型A抗原三糖配体介质对于纯化的鼠单克隆IgM-A抗体的结合能力,作为暴露于腐蚀性清洁条件之后监测介质质量的方式
此为代表性的实施例,证明了血型A抗原三糖(TriA)配体介质对于纯化的鼠单克隆IgM-A抗体的能力是一种有用的方法,可用于监测介质在暴露于严格的腐蚀性清洁条件之后的质量。
在0小时、50小时、或150小时,使1.0M的氢氧化钠溶液以0.5mL/min流过TriA配体介质的包装柱(5.0mL,1.0cm直径以及6.4cm长)。继而用10mM PBS中和所述介质直至柱中存在的溶液的pH为大约pH 7。继而测量了三种TriA配体介质对于抗-A IgM单克隆抗体的静态结合能力,并与使用相同介质从IVIG添加物中去除抗-A IgG的百分比进行了比较。
将一组2.0mL的微量离心管填充了0.35mL的10mM PBS缓冲液或者0.50mL的10mM PBS缓冲液作为对照。将10mM PBS缓冲液中的0.15mL的介质(15μL介质体积)的10%上清添加至微量离心管,除了对照以外。随后,将10mM PBS缓冲液中的1.0mL的1.0mg/mL抗-A IgM单克隆抗体溶液添加至每个管。使所述管在室温旋转4小时。将微量离心管离心并用0.22微米的膜将所得的上清转移至离心过滤装置。将所述装置离心并继而在280nm测量了滤液的光吸收。每个样品的溶液光吸收继而被用于计算介质对抗-A IgM单克隆抗体的静态结合能力。
基于280nm处1.50的消光系数(根据蛋白的氨基酸组成估计)而计算抗-A IgM的静态结合能力。继而将抗-A IgM单克隆抗体静态结合能力与静态条件下使用相同介质从IVIG添加物去除抗-A IgG抗体的百分比进行比较。
通过已经建立的流式细胞术方法(Christensson,M.et al,Transfusion,1996,36,500-505),确定了代表性的IVIG添加物中血型A抗原多克隆IgG抗体的浓度。将A型红血细胞与代表性的IVIG添加物温育预定的时间,随后深度洗涤。继而将细胞用荧光标记的抗-人IgG染色(Alexa488AffiniPure F(ab')2Fragment Goat anti-Human IgG(H+L),部件号:109-546-088,Jackson ImmunoResearch,West Grove,PA,USA),并进行流式细胞术(Guava 5HT,EMD Millipore)。净平均荧光强度(MFI)值被用于比较在与血型A三糖抗原配体介质接触之前和之后样品中抗-A多克隆IgG的浓度。
如下表3中所总结的,此实验证明了各种TriA配体介质对于单克隆抗-A IgM的静态结合能力的相对差异,与从IVIG添加物去除抗-A IgG百分比的相对差异相关联。观察到,TriA配体介质暴露于腐蚀性清洁条件时间越长,发现的对单克隆抗-A IgM的静态结合能力越低,并且有更少的抗-A IgG抗体从IVIG添加物被去除。
因此,TriA配体介质对于单克隆抗-A IgM的静态结合能力可用于监测此类型的介质在暴露于腐蚀性条件之后的质量。
表3.在暴露于1.0M的氢氧化钠各种时长之后,TriA配体介质对于单克隆抗-A IgM的能力以及从IVIG添加物中去除抗-A IgG的百分比
实施例8.血型B抗原三糖配体介质对于纯化的单克隆鼠单克隆IgM-B的结合能力,作为暴露于腐蚀性清洁条件之后监测介质质量的方式
此为代表性的实施例,证明了血型B抗原三糖(TriB)配体介质对于纯化的鼠单克隆IgM-B抗体的能力是一种有用的方法,可用于监测介质在暴露于严格的腐蚀性清洁条件之后的质量。
在0小时、50小时、或150小时,使1.0M的氢氧化钠溶液以0.5mL/min流过TriB配体介质的包装柱(5.0mL,1.0cm直径以及6.4cm长)。继而用流动过柱的10mM PBS中和所述介质直至柱中存在的溶液的pH为大约pH 7。继而测量了三种TriB配体介质对于抗-B IgM单克隆抗体的静态结合能力,并与使用相同介质从IVIG添加物中去除抗-B IgG的百分比进行了比较。
将一组2.0mL的微量离心管填充了0.35mL的10mM PBS缓冲液或者0.50mL的10mM PBS缓冲液作为对照。将10mM PBS缓冲液中的0.15mL的介质(15μL介质体积)的10%悬液添加至微量离心管,除了对照以外。随后,将10mM PBS缓冲液中的1.0mL的1.0mg/mL抗-B IgM单克隆抗体溶液添加至每个管。使所述管在室温旋转4小时。接着将微量离心管离心并用0.22微米的膜将所得的上清转移至离心过滤装置。将所述装置离心并继而在280nm测量了滤液的光吸收。每个样品的溶液光吸收继而被用于计算介质对抗-B IgM单克隆抗体的静态结合能力。基于280nm处1.44的消光系数(根据蛋白的氨基酸组成估计)而计算了抗-B IgM的静态结合能力。继而将抗-B IgM单克隆抗体静态结合能力与从IVIG添加物去除抗-B IgG抗体的百分比进行了比较。
通过已经建立的流式细胞术方法(Christensson,M.et al,Transfusion,1996,36,500-505),确定了代表性的IVIG添加物中血型B抗原多克隆IgG抗体的浓度。将B型红血细胞与IgG浓缩物温育预定的时间,随后深度洗涤。继而将细胞用荧光标记的抗-人IgG染色(Alexa488AffiniPure F(ab')2Fragment Goat anti-Human IgG(H+L),部件号:109-546-088,Jackson ImmunoResearch,West Grove,PA,USA),并继而进行流式细胞术(Guava 5HT,EMD Millipore)。净平均荧光强度(MFI)值被用于比较在与血型A三糖抗原配体介质接触之前和之后添加物中抗-A多克隆IgG的浓度。
如下表4中所总结的,此实验证明了各种TriB配体介质对于单克隆抗-B IgM的静态结合能力的相对差异,与从IVIG添加物去除抗-B IgG百分比的相对差异相关联。据发现,TriB配体介质暴露于腐蚀性清洁条件的时长并未大大影响其对单克隆抗-B IgM的静态结合能力或者静态条件下从IVIG添加物去除抗-B IgG抗体的量。该数据表明了出乎意料的结果:TriB配体介质对于单克隆抗-B IgM的静态结合能力可用于监测此类型介质的质量。
表4.在暴露于1.0M的氢氧化钠各种时长之后,TriB配体介质对于单克隆抗-B IgM的能力以及从IVIG添加物中去除抗-B IgG的百分比
实施例9.通过分别测量对于纯化的鼠单克隆抗体IgM-A和IgM-B的静态结合能力来区分血型A和血型B抗原三糖配体介质
此为代表性的实施例,证明了血型A抗原三糖(TriA)配体介质和血型B抗原三糖(TriB)配体介质分别对于鼠单克隆抗体IgM-A和IgM-B的相对静态结合能力可用于区分这两种类型的介质。
容易地区分两种类型介质的能力是有用的,因为两种介质通常一起用于从血液和血浆制品中去除抗-A和抗-B抗体并且很容易弄混。通过测量TriA配体介质和TriB配体介质对于单克隆抗-A IgM和单克隆抗-B IgM的静态结合能力证明了区别。
将一组2.0mL的微量离心管填充了0.35mL的50mM PBS缓冲液或者0.50mL的50mM PBS缓冲液作为对照。将50mM PBS缓冲液中的0.15mL的介质(15μL介质体积)的10%悬液添加至微量离心管,除了对照以外。随后,将50mM PBS缓冲液中的1.0mL的1.0mg/mL抗-A IgM单克隆抗体溶液、或50mM PBS缓冲液中的1.0mL的1.0mg/mL抗-B IgM单克隆抗体溶液添加至每个管。使所述管在室温旋转4小时。接着将微量离心管离心并用0.22微米的膜将所得的上清转移至离心过滤装置。将所述装置离心并继而在280nm测量了滤液的光吸收。每个样品的溶液光吸收继而被用于计算介质对抗-A IgM单克隆抗体和抗-B IgM单克隆抗体的静态结合能力。基于280nm处1.50的消光系数(根据蛋白的氨基酸组成估计)而计算了抗-A IgM静态结合能力。基于280nm处1.44的消光系数(根据蛋白的氨基酸组成估计)而计算了抗-B IgM静态结合能力。
如下表5中所总结的,此实验证明了能够结合抗-A抗体或者能够结合抗-B抗体的介质的身份,可以通过测量它们对抗-A IgM单克隆抗体和抗-B IgM单克隆抗体的结合能力来进行区分。
观察到TriA配体介质对抗-A IgM单克隆抗体具有显著的结合能力,而其对抗-B IgM单克隆抗体则具有很低的结合能力。相反,观察到TriB配体介质对抗-B IgM单克隆抗体具有显著的结合能力,而其对抗-A IgM单克隆则具有很低的结合能力。以此方式,可以容易地区分A-抗原配体介质和B-抗原配体介质,特别是在此类介质样品的身份未知时。
表5.TriA配体介质和TriB配体介质对单克隆抗-A IgM和抗-B单克隆IgM的能力
实施例10.基于对纯化的IgM-A或IgM-B单克隆抗体的结合能力而产生介质的混合物及其相对质量的评价
如上文所观察到的,血型A抗原介质或血型B抗原介质分别对纯化的单克隆IgM-A或IgM-B抗体的相对结合能力,是用于评价或者预测此类介质实际上可如何从样品(例如,血液、血液制品、血浆、或IVIG)中去除血型A抗原抗体或血型B抗原抗体的良好标示。
血型A抗原介质对纯化的单克隆IgM-A的相对结合能力以及血型B抗原介质对IgM-B抗体的相对结合能力可用于产生正确比例的此两种介质的混合物,其继而可以用于在一个层析步骤中从样品中去除血型A抗原抗体和血型B抗原抗体。
这会特别有用,因为一般而言,血型A抗原抗体和血型B抗原抗体的量通常会在样品与样品之间有变化。因此,可以良好的发挥作用来从一种样品中去除此类抗体的介质的混合物,在另一种样品的情形中未必会同样良好的发挥作用。
本文所述的方法可用于设计介质的混合物,只要知晓样品中抗-A和抗-B抗体的量,就可以对该样品发挥良好的作用。
例如,由于介质对于纯化的单克隆IgM抗体的结合能力,与从样品中去除抗A或抗B抗体相关联,那么一旦知晓样品中抗-A和抗-B抗体的量,则可以设计介质的混合物,从而具有一定比例的血型A抗原介质和血型B抗原介质,其将会基于对各个IgM分子的结合能力而适于从样品中去除期望的量的抗A和/或抗B抗体。
本文所述的方法也可以用于确定介质混合物的相对质量,所述介质混合物包括具有血型A抗原配体的介质和具有血型B抗原配体的介质。
虑及说明书中引用的参考文献的教导而对说明书有了最深入的理解,所述文献在此援引加入本文。说明书中的实施方案提供了对实施方案的说明而不应被理解为限制其范围。本领域技术人员(从业者)可容易地意识到,本公开还涵盖了许多其它的实施方案。所有出版物和参考材料都以其整体援引加入。援引加入的材料与本说明书有冲突或者不一致时,以本说明书为准。本文所引用的任何参考文献并非认可此文献是现有技术。
除非另有说明,本说明书(包括权利要求)中所使用的表示成分、细胞培养物、处理条件等等量的所有数字,都理解为在所有情况下都受到术语“大约”的修饰。因此,除非另有说明,数字参数都为大约数,并且可以基于期望的性质(可从本文公开的实施例获得)而改变。除非另有说明,在一系列要素之前的术语“至少”应理解为是指该系列中的每个要素。本领域技术人员会意识到、或者能够使用不超过常规的实验而确定本文所述具体实施方案的许多等价方案。此类等价方案要涵盖在以下的权利要求中。
可以对本文所公开的实施方案做出许多修改和变化而不偏离其精神和范围,这对于本领域技术人员而言是明显的。本文所述的具体实施方案仅仅是以示例性的方式提供而不是要以任何方式进行限制。本说明书和实例要理解为仅仅是示例性的,而本公开的真正范围和精神是由以下的权利要求来指明的。
- 还没有人留言评论。精彩留言会获得点赞!