一种病原性鱼肠道弧菌快速检测试纸的制作方法
本发明属于病原微生物检测技术领域,具体涉及一种病原性鱼肠道弧菌(Vibrio ichthyoenteri)快速检测试纸及其制备方法。
背景技术:
鱼肠道弧菌是革兰氏阴性菌,是海洋环境中常见菌群之一,广泛分布在海水和生物群体中,它的致病性受宿主的生理状况和水质环境条件等综合因素影响,是一种条件致病菌。鱼肠道弧菌能够引起多种养殖鱼类发病,给水产养殖业造成严重的经济损失。有效快速的检测诊断是预防和控制该病原菌传播的关键。
目前常用的鱼肠道弧菌的检测方法有间接免疫荧光抗体技术、免疫酶联反应、聚合酶链式反应(PCR)、实时定量PCR等,但这些技术在实用性上皆有一定的局限,耗时长,操作复杂,需要专业设备和人员,不适用于普通养殖人员在现场对鱼肠道弧菌的实时检测。胶体金免疫层析试纸具有易于携带、操作简便快捷、结果肉眼可见、不需要专业人员和设备、经济实用等优点,是一种十分有发展前景的现场快速检测技术。水产动物中虽已制备多种养殖动物病原的单(多)克隆抗体,但现场快速检测试纸技术未能得到很好地开发,目前尚无鱼肠道弧菌胶体金快速检测试纸的报道。
细菌是多种抗原成分组成的复合体,其抗原包括菌体抗原、鞭毛抗原、荚膜抗原和菌毛抗原等,可诱导机体产生抗体,因此,可利用抗原-抗体特异性反应原理以达到确诊病原的目的。但是,因分类地位相近,不同弧菌间往往具有共同的抗原性蛋白,导致不同细菌/弧菌之间存在交叉免疫反应性,从而对检测结果的准确判定造成干扰,因此,准确判定是某种病原菌感染还是其他菌的交叉反应是免疫学技术检测病原时需要解决的关键问题。通常的解决方案是通过筛选病原菌特有的抗原/抗体以提高检测准确性,但是,水产动物病原性弧菌种类繁多,多种病原菌可能与鱼肠道弧菌具有共同抗原,共同抗原的存在增加了筛选难度,工作量繁重。
技术实现要素:
本发明的目的是提供一种病原性鱼肠道弧菌的快速检测试纸,能特异性的对鱼类病原性鱼肠道弧菌进行快速检测,并能避免交叉免疫反应导致的检测误差。
本发明提供的鱼肠道弧菌快检测试纸,包括载体板、样品垫、金标垫、硝酸纤维素膜和吸水垫,其中样品垫和吸水垫位于载体板的两端,硝酸纤维素膜位于载体板的中部;样品垫与硝酸纤维素膜交界处设有载有金标兔抗鱼肠道弧菌抗体的金标垫,金标垫一端边缘重叠在样品垫之下,另一端边缘重叠在硝酸纤维素膜之上;硝酸纤维素膜上从靠近金标垫一侧开始设有依次排列的四条检测线T1、T2、T3、T4和一条质控线,其中检测线T1为鱼肠道弧菌的外膜蛋白、检测线T2为鞭毛蛋白、检测线T3为鱼肠道弧菌的胞外产物、检测线T4为全菌破碎蛋白;质控线C包被有羊抗兔IgG。
上述使用的兔抗鱼肠道弧菌抗体,其制备方法如下:
将鱼肠道弧菌扩大培养,并将菌液浓度调至1×108CFU/mL,福尔马林灭活后免疫纯种新西兰大白兔;第一次混入弗氏完全佐剂,;间隔一周后加强免疫,混入弗氏不完全佐剂,间隔两周后重复一次;一周后取血,分离得到血清,纯化得到兔抗鱼肠道弧菌抗体。
所述的鱼肠道弧菌外膜蛋白,其制备方法如下:
将鱼肠道弧菌扩大培养,离心后磷酸盐缓冲液(PBS)洗涤,重悬至原体积1/25,加入10%蔗糖,混匀后-20℃下作用15min;室温下加入等体积0.4%Triton-X100,作用一段时间后离心取上清,加入2.5倍体积的冰乙醇-20℃过夜;离心取沉淀,洗涤重悬后,加入等体积KI溶液,37℃作用1h;离心取上清,加入2.5倍体积冰乙醇-20℃过夜;离心取沉淀,重悬后透析、冻干得到鱼肠道弧菌外膜蛋白。
所述的鱼肠道弧菌鞭毛蛋白,其制备方法如下:
将鱼肠道弧菌扩大培养,离心后PBS洗涤、重悬至原体积1/20,用1mol/L HCl调整pH=2.0,搅拌30min后低温离心取上清;上清液调整pH至中性,加入(NH3)2SO4,4℃放置过夜;低温超高速离心,取沉淀,重悬后透析、冻干得到鱼肠道弧菌鞭毛蛋白。
所述的鱼肠道弧菌胞外产物,其制备方法如下:
将鱼肠道弧菌接种于液体培养基中培养后,将液体培养物涂布于预先放置了一层玻璃纸的固体琼脂平板上,37℃培养36h;用PBS洗下菌体,收集菌体后4℃下高速离心;将上清经微孔滤膜过滤,加入(NH4)2SO4,4℃放置过夜;然后低温离心取沉淀,重悬后透析、冻干得到鱼肠道弧菌胞外产物。
所述的鱼肠道弧菌全菌破碎蛋白,其制备方法如下:
将鱼肠道弧菌扩大培养,菌液置于超声波破碎仪中低温破碎得到全菌破碎液,冻干得到鱼肠道弧菌全菌破碎蛋白。
本发明将病原菌的多种抗原特异性的排列组合在一起与待检样品同时进行反应,且在T4线上特别设置全菌蛋白,解决了其他菌的共同抗原导致的交叉反应对结果判定的干扰问题,可以准确区别阳性结果与交叉反应。
附图说明
图1、本发明鱼肠道弧菌快速检测试纸条的结构示意图。
1.样品垫;2.金标垫;3.硝酸纤维素膜;4.吸水垫;5.载体底板;6.检测线T1;7.检测线T2;8.检测线T3;9.检测线T4;10.质控线C。T1、T2、T3、T4线分别为外膜蛋白、鞭毛蛋白、胞外产物和全菌蛋白。C线为羊抗兔IgG。
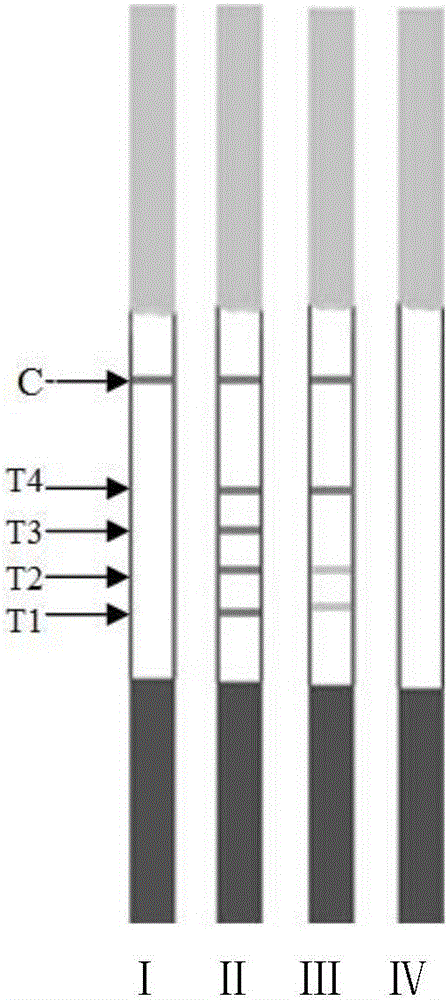
图2、本发明鱼肠道弧菌快速检测试纸条的检测结果示意图。
Ⅰ:鱼肠道弧菌阳性结果;Ⅱ:鱼肠道弧菌阴性结果;Ⅲ:鱼肠道弧菌阴性结果,但有其他菌的免疫交叉反应;Ⅳ:试纸失效或本次操作出现问题。
图3、本发明鱼肠道弧菌快速检测试纸检测5种弧菌结果图。
Ⅰ:鳗弧菌检测结果;Ⅱ:溶藻弧菌检测结果;Ⅲ:哈维氏弧菌检测结果;Ⅳ:副溶血弧菌检测结果;Ⅴ:PBS检测结果;Ⅵ:鱼肠道弧菌检测结果。
图4、本发明鱼肠道弧菌快速检测试纸的最低检测限。
图5、本发明鱼肠道弧菌快速检测试纸应用于半滑舌鳎中鱼肠道弧菌的检测结果)。ⅰ:健康半滑舌鳎组织样品液的检测结果;ⅱ:PBS检测结果;ⅲ:患皮肤溃疡病半滑舌鳎组织样品液的检测结果。
具体实施方式
申请人在研究中发现,之前使用鱼抗血清来检测鱼肠道弧菌,虽然检测出的阳性率高,其鱼抗血清与鱼肠道弧菌反应最强烈,但与鳗弧菌、副溶血弧菌、溶藻弧菌、哈维氏弧菌等其他弧菌存在程度不等的交叉反应,这是因为其他弧菌与鱼肠道弧菌具有某些共同抗原,共同抗原在免疫检测过程中会导致交叉反应,从而对阳性结果的判定造成干扰;导致检测出的鱼肠道弧菌可能是假阳性。
在上述分析的结果上,申请人将鱼肠道弧菌四种特异性抗原组分作为试纸条的四条检测线,其中,T4检测线特别设计为全菌蛋白,如果待测样品中含有鱼肠道弧菌,则与检测线上的四种抗原竞争结合金标垫上的金标兔抗鱼肠道弧菌抗体,待测样品液扩散到金标垫时,金标兔抗鱼肠道弧菌抗体与待检样品中鱼肠道弧菌结合,形成金标抗体-菌复合物,并封闭金标抗体中鱼肠道弧菌特异性抗原的结合位点,阻止金标抗体与硝酸纤维素膜上检测线T1、T2、T3和T4上的抗原蛋白结合,则T1-T4线皆无红色条带出现,结果为阳性;当复合物扩散至质控线(C线)处,被该处的羊抗兔IgG所俘获,聚集而形成肉眼可见的条带。相反,若待测样品中不含有鱼肠道弧菌,待测样品液扩散至金标垫时未形成金标抗体-菌复合物,金标抗体与T1、T2、T3和T4线上的四种抗原反应而形成肉眼可见的条带,4条检测线全部显色,结果为阴性。如果待测样品中含有其他具有共同抗原的病原菌,金标鱼肠道弧菌抗体与其共同抗原结合形成金标抗体-菌复合物,则T1-T3线中1-3条线因含有的共同抗原不与金标鱼肠道弧菌抗体反应而颜色变浅或者不显色,由于T4线上特别设置了鱼肠道弧菌全菌蛋白,其中含有的共同抗原不与金标鱼肠道弧菌抗体反应,从而T4线颜色变浅,但是T4线上还含有除共同抗原以外的鱼肠道弧菌其他抗原蛋白,其与金标抗体反应从而使T4线一定显现红色,因此,只要出现C线及T4线显色、T1-T3线中1条或几条线不显色,则检测结果为其他菌的交叉反应。
本发明通过在检测层上设置鱼肠道弧菌的多种抗原组分作为多条检测线,其中T4检测线上特别设置全菌蛋白,实现在无需筛选鱼肠道弧菌特有抗原/抗体、不排除掉其他病原菌可能含有的共同抗原的情况下,准确鉴别鱼肠道弧菌阳性结果与交叉反应;尤其在其他病原菌与鱼肠道弧菌含有多种共同抗原情况下,因在T4线上设置全菌蛋白而确保将交叉反应与鱼肠道弧菌阳性进行准确鉴别。
一、本发明的试纸的制备方法如下:
(1)金标垫的制备
①胶体金及金标兔抗的制备
采用微波炉-柠檬酸三钠还原法制得颗粒大小为20nm的胶体金,用0.1mol/L碳酸钾溶液调节胶体金pH值为8.4;将兔抗鱼肠道弧菌按合适的比例加入胶体金中,再加入BSA,离心纯化后用金标保存液悬起,即为金标兔抗液。
②金标垫的制备
将制成金标兔抗液喷涂在玻璃纤维上,并冷冻干燥即为金标垫。
(2)硝酸纤维素膜的检测层设计与制备
检测层是将病原菌的多种抗原组分排列在一起与待检样品同时进行反应,则该菌的所有抗原成分皆与该菌的抗体发生阳性反应,而其他菌只有共同抗原与该菌抗体发生交叉反应,所以,所有抗原全部反应即为阳性,部分抗原反应则为交叉,借此可以排除交叉反应对阳性结果判定的干扰,所以检测层设计为病原菌多种抗原组分同时使用。另外,考虑到所检测病原菌与其他菌可能含有多种共同抗原的情况,特别设置一条检测线使其一定含有除共同抗原以外的抗原组分,以便准确鉴别交叉反应与阳性结果。由此,分别将一定浓度的鱼肠道弧菌的四种抗原组分,按照一定间距和一定顺序喷涂于硝酸纤维膜上作为四条检测线T1、T2、T3和T4,且将T4线特别设计为全菌破碎蛋白;将羊抗兔IgG喷涂于硝酸纤维膜上作为质控线,晾干,于封闭液中浸泡,洗涤后干燥。
(3)鱼肠道弧菌快速检测试纸的制作
在载体板上依次贴上硝酸纤维素膜、吸水垫、金标垫和样品垫,再用切条机切成3.75mm宽的试纸条,装入包装卡壳后,密封于铝箔袋中保藏。
二、在本发明中,鱼肠道弧菌快速检测试纸的最低检测限的研究方法如下:
将纯化好的病原菌用PBS调至四个浓度梯度,用鱼肠道弧菌快速检测试纸检测菌液。当某个浓度时,检测线T1-T4出现全部或部分显色,则这个浓度的高一级浓度为检测试纸的最低检测限。
三、在本发明中,鱼肠道弧菌快速检测试纸的检测鱼肠道弧菌四种抗原蛋白的特异性并确定抗原划线浓度的操作如下:
将制备好的四种鱼肠道弧菌抗原蛋白包被96孔酶标板中,每个蛋白设三个平行,并以无菌PBS作为阴性对照,4℃过夜。吸出包被液,用含0.05%Tween-20的PBS洗涤,每次5min,洗3次。每孔加入3%牛血清白蛋白(BSA),37℃封闭1h,洗涤3次。每孔加入兔抗鱼肠道弧菌抗体(1:2000稀释),37℃孵育1h,洗涤3次。每孔加入碱性磷酸酶标记的羊抗兔IgG(1:8000稀释),37℃孵育1h,洗涤3次。每孔加入底物显色液于暗处反应10-20min,加入NaOH溶液终止显色反应,检测405nm处的OD值。
以包被PBS为阴性对照,测定波长为405nm时各孔的光吸收值,计算各实验孔与阴性对照的光吸收值之比(P/N),当P/N≥2.1时为阳性,计算四种抗原蛋白间的P/N比值,并根据结果确定鱼肠道弧菌快速检测试纸检测层四条检测线的划线浓度比例。
四、利用鱼肠道弧菌快速检测试纸对待测样品进行检测,步骤如下:平放本发明试纸检测卡,向样品孔中滴加检测样品液100μl,等待10~15min,肉眼观察检测结果,根据检测线T1、T2、T3和T4显色情况来判断是否感染鱼肠道弧菌。
检测结果判定方法:
I.C线呈现红色条带,T1、T2、T3、T4线皆不显色,结果为鱼肠道弧菌阳性;
II.C线及T1、T2、T3、T4线皆出现红色条带,结果为鱼肠道弧菌阴性,或者该菌浓度低于检测限;
Ⅲ.C线及T4检测线显红色,T1、T2、T3线出现1条或多条线不显色,结果为鱼肠道弧菌阴性,但有其他菌的交叉反应。
Ⅳ.C线不显色,试纸失效或本次操作出现问题,检测结果无效。
下面通过具体实施例来进一步说明本发明。
实施例中所需仪器以及试剂:
冷冻离心机(Sigma公司);高速冷冻离心机(美国Beckman公司);超高速离心机(日本Hitachi公司);喷膜仪XYZ3060(Biodot公司);半自动贴膜仪LM5000(Biodot公司);切条仪(Biodot公司);柠檬酸三钠(购自中国上海试剂一厂,分析纯);氯金酸(购自Sigma公司,分析纯),羊抗兔IgG(购自索莱宝公司);牛血清蛋白(购自Sigma公司);Tween-20(购自索莱宝公司);硝酸纤维素膜(购自Whatman公司)。
实施例1:鱼肠道弧菌快速检测试纸金标垫的制备
1.兔抗鱼肠道弧菌抗体的制备及纯化
(1)兔抗鱼肠道弧菌抗体的制备
①37℃下将鱼肠道弧菌扩大培养24h,0.01mol/L无菌PBS洗涤3次,重悬菌液,调整至1×108CFU/mL。向菌液中加入一定量的福尔马林,灭活24h。次日取菌液平板划线检查灭活程度。
②分四次免疫新西兰大白兔,每次间隔一周。第一次免疫,取菌液按照1:2(v:v)混合弗氏完全佐剂,背部6点注射,每点0.2mL。第二次免疫,取菌液按照1:2(v:v)混合弗氏不完全佐剂,背部6点注射,每点0.2mL。后两次免疫不加佐剂,每次注射0.6mL菌液。
③第四次免疫一周后,心脏穿刺取全血,室温下倾斜放置1h,4℃静置过夜。次日,4℃下10,000×g离心15min,弃沉淀,获得血清。
(2)兔抗鱼肠道弧菌抗体的纯化
①向血清加入4倍体积0.06mol/L pH=4.0醋酸缓冲液,用0.01mol/L NaOH调整血清稀释液至pH=4.5。
②室温下边搅拌边缓慢滴加正辛酸,加入量为每1mL血清稀释液加25μL正辛酸,滴加后继续搅拌30min。
③4℃下10,000×g离心30min,弃沉淀,收集上清液。上清液用0.45pm微孔滤膜除去悬浮物后,量体积。
④按照10%体积加入0.1mol/L无菌PBS,并用5mol/L NaOH调整pH=7.4。
⑤上清液4℃遇冷后测量液体总体积,保持4℃下按照277g/L缓慢加入(NH4)2SO4粉末(终浓度达45%饱和度)边加边搅拌,加完后继续搅拌30min,4℃静置过夜。
⑥次日4℃下10,000×g离心15min,弃上清,收集沉淀。沉淀用少量0.01mol/L PBS溶解(为原血清体积的1/10),透析24h,中途需更换两次透析液。冻干,称重,并调整至合适浓度,保存于-80℃。
(3)抗体效价测定
酶标板每孔加入100μL 5×107CFU/mL鱼肠道弧菌菌液包被过夜。次日弃去板内液体,用含0.05%Tween-20的PBS(PBST:含0.05%Tween-20的0.01mol/L PBS,pH=7.4)洗涤酶标板,每孔加入200μL 3%BSA,37℃封闭1h;洗涤酶标板,依次加入100μL梯度稀释的兔抗鱼肠道弧菌抗体(表2),设置3个平行,阴性对照加100μL 0.01mol/L PBS,37℃孵育1h;用PBST洗涤酶标板,每孔加入100μL AP标记羊抗兔IgG抗体,37℃孵育1h;洗涤酶标板,每孔加入200μL底物显色液(含1mg/mL pNPP,0.5mol/L氯化镁以及10%二乙醇胺)避光发色5min,用酶标仪测定OD405值。结果显示兔抗鱼肠道弧菌抗体的效价为1×105(表1)。
表1:兔抗鱼肠道弧菌抗体效价的测定
2.胶体金标记兔抗鱼肠道弧菌抗体的制备
(1)胶体金的制备
取0.01%氯金酸溶液100mL,高档火沸腾2min,迅速一次性加入少量1%柠檬酸三钠溶液,放入微波炉中用中档火继续加热3min后,取出冷却至室温并补充损失水分,制得颗粒大小20nm左右的胶体金。用0.1mol/L碳酸钾溶液和0.1mol/L盐酸调节pH值至8.4,室温中进行继续抗体标记步骤或保存于4℃。
(2)胶体金标记兔抗鱼肠道弧菌抗体的制备
取胶体金按照适当比例加入兔抗鱼肠道弧菌抗体,连续搅拌20min,室温静置10min。在向其加入终浓度为1%BSA,连续搅拌15min,室温静置10min。将上述溶液在4℃下1,200×g离心15min,弃沉淀取上清液。上清于4℃下13,500×g离心30min,弃上清取沉淀,沉淀用金标抗体洗涤液(含1%BSA,0.01mol/L PBS,pH=8.4)洗涤,再离心,仔细吸去上清液,将沉淀用金标抗体保存液(含3%蔗糖,1%BSA,0.2%Tween-20和0.02%NaN3的0.01mol/L PBS,pH=8.4)重悬至原体积1/10,即为金标兔抗鱼肠道弧菌抗体,避光保存于4℃或立即进行下一步骤。
3.金标垫的制备
将金标兔抗鱼肠道弧菌抗体液体均匀喷涂于玻璃纤维上,冷冻干燥,避光密封保存于4℃。
实施例2:鱼肠道弧菌快速检测试纸检测层的制备
1、鱼肠道弧菌外膜蛋白制备
①37℃下扩大培养鱼肠道弧菌,4℃下8,000×g离心15min,洗去培养基,并用0.01mol/L PBS重悬洗涤3次,最后加入PBS浓缩至原体积1/25。
②向收集的菌液中加入少量10%蔗糖溶液,混匀后,在-20℃中处理15min。加入等体积0.4%Triton X-100(PBS),在室温下混匀,作用10min。4℃下12,000×g离心15min,取上清。加入2.5倍体积冰乙醇,混匀后,在-20℃下放置过夜。次日,4℃下12,000×g离心15min,取沉淀。
③沉淀经Tris-NaCl(pH=7.4)洗涤后,加入等体积0.6mol/L KI溶液,混匀后,37℃水浴1h。4℃下12,000×g离心15min,取上清。加入2.5倍体积冰乙醇,混匀后,在-20℃下放置过夜。次日,4℃下12,000×g离心15min,取沉淀。用10mL 0.01mol/L PBS重悬后,于超纯水中透析24h,每6h换一次超纯水。冻干后,溶于PBS调至合适浓度,并冻存于-80℃。
2、鱼肠道弧菌鞭毛蛋白制备
①37℃下扩大培养鱼肠道弧菌,4℃下1,500×g离心30min,洗去培养基,0.01mol/L PBS重悬洗涤3次,最后加入无菌生理盐水浓缩至原体积1/25。
②用1mol/L HCl将收集的菌液pH调整至2.0,室温下不断搅拌30min,并且保持pH=2.0。4℃1,500×g离心30min,取上清。4℃533,000×g离心上清液1h,弃沉淀,取上清。上清液用1mol/L NaOH调整pH至7.2,并缓慢加入(NH4)2SO4至终浓度为2.67mol/L,冰浴搅拌30min。将混合液4℃放置过夜。次日,4℃533,000×g离心15min,弃上清,取沉淀,并溶于一定量0.01mol/L PBS中,透析24h,每6h换一次透析液。冻干后,溶于PBS中调制合适浓度,保存于-80℃。
3、鱼肠道弧菌胞外产物制备
①将鱼肠道弧菌接种于营养琼脂液体培养基,37℃摇床培养24h。取1mL的液体培养物涂布在预先放置了一层玻璃纸的营养琼脂平板上,37℃培养24~48h。
②每平板用6mL 0.01mol/L PBS洗下菌体,收集菌悬液在4℃下7,000×g离心30min,上清经0.22pm微孔滤膜过滤取出剩余菌体后,加入终浓度为2.0mol/L的(NH4)2SO4,室温下搅拌1h,4℃沉降过夜。次日,4℃10,000×g离心1h取沉淀,溶于一定量0.01mol/LPBS中,于超纯水中透析24h,每6h换一次超纯水冻干后,用PBS中调至合适浓度,冻存于-80℃。
4、鱼肠道弧菌全菌破碎蛋白的制备
将鱼肠道弧菌接种于营养琼脂液体培养基,37℃扩大培养24h。4℃下5,000×g离心15min,0.01mol/L PBS洗涤重悬3次。将菌液调整至1×108CFU/mL,超声波破碎机破碎(Sonics&Materials;振幅39%;pulse on,3sec;pulse off,3sec)至液体澄清,即为鱼肠道弧菌破碎菌样品,用PBS调至适合浓度,冻存于-80℃。
5.双抗夹心ELISA检测鱼肠道弧菌四种抗原蛋白的特异性并确定抗原划线浓度
①将制备好的四种鱼肠道弧菌抗原蛋白包被96孔酶标板中(100μL/孔),每个蛋白设三个平行,并以无菌PBS作为阴性对照,4℃过夜。
②吸出包被液,用含0.05%Tween-20的PBS(PBST:含0.05%Tween-20的0.01mol/L PBS,pH=7.4)洗涤,每次5min,洗3次。
③每孔加入200μL 3%的牛血清白蛋白(PBS配制),37℃封闭1h,同②法洗涤3次。
④每孔加入100μL兔抗鱼肠道弧菌抗体(1:2,000稀释),37℃孵育1h,同②法洗涤3次。
⑤每孔加入100μL碱性磷酸酶标记的羊抗兔IgG(1:8,000稀释),37℃孵育1h,同②法洗涤3次。
⑥每孔加入200μL底物显色液,暗处反应10-20min,每孔加入50μL 2mol/L NaOH溶液终止显色反应,检测405nm处OD值。
以包被PBS为阴性对照,测波长为405nm时各孔光吸收值,计算各实验孔与阴性对照光吸收值之比(P/N),当P/N≥2.1时为阳性,计算四种抗原蛋白间的P/N比值,确定鱼肠道弧菌快速检测试纸检测层四条检测线的划线浓度比例。所得的T1、T2、T3、T4线上四种抗原蛋白的划线浓度分别为外膜蛋白0.3mg/mL、鞭毛蛋白0.5mg/mL、胞外产物1.0mg/mL、全菌破碎蛋白0.4mg/mL。
6.鱼肠道弧菌快速检测试纸检测层的制备
用0.01mol/L PBS将鱼肠道弧菌外膜蛋白、鞭毛蛋白、胞外产物和全菌破碎蛋白的浓度分别调整至0.3mg/mL、0.5mg/mL、1.0mg/mL和0.4mg/mL,用喷膜仪分别将外膜蛋白、鞭毛蛋白、胞外产物、全菌破碎蛋白喷涂于硝酸纤维素膜上作为检测线T1、T2、T3和T4,四条检测线之间相距1.5mm。用0.01mol/L PBS调整羊抗兔IgG浓度为0.5mg/mL,将其喷涂于硝酸纤维膜上作为质控线(C线),质控线与检测线T4相距5mm,质控线靠近吸水垫(图1:4),检测线T1靠近样品垫(图1:1)。将包被好的硝酸纤维素膜室温干燥后,在37℃下封闭液(含3%BSA,0.01mol/L PBS,pH=7.4)浸泡1h,PBST漂洗3次,每次5min,干燥。
7.鱼肠道弧菌快速检测试纸的制作和应用
在载体底板(图1:5)上依次粘贴上硝酸纤维素膜(图1:3)、金标垫(图1:2)、样品垫(图1:1)和吸水垫(图1:4),组装成试纸条整板。其中硝酸纤维膜上端边缘重叠于吸水垫边缘之下,而硝酸纤维素膜下端边缘则在金标垫上端边缘之下,样品垫的上端边缘重叠在金标垫的下端边缘之上(图1)。
将组装好的试纸条整版用切条机裁成3.75mm宽的试纸条,装入包装卡壳中,并密封保存于有干燥剂的铝箔袋中。
实施例3:鱼肠道弧菌快速检测试纸的检测方法
(1)待检样品的制备
取疑似患鱼肠道弧菌的鱼病灶组织、肾或血液,每1g组织样品用5mL 0.01mol/L无菌PBS或0.9%无菌生理盐水,冰浴条件下充分研磨3~5min,用筛绢过滤得到的研磨液作为检测样品液。
(2)鱼肠道弧菌快速检测试纸检测待检样品
平放本发明试纸检测卡,向样品孔中滴加检测样品液100μl,等待10~15min,肉眼观察检测结果,根据检测线T1、T2、T3和T4显色情况来判断水产动物是否感染鱼肠道弧菌。
(3)结果的判断(图2)
Ⅰ:C线呈现红色条带,T1、T2、T3、T4线皆不显色,表明该个体感染了鱼肠道弧菌。
Ⅱ:C线及检测线T1、T2、T3、T4线皆出现红色条带,结果为鱼肠道弧菌阴性,或者该菌浓度低于检测限。
Ⅲ:C线及T4检测线显红色,T1、T2、T3线出现1条或多条线不显色,表明该个体未感染鱼肠道弧菌,但感染了与鱼肠道弧菌具有共同抗原的其他病原菌,结果判为交叉反应。
Ⅳ:C线不显色,试纸失效或本次操作出现问题,检测结果无效。
实施例4:鱼肠道弧菌快速检测试纸的特异性、重复性和稳定性测试
(1)特异性
将纯化的鳗弧菌、溶藻弧菌、哈维氏弧菌、副溶血弧菌和鱼肠道弧菌调整到适当浓度,以PBS作为阴性对照,使用该发明试纸检测以上6组样品,结果显示,鳗弧菌、溶藻弧菌、哈维氏弧菌、副溶血弧菌皆使检测线T1、T2、T3、T4和质控线显色,其中T3线颜色较PBS浅(Ⅰ、Ⅱ、Ⅲ、Ⅳ),表明这4种菌的胞外产物中与鱼肠道弧菌具有共同抗原;PBS使检测线T1、T2、T3、T4和质控线均显色(Ⅴ);鱼肠道弧菌使检测线T1、T2、T3和T4均不显色,质控线显色(Ⅵ)。这些结果表明本发明的快速检测试纸具有良好的特异性,可以准确区分鱼肠道弧菌感染与其他菌的交叉反应。(图3)
(2)重复性
使用不同批次试纸检测鱼肠道弧菌样品和PBS,每组重复5次,结果无明显差别。
(3)稳定性
本发明试纸分别以4℃和室温下避光密封储存,每隔1个月使用试纸检测鱼肠道弧菌样品和PBS。结果为4℃下储存有效期为12个月,室温下有效期为6个月。
(4)试纸条最低检测限
将纯化好的鱼肠道弧菌用PBS调至5×107、5×106、5×105、5×104CFU/mL。用鱼肠道弧菌快速检测试纸从浓度高至低检测这五种的菌液,结果显示,5×107、5×106、5×105CFU/mL时,检测线T1-T4全部不显色,而5×104CFU/mL使T1-T4线显色,则本发明试纸对鱼肠道弧菌的最低检测下限为5×105CFU/mL。(图4)
实施例5:患溃疡病半滑舌鳎中鱼肠道弧菌的检测
发病半滑舌鳎体表皮肤有不同大小的溃疡、溃烂面,鳍基部出血、溃烂,有的病鱼腹部膨大内有腹水,肠道膨出几乎脱出肛外,肠壁薄,肠内充满液体,解剖发现病鱼肝脏发白或充血发红,肠道无食,胆囊肿大。无菌操作取病鱼肝、脾、肾等组织,每1g组织样品用5mL 0.01mol/L无菌PBS,冰浴条件下充分研磨3~5min,用筛绢过滤得到的研磨液作为检测样品液。健康半滑舌鳎组织和PBS同时检测作为阴性对照。
平放本发明试纸检测卡,向样品孔中滴加检测样品液100μl,等待10~15min,肉眼观察检测结果,发现患病半滑舌鳎样品液使C线线红色,T1-T4检测线皆不显色,表明样品液中具有鱼肠道弧菌(图5:ⅲ)。健康半滑舌鳎组织样品液和PBS皆使C线及4条检测线显红色(图5:ⅰ、ⅱ)。
上述患病半滑舌鳎的肝、脾、肾等组织研磨液,划线接种于2216E平板,25℃培养24h,挑取形态一致的优势菌落进行纯化培养,直至获得纯培养菌株,利用生理生化及分子生物学方法进行鉴定,采用27F和1492R进行16S rRNA基因序列的扩增,并进行hsp60基因序列的扩增,扩增产物送某基因科技有限公司进行测序,分析鉴定结果显示为鱼肠道弧菌感染,表明本发明的鱼肠道弧菌快速检测试纸具有很好的检测特异性。
- 还没有人留言评论。精彩留言会获得点赞!