一种测定胶原蛋白分子质量的方法与流程
本发明涉及胶原蛋白分子测定技术领域,更具体地说,涉及一种利用凝胶过滤色谱柱结合高效液相色谱法测定胶原蛋白分子质量的方法。
背景技术:
胶原蛋白分子是依靠氢键等非共价键维持其三股螺旋构象,当胶原分子从外界吸收足够多的热量后,这些非共价键就会遭到破坏,胶原的三股螺旋构象会随之改变为无规卷曲构象。胶原在热变性后会成为明胶甚至变成相对分子质量更小的水解胶原,此时胶原的低抗原性、生物相容性等优良特性都将消失,因而胶原的制备、储存和应用都必须防范胶原受到升温、光照等物理因素变化的影响,避免热变性过程的发生,以确保胶原三股螺旋结构与生物学性能不发生改变。
目前国内测定蛋白质的方法有考马斯亮蓝法、凯氏定氮法、双缩脲法,但这些方法都是对总蛋白质含量的测定,而聚丙烯酰氨凝胶电泳法可以对蛋白质分子质量的分布特点进行定性,但由于每一批样品染色程度的差异,会对实验结果有一定的影响。
凝胶过滤色谱一般用于分离水溶性大分子,一个含有各种分子量的样品溶液缓慢流经凝胶过滤色谱柱时,各分子在柱内同时进行着两种不同的运动:垂直向下的移动和无定向的扩散运动。大分子物质由于直径较大,不易进入凝胶颗粒的微孔,只能分布于颗粒之间,所以在洗脱时向下移动的速度较快。小分子物质除了可在凝胶颗粒间隙中扩散外,还可以进入凝胶颗粒的微孔中,即进入凝胶相内,在向下移动的过程中,从一个凝胶内扩散到颗粒间隙后再进入另一凝胶颗粒,如此不断地进入和扩散,小分子物质的下移速度落后于大分子物质,从而使样品中分子大的先流出色谱柱,中等分子的后流出,分子最小的最后流出,从而达到分离的效果。
技术实现要素:
本发明的目的在于,开发一种针对胶原蛋白分子质量进行测量的方法,可以实现对胶原蛋白分子质量的精准检测。
为了达到上述目的,本发明提供了一种测定胶原蛋白分子质量的方法,具体步骤如下:
s1、制备标准样品:选用若干分子量分布于40~200kda的蛋白作为分子质量标准品,所述分子质量标准品的数量大于等于5个;
所述标准样品优选为肌球蛋白(200kda)、β-半乳糖苷酶(116kda)、磷酸酶b(97.2kda)、牛血清蛋白(66.4kda)、卵清蛋白(43kda)作为分子质量标准品;
s2、制备检测样品:取待测冻干后的胶原蛋白溶于质量浓度为0.01~0.1%的迭氮钠溶液中,搅拌至充分溶解,4℃静置24~48h,制得胶原蛋白液;
所述胶原蛋白液中待测胶原蛋白的终浓度为0.2~10mg/ml;
取所述胶原蛋白液,加入等体积的0.02mol/lnah2po4-0.2mol/lna2so4缓冲溶液,所述0.02mol/lnah2po4-0.2mol/lna2so4缓冲溶液中含质量浓度为0~1%的十二烷基硫酸钠及0~6mol/l的尿素,摇床震荡1~5h,过0.45μm水系膜,得到待测胶原蛋白检测样品;
本发明采用冻干的胶原蛋白可以保证配制成溶液后的浓度。
s3、样品测定:采用tsk-gelg4000-swxl(7.8mm×30.0cm)凝胶过滤色谱柱测定分别步骤s1制得的分子质量标准品及步骤s2制得的待测胶原蛋白检测样品,得到分子量标准品以及胶原蛋白的保留时间;
具体检测条件为:
进样量:20μl;进样浓度:0.1~1mg/ml;检测波长:220nm;
流动相:所述流动相组成与步骤s2所述0.02mol/lnah2po4-0.2mol/lna2so4缓冲溶液的组成相同;
洗脱流速:0.2~1ml/min;
s4、根据步骤s3测得的分子量标准品保留时间,以标准品分子质量的对数与保留时间做线性回归,得到胶原蛋白分子量标准曲线;
将步骤s3得到的待测胶原蛋白的保留时间与标准曲线进行比对,即可得到胶原蛋白的分子质量。
本发明的有益效果在于:
1、本发明依据凝胶色谱柱对不同尺寸的分子进行分离,从而进行测定。本发明方法操作简便,分离效果好,利用保留时间,标准样品的相对分子质量对数即可对蛋白质的分子质量进行分析。对不同分子质量的标准样品进行柱分离分析,由于蛋白质分子质量大小的不同,分子会自大而小依次流出色谱柱,得到峰面积各不相同的色谱峰,因此依据标准样品的保留时间与相对分子质量对数的标准曲线,按照标准样品分子质量的测定方法对胶原蛋白的分子质量进行测定,将测定结果与标准曲线进行比对,可以得到不同温度贮存过程中胶原蛋白分子质量的变化情况。
2、本发明采用凝胶过滤色谱-高效液相色谱法对胶原蛋白的分子质量进行测定,可以快速得到胶原蛋白在不同处理条件下的分子质量变化情况,能够直观地反应胶原蛋白的降解情况,为胶原蛋白的分析提供了一种更加简便的方法。
附图说明
图1是实施例1得到的保留时间-相对分子质量对数标准曲线图。
图2是实施例2经37℃处理0h未经处理的胶原蛋白的凝胶色谱图。
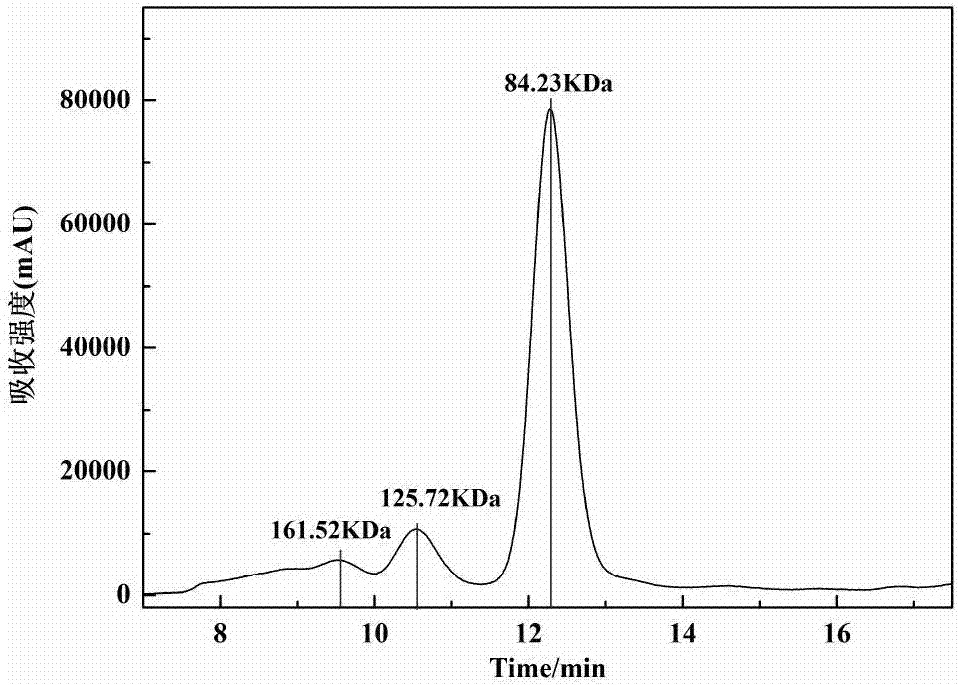
图3是实施例2经37℃处理8h后的胶原蛋白的凝胶色谱图。
图4是实施例2经37℃处理24h后的胶原蛋白的凝胶色谱图。
具体实施方式
实施例1:制作标准曲线
标准样品制备:选用若干分子量分布于40~200kda的蛋白作为分子质量标准品,所述分子质量标准品的数量大于等于5个;分子质量标准品分别选用肌球蛋白(200kda)、β-半乳糖苷酶(116kda)、磷酸酶b(97.2kda)、牛血清蛋白(66.4kda)、卵清蛋白(43kda),采用高效液相色谱(hplc)确定上述蛋白质的分子质量。
hplc结合tsk-gelg4000-swxl(7.8mm×30.0cm)凝胶过滤色谱柱测定条件:进样量:20μl;进样浓度:0.6mg/ml;检测波长:220nm;流动相:0.01mol/lnah2po4-0.1mol/lna2so4缓冲溶液(含0.1%十二烷基硫酸钠,0.01%尿素);洗脱流速:0.7ml/min。根据保留时间与相对分子质量对数确定标准曲线,为y=-0.1017x+6.1764(r2=0.9166),标准曲线图见图1。
实施例2:检测待测样品
标准样品制备:选用若干分子量分布于40~200kda的蛋白作为分子质量标准品,所述分子质量标准品的数量大于等于5个;分子质量标准品分别选用肌球蛋白(200kda)、β-半乳糖苷酶(116kda)、磷酸酶b(97.2kda)、牛血清蛋白(66.4kda)、卵清蛋白(43kda),采用高效液相色谱(hplc)确定上述蛋白质的分子质量。
称取冻干后的海蜇伞部酶促溶性胶原蛋白(psc)溶于0.05%迭氮钠溶液中,终浓度为2mg/ml,搅拌使其充分溶解,37℃分别静置0、8、24h。将配置样品加入等体积的0.02mol/lnah2po4-0.2mol/lna2so4缓冲溶液(含0.2%十二烷基硫酸钠),摇床震荡1h,过0.45μm水系膜。采用高效液相色谱(hplc)确定海蜇伞部psc的分子质量。
hplc结合tsk-gelg4000-swxl(7.8mm×30.0cm)凝胶过滤色谱柱测定条件:进样量:20μl;进样浓度:0.6mg/ml;检测波长:220nm;流动相:0.01mol/lnah2po4-0.1mol/lna2so4缓冲溶液(含0.2%十二烷基硫酸钠);洗脱流速:0.7ml/min。
根据保留时间与相对分子质量对数确定标准曲线,为y=-0.1017x+6.1764(r2=0.9166)。
37℃分别静置0、8、24h的胶原蛋白凝胶色谱图见图2、3、4,psc在37℃条件下贮存8h后,大分子的分子质量分别为84.23kda、125.72kda以及161.52kda,热处理后,大分子量的吸收峰值明显下降,降解率为20%;低于60kda的吸收峰值明显增加,部分大分子质量物质被热降解为小分子质量物质。24h后,分子量较大的海蜇伞部psc已完全受热降解,符合胶原蛋白的降解率随贮存时间的增长而增大的规律。
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明披露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!