茵陈配方颗粒的指纹图谱检测方法以及质量控制方法与流程
本发明涉及茵陈配方颗粒的质量检测领域,具体而言,涉及一种茵陈配方颗粒的指纹图谱检测方法以及质量控制方法。
背景技术:
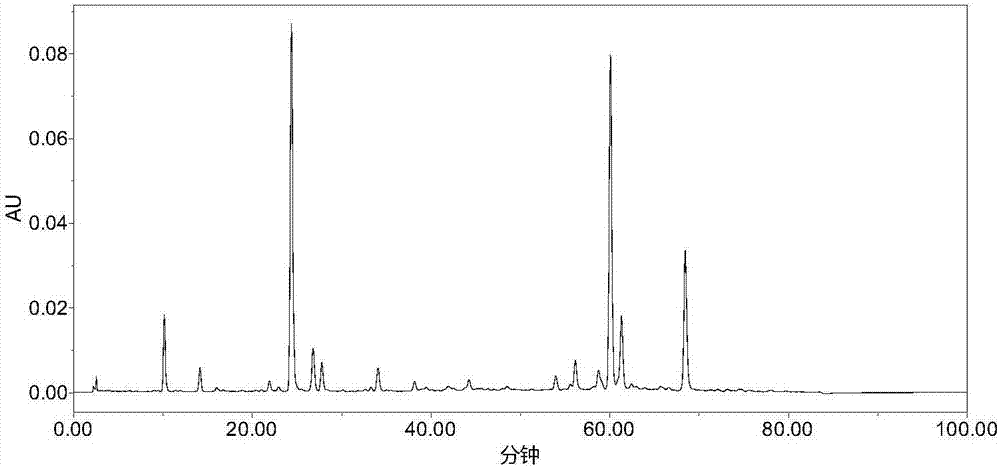
:茵陈是菊科植物滨蒿或茵陈蒿的干燥地上部分,其具有清湿热、退黄疸的功能,用于黄疸尿少,湿疮瘙疗、传染性黄疸型肝炎。目前,茵陈药材及其制剂的液相色谱质量控制方法多以一个或几个有效成分的含量测定为主。指纹图谱是一种以现代分析为依托的新的中药质量控制模式,是目前国际上公认的控制中药质量的最理想的技术。但现有的茵陈指纹图谱检测方法主要集中在检测茵陈药材的产品质量,而对不同厂家的茵陈配方颗粒及其在生产过程中的各个阶段的产品质量无法得到控制,导致最终产品的质量及均一性不佳且无法究其原因。技术实现要素:本发明的目的在于提供一种茵陈配方颗粒的指纹图谱检测方法,建立茵陈配方颗粒各个阶段的产品的指纹图谱,更好地控制茵陈配方颗粒的质量。本发明的另一目的在于提供一种上述茵陈配方颗粒的质量控制方法,通过上述茵陈配方颗粒的指纹图谱检测方法对茵陈配方颗粒的各个阶段的产品进行质量控制,从而更好地控制茵陈配方颗粒的质量。本发明的实施例是这样实现的:一种茵陈配方颗粒的指纹图谱检测方法,其包括:取绿原酸配制对照品溶液,分别取多种茵陈药材配制多个供试品溶液,将对照品溶液和供试品溶液进行高效液相色谱分析;其中,色谱条件包括:以甲醇和冰乙酸的水溶液作为流动相分别将对照品溶液和供试品过色谱柱并进行梯度洗脱,并且在梯度洗脱的过程中控制甲醇的体积,使得甲醇的体积占流动相总量的百分比由4~6%增加至40~50%,接着降低至4~6%。一种茵陈配方颗粒的质量控制方法,其包括上述茵陈配方颗粒的指纹图谱检测方法。本发明实施例的茵陈配方颗粒的指纹图谱检测方法以及质量控制方法的有益效果是:本发明实施例的茵陈配方颗粒的指纹图谱检测方法在梯度洗脱的过程中控制甲醇的体积,使得甲醇的体积占流动相总量的百分比由4~6%增加至40~50%,接着降低至4~6%。通过合理梯度洗脱参数,来分析茵陈配方颗粒的化学成分,建立峰型明显、分离程度均匀的茵陈配方颗粒的指纹图谱,系统地反映了茵陈配方颗粒化学成分的全貌,并且按照本发明实施例的检测方法获得共有峰相对保留时间较为稳定,可为评价或控制茵陈配方颗粒的质量提供依据。并且,本发明实施例的指纹图谱色谱峰的分离度好,色谱峰之间明显分离,能够准确地得到茵陈配方颗粒中主要化学成分的色谱峰,检测方法具有良好的稳定性和重复性,利用该指纹图谱检测在茵陈配方颗粒生产过程中各个节点的产品的质量,确保各个节点的产品的质量及稳定性。附图说明为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。图1为本发明实施例1提供的对照品溶液-绿原酸的高效液相图谱;图2为本发明实施例1提供的供试品溶液-茵陈饮片的高效液相图谱;图3为本发明实施例1提供的供试品溶液-茵陈标准煎的高效液相图谱;图4为本发明实施例1提供的供试品溶液-茵陈提取物的高效液相图谱;图5为本发明实施例1提供的供试品溶液-茵陈提取物喷干粉的高效液相图谱;图6为本发明实施例1提供的供试品溶液-茵陈配方颗粒1的高效液相图谱;图7为本发明实施例1提供的供试品溶液-茵陈配方颗粒2的高效液相图谱;图8为本发明实施例1提供的对照品溶液和供试品溶液堆叠形成的茵陈指纹图谱;图9为图8所示的茵陈指纹图谱的3d扫描图;图10为本发明试验例1在色谱条件1得到的高效液相图谱;图11为本发明试验例1在色谱条件2得到的高效液相图谱;图12为本发明试验例1在色谱条件3得到的高效液相图谱;图13为本发明试验例1在色谱条件4得到的高效液相图谱;图14为本发明试验例1在色谱条件5得到的高效液相图谱;图15为本发明试验例1在色谱条件6得到的高效液相图谱;图16为本发明试验例1在色谱条件7得到的高效液相图谱;图17为本发明试验例1在色谱条件8得到的高效液相图谱;图18为本发明试验例1在色谱条件9得到的高效液相图谱。具体实施方式下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。下面对本发明实施例的茵陈配方颗粒的指纹图谱检测方法进行具体说明。本发明实施例采用的实验仪器与试药见表1。表1实验仪器与试药统计表实验仪器与试药型号茵陈饮片哈尔滨珍宝制药有限公司:160106茵陈标准煎哈尔滨珍宝制药有限公司:yc-20160909茵陈提取物哈尔滨珍宝制药有限公司:yc-20160826-3茵陈提取物喷干粉哈尔滨珍宝制药有限公司:yc-20160830茵陈配方颗粒1市售购买:yc-1511065茵陈配方颗粒2市售购买:yc-a1501397绿原酸对照品中国食品药品检定研究院:110753-201415甲醇hplc,merck冰乙酸hplc,merck甲醇hplc,科密欧液相系统waters1525色谱柱watersx-brigec18(4.6×250mm,5μm)色谱柱agilentzorbaxeclipsexdb-c18(4.6×250mm,5μm)本发明实施例的茵陈配方颗粒的指纹图谱检测方法包括以下步骤:步骤s1.1:配制对照品溶液取绿原酸配制对照品溶液,具体地,取绿原酸对照品适量,精密称定,加45~55%甲醇制成每1ml含0.1~0.3mg的溶液,即得。也即是,对照品溶液中绿原酸的浓度为0.1~0.3mg/ml,优选地,对照品溶液中绿原酸的浓度为0.2mg/ml。步骤s1.2:配制供试品溶液分别取茵陈药材制成多个节点供试品,并由多个节点供试品配制多个节点供试品溶液。具体地,取茵陈药材,按《中国药典》2015版一部茵陈项下炮制方法进行炮制,也即是,除去残根和杂质,切碎,筛去灰屑,制得茵陈饮片。其中,茵陈药材可直接于市面上进行采购。向茵陈饮片中加入8~12倍体积的纯化水,置标准煎煎煮器具中浸泡10~50分钟,第一次煎煮20~40分钟,再加入9~11倍体积的纯净水,第二次煎煮10~30min,合并两次煎煮液,作为茵陈标准煎。将上述茵陈标准煎于60~80℃浓缩至相对密度1.02~1.10,作为茵陈提取物。将上述茵陈提取物于140~180℃条件下喷雾干燥,作为茵陈提取物喷干粉。茵陈配方颗粒可以自制,即将上述茵陈提取物喷干粉经过制粒,作为茵陈配方颗粒。茵陈配方颗粒也可以购买,本实施例中,优选采用的茵陈配方颗粒是直接于市面上进行采购的。优选地,茵陈标准煎制备工艺为一煎加入12倍纯化水,浸泡30min,煎煮20min,二煎加入10倍纯化水,煎煮10分钟,合并煎液。优选地,茵陈煎液80℃浓缩至相对密度1.05。优选地,茵陈提取物喷雾干燥温度为150℃。需要说明的是,在配制对照品溶液和供试品溶液时,采用相同的甲醇溶液进行配制。由于在制备茵陈配方颗粒的过程中,会产生不同节点的产品,本实施例中,选择不同节点的产品作为节点供试品,具体地,多个节点供试品包括上述由茵陈药材制备得到的茵陈饮片、茵陈标准煎、茵陈提取物和茵陈提取物喷干粉,以及于市面上采购的不同厂家的茵陈配方颗粒,分别标记为茵陈配方颗粒1以及茵陈配方颗粒2。其中,茵陈饮片、茵陈标准煎、茵陈提取物和茵陈提取物喷干粉是在制备茵陈配方颗粒的过程中,不同节点的产品,而茵陈配方颗粒1以及茵陈配方颗粒2是不同厂家的两个终产品。下面依次将多个节点供试品配制成节点供试品溶液,具体如下:所得不同节点茵陈样品均加入体积百分比50%的甲醇溶剂5~50ml(根据样品浓度不同予以变更),超声30~50min,滤过,作为供试品溶液。s1.2.1茵陈饮片的供试品溶液的制备:取茵陈饮片粉末(过24目筛)约1g,精密称定,置于具塞锥形瓶中,精密加入50%甲醇15~25ml,称定重量,超声30~50min,放冷至室温,再称定重量,用50%甲醇补足减失的重量,摇匀,滤过,取续滤液即得。s1.2.2茵陈标准煎的供试品溶液的制备:精密量取茵陈标准煎20ml,置25ml容量瓶中,超声30~50min,放冷至室温,再称定重量,加50%甲醇定容至刻度,摇匀,滤过,取续滤液即得。s1.2.3茵陈提取物的供试品溶液的制备:精密称取约4g茵陈提取物,置50ml容量瓶中,超声30~50min,放冷至室温,再称定重量,用50%甲醇定容至刻度,摇匀,滤过,取续滤液即得。s1.2.4茵陈提取物喷干粉的供试品溶液的制备:精密称取约0.3~0.5g茵陈提取物喷干粉,置50ml容量瓶中,超声30~50min,放冷至室温,再称定重量,用50%甲醇定容至刻度,摇匀,滤过,取续滤液即得。s1.2.5茵陈配方颗粒的供试品溶液的制备:精密称取约0.3~0.5g茵陈配方颗粒(研细),置50ml容量瓶中,超声30~50min,放冷至室温,再称定重量,用50%甲醇定容至刻度,摇匀,滤过,取续滤液即得。步骤s1.3:高效液相色谱分析将对照品溶液和供试品溶液进行高效液相色谱分析。分别精密吸取对照品溶液与供试品溶液各10μl,注入液相色谱仪,测定。色谱条件为:以甲醇和冰乙酸的水溶液作为流动相分别将对照品溶液和供试品过色谱柱并进行梯度洗脱,并且在梯度洗脱的过程中控制甲醇的体积,使得甲醇的体积占流动相总量的百分比由4~6%增加至40~50%,接着降低至4~6%。具体地,色谱条件还包括:以watersx-brigec18或agilentzorbaxeclipsexdb-c18为色谱柱,并于检测波长为327-340nm;流速为0.8~1.2ml/min;色谱柱的温度为25℃-35℃下进行。优选地,色谱柱为agilentzorbaxeclipsexdb-c18,检测波长优选为326nm;流速为1ml/min;色谱柱的温度优选为30℃。在梯度洗脱对照品和供试品时:t=0min~10min时,甲醇占所述流动相总量的百分比为4%-6%,冰乙酸的水溶液占流动相总量的百分比为94%-96%;t=10min~80min时,甲醇占流动相总量的百分比由4%-6%变化为8%-12%,冰乙酸的水溶液占流动相总量的百分比由94%-96%变化为88%-92%;t=80min~82min时,甲醇占流动相总量的百分比由8%-12%变化为40%-50%,冰乙酸的水溶液占流动相总量的百分比由88%-92%变化为50%-60%;t=82min~100min时,甲醇占流动相总量的百分比由40%-50%变化为4%-6%,冰乙酸的水溶液占流动相总量的百分比由50%-60%变化为94%-96%。优选地,在梯度洗脱对照品和供试品时:t=0min~10min时,甲醇占流动相总量的百分比为5%,冰乙酸的水溶液占流动相总量的百分比为95%;t=10min~80min时,甲醇占流动相总量的百分比由5%变化为10%,冰乙酸的水溶液占流动相总量的百分比由95%变化为90%;t=80min~82min时,甲醇占流动相总量的百分比由10%变化为45%,冰乙酸的水溶液占流动相总量的百分比由90%变化为55%;t=82min~100min时,甲醇占流动相总量的百分比由45%变化为5%,冰乙酸的水溶液占流动相总量的百分比由55%变化为95%。需要说明的是,t=0min~10min,本实施例中,表示为t=[0,10),其中,t为时间范围值,也即是,该时间段的最小值可取端点值,而最大值不包含t=10这一端点值,以下梯度的时间范围相同,这里不再赘述。此外,本发明实施例提供的茵陈配方颗粒的质量控制方法,其包括本发明实施例的茵陈配方颗粒的指纹图谱检测方法。具体地:步骤s2.1:按照本发明实施的检测方法建立茵陈配方颗粒的标准图谱。步骤s2.2:建立待检测颗粒样品的指纹图谱。具体地:将待检测的颗粒样品按照本发明实施例的检测方法进行检测,获得液相图谱。步骤s2.3:将颗粒样品的指纹图谱与标准图谱进行对比,通过图谱中的色谱峰出峰时间、峰数量、峰值等参数来评价或控制茵陈配方颗粒的各个节点的产品的质量。下面结合实施例对本发明进一步说明。实施例1s1.1:配制对照品溶液取绿原酸对照品适量,精密称定,加50%甲醇制成每1ml含0.2mg的溶液,即得。s1.2:配制供试品溶液分别取多个节点供试品(茵陈饮片、茵陈标准煎、茵陈提取物、茵陈提取物喷干粉、茵陈配方颗粒1和茵陈配方颗粒2),将多个节点供试品分别配制成多种节点供试品溶液。其中,取茵陈药材,按《中国药典》2015版一部茵陈项下炮制方法进行炮制,除去残根和杂质,切碎,筛去灰屑,制得茵陈饮片。向茵陈饮片中加入12倍体积的纯化水,置标准煎煎煮器具中浸泡30分钟,第一次煎煮20分钟,再加入10倍体积的纯净水,第二次煎煮10min,合并两次煎煮液,作为茵陈标准煎;将茵陈标准煎于80℃浓缩至相对密度1.05,作为茵陈提取物;将茵陈提取物于150℃条件下喷雾干燥,作为茵陈提取物喷干粉;茵陈配方颗粒直接于市面上采购得来。具体如下:s1.2.1茵陈饮片的供试品溶液的制备:取茵陈饮片粉末(过24目筛)约1g,精密称定,置于具塞锥形瓶中,精密加入50%甲醇20ml,称定重量,超声30min,放冷至室温,再称定重量,用50%甲醇补足减失的重量,摇匀,滤过,取续滤液即得。s1.2.2茵陈标准煎的供试品溶液的制备:精密量取茵陈标准煎20ml,置25ml容量瓶中,超声30~50min,放冷至室温,再称定重量,加50%甲醇定容至刻度,摇匀,滤过,取续滤液即得。s1.2.3茵陈提取物的供试品溶液的制备:精密称取约4g茵陈提取物,置50ml容量瓶中,超声30min,放冷至室温,再称定重量,用50%甲醇定容至刻度,摇匀,滤过,取续滤液即得。s1.2.4茵陈提取物喷干粉的供试品溶液的制备:精密称取约0.4g茵陈提取物喷干粉,置50ml容量瓶中,超声30min,放冷至室温,再称定重量,用50%甲醇定容至刻度,摇匀,滤过,取续滤液即得。s1.2.5茵陈配方颗粒1和茵陈配方颗粒2的供试品溶液的制备:分别精密称取约0.3~0.5g茵陈配方颗粒1和2(研细),分别置50ml容量瓶中,超声30min,放冷至室温,再称定重量,用50%甲醇定容至刻度,摇匀,滤过,取续滤液即得。分别将上述六种节点供试品配制的六种节点供试品溶液按下列色谱条件进行高效液相色谱分析。本实施例的图谱是按照高效液相色谱法(《中国药典》2015年版四部通则0512)测定的。色谱柱:agilentzorbaxeclipsexdb-c18(4.6×250mm,5μm)流动相a:甲醇;流动相b:1%冰乙酸的水溶液检测波长:326nm;流速1.0ml/min,进样量10μl;柱温30℃按下表2进行梯度洗脱。表2.实施例1的梯度洗脱参数根据本实施例提供的检测方法,获得的对照品以及供试品的高效液相图谱可参见图1~图7,具体如下:获得的对照品的高效液相图谱如图1所示,获得的茵陈饮片的高效液相图谱如图2所示,获得的茵陈标准煎的高效液相图谱如图3所示,获得的茵陈提取物的高效液相图谱如图4所示,获得的茵陈提取物喷干粉的高效液相图谱如图5所示,获得的茵陈配方颗粒1的高效液相图谱如图6所示,获得的茵陈配方颗粒2的高效液相图谱如图7所示。然后将图1~图7得到的高效液相图谱堆叠,形成图8的不同样品的指纹图谱堆积图,其中;高效液相图谱中101表示绿原酸对照品的图谱(即图1);102表示yc-a1501397(即图6);103表示yc-1511065(即图7);104表示yc-20160830(即图5);105表示yc-20160826-3(即图4);106表示yc-20160909(即图3);107表示茵陈饮片160106(即图2)。从图8和图9得到的指纹图谱可以看出,茵陈饮片、茵陈标准煎、茵陈提取物、茵陈提取物喷干粉、茵陈配方颗粒1以及茵陈配方颗粒2的色谱图中共有峰为9个。将所得色谱图导入指纹图谱比对软件,以茵陈标准煎为对照图谱,对比不同节点样品指纹图谱相似度,结果见下表:表3.不同节点样品指纹图谱相似度比较样品名称相似度(参照)相似度(对照)茵陈标准煎1.0000.973茵陈饮片0.7980.882茵陈提取物0.9820.993茵陈喷干粉0.9770.992茵陈配方颗粒10.8170.891茵陈配方颗粒20.8100.889不同节点样品指纹图谱相似度均不低于0.85。不同厂家的配方颗粒(茵陈配方颗粒1和茵陈配方颗粒2)指纹图谱相似度类似,且不低于0.85。因此本实施例提供的可以作为控制茵陈不同节点样品、不同批次产品质量的控制方法。且满足在茵陈配方颗粒生产过程中各节点指纹图谱相似度对比应不低于0.85。并且不同厂家茵陈配方颗粒间指纹图谱相似度应不低于0.85。实施例2本实施例提供的茵陈配方颗粒的指纹图谱检测方法与实施例1基本相同,区别在于,本实施例中色谱条件不同:色谱柱:agilentzorbaxeclipsexdb-c18(4.6×250mm,5μm)流动相a:甲醇;流动相b:1%冰乙酸的水溶液检测波长:330nm;流速1.2ml/min,进样量10μl;柱温35℃按下表3的梯度洗脱参数进行梯度洗脱。表4.实施例2的梯度洗脱参数实施例3本实施例提供的茵陈配方颗粒的指纹图谱检测方法与实施例1基本相同,区别在于,本实施例中色谱条件不同:色谱柱:agilentzorbaxeclipsexdb-c18(4.6×250mm,5μm)流动相a:甲醇;流动相b:1%冰乙酸的水溶液检测波长:327nm;流速0.8ml/min,进样量10μl;柱温25℃按下表4进行梯度洗脱。表5实施例3的梯度洗脱参数实施例4~5实施例4~5提供的茵陈配方颗粒的指纹图谱检测方法与实施例1基本相同,区别在于,实施例4中配制的对照品溶液中绿原酸的浓度为0.1mg/ml,实施例5中配制的对照品溶液中绿原酸的浓度为0.3mg/ml。实施例6本实施例提供的茵陈配方颗粒的指纹图谱检测方法与实施例1基本相同,区别在于,由茵陈饮片制成多个节点供试品的工艺参数不同:其中,向茵陈饮片中加入8倍体积的纯化水,置标准煎煎煮器具中浸泡10分钟,第一次煎煮30分钟,再加入9倍体积的纯化水,第二次煎煮20min,合并两次煎煮液,作为茵陈标准煎;将茵陈标准煎于60℃浓缩至密度1.02,作为茵陈提取物;将茵陈提取物于140℃条件下喷雾干燥,作为茵陈提取物喷干粉。实施例7本实施例提供的茵陈配方颗粒的指纹图谱检测方法与实施例1基本相同,区别在于,由茵陈饮片制成多个节点供试品的工艺参数不同:其中,向茵陈饮片中加入10倍体积的纯化水,置标准煎煎煮器具中浸泡50分钟,第一次煎煮40分钟,再加入11倍体积的纯化水第二次煎煮30min,合并两次煎煮液,作为茵陈标准煎;将茵陈标准煎于70℃浓缩至密度1.10,作为茵陈提取物;将茵陈提取物于180℃条件下喷雾干燥,作为茵陈提取物喷干粉。试验例1色谱条件的优化选择以绿原酸作为对照品,以茵陈标准煎作为供试品,按照实施例1的方法分别配制对照品溶液和节点供试品溶液,然后分别于7个不同的色谱条件下进行高效液相色谱,并分析所得图谱的峰型及分离度,从而选择最优的色谱条件。色谱条件1色谱柱:watersx-brigec18(4.6×250mm,5μm)流动相a:甲醇;流动相b:1%冰乙酸的水溶液检测波长:326nm;进样量10μl;柱温30℃表6.色谱条件1的梯度洗脱参数按照色谱条件1得出的茵陈标准煎在色谱条件1下的色谱图,如图10所示。色谱条件2色谱柱:watersx-brigec18(4.6×250mm,5μm)流动相a:甲醇;流动相b:1%冰乙酸的水溶液检测波长:326nm;进样量10μl;柱温30℃表7.色谱条件2的梯度洗脱参数按照色谱条件2得出的茵陈标准煎在色谱条件1下的色谱图,如图11所示。色谱条件3色谱柱:watersx-brigec18(4.6×250mm,5μm)流动相a:甲醇;流动相b:1%冰乙酸的水溶液检测波长:326nm;进样量10μl;柱温30℃表8.色谱条件3的梯度洗脱参数按照色谱条件3得出的茵陈标准煎在色谱条件1下的色谱图,如图12所示。色谱条件4:色谱柱:watersx-brigec18(4.6×250mm,5μm)流动相a:甲醇;流动相b:1%冰乙酸的水溶液检测波长:326nm;进样量10μl;柱温30℃表9.色谱条件4的梯度洗脱参数按照色谱条件4得出的茵陈标准煎在色谱条件1下的色谱图,如图13所示。色谱条件5:色谱柱:watersx-brigec18(4.6×250mm,5μm)流动相a:甲醇;流动相b:1%冰乙酸的水溶液检测波长:326nm;进样量10μl;柱温30℃表10.色谱条件5的梯度洗脱参数按照色谱条件5得出的茵陈标准煎在色谱条件1下的色谱图,如图14所示。色谱条件6:色谱柱:watersx-brigec18(4.6×250mm,5μm)流动相a:甲醇;流动相b:1%冰乙酸的水溶液检测波长:326nm;进样量10μl;柱温30℃表11.色谱条件6的梯度洗脱参数按照色谱条件6得出的茵陈标准煎在色谱条件1下的色谱图,如图15所示。色谱条件7:参照实施例1提供的色谱条件得出的色谱图,如图16所示。色谱条件8:参照实施例2提供的色谱条件得出的色谱图,如图17所示。色谱条件9:参照实施例3提供的色谱条件得出的色谱图,如图18所示。表12不同色谱条件下的色谱峰分布情况在条件7~9下检测的色谱峰均匀性佳,色谱峰完全分离,因而选择条件7~9作为色谱条件。需注意:色谱条件6下的色谱图的峰型和分离度较佳,但色谱峰未完全分离,色谱条件6和色谱条件7的梯度洗脱的参数相同,色谱柱不同,即色谱柱优选采用agilentzorbaxeclipsexdb-c18(4.6×250mm,5μm)。试验例2节点对照品溶液的配制工艺选择工艺1:向茵陈饮片中加体积百分比为45%的甲醇溶剂15ml,70℃条件下回流提取1h,过滤得回流提取液,再用甲醇溶剂定容。工艺2:向茵陈饮片中加体积百分比为45%的甲醇溶剂15ml,于40℃条件下超声提取1次,每次25min;过滤得超声提取液再用甲醇溶剂定容。工艺3:向茵陈饮片中加体积百分比为45%的甲醇溶剂15ml,先于70℃条件下回流提取1h,接着于40℃条件下超声提取1次,每次25min;过滤得超声提取液再用甲醇溶剂定容。工艺4:向茵陈饮片中加体积百分比为45%的甲醇溶剂15ml,先40℃条件下超声提取1次,每次25min;过滤得到超声提取液,再对超声提取液于70℃条件下回流提取1h,接着于过滤得超声提取液再用甲醇溶剂定容。工艺5:如实施例1所示工艺6:如实施例6所示工艺7:如实施例7所示表13.不同工艺条件下的色谱峰分布情况试验对象工艺色谱峰分布情况试验例2-1工艺1色谱峰个数少、小部分显现,成分提取不完全,杂质多试验例2-2工艺2色谱峰重合、部分显现,成分提取不完全、杂质多试验例2-3工艺3色谱峰完全呈现,但部分重合、分离度差,杂质较多试验例2-4工艺4色谱峰完全呈现,但部分重合、分离度差,杂质较多实施例1工艺5色谱峰完全呈现,均匀性最佳,色谱峰完全分离,杂质少实施例6工艺6色谱峰完全呈现,均匀性佳,色谱峰完全分离,杂质少实施例7工艺7色谱峰完全呈现,均匀性佳,色谱峰完全分离,杂质少试验例3本发明实施例的检测方法的精密度试验对茵陈标准煎按照实施例1提供的检测方法进行色谱分析,每次进样体积为10μl,记录80min内的色谱图,并记录各特征峰的相对保留时间以及特征峰的相对峰面积,计算得出各特征峰的相对保留时间rsd均小于0.3%,特征峰的相对峰面积rsd均小于2.0%,说明本发明实施例的检测方法精密度好。试验例4本发明实施例的检测方法的重复性试验取6份茵陈标准煎按照实施例1提供的检测方法进行色谱分析,进样体积10μl,记录80min内的色谱图,检测结果见表12和表13。如表12和表13所记录的结果,所得各特征峰的相对保留时间rsd均小于0.3%,特征峰的相对峰面积rsd均小于2.0%,说明本实发明实施例的检测方法重复性好。试验例5本发明实施例的检测方法的稳定性试验取茵陈标准煎按照实施例1提供的检测方法进行色谱分析,分别于0,4,8,12,24h测定,记录80min内的色谱图,相对应的色谱峰相对保留时间rsd均小于0.3%,特征峰的相对峰面积rsd均小于2.0%,结果表明供试品溶液在24h内稳定。由此,建立茵陈配方颗粒的指纹图谱如图8和图9所示,以其作为标准图谱,对后续各个节点的待检测颗粒进行质量检测及控制。综上所述,本发明的茵陈配方颗粒的指纹图谱的检测方法,其建立的指纹图谱系统地反映了茵陈配方颗粒的化学成分全貌,共有峰相对保留时间较为稳定,并且该检测方法精密度高、重复性好、稳定性好,可为评价或控制茵陈配方颗粒的质量提供依据。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1