液相色谱质谱联用直接检测生物组织均匀样本中氨基酸的方法与流程
本发明申请属于仪器分析领域,具体涉及一种用液相色谱质谱联用直接检测生物组织均匀样本中氨基酸的方法。
背景技术:
氨基酸的检测分析是生命科学、食品科学、临床医学等领域的重要研究手段,因此对氨基酸分析方法的研究与改进具有重要的意义。氨基酸分析方法从1958年首先实现自动化,随后逐渐发展,灵敏度、准确度、自动化程度都在逐渐提高。
2008年boogers等人将uplc与accq·tag(waters公司)在线衍生法联用,分析酪蛋白和血清白蛋白中水解的氨基酸。
accq·tag方法作为目前应用广泛的一种氨基酸分析方法,需要购买试剂包与试剂盒,成本较高,氨基酸需要进行衍生化,实验前的操作相对繁琐,且衍生剂只能保存一周,检测成本高,易水解的氨基酸无法测定,能够检测的氨基酸类型受限。
生物组织类型多,不同的生物组织其物理性质、化学组成都不尽相同,相应地,其氨基酸组成含量的测量方法也不尽相同。
技术实现要素:
至少针对以上所述问题之一,本发明提供了用液相色谱质谱联用直接检测生物组织均匀样本中氨基酸的方法,该方法包括用提取液处理生物组织均匀样本,所述提取液包括液相色谱的流动相。
作为本发明可选实施例,提取液可以包括:
乙腈,其浓度为50%-95%;
缓冲液,由浓度为0.1%-0.3%的甲酸和浓度为1-10mm的甲酸铵组成,或者由浓度为0.1%-0.3%的乙酸和浓度为1-10mm的乙酸铵组成;
所述提取液的ph在3-5.5之间。
作为本发明公开可选实施例,提取液的制备方法可以包括:
(a)将乙腈、甲酸或乙酸、甲酸铵或乙酸铵按照100:0.1:0.2的体积比混合,超声混匀,得到有机相;
(b)将水和甲酸或乙酸按照100:0.1的体积比混合,超声混匀,得到水相;
(c)将得到的有机相和水相,按照5-6:1的体积比混合,超声混匀,得到提取液。
作为本发明公开可选实施例,提取液可以与液相色谱初始流动相组成相同。
作为本发明公开可选实施例,生物组织均匀样本可以包括血清、尿或脑脊液。
作为本发明公开可选实施例,生物组织均匀样本的处理方法可以包括:
(i)将样本放入-80℃冰箱冷冻;
(ii)将冷冻后的样本,按照样本与提取液的体积比4:991,加入提取液;
(iii)加入内标氘代苯丙氨酸,涡旋混合,内标氘代苯丙氨酸在最终待测样本溶液中的体积比为0.5%;
(iv)12000rpm、4℃离心,取上清液,待测。
进一步,作为本发明公开可选实施例,提取液的ph可以在4.0-4.8之间。
作为本发明公开可选实施例,直接检测生物组织均匀样本中氨基酸的方法还包括以下步骤:
a)氨基酸标准品母液配制;
b)对氨基酸标准品进行母子离子对、锥孔电压和碰撞能量摸索;
c)液相色谱质谱联用条件和质谱条件优化;
d)求得氨基酸标准曲线;
e)液相色谱质谱联用检测生物样本中氨基酸含量。
作为本发明公开可选实施例,液相色谱质谱联用条件可以包括:
watersacquityuplc系统,包括四元泵溶剂系统,在线脱气机和自动进样器;
xevotq-s检测器,masslynxtmv4.1质谱工作站软件;
色谱柱:acquityuplcbehamide,规格:100mm×2.1mm,1.7μm;
流动相:a:乙腈,含1mmol·l-1甲酸铵和0.2%甲酸,
b:超纯水,含1mmol·l-1甲酸铵和0.1%甲酸;
梯度洗脱:
流速:0.3ml·min-1,柱温:40℃,进样量:5μl。
作为本发明公开可选实施例,质谱条件可以包括:
esi离子源:正离子模式;毛细管电压:0.4kv;去溶剂温度:400℃;去溶剂气流速:800l/hr;锥孔气流速:150l/hr;雾化气压力:7.0bar;采用mrm方式进行采集。
作为本发明公开可选实施例,检测血清样本氨基酸时,氨基酸标准品母液的配制可以包括:对l-2-氨基己二酸和叶酸,均用含0.1%甲酸的水溶液配制为100μg·ml-1的标准品母液;对其余氨基酸,用超纯水配制成1mg·ml-1的标准品母液;然后根据需要用提取液稀释,配制混合标准品。
作为本发明公开可选实施例,检测尿样本氨基酸时,氨基酸标准品母液的配制可以包括:对高半胱氨酸和l-2氨基己二酸,用含0.1%甲酸的水溶液分别配制为100μg·ml-1、1mg·ml-1的标准品母液;对其余氨基酸,加超纯水分别配制成浓度为1mg·ml-1的标准品母液;根据需要用提取液稀释标准品母液,配制混合标准品。
作为本发明公开可选实施例,检测脑脊液氨基酸时,氨基酸标准品母液的配制可以包括:对高半胱氨酸、l-2氨基己二酸,用含0.1%甲酸的水溶液分别配制为100μg·ml-1、1mg·ml-1的标准品母液;对其余氨基酸标准品,加超纯水分别配制成浓度为1mg·ml-1的标准品母液;根据需要用提取液稀释标准品母液,配制混合标准品。
本发明另一方面,提供一种用于液相色谱质谱联用直接检测生物组织均匀样本中氨基酸的方法的试剂包,可以包括如下组分:
乙腈,其浓度为50%-95%;
缓冲液,所述缓冲液由浓度为0.1%-0.3%的甲酸和浓度为1-10mm的甲酸铵组成,或者由浓度为0.1%-0.3%的乙酸和浓度为1-10mm的乙酸铵组成;
所述提取液的ph在3-5.5之间。
本发明公开用液相色谱质谱联用直接检测生物组织均匀样本中氨基酸的方法,可以对血清、尿及脑脊液等生物样本用提取液进行处理后直接检测,样本处理方法简单,样本用量少,低至4μl,检测灵敏度高,可达pg/ml级,可检测的氨基酸浓度范围宽,选择的同位素内标降低基质干扰,提高检测准确度,同时检测的氨基酸种类多达29种,且检测时间短。
附图说明
图1大鼠血清中26种氨基酸lc-ms/ms谱(标准品)。
图2大鼠血清中26种氨基酸lc-ms/ms谱(样本)。
图3大鼠尿中25种氨基酸lc-ms/ms谱(标准品)。
图4大鼠尿中25种氨基酸lc-ms/ms谱(样本)。
图5大鼠脑脊液中29种氨基酸lc-ms/ms谱(标准品)。
图6大鼠脑脊液中29种氨基酸lc-ms/ms谱(样本)。
具体实施方式
生物样本多种多样,有血浆、血清、全血、淋巴、唾液、各种组织、毛发、尿液、胆汁、泪液、脊髓液、汗液、乳汁、羊水、粪便以及呼出的气体。在本发明公开中,为了便于样本中氨基酸成分的分析,主要针对血液、尿液、唾液、胆汁、脑脊液、淋巴液、乳汁和性腺分泌液等液体组织,这类组织可以统一归类为均匀生物组织。在本发明中可以统称为生物组织均匀样本。
在本发明公开中,对于生物组织均匀样本的检测,生物组织样本的处理过程接近,对得到的待测样本其检测方法类似,可以作为同一类方法进行考察。
本发明公开中选择血清、尿和脑脊液作为均匀生物组织的典型样本,进行氨基酸含量的检测。
氨基酸是两性分子,正负离子都能解离,解离度与溶液的ph值有关,如向该溶液中加入酸时,其两性离子的-coo-负离子,在电场中向负极移动,加入碱性时,其两性离子的-nh3+正离子释放出质子,其自身成为负离子,在电场中向正极移动,而且氨基酸在溶液中的等电点也受ph值的影响,所以通常都采用加入酸溶液的方式,如盐酸、磷酸等,提取生物样本中的氨基酸。但是,因为本发明公开采用加入酸性缓冲溶液的方法,保证有效提取氨基酸。如甲酸/甲酸铵缓冲液,乙酸/乙酸铵缓冲液,并对其酸度值ph进行优选。ph值的选择可选3-5.5之间,较为优选ph在3.3-5.1之间,更为优选ph在4.0-4.8之间。同时,含有氨基酸的提取液作为待测样本,进行色谱质谱分析时,提取液会流经色谱柱和质谱分析电离室,所以提取液的组成会检测结果产生直接的影响,本发明公开选择的甲酸/甲酸铵缓冲液、乙酸/乙酸铵缓冲液则能够满足色谱质谱联用分析中组成容易气化的要求,提高了分析精度,鉴于此,本发明公开更加优选甲酸/甲酸铵缓冲液。而且,本发明公开采用含有甲酸/甲酸铵的乙腈水溶液作为色谱分析流动相,与提取液组成成分相同的流动相,可以进一步促进生物组织样本中氨基酸的分离和检测。
进一步,缓冲液中缓冲盐的浓度,也对生物组织提取效果有影响,例如甲酸铵或乙酸铵可以选择1-10mm之间的任意浓度。浓度低于1mm或者高于10mm,其提取效率明显下降,色谱峰的宽度明显变宽,不利于氨基酸的提取和分离。
本发明公开实施中,内标采用氘代苯丙氨酸标准品,其配制过程可以包括,取氘代苯丙氨酸标准品,精密称定,用超纯水配制成浓度为1mg·ml-1的内标母液,然后根据需要用提取液进行稀释。例如,可以将100μl、1mg·ml-1的内标母液与900μl提取液混合,涡旋混匀,配制成10μg·ml-1的内标溶液,可以将10μl、10μg·ml-1的内标溶液与990μl提取液混合,涡旋混匀,配制成100ng·ml-1内标溶液。
本发明公开的提取液的制备或配制方法中,示例性的描述了以甲酸和甲酸铵为缓冲液组分的具体实现方式,作为其他符合本发明公开要求的缓冲液,如乙酸和乙酸铵缓冲体系,或者其他缓冲液体系,也可以采用同样的方法,进行提取液的配制。
进一步,作为本发明公开的提取液,乙腈的含量直接影响提取效率和检测灵敏度,例如,可以选择其含量在50%-95%之间,或者在60-90%之间,或者可以在70-85%之间。
作为提取液的选择,可以根据生物组织样本的性质进行优选。例如,可以配制如下组分的提取液:
(1)50%乙腈水溶液,包含0.1%甲酸和1mmol甲酸铵,ph为3.18;
(2)85%乙腈水溶液,包含0.1%甲酸和1.7mmol甲酸铵,ph为4.32;
(3)95%乙腈水溶液,包含0.1%甲酸和1.9mmol甲酸铵,ph为5.46;
(4)85%乙腈水溶液,包含0.1%甲酸和10mmol甲酸铵,ph为5.11;
通过对以上四种提取液的性能考察发现,经过以上提取液体处理后,样本中的氨基酸都能够被有效提取,只是峰形和相应强度有所区别,例如,在提取液(2)和(4)中结果要优于(1)和(3),其中(2)中的结果更优。
生物组织样本的数量,也会对本发明公开的方法产生影响,一般地生物组织样本中氨基酸的检测中,基质效应都会对检测结果产生比较大的影响,本发明公开中,选择适量的样本数量,则可以有效控制基质效应的影响,例如,生物样本在4-10μl之间,可以消除基质效应对检测结果的影响。鉴于本发明公开的样本处理方法和分析方法,生物样本较为优选4-8μl之间,更优选4-6μl之间。
提取液的数量也对生物组织样本中氨基酸的提取产生影响。因为生物样本基质的复杂性,选取生物样本的体积越小,提取液的体积越大,基质效应的影响越小,例如本发明公开中,提取液的体积是生物组织样本的250倍,在此范围内可以有效提取生物组织中的氨基酸组分,并能够满足提取之后对氨基酸的分离和检测需求。
流动相成分选择,主要考虑的因素之一是在液相色谱、质谱分离检测过程中便于氨基酸的分离和检出,提高检测灵敏度和分辨率,而且易于气化的流动相成分有利于质谱检测,所以本发明公开的流动相采用含有缓冲液的有机相和水相溶液,例如含有甲酸/甲酸铵缓冲液的乙腈溶液作为有机相,含有甲酸/甲酸铵缓冲液的超纯水为水相。例如,有机相为乙腈,其中含1mmol·l-1(mol·l-1可以表示为m,mmol·l-1可以表示为mm)甲酸铵和0.2%甲酸,水相为超纯水,其中含1mmol·l-1甲酸铵和0.1%甲酸。
本发明公开的检测方法中,采用的提取液与液相色谱的流动相可以具有相同的组成组分,这不仅有利于生物组织样本中氨基酸的提取,而且有利于在分析阶段不同氨基酸的有效分离和完全检测,而且,作为较为优选的方案,可以选择组成组分相同、含量接近的提取液和流动相,更为优选的是,提取液的组分和浓度与液相色谱初始流动相的组分浓度完全对应一致时,具有更优的分析检测结果。
对各氨基酸标准品进行母子离子对、锥孔电压与碰撞能量的摸索。将各氨基酸从浓度为1ng/ml开始逐渐增大浓度,利用uplc/xevotq-s仪器的intellistart功能进行摸索,直至确认各氨基酸的母子离子对、锥孔电压及碰撞能量,如表1。
表1.29种氨基酸的母子离子对、锥孔电压及碰撞能量
对色谱质谱联用条件及质谱条件进行优化。
将确定好的氨基酸母子离子对、锥孔电压碰撞能量编入mrm质谱方法,色谱柱选择acquityuplcbehamide,1.7μm,2.1x100mm,从进样器进样,确保每个氨基酸正常出峰。
本发明公开的氨基酸检测方法中,生物组织样本的处理方法涉及到的处理步骤,并没有严格限定其处理顺序,如果没有特别说明,或者在实验允许的范围之内,可以根据需要对处理步骤做适当的调整,并不影响样本的处理结果,也在本发明精神实质范围之内。
本发明公开中以范围或区间表示的数值参数,通常是指包括两端值在内的范围内的所有数值。除非特别指明,本发明公开所述及的百分比浓度为体积之比。
本发明公开的氨基酸检测方法中,生物组织样本的处理方法,还可以包括为了便于样本处理需要的其他步骤,如样本的分装、提取液的配制或预配制等,这些步骤的增加或减少,并没有超出本发明公开的氨基酸直接检测方法的范围。
本发明公开的氨基酸检测方法中,检测方法包括的各个步骤,并没有严格限定其顺序,如果没有特别说明,或者检测方法必然的逻辑要求,可以根据实际检测的需求,做适当调整,并不影响检测结果,而且可以根据需要增加其他步骤,如增加重复性考察步骤、回收率考察步骤,也可以根据需要减少一些步骤,如氨基酸标准曲线(或称线性考察)步骤、或母液配制步骤等,只要满足氨基酸检测的需求所做的改动,都不影响本发明公开的精神实质。
本发明公开提供的用于液相色谱质谱联用直接检测生物组织均匀样本中氨基酸的试剂包,可以是试剂包的形式,也可以是试剂盒或其他方便提供的形式;用于生物样本处理提取液的试剂,其提供形式并不改变其作为提取液使用的功能作用,所以不会改变其实质内容,任何其他形式的变化,都在本发明公开的精神实质范围之内。
本发明公开中,除非特别指明,述及的技术术语具有本领域技术人员理解的通常含义。液相色谱与质谱联用的分析方法即是指lc-ms/ms。
以下通过实施例的示例性描述和数据的公开,本发明技术方案的细节和发明实质将更加清晰,清楚,应当理解,这些细节并不是对本发明实质内容和保护范围的限制。
实施例1
血清样本的检测。
1.实验仪器
2.试剂
标准品:甘氨酸(glycine)、β-丙氨酸(β-alanine)、肌氨酸(sarcosine)、丙氨酸(alanine)、γ-氨基丁酸(γ-aminobutyricacid)、丝氨酸(serine)、缬氨酸(valine)、苏氨酸(threonine)、牛磺酸(taurine)、亮氨酸(leucine)、异亮氨酸(isoleucine)、反式-羟脯氨酸(trans-4-hydroxy-l-proline)、天冬酰胺(asparaginate)、鸟氨酸(ornithine)、赖氨酸(lysine)、甲硫氨酸(methionine)、l-2氨基己二酸(l-2-aminoadipicacid)、苯丙氨酸(phenylalanine)、1-甲基-组氨酸(1-methyl-histidine)、3-甲基-组氨酸(3-methyl-histidine)、精氨酸(arginine)、瓜氨酸(citrulline)、色氨酸(tryptophan)、叶酸(folicacid)均购于美国sigma公司,谷氨酰胺(glutamine)、组氨酸(histidine)购于加拿大tci公司。
乙腈和甲酸:质谱级,美国fisher公司;甲酸铵:美国sigma公司;实验用水:milli-qsystem超纯水纯化系统制备。
3.样本
血清样本来自sprague-dawley大鼠,按照生物组织均匀样本实验要求,依据规范、合理的操作流程采集提供。
4.色谱质谱联用条件
watersacquityuplc系统,包括四元泵溶剂系统,在线脱气机和自动进样器;waters公司,milford,usa;xevotq-s检测器,waters公司;masslynxtmv4.1质谱工作站软件,waters公司;色谱柱:acquityuplcbehamide,规格:100mm×2.1mm,1.7μm;
流动相a:乙腈:含1mmol·l-1甲酸铵和0.2%甲酸,
b:超纯水:含1mmol·l-1甲酸铵和0.1%甲酸;
梯度洗脱:见表2;
表2梯度洗脱时间、流动相对照表
流速:0.3ml·min-1,柱温:40℃,进样量:5μl。
5.质谱条件
esi离子源:正离子模式;毛细管电压:0.4kv;去溶剂温度:400℃;去溶剂气流速:800l/hr;锥孔气流速:150l/hr;雾化气压力:7.0bar;采用mrm方式进行采集。
6.标准品母液的配制
取所有氨基酸标准品适量,精密称定,对l-2氨基己二酸、叶酸,均用含0.1%甲酸的水溶液分别配制为100μg·ml-1的标准品母液,对其余氨基酸,加超纯水分别配制成浓度为1mg·ml-1的标准品母液,根据需要用提取液进行稀释,并配制混合标准品,分别以s/n大于3、10作为检测限(lod)和定量限(loq),lod和loq浓度见表4,混合标准品谱图如图1血清中26种氨基酸lc-ms/ms谱(标准品)。
7.提取液配制
有机相:85ml乙腈、85μl甲酸、17μl10mol/l的甲酸铵混合,超声混匀;
水相:15ml超纯水、15μl甲酸混合,超声混匀;
二者混合后,再超声3min混匀,得到提取液。
8.样本制备
将大鼠血清分装成4μl/份,-80℃冰箱冷冻。取出已分装好的血清,加入991μl提取液,加入5μl内标(氘代苯丙氨酸100ng/ml),涡旋混合1min,12000rpm,4℃离心5min,取上清液待测。监测结果,见图2血清样本中26种氨基酸lc-ms/ms谱(样本)。
9.样本检测
9.1检测方法线性关系考察
表3大鼠血清样本氨基酸标准品
线性母液的配制。取提取液和表3中氨基酸标准品,配制为2ml母液,涡旋1min(max),加提取液稀释为系列浓度的混合标准品溶液,每个浓度的混合标准品溶液均含0.5ng/ml的氘代苯丙氨酸作为内标物进行校准,按所设色谱条件和质谱条件进样分析,以各氨基酸与内标物的峰面积比值为纵坐标(y),以浓度(pg/μl)为横坐标(x)进行线性回归,计算r,r值在0.9811-0.9999,表明该方法线性良好,结果如下表4。
表4.大鼠血清样本中26种氨基酸的线性方程、线性范围及检测限和定量限
9.2精密度和重复性考察
日内精密度考察:选取低(l)、中(m)、高(h)点浓度的混合标准品溶液各1份,连续进样6次测定,如下表5所示,26种氨基酸峰面积的rsd(%)在1.27-36.7%之间,表明本方法的日内精密度良好。
日间精密度考察:选取低(l)、中(m)、高(h)点浓度的混合标准品溶液各1份,连续3天进样测定,如下表5所示,26种氨基酸峰面积的rsd(%)在1.13-36.09%之间,表明本方法的日间精密度良好。
重复性考察:取同一批分装的样本6份,按前述样本制备方法制备待测样本溶液,进行测定。结果如下表5所示,26种氨基酸峰面积的rsd(%)在0.70-8.81%之间,表明本方法的重复性良好。
表5.大鼠血清样本中26种氨基酸的日间精密度、日内精密度及方法重复性
9.3回收率的考察
取已分装的样本18份,分为3组,4℃冰箱解冻,分别加入样本浓度的50%、100%、150%的标准品溶液,制备待测样本溶液,进行测定,回收率计算方程:回收率(%)=(测量值-样本含量)/加入量×100%,回收率及其峰面积的rsd(%)如下表6所示,回收率在72.71%-128.62%,表明该方法准确可靠。
表6.大鼠血清样本中26种氨基酸的回收率
9.4冻融稳定性考察
取已分装的样本12份,分为3组,每组样本数n为4,分别冻融3次,每次12h,按样本处理方法制备待测样本溶液,进行测定,结果见表7,峰面积的rsd(%)在3.24%-10.92%之间,表明经过3次冻融样本稳定。
表7.大鼠血清样本中26种氨基酸的冻融稳定性
实施例2
尿样本的检测。
1.实验仪器
同实施例1。
2.试剂
甘氨酸(glycine)、β-丙氨酸(β-alanine)、肌氨酸(sarcosine)、丙氨酸(alanine)、γ-氨基丁酸(γ-aminobutyricacid)、丝氨酸(serine)、组胺(histamine)、缬氨酸(valine)、牛磺酸(taurine)、亮氨酸(leucine)、异亮氨酸(isoleucine)、反式-羟脯氨酸(trans-4-hydroxy-l-proline)、天冬酰胺(asparaginate)、鸟氨酸(ornithine)、高半胱氨酸(homocysteine)、赖氨酸(lysine)、谷氨酸(glutamicacid)、甲硫氨酸(methionine)、l-2氨基己二酸(l-2-aminoadipicacid)、苯丙氨酸(phenylalanine)、精氨酸(arginine)、瓜氨酸(citrulline)、色氨酸(tryptophan)、叶酸(folicacid)均购于美国sigma公司,谷氨酰胺(glutamine)购于加拿大tci公司。
乙腈和甲酸:质谱级,美国fisher公司;甲酸铵:美国sigma公司;实验用水:milli-qsystem超纯水纯化系统制备。
3.样本
尿样本来自sprague-dawley大鼠,依据生物组织均匀样本的规范、合理的操作流程采集提供。
4.色谱质谱联用条件
同实施例1。
5.质谱条件
同实施例1。
6.标准品母液的配制
取所有氨基酸标准品适量,精密称定,对高半胱氨酸、l-2氨基己二酸,均用含0.1%甲酸的水溶液分别配制为100μg·ml-1、1mg·ml-1的标准品母液,对其余氨基酸,加超纯水分别配制成浓度为1mg·ml-1的标准品母液,根据需要用提取液进行稀释,并配制混合标准品,分别以s/n大于3、10作为检测限(lod)和定量限(loq),lod和loq浓度见表8,lod浓度在0.0036-10ng/ml,loq浓度在0.016-20ng/ml表明该方法灵敏度很高。混合标准品谱图如图3大鼠尿中25种氨基酸lc-ms/ms谱(标准品)。
7.提取液配制
同实施例1。
8.样本制备
将尿样离心,12000rpm,4℃,5min,取上清液备用。取991μg提取液,加入4μl尿样,5μl内标(内标为氘代苯丙氨酸,其浓度100ng/ml),涡旋混合1min,12000rpm,4℃离心5min,取上清液待测。
检测结果见图4大鼠尿样本中25种氨基酸lc-ms/ms谱。
9.样本检测
9.1线性关系考察
表9大鼠尿样本氨基酸标准品
线性母液的配制。取提取液和表9中尿样本氨基酸标准品,配制为2ml母液,涡旋1min(max),加提取液稀释为系列浓度的混合标准品溶液,每个浓度的混合标准品溶液均含0.5ng/ml的氘代苯丙氨酸作为内标物进行校准,按所设色谱条件和质谱条件进样分析,结果发现尿样基质对内标有抑制作用,故处理方法不选择内标,以各氨基酸峰面积为纵坐标(y),以浓度(pg/μl)为横坐标(x)进行线性回归,计算r,r值在0.9858-0.9999之间,表明该方法线性良好。结果如表8。
表8.大鼠尿样本中25种氨基酸的线性方程、线性范围及检测限和定量限
9.2精密度和重复性考察
日内精密度考察:选取低、中、高点浓度的混合标准品溶液各1份,连续进样6次测定,如下表10所示,25种氨基酸峰面积的rsd(%)在1.24%-20.23%之间,表明本方法的日内精密度良好。
日间精密度考察:选取低、中、高点浓度的混合标准品溶液各1份,连续3天进样测定,25种氨基酸峰面积的rsd如下表10所示,氨基酸的rsd(%)均在1.14%-38.60%之间,表明该方法日间精密度良好。
重复性考察:取同一批分装的样本6份,按前述样本制备方法制备待测样本溶液,进行测定。结果如下表10所示,峰面积的rsd(%)在1.31-9.60%表明本方法的重复性良好。
表10.大鼠尿样本中25种氨基酸的日间精密度、日内精密度及方法重复性
9.3回收率的考察
取已分装的样本18份,分为3组,4℃冰箱解冻,分别加入样本浓度的50%、100%、150%的标准品溶液,未检测到的氨基酸加入loq浓度的50%、100%、150%的标准品溶液,制备待测样本溶液,进行测定,回收率计算方程:回收率(%)=(测得量-本底)/加入量×100%,回收率及其峰面积的rsd如下表11所示,回收率(%)在72.12%-126.63%之间,表明该方法准确可靠。
表11.大鼠尿样本中25种氨基酸的回收率
9.4冻融稳定性考察
取已分装的样本12份,分为3组,每组样本数n为4,分别冻融3次,每次12h,按前样本处理方法制备待测样本溶液,进行测定,结果见表12,rsd(%)在2.52%-9.82%之间,表明经过3次冻融,样本稳定。
表12.大鼠尿样本中25种氨基酸的冻融稳定性
实施例3
脑脊液样本检测
1.实验仪器
同实施例1.
2.试剂
标准品:甘氨酸(glycine)、β-丙氨酸(β-alanine)、肌氨酸(sarcosine)、丙氨酸(alanine)、γ-氨基丁酸(γ-aminobutyricacid)、丝氨酸(serine)、组胺(histamine)、缬氨酸(valine)、苏氨酸(threonine)、牛磺酸(taurine)、亮氨酸(leucine)、异亮氨酸(isoleucine)、反式-羟脯氨酸(trans-4-hydroxy-l-proline)、天冬酰胺(asparaginate)、鸟氨酸(ornithine)、高半胱氨酸(homocysteine)、赖氨酸(lysine)、谷氨酸(glutamicacid)、甲硫氨酸(methionine)、l-2氨基己二酸(l-2-aminoadipicacid)、苯丙氨酸(phenylalanine)、1-甲基-组氨酸(1-methyl-histidine)、3-甲基-组氨酸(3-methyl-histidine)、精氨酸(arginine)、瓜氨酸(citrulline)、色氨酸(tryptophan)、肌肽(carnosine)均购于美国sigma公司,谷氨酰胺(glutamine)、组氨酸(histidine)购于加拿大tci公司。
乙腈和甲酸:质谱级(美国fisher公司);甲酸铵:美国sigma公司;实验用水:milli-qsystem超纯水纯化系统制备。
3.样本
脑脊液样本来自sprague-dawley大鼠,按照均匀生物样本实验要求,依据规范、合理的操作流程采集提供。
4.色谱质谱联用条件
同实施例1。
5.质谱条件
同实施例1。
6.标准品母液的配制:
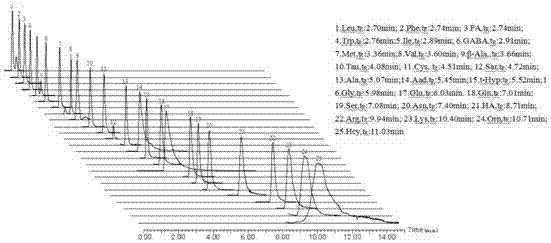
取适量氨基酸标准品,精密称定;对高半胱氨酸、l-2氨基己二酸,均用含0.1%甲酸的水溶液分别配制为100μg·ml-1、1mg·ml-1的标准品母液;对其余氨基酸标准品,加超纯水分别配制成浓度为1mg·ml-1的标准品母液;根据需要用提取液进行稀释,并配制混合标准品;分别以s/n大于3、10作为检测限(lod)和定量限(loq),lod和loq浓度见表14,lod浓度在0.0036-10ng/ml,loq浓度在0.016-20ng/ml表明该方法灵敏度很高。混合标准品谱图如图5大鼠脑脊液中29种氨基酸lc-ms/ms谱(标准品)。
7.提取液配制
同实施例1。
8.样本制备
将脑脊液样分装成4μl/份,-80℃冰箱冷冻。取出已分装好的脑脊液,加入991μl提取液,加入5μl内标(内标为氘代苯丙氨酸,其浓度为100ng/ml),涡旋混合1min,12000rpm,4℃离心5min,取上清液待测。检测结果见图6大鼠脑脊液中29种氨基酸lc-ms/ms谱(样本)。
9.样本检测
9.1线性关系考察
表13大鼠脑脊液样本氨基酸标准品
线性母液的配制。取提取液和上表13所列氨基酸标准品,配制为2ml母液,涡旋1min(max),加提取液稀释为系列浓度的混合标准品溶液,每个浓度的混合标准品溶液均含1.5ng/ml的氘代苯丙氨酸作为内标物进行校准,按所设色谱条件和质谱条件进样分析,以各氨基酸与内标物的峰面积比值为纵坐标(y),以浓度(pg/μl)为横坐标(x)进行线性回归,计算r,r值在0.9811-0.9999,表明该方法线性良好。结果如表14大鼠脑脊液样本中29种氨基酸的线性方程、线性范围及检测限和定量限。
表14.大鼠脑脊液样本中29种氨基酸的线性方程、线性范围及检测限和定量限
9.2精密度和重复性考察
日内精密度考察:选取低、中、高点浓度的混合标准品溶液各1份,连续进样6次测定,29种氨基酸峰面积的rsd(%)如下表15所示,在1.02%-22.95%之间,表明本方法的日内精密度良好。
日间精密度考察:选取低、中、高点浓度的混合标准品溶液各1份,连续3天进样测定,29种氨基酸峰面积的rsd(%)如下表15所示,均在0.61%-22.56%之间,表明本方法日间精密度良好。
重复性考察:取同一批分装的样本6份,按前述样本制备方法制备供试品溶液,进行测定。结果如下表15所示,29种氨基酸峰面积的rsd(%)均在2.29%-7.50%之间,表明本方法的重复性良好。
表15大鼠脑脊液样本中29种氨基酸的日间精密度、日内精密度及方法重复性
9.3回收率的考察
取已分装的样本18份,分为3组,4℃冰箱解冻,分别加入样本浓度的50%、100%、150%的标准品溶液,制备待测样本溶液,进行测定,回收率计算方程:回收率(%)=(测得量-样本含量)/加入量×100%,回收率及其峰面积的rsd(%)如下表16所示,回收率在70.40%-126.98%,表明该方法准确可靠。
表16.大鼠脑脊液样本中29种氨基酸的回收率
9.4冻融稳定性考察
取已分装的样本12份,分为3组,每组样本数n为4,分别冻融3次,每次12h,按前样本处理方法制备待测样本溶液,进行测定,结果见表17,峰面积的rsd(%)在2.47%-6.92%,表明经过3次冻融,样本稳定。
表17.大鼠脑脊液样本中29种氨基酸的冻融稳定性
- 还没有人留言评论。精彩留言会获得点赞!