特定凝集素组合在制备用以鉴别上皮性卵巢癌的测试载体方面的用途以及试剂盒的制作方法
本发明涉及一种基于唾液糖蛋白鉴别上皮性卵巢癌的凝集素用途以及试剂盒。
背景技术:
卵巢癌(Ovarian cancer,OC)是常见的女性生殖系统肿瘤之一,在全球常见癌症中居第六位,常见女性癌症中居第五位,死亡人数在导致全球女性死亡的主要癌症中列第七位。近年来,卵巢癌发病率在我国呈上升趋势,预计2016年我国卵巢癌发病率将达到6.43/10万人;由于缺乏明显的鉴别性体征和筛查方法、卵巢癌的早期诊断十分困难。临床研究表明,早期阶段(I/II)确诊的卵巢癌患者5年生存率可达90%以上,然而,约70%-85%的患者在确诊时都已处于晚期阶段(III/IV期),平均5年存活率仅有20%-35%,致使卵巢癌成为病死率最高的妇科恶性肿瘤。卵巢癌中85%~90%的病理类型是上皮性卵巢癌(EOC)。鉴于患者的生存率与确诊时的疾病分期密切相关,早期检测成为提高卵巢癌生存期的关键。
在人体内,糖分子主要以单糖或寡聚糖的形式存在,寡糖链既是糖复合物(糖蛋白、糖脂等)的重要组成部分,同时也具有重要的生物学功能。作为一种,蛋白质糖基化修饰是最重要的翻译后修饰之一。研究表明,70%的人类蛋白质含有一个或多个糖链,这些糖链由甘露糖、半乳糖及N-乙酰葡糖胺等十几种单糖组成,经不同糖基转移酶、糖苷酶及磺基转移酶的催化以不同的连接方式可构成庞大的糖链谱。
在细胞恶变和肿瘤发生、发展的过程中,糖基化异常是一个普遍现象,而且这种改变常早于糖蛋白表达量的变化。鉴于目前所发现的卵巢癌标志物均为糖蛋白,因此对其糖基化模式和糖链结构做精细的解析,从中寻找或发现新的特异性肿瘤标志物,成为近年来卵巢癌生物标志物研究的新热点。相较于蛋白质和脂质部分,糖链的改变往往是对机体生理、病理状态变化的应答更灵敏,因此研究糖复合物糖基化模式可以提高肿瘤蛋白标志物检测的特异性与灵敏度,为癌症早期发现、诊断、预后及耐药性监测提供新的方法。
初步的研究显示,特异性的血清N-糖链结构,能够有效的鉴别卵巢癌和健康对照,有可能为卵巢癌的检测提供具有更高准确性、灵敏度和特异性的生物标志物。留一法交叉验证,以特异性N-糖链为标志物,对卵巢癌的鉴别敏感度达86%、特异性为95.8%。
唾液是由唾液腺、颌下腺等汇聚形成的无色无味、弱酸性的混合性低渗液体,是人体内重要的体液之一,组成成分虽极为复杂,却相对稳定。有研究数据显示人类唾液中蛋白总量高达0.5~3g·L-1,从中鉴定出1166种有代表性的蛋白,其中192种唾液蛋白同时存在于血浆蛋白中。唾液糖蛋白组构成的改变能够反映人体生理状态的变化,通过比对唾液糖蛋白组的组成成分,能够为洞悉机体的生理状态和身体的各种变化过程提供一个客观的观察指标。如前所述,蛋白质的异常糖基化是肿瘤发生的一个重要标志。唾液蛋白中糖基化蛋白的比例较高,且多为N-糖链糖蛋白。因此,人类唾液成为糖蛋白的理想来源。加之唾液糖蛋白与血清糖蛋白具有高度的相似性,唾液糖蛋白的组成和丰度,可以很好的反映血液中各种糖蛋白水平的变化。鉴于唾液与人体健康及疾病状态密切相关性,作为重要的人体液个人信息库之一,唾液标本用于临床疾病的早期诊断、不仅可用于口腔局部疾病的有效治疗和疾病预防,还可用于全身系统性疾病的诊断、病程监控和健康的评估。
凝集素是一类糖结合蛋白,其可识别不同的糖链结构并以多价形式与这些糖链特异性结合。基于凝集素的糖组学技术是后基因组学时代的一种新兴的、综合性技术,最具代表性的为凝集素芯片。进入新世纪以来,凝集素糖组学技术已发展成为与质谱等方法相互补充的,一种快速、灵敏、高通量的糖生物学分析工具,应用领域也从糖组学基础研究逐渐拓展到生物化学、医学检验学、免疫学、分子生物学、生物信息学等诸多领域。
技术实现要素:
本发明涉及一种无创性、简便快速、样本微量、高通量的通过检测受试者唾液中糖蛋白和糖链变化来鉴别诊断上皮性卵巢癌(epithelial ovarian cancer,EOC)的凝集素芯片技术及相应的检测试剂盒。
以此来解决目前在上皮性卵巢癌鉴别诊断方法中存在的特异性不高、样本存在血源性疾病危害、不适于做大规模人群普查等问题。
本发明所提供的上皮性卵巢癌唾液糖蛋白鉴别诊断芯片由一组凝集素(ConA、WGA、LCA、AAL、WFA、RCA120、UEA-I、VVA、SNA、PSA、ECA、MAL-Ⅱ、HHL、PHA-E、LTL、PNA等)所构成,检测试剂盒包括上述凝集素组芯片及配套的检测试剂。检测结果可通过仪器测量标记物相对荧光强度实现对检测物的定量分析,也可目测做定性分析;
本发明还包括检测结果的判别方法和判别标。
当凝集素PSA所识别的糖链结构(α-D-Man,Fucα-1,6GlcNAc,α-D-Glc)和SNA所识别的糖链结构(Sia2-6Galβ1-4Glc(NAc))显著上调,凝集素MAL-II所识别的糖链结构(Sia2-3Galβ1-4Glc(NAc))、ECA所识别的糖链结构(Galβ-1,4GlcNAc(type II),Galβ1-3GlcNAc(type I))和HHL所识别的糖链结构(High-Mannose,Manα1-3Man,Manα1-6Man,Man5-GlcNAc2-Asn)显著下调初步判定样本来自健康人群。
当凝集素PHA-E所识别的糖链结构(Bisecting GlcNAc and biantennary N-glycans)显著上调,凝集素LTL所识别的糖链结构(Fucoseα-1,3GlcNAc(core fucose),Sia-Lex)和PNA所识别的糖链结构(Galβ1-3GalNAcα-Ser/Thr(T))显著下调,可初步判定样本来自良性卵巢疾病患者。
当凝集素RCA120所识别的糖链结构(β-gal,Galβ1,4GlaNAc(type II)Galβ1-3GlcNAc(type I)containing GlcNAc and MurNAc)、UEA-I所识别的糖链结构(Fucoseα1-2Galβ1-4Glc(NAc))、ConA所识别的糖链结构(High Mannose,Mannα1-6(Mannα1-3),Man,terminal GlcNac)、LCA所识别的糖链结构(α-D-Man,Fucα-1,6GlcNAc,α-D-Glc)、AAL所识别的糖链结构(Fucα-1,6GlcNAc(core fucose),Fucα-1,3(Galβ1-4)GlcNac)、WFA所识别的糖链结构(terminating in GalNAcα/β1-3/6Gal)和WGA所识别的糖链结构(Multivalent Sia and(GlcNAc)n)显著上调,DBA所识别的糖链结构(αGalNAc,Tn antigen,GalNAcα1-3((Fucα1-2))Gal(blood group A antigen))、VVA所识别的糖链结构(terminal GalNAc,GalNAcα-Ser/Thr(Tn),GalNAcα1-3Gal)、NPA所识别的糖链结构(High-Mannose,Manα1-6Man)和GNA所识别的糖链结构(High-Mannose,Manα1-3Man)显著下调,可初步判定样本来自上皮性卵巢疾病患者。
本发明还包括上述凝集素组芯片检测试剂盒的应用,其主要步骤包括唾液样本采集;唾液蛋白处理和荧光标记;凝集素芯片检测及其数据分析。
该试剂盒包括:蛋白酶抑制剂、DMSO、Cy 3荧光染料、Cy5荧光染料、Sephadexg G-25柱、牛血清白蛋白(BSA)、氧基硅烷试剂(GPTS)、Bradford试剂、PVDF膜、Tween-20、玻璃片基以及以上特定的凝集素组合。
进一步还初步构建了能够量化细分的五种诊断模型。
本发明与现有检测方法相比较具有如下优势:
本发明是将一组特定的凝集素(19种)作为探针固定于表面修饰的基片上,通过凝集素与唾液中糖蛋白糖链特异性结合,可以快速检测出患者唾液样品中差异性表达的糖蛋白和糖链结构,实现了对样本中多种糖蛋白和糖链结构的快速、高通量检测。
本发明以唾液作为待检测物,其采集简便易行、无创,同时可有效的避免以血液标本为检测物而带来的血源性病原体(HIV、HBV、HCV、TP等)对实验室和检验人员的安全威胁。
附图说明
图1为凝集素芯片点样阵列图及应用于糖蛋白和糖链的荧光检测图,图1-A为凝集素芯片点样阵列图,图1-B分别为健康女性志愿者(HV)、良性卵巢疾病患者(OB)、卵巢癌I期患者(OC-I)、卵巢癌II期患者(OC-II)和卵巢癌III期患者(OC-III)唾液糖蛋白和糖链结构荧光检测结果图。
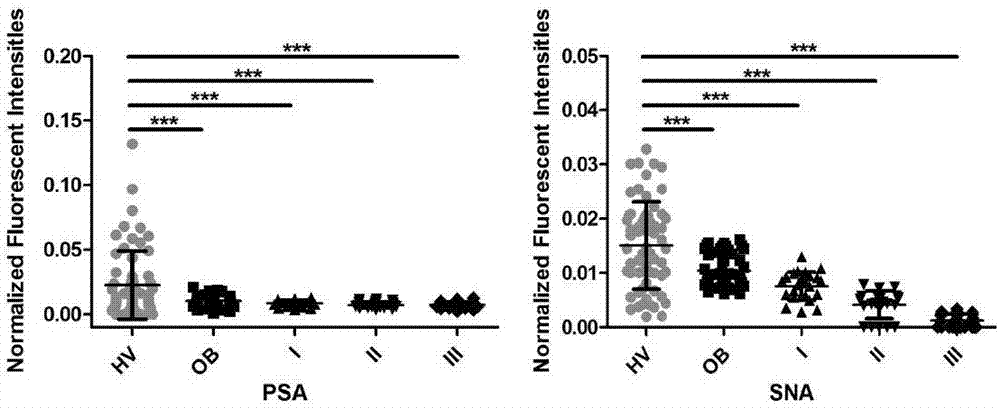
图2-图7为凝集素散点图,其中:
图2表明HV与凝集素PSA、SNA的反应性与OB、OC间有显著性差异。
图3表明HV与凝集素MAL-Ⅱ、ECA、HHL的反应性显著下调。
图4表明OB与凝集素PHA-E的反应性显著高于HV、OC。
图5表明OB与凝集素LTL、PNA的反应性显著下调。
图6表明OC与凝集素RCA120、UEA-Ⅰ、ConA、LCA、AAL、WFA和WGA的反应性显著上调。
图7表明OC与凝集素DBA、VVA、NPA、GNA的反应性显著下调。
注:以上散点图中,*P<0.05;**P<0.01;***P<0.001.Rs:Spearman相关系数。
图8为凝集素芯片结果的聚类分析图。横轴为个例样本,纵轴为37种凝集素。每个方块的强度代表凝集素对样本的结合水平。右侧灰度标尺自上而下表示结合强度由高到低(原聚类分析彩图对应为:红:高结合;绿:低结合;黑:中等强度结合)。
图9为主成分分析图;图中示意了上、中、下三个灰度区块(原彩图对应为黄、绿、红),从图中可以看出63例健康女性志愿者(HV)唾液标本全部分布于下侧区块,51例卵巢良性疾病(OB)患者唾液标本几乎全部分布于中部区块,而78例已确诊的上皮性卵巢癌(OC)患者唾液标本大部分布于上侧区块,部分卵巢癌I期患者(OC-I)唾液标本位于中部区块,显示OC-I与OB间存在交叉反应。但下侧区块与上侧区块完全没有交叉,表明本发明的凝集素芯片检测技术对HV和OC的检测具有很高的特异性。
具体实施方式
下面通过给出的具体实施例对本发明做进一步说明,但不作为对本发明的限定。
本发明从37种凝集素(如表1所示)中筛选用于鉴别诊断上皮性卵巢癌女性患者的凝集素探针。
表1
本发明中使用的试剂盒材料包括:蛋白酶抑制剂,DMSO,Cy3、Cy5荧光染料,Sephadexg G-25柱,牛血清白蛋白(BSA),玻璃片基,氧基硅烷试剂(GPTS),Bradford试剂,PVDF膜,Tween-20。
1.唾液样本的收集
共采集唾液样本192例,健康女性志愿者(HV)唾液63例,卵巢良性疾病(OB)患者唾液51例,已确诊的上皮性卵巢癌(OC)患者唾液78例,其中I期患者24例、II期患者22例、III期患者32例。如表2所示。
表2样本信息
2.唾液蛋白处理和荧光标记
唾液收集流程如下,受试者禁食2小时后,用生理盐水漱口,保持舌尖顶住上颚使唾液自然分泌,用无菌管收集自然流出的唾液,收集的唾液中加入蛋白酶抑制剂(1μL/mL),以防蛋白降解,4℃、12,000rpm×10min离心后收集上清液,0.22μm微孔滤膜过滤除菌,收集处理后的唾液样本BCA法测定蛋白浓度蛋(白含量100μg),用Cy3荧光染料标记,Sephadex G-25层析纯化,收集到的荧光标记后的唾液蛋白用于凝集素芯片检测实验。
3.凝集素芯片制备
将37种凝集素以及2个BSA(阴性对照)和1个标有Cy3的BSA(阳性对照)溶于各自buffer中配制成1mg/mL的点样液,使用博奥晶芯SmartArrayer 48点样仪(设置参数:矩阵个数、点样湿度、重复次数、预点样位置与次数、取样深度时间等),按图1-A所示的排布方式,将凝集素和对照液点在环氧化片基上,点制好的芯片置于湿盒中避光保存过夜,于37℃真空干燥箱中干燥2h后置于芯片盒中于4℃保存。
4.凝集素芯片实验及其数据分析
取点制好的凝集素芯片置于37℃真空干燥箱中回温30min,分别用1×PBST和1×PBS,各低速震摇洗涤洗1次,5min/次,离心甩干芯片,放入孵育盒,加入650μL封闭液,旋紧孵育盒,置于芯片恒温旋转杂交仪中,室温低速旋转封闭1h。完成封闭后,取出芯片,同上用1×PBST和1×PBS各洗涤2次,5min/次。离心甩干后置于孵育盒中加入样品液(孵育缓冲液+标记蛋白),旋紧芯片孵育盒后置于芯片恒温旋转杂交仪中,室温低速旋转孵育3h。完成孵育后,取出芯片,同上用1×PBST和1×PBS各洗涤2次,5min/次,离心甩干,用Genepix 4000B芯片扫描仪进行扫描读取芯片数据。并使用实验室自主编程设计的凝集素芯片归一化分析软件进行自动归一化分析。
图8和图9是利用同一数据源(192例唾液样本)以不同处理方法得到的不同展现形式,显示了不同样本组的糖蛋白糖链存在差异,表明糖蛋白糖链可以用于区别不同样本组。
5.诊断模型的构建
进一步的,依据192例唾液样本的凝集素芯片结果,利用逐步逻辑回归(forward stepwise logistic regression analysis)分别构建卵巢良性疾病(OB)、卵巢癌-I期(OC-I)、卵巢癌-II期(OC-II)、卵巢癌-III期(OC-III)以及卵巢癌(OC)五种诊断模型。纳入模型的凝集素均来源于各组间有显著差异的凝集素。
1.Model OB模型公式
2.Model OC-I模型公式
3.Model OC-II模型公式
4.Model OC-III模型公式
5.Model OC模型公式
之所以进一步建立上述五种诊断模型,是希望能够量化细分OB、OC-I、OC-II、OC-III以及OC。这五种诊断模型将原本的数据进行了量化分析,根据ROG曲线获得最优敏感度特异性时的cutoff值。根据cutoff值进行判断:
假如cutoff值为0.5,大于cutoff值是为癌,则样本代入模型计算所得的值越靠近0则健康的可能性越大,越接近1,则癌的可能性越大。并且模型本身是一个sigmoid函数,90%的数据极度靠近0或者1,接近阈值的数据并不多。该模型给出了明确的阈值,非常方便去进行判断。
上述内容是结合具体的实施方式对本发明所做的进一步详细说明,不能认定本发明的具体实施只局限于这些说明。对于本发明所属技术领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干简单推演或替换,都应当视为属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!