一种基于适配体与滚环扩增的外泌体检测方法与流程
本发明涉及生化检测和分子诊断领域,具体涉及一种基于适配体与滚环扩增的外泌体检测方法。
背景技术:
外泌体为各类细胞分泌的双层膜性囊泡,直径在30-100nm,其中含有细胞特异的蛋白质、脂质和核酸等多种组分。外泌体几乎在所有类型的人体体液,包括外周血,唾液,尿液,等中均可有效检测。外泌体所携带和传递重要的信号分子形成了一种全新的细胞间信息传递系统,影响细胞的生理状态并与多种疾病的发生与进程密切相关,如肿瘤细胞分泌的外泌体可进入淋巴系统和肿瘤组织内的毛细血管,发挥对恶性肿瘤的调控作用。此外,外泌体的特征部分也能反映来源肿瘤的表型,其携带的肿瘤特异性抗原和mirna可以作为肿瘤诊断标志物。调查研究显示,外泌体通过参与转移前微环境的形成,调控细胞的增殖和凋亡等,在癌症的侵袭和转移中发挥着重要作用。除了用于疾病诊断外,外泌体还具有抗肿瘤免疫,诱导肿瘤免疫逃逸、促进肿瘤血管新生和肿瘤转移等生理功能。因此,体液中的外泌体不仅可以作为癌症早期诊断及预后评价的重要指标。
众所周知的,dna是贮存和传递遗传信息的分子,由于其精确的a-t,c-g碱基互补配对原则赋予了其结构的可预测性和重复性,近年来,dna也被用于构建从一维到三维的各种球状、树枝状以及更为复杂的纳米结构。dna纳米结构具有生物相容性好、易于化学修饰、物理化学性质稳定等优点,因此在临床医学领域有着巨大的潜力。电化学生物传感器的特异性好、灵敏度高,且成本较低,近年来,有相关基于外泌体表面标志物的三明治免疫夹心法、多通道金芯片等电化学法检测外泌体的报道,研究者通过不同的信号放大原理实现了对外泌体的定量检测,且能够用于实际血清样本的检测,然而,这些方法都存在各自的缺陷,比如灵敏度较低,无法针对特异性的癌症相关外泌体等,因此,筛选出能特异性结合癌症相关外泌体的靶向探针,并设计高效的信号放大机制,最终构建出高灵敏度的外泌体电化学传感器对于辅助癌症的早期诊断和治疗有着重要意义。
技术实现要素:
本发明的目的是提供一种基于适配体与滚环扩增的外泌体检测方法。本发明解决了由于正常细胞产生的外泌体对检测产生干扰,背景信号高,利用外泌体特异性抗体或适配体作为识别探针的方法则存在灵敏度低的问题。
为实现上述目的,本发明提供的技术方案是:
一种基于适配体与滚环扩增的外泌体检测方法,包括如下步骤:
1)制备修饰外泌体膜蛋白抗体的金电极,利用bsa封闭位点;
2)通过磷酸化的挂锁探针和连接探针制备环状模板,利用核酸外切酶去除未成环的探针;
3)将抗体修饰的电极与外泌体孵育,将外泌体特异性适配体-引物探针修饰到电极表面;
4)加入环状模板、聚合酶缓冲液、dntps、bsa及phi29dna聚合酶,将电极在37℃孵育,再与高铁血红素溶液孵育;
5)用pbs洗涤,将电极浸入到工作溶液进行电化学测量,电极工作溶液的成分为:pbs+100mmkcl+8mmh2o2。
步骤1)所述制备修饰外泌体膜蛋白抗体的金电极是通过先在预处理电极上形成半胱胺自组装单层,再与戊二醛溶液反应,抗体经由半胱胺的自组装单层和戊二醛的双官能交联固定到金电极的表面。
步骤2)构建环状模板的挂锁探针中包含了两个g四联体互补序列,因此能通过滚环扩增产生众多g四联体序列,连接探针与挂锁探针两端互补,可以通过t4连接酶将挂锁探针成环。
步骤3)金电极上修饰的抗体能捕获外泌体,适配体-引物探针包含能特异性识别外泌体的适配体序列和一段与环状模板互补的引物序列。
步骤4)中,适配体-引物探针能与环状模板结合,在加入缓冲液和酶等组分后能启动滚环扩增,形成大量g-四联体重复单元,与血红素结合后形成模拟过氧化物酶结构。
步骤5)中,在金电极表面形成的大量模拟过氧化物酶结构能催化过氧化氢反应产生电信号。
与现有技术相比,本发明的有益效果是:
本发明应用电化学传感器的方法构建出基于外泌体特异性的适配体探针,利用g-四联体-hemin模拟过氧化酶催化过氧化氢产生信号,并结合滚环扩增合成大量g-四联体进行信号放大,因此本发明技术极大的提高了外泌体的检测灵敏度。
附图说明
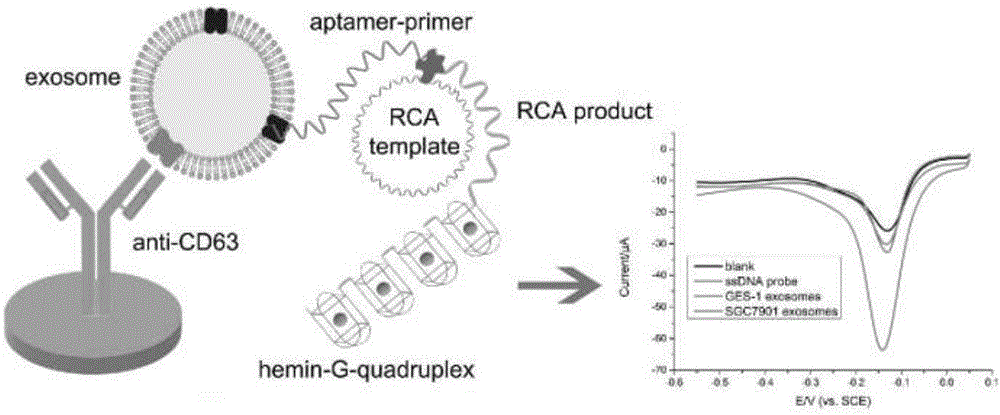
图1为一种基于适配体与滚环扩增的外泌体检测方法流程示意图。
图2为环状模板及滚环扩增产物电泳图。
图3为电极修饰图(从左至右依次为分子量标准,环状模板制备后未加核酸外切酶,模板制备后加入核酸外切酶,模板制备过程中未加入t4连接酶,滚环扩增三次重复实验)。
图4为外泌体定量检测线性关系图。
具体实施方式
一种基于适配体与滚环扩增的外泌体检测方法,首先设计包含外泌体特异性适配体序列和与环状模板互补的引物序列的适配体-引物探针。环状模板通过连接探针和挂锁探针在t4dna连接酶的作用制备。外泌体表面膜蛋白抗体经由半胱胺的自组装单层和戊二醛的双官能交联固定到金电极的表面,多余位点则由bsa封闭。外泌体被捕获到金电极表面后加入适配体-引物探针,该探针能捕获环状模板,并在phi29dna聚合酶的催化下启动滚环扩增,由于挂锁探针中含有两段与g-四联体互补的序列,经由滚环扩增形成大量的g-四联体重复单元,在钾离子存在的情况下能结合血红素分子并折叠成hrp-模拟酶结构,催化过氧化氢的反应电流信号。
其步骤如下:
1.制备修饰抗体的金电极:(1)金电极用0.05mm氧化铝浆料抛光,将电极用超纯水冲洗干净,室温干燥;(2)预处理的金电极在含有15mm半胱胺的pbs溶液中浸泡过夜,以产生半胱胺的自组装单层;(3)金电极浸泡在用5%的戊二醛水溶液中,37℃反应6小时;(4)金电极与10μl20μg/ml的外泌体膜蛋白抗体在37℃孵育1小时;(5)电极浸泡在5mg/ml的bsa溶液中,37℃孵育1小时,超纯水冲洗。
2.环状模板制备:(1)磷酸化挂锁探针(100μm)和1μl连接探针(100μm)在t4连接酶缓冲液中杂交;(2)加入60ut4dna连接酶,并将该混合物在16℃过夜孵育;(3)t4连接酶在65℃保持15分钟失活,加入外切酶i20u,外切酶iii50u消化剩余的单链dna和双链dna;(4)酶通过在85℃加热10分钟变性,在4℃保存直至使用。
3.电极捕获外泌体:(1)将抗体修饰的电极与pbs重悬的外泌体溶液在37℃孵育1小时,电极用pbs溶液清洗;(2)将10μl的100nm的适配体-引物探针修饰到电极表面,37℃孵育1小时;
4.启动滚环扩增:(1)加入1μlphi29dna聚合酶缓冲液,0.5μl10mmdntps,0.2μl0.1mg/mlbsa,10uphi29dna聚合酶和10μl120nm环状模板,将电极在37℃孵育2小时;(2)电极与高铁血红素溶液(100nm)在37℃孵育1小时。
5.电信号检测:电极用pbs洗涤三次,将电极浸入到工作溶液进行电化学测量,电极工作溶液的成分为:pbs+100mmkcl+8mmh2o2。
以下结合具体实施例对本发明作进一步描述:
实施例1:环状模板制备及滚环扩增产物。
1.磷酸化挂锁探针(100μm)和1μl连接探针(100μm)在t4连接酶缓冲液中杂交;加入60ut4dna连接酶,并将该混合物在16℃过夜孵育;t4连接酶在65℃保持15分钟失活,加入外切酶i20u,外切酶iii50u消化剩余的单链dna和双链dna;酶通过在85℃加热10分钟变性。
其中挂锁探针和连接探针的序列如下:
挂锁探针:
5’-tagcacggacattttcccaacccgccctacccttttttttttcccaacccgccctacccttttgtaactgtttccttc-3’
连接探针:5’-tgtccgtgctagaaggaaacagttac-3’
2.加入1μlphi29dna聚合酶缓冲液,0.5μl10mmdntps,0.2μl0.1mg/mlbsa,10uphi29dna聚合酶,10μl100nm适配体-引物探针以及10μl120nm环状模板,将电极在37℃孵育2小时。
其中适配体-引物探针以与胃癌外泌体特异性结合的适配体为例(下划线部分为适配体序列):
5’-tactgcatgcacaccacttcaactatttttttttttgctagaaggaaacagttac-3’
3.电泳结果表明,在环状模板制备过程中未加入t4连接酶的组在核酸外切酶的作用下被全部降解,环状模板制备后未加入核酸外切酶的组则有除了成环模板之外的条带,仅有加入t4连接酶,并在成环后加入核酸外切酶的组存在唯一的条带,说明环状模板制备成功;滚环扩增产物由于长度过长,在电泳图中位于1031bp之后,说明滚环扩增成功。
实施例2:为金电极表面修饰抗体并用于捕获胃癌外泌体,并启动滚环扩增。
1.金电极用0.05mm氧化铝浆料抛光,将电极用超纯水冲洗干净,室温干燥;预处理的金电极在含有15mm半胱胺的pbs溶液中浸泡过夜,以产生半胱胺的自组装单层;金电极浸泡在用5%的戊二醛水溶液中,37℃反应6小时;金电极与10μl20μg/ml的anti-cd63抗体在37℃孵育1小时;电极浸泡在5mg/ml的bsa溶液中,37℃孵育1小时,超纯水冲洗。
2.将抗体修饰的电极与pbs重悬的胃癌外泌体溶液在37℃孵育1小时,电极用pbs溶液清洗;将10μl的100nm的适配体-引物探针修饰到电极表面,37℃孵育1小时;加入1μlphi29dna聚合酶缓冲液,0.5μl10mmdntps,0.2μl0.1mg/mlbsa,10uphi29dna聚合酶和10μl120nm环状模板,将电极在37℃孵育2小时;
3.利用电化学工作站对电极进行检测:如图二所示,随着电极修饰和胃癌外泌体捕获等步骤的进行,cv信号越来越弱,金电极阻抗则越来越大,这是因为修饰的抗体、外泌体和长单链核酸阻碍了电子转移,导致电极氧化还原峰电流的降低,电极阻抗增大,上述实验结果说明抗体修饰、靶物质捕获及滚环扩增成功。
实施例3:电极工作过程
1.制备修饰抗体的金电极:(1)金电极用0.05mm氧化铝浆料抛光,将电极用超纯水冲洗干净,室温干燥;(2)预处理的金电极在含有15mm半胱胺的pbs溶液中浸泡过夜,以产生半胱胺的自组装单层;(3)金电极浸泡在用5%的戊二醛水溶液中,37℃反应6小时;(4)金电极与10μl20μg/ml的anti-cd63抗体在37℃孵育1小时;(5)电极浸泡在5mg/ml的bsa溶液中,37℃孵育1小时,超纯水冲洗。
2.环状模板制备:(1)磷酸化挂锁探针(100μm)和1μl连接探针(100μm)在t4连接酶缓冲液中杂交;(2)加入60ut4dna连接酶,并将该混合物在16℃过夜孵育;(3)t4连接酶在65℃保持15分钟失活,加入外切酶i20u,外切酶iii50u消化剩余的单链dna和双链dna;(4)酶通过在85℃加热10分钟变性,在4℃保存直至使用。
3.电极捕获外泌体:(1)将抗体修饰的电极与pbs重悬的不同浓度的胃癌外泌体溶液在37℃孵育1小时,电极用pbs溶液清洗;(2)将10μl的100nm的适配体-引物探针修饰到电极表面,37℃孵育1小时;
4.启动滚环扩增:(1)加入1μlphi29dna聚合酶缓冲液,0.5μl10mmdntps,0.2μl0.1mg/mlbsa,10uphi29dna聚合酶和10μl120nm环状模板,将电极在37℃孵育2小时;(2)电极与高铁血红素溶液(100nm)在37℃孵育1小时。
5.电信号检测:电极用pbs洗涤三次,将电极浸入到工作溶液进行电化学测量,电极工作溶液的成分为:pbs+100mmkcl+8mmh2o2。
6.利用origin分析数据,如图4所示,在外泌体浓度为4.8×103到4.8×106/ml时,电信号与外泌体浓度的对数呈良好的线性关系。
以上所述,仅是本发明的较佳实施例,并非对本发明作任何形式上的限制,任何熟悉本专业的技术人员,在不脱离本发明技术方案范围内,依据本发明的技术实质,对以上实施例所作的任何简单的修改、等同替换与改进等,均仍属于本发明技术方案的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种舌癌细胞的核酸适配体及试剂盒的制造方法与工艺
- 金黄色葡萄球菌肠毒素C2的核酸适配体C203及其筛选方法和应用与制造工艺
- 胰岛素核酸适体INS5及其制备方法与制造工艺
- 一种高亲和力兴奋剂核酸适体EPO4及其制备方法与制造工艺
- 一种邻苯二甲酸酯类增塑剂单链DNA核酸适配体及其筛选与表征方法及电化学传感器与制造工艺
- 基于高特异性核酸适体荧光探针INS1胰岛素试剂盒及其检测方法与制造工艺
- 运用核酸适配体与溶菌酶特异性识别并形成G四链体进行荧光显现潜指纹的方法与制造工艺
- 基于快速识别核酸适体荧光探针INS2胰岛素试剂盒及其检测方法与制造工艺
- 一种用于检测沙门氏菌的增敏型核酸适配体试纸条及其制备方法
- 几种识别灭草松的核酸适配体序列及其衍生物的制作方法