肺血栓栓塞症基因面板试剂盒及其应用的制作方法
本发明涉及生物医药技术领域,具体提供一种检测肺血栓栓塞症基因的液相基因面板(panel)捕获试剂盒及其应用。
背景技术:
肺血栓栓塞症(pulmonarythromboembolism,pte)是指来自静脉系统或右心的血栓阻塞肺动脉或其分支所致的疾病,以肺循环和呼吸功能障碍为主要临床表现和病理生理特征。pte是一种多因素引发的疾病,发病因素包括静脉系统中凝血异常、环境及遗传因素。其主要表现为血液循环系统血栓形成。有报道称,美国dvt和pte的发病率在心血管疾病中占第三位,仅次于冠心病和高血压。目前,我国pte流行病学缺乏大样本统计资料,但根据一项32年的临床数据回顾性分析发现,我国pte发病率在逐年上升,具有家族聚集性。未经治疗的pte患者死亡率约为30%,正确诊断治疗后,病死率为3%左右。抗凝和溶栓等治疗大多建立在pte发生以后,药物治疗还存在药物抵抗或出血风险,且停药后易复发。由于pte临床症状特异性不明显,疾病生前诊断率低于50%。因此及时发现并正确诊断及治疗可有效地降低死亡风险。开发更为精准的疾病诊断或检测的新方法具有重要的现实意义。
pte遗传因素占60%以上,凝血系统基因遗传缺陷是最为主要的肺栓塞发病因素之一。pte血栓形成与凝血或抗凝基因proc、serpins、pros等遗传突变密切相关,在中国人群中存在特异性的遗传突变位点。遗传性抗凝蛋白缺陷是pte的主要病因。随着研究的深入,大量的遗传致病基因已经被报道证实与pte的发病风险、凝血缺陷或药物治疗密切相关。
目前的常规肺栓塞风险或发病因素的检测,大部分是通过elisa(凝血四项等)、基因检测芯片或者pcr等基因分型技术检测,检测速度慢、效率低、成本高,检测的通量较低,无法同时检测大量基因,同时检测多方面的指标需要通过多种技术手段。
因此开发一种高通量、快速、准确的检测肺栓塞的遗传致病因素以及药物耐受等因素的方法具有重要的科学与现实意义。同时高通量、准确有效的遗传检测手段,可为pte遗传突变个体的个性化分子诊疗、抗凝或溶栓用药提供指导,提高疾病治愈率,降低发病率、死亡风险。
技术实现要素:
本发明实施例的目的在于提供一种检测肺血栓栓塞症的致病性基因、凝血缺陷基因、临床耐药基因的液相基因面板(panel)捕获试剂盒,可用于肺血栓栓塞症遗传因素的精准检测。本发明的方法基于目标区域磁珠法液相捕获系统以及全外显子二代测序技术,获得针对肺血栓栓塞症的目标基因全外显子序列信息,通过本发明基因面板对遗传信息进行大范围捕获并测序,该基因面板可用于家族性以及高风险的肺栓塞群体的遗传风险评估、疾病预防、遗传咨询,并为诊断以及临床用药提供参考。
本发明实施例提供的检测肺血栓栓塞症的液相基因面板捕获试剂盒包括以下目标基因对应的探针:
(一)与血栓风险因素相关的基因
(二)与凝血相关的基因
(三)与药物耐受相关的基因
,其中每个基因至少具有两个对应的探针序列。
优选地,所述探针至少包括seqidno1-seqidno184。
进一步优选地,本发明实施例提供的检测肺血栓栓塞症的液相基因面板捕获试剂盒,为液相芯片,该液相芯片包括对应的生物素标记(在5’端标记)的探针以及链霉亲和素磁珠。
本发明实施例提供的上述试剂盒可用于检测该基因面板成员的基因突变,为临床诊断及用药提供参考和指导。
本发明的实施,包括了基因面板芯片捕获试剂盒系统,以及样品的前处理实验技术以及后续数据分析的平台,其获得的检测遗传突变信息可用于疾病预防、遗传咨询,指导临床用药选择及剂量确定。
本发明基于对肺栓塞群体的遗传因素研究,结合目前已报道突变位点,利用生物信息学分析、设计目标基因的捕获探针,并通过integrateddnatechnologies平台,筛选获得肺栓塞高风险的遗传致病基因序列,设计整个捕获芯片及基因panel。该panel可对肺栓塞相关的风险基因f5、蛋白c、蛋白s以及一系列的凝血因子的全编码外显子区域进行目标捕获,获得目标基因序列,随后对获得的目标区域序列进行二代测序,并利用生物信息学分析其携带的遗传突变位点,注释其遗传位点与致病、临床用药的相关性。
本发明的基因panel综合了肺栓塞多层次方面的遗传因素,覆盖全面,其目标捕获可明显提高基因的测序深度,为获得更为精确的测序结果提供保障。同时,二代测序技术panel平台成熟,可作为肺栓塞患者进行遗传检查,风险评估以及耐药人群的临床治疗指导。
附图说明
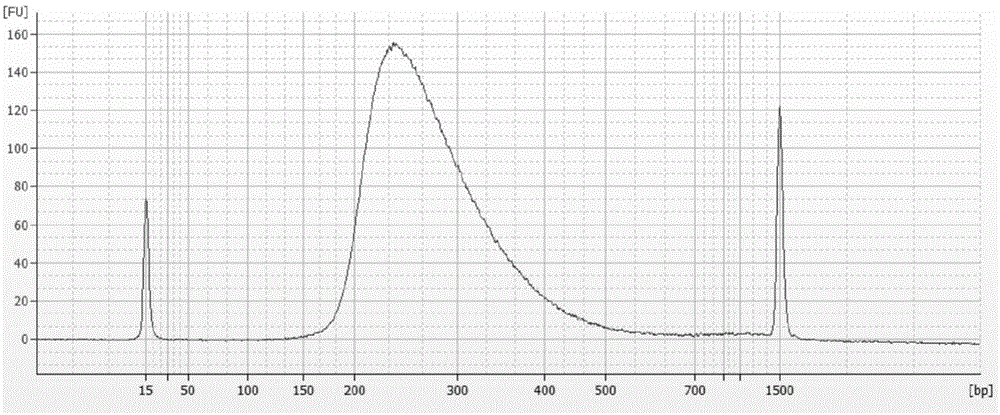
图1为扩增文库dna分析峰图。
图2为本发明实施例提供的肺血栓栓塞症的基因panel的检测试剂盒对某患者检测后基因sanger测序的验证结果,其中serpine2有突变。
图3为本发明实施例提供的肺血栓栓塞症的基因panel的检测试剂盒对另一患者检测后基因sanger测序的验证结果,其中serpine2无突变。
图4为本发明实施例提供的肺血栓栓塞症的基因panel的检测试剂盒对另一患者检测后基因反向测序的验证结果,其中proc有突变。
图5为本发明实施例提供的肺血栓栓塞症的基因panel的检测试剂盒对另一患者检测后基因反向测序的验证结果,其中proc无突变。
具体实施方式
为了使本发明要解决的技术问题、技术方案及有益效果更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
本发明实施例提供一种用于检测肺血栓栓塞症的基因panel的液相芯片捕获试剂盒,主要用于检测如上所述的92个基因,这些基因组成上述基因面板。
具体地,上述检测包括通过探针来对目标基因进行杂交的步骤,即,该试剂盒包括上述92个基因对应的探针,每个基因至少对应2个探针,探针序列至少为seqidno1–seqidno184。
寡聚核苷酸探针利用生物素在5’端进行标记、合成,探针通过碱基互补配对与片段化的基因组dna文库杂交,再用链霉亲和素磁珠(dynabeadsmyonestreptavidint1)纯化将目标区域拉下来进行富集。基于生物素标记的探针信息,通过肺血栓栓塞症患者的基因突变的液相磁珠捕获系统对目标基因的目标区域进行有效捕获,通过后续二代测序,可用于检测panel中基因的遗传突变。
上述探针的浓度及链霉亲和素磁珠的含量为本领域技术人员所熟知的,链霉亲和素磁珠可从市场购得。
上述92个基因均为本发明的基因panel所必不可少的。
基因panel是一个基因组合,在基因检测中使用基因panel所检测基因的所有编码遗传位点,比pcr技术检测的基因信息更全面、完整,相对来说,获得的基因信息量更大。人体内的基因有2万多个编码蛋白质的基因,也有虽然不编码蛋白质,但是在人的疾病发生和天赋潜能中发挥重要作用的基因,人的基因的碱基数量高达64亿,在用基因panel进行基因检测时,核心点在于如何选择基因组合中与疾病风险评估、诊断及治疗相关的基因以及基因信息与各临床、诊疗因素的相关性如何阐述。
本发明提供的上述基因面板(panel)的检测探针,可通过发现基因突变及基因缺陷,由此用于针对肺栓塞患者高风险患者进行遗传咨询、风险评估以及耐药人群的临床治疗提供遗传检测信息,指导临床的诊断及治疗等,这些用途主要通过对本发明的液相基因panel试剂盒对目标基因进行有效捕获,检测结果进行分析获得。
本发明基因panel通过自主研发测算进行探针设计,总共92个目标基因,包含1142个目标区域,区域片段大小205.1kbp;总计探针大于或等于184个,每个基因至少设计两个探针,优选覆盖99.5%的区域;本发明应用于样品测序的推荐最小测序数据量为57mbp/样品。
本发明的试剂盒中的探针设计基于人类数据库h.sapiens(ucschg19,grch37,february2009);目标区域探针及位置信息基于数据库:ccds,ensembl,gencode,refseq。
探针信息如下表1所示:
表1探针设计相关信息
发明人利用以上92个基因panel进行捕获、并测序,具体步骤如下:
实施例1基因组dna样品提取
使用qiaampdnabloodminikit(qiagen,cat:y5-51106)对受试者进行静脉血dna的提取和纯化,具体步骤如下:
1.取静脉血,常温下1000g离心15min,吸取1ml的血细胞,加dna裂解液3ml,旋涡震荡仪充分混匀后,标记名字及日期。
2.吸取20μl蛋白酶k至1.5ml离心管的底部。
加入200μl血液样品至离心管中,再加入200μlbufferal至样品中,涡旋振荡15s混匀。
3.在56℃孵育10min后,快速离心,去除残留在1.5ml离心管盖子中的液滴。
4.加入200μl的无水乙醇,涡旋振荡15s混匀。振荡完毕后,快速离心,将混合物转移至qiaampmini离心管柱,6000g离心1min。
5.将qiaampmini离心柱放入一个新的干净2ml接收管中,将滤液连同使用过的收集管丢弃。
6.小心打开qiaampmini离心柱,加入500μlbufferaw1,6000g离心1min。重复步骤5。
7.打开qiaampmini离心柱,加入500μlbufferaw2,20000g离心3min。
8.将qiaampmini离心柱转移到一个新的1.5ml收集管,加入200μlbufferae。室温孵育1min,然后6000g离心1min。
9.浓度检测:纯度一般以od260/280=1.8~2.0为宜。
实施例2目标基因全外显子组捕获、文库构建
设计并合成探针序列,如seqidno.1至seqidno.184所示,并标记有生物素,制备基因panel液相芯片。
将实施例1中所获取的样品经本发明的全外显子基因panel液相芯片系统捕获、检测,获得测序前捕获的目标区域文库结果。
采用本发明的基因panel液相芯片系统,对实施例1的目标基因dna的全外显子区域dna进行高效富集,然后在illuminahiseq平台上进行高通量、高深度测序。建库和捕获实验采用本发明的基因panel液相芯片系统,所选取的配套试剂和耗材由对应供应商提供,操作均按以下实验流程及说明书调整适宜方案进行使用,实验流程步骤经优化后进行操作。
实验基本流程如下(注:以下英文名称均为说明书上的名称):
一.dna样品制备:
启动covaris破碎仪,将冷却器温度设定在2℃至5℃之间,确保水浴中的温度读数显示为5℃。检测确定gdna样品浓度。用1xlowtebuffer在1.5-mllobind管中,将200nggdna稀释到总体积为50μl,将微管固定在支架中,按表2设置仪器参数,将gdna剪切成长度为150-200bp的片段。
表2covaris剪切设置(sonolabsoftwarev7)
二.文库构建:
2.1末端修复:准备末端修复混合试剂,如表3所示,全程在冰上操作,涡流混合器上混匀。为保证反应充分,每步反应都应准备过量试剂。
表3末端修复混合试剂的制备
2.2pcr板上每孔加入52μl末端修复混合试剂和50μldna剪切片段,充分混匀。pcr板在20℃孵育30分钟。
2.3样品纯化:使磁珠在室温下孵育30分钟后,混匀,加入经末端修复的dna中,pcr板每孔加入180μl,吸取抽吸10次充分混匀。室温孵育5分钟后,再将板放入磁分选装置中5分钟。将板转移到磁性支架上,在每个样品中加入200μl新配的70%乙醇,静置1分钟后,去除乙醇。添加乙醇和去除乙醇的步骤重复一次。在热循环器上干燥样品,将样品保持在37℃,持续3至5分钟,直到残余乙醇完全蒸发,再加入32μl无核酸酶(nuclease-free)的水到每个样品中,混匀,室温下孵育2分钟。将板放在磁性支架中,放置3分钟,直到溶液澄清为止。然后将上清液(约30μl)移至新鲜pcr板,弃去磁珠。
2.4dna片段3'端腺苷酸化:使用表4在冰上制备adenylationmastermix,涡流混合器上混匀,对dna片段3'端腺苷酸化。
表4adenylationmastermix的制备
往步骤2.3中获得的经末端修复的纯化后的dna样品中加入adenylationmastermix,每孔20μl,在热循环器中37℃孵育30分钟。
2.5重复步骤2.3一次。
2.6连接dna片段两端接头:连接酶将a、b接头的3'末端连接到dna片段两端。a、b接头都是44bp的双链寡聚核苷酸,其中b接头5'带有生物素的探针序列,用于下一步纯化。按nuclease-freewater:oligomix=1:10的比例稀释,现配现用,如表5在冰上制备连接主混合液(ligationmastermix),涡流混合器上混匀。
表5ligationmastermix的制备
往步骤2.5中获得的添加a尾的纯化后的dna样品中加入ligationmastermix,每孔37μl,在热循环器中20℃孵育15分钟。
2.7重复步骤2.3一次。
三文库扩增:
3.1如表6所示制备预捕获pcr反应混合液,全程在冰上操作,涡流混合器上混匀。为保证反应充分,每步反应的应准备过量试剂。
表6预捕获pcr反应混合液
往步骤2.7中获得纯化后的dna样品中加入预捕获pcr反应混合液,每孔20μl,按表7运行预捕获pcr热循环程序。
表7预捕获pcr热循环程序
3.2重复步骤2.3一次,收集上清用于捕获、杂交实验。
3.3文库质量和数量评估:使用2100bioanalyzer和dna1000仪器进行样
品分析。分析结果如图1所示,验证电泳图谱显示dna片段大小约为225
至275bp时出现峰值。峰下积分法检测文库dna的浓度。。
四、杂交和捕获
4.1将dna样品杂交到探针,制备捕获文库:
将文库扩增所得产物用于后续探针杂交反应。杂交反应需要样品约750ngdna。
4.1.1对于dna浓度高于221ng/l的预处理文库,稀释到221ng/μl,取3.4μl体积备用。
4.1.2对于dna浓度低于221ng/l的预处理文库,使用真空浓缩器将样品在45℃浓缩,再用无核酸酶的水重溶,使其最终浓度为221ng/l。在涡流混合器上混匀后,在离心机中旋转1分钟。
4.1.3将每个3.4μl的gdna文库样品(750ng)转移到96孔板,密封后放置在冰上保存。
4.1.4提前将捕获探针的杂交缓冲液(由供应商提供)复温。如果出现沉淀,将杂交缓冲液在65℃中复温5分钟。杂交缓冲液使用前在室温下放置。
4.1.5如表8所示将各试剂混合,制备封闭混合液。制备好的溶液使用前在冰上放置。
表8封闭混合液的制备
4.1.6将步骤4.1.3中准备好的含有gdna文库样品的96孔板取出,每孔加入封闭混合液5.6μl。吸管上下混合。
4.1.7然后将96孔板密封后转移到热循环器,在热循环器中95℃孵育5分钟,然后在65℃中保温5分钟以上。
4.1.8根据捕获文库的大小准备适当稀释的封闭液。为保证反应充分,在制备过程中,准备过量的rnase封闭液。封闭液使用前放置在冰上保存。
4.1.9根据表9制备捕获文库混合液,室温下保存备用,其中探针合成由供应商完成,并且提供的探针为统一浓度。
表9探针捕获文库混合液制备
4.1.10将捕获文库杂交混合液加入步骤4.1.7中的96孔板中,每孔加入25μl。用吸管抽吸8至10次混匀。
4.1.11将96孔板密封后,65℃孵育16至24小时。
4.2.杂交产物链霉亲和素磁珠捕获、纯化
链霉亲和素包被磁珠的制备:
4.2.1在循环水浴中,65℃预热washbuffer2备用。
4.2.2在涡旋混合器上大力混匀dyabeadmyone链霉亲和素t1磁珠。
4.2.3使用新的pcr板上,根据杂交样品数决定用量,每个样品每孔加入50μl重悬浮珠。
4.2.4清洗磁珠:加入200μlbindingbuffer,抽吸混匀,直到珠子完全重新悬浮,将pcr板放入磁选装置中。等到溶液澄清后,取出并弃上清液。再重复两次,总共洗涤3次。
4.2.5在200μl的bindingbuffer中重新沉淀磁珠。
4.3.用链霉亲和素包被珠捕获杂交dna
4.3.1估算并记录24小时孵育后剩余的杂交溶液的体积。
4.3.2在使用多通道吸管将每个杂交混合物的整个体积(大约25至29μl)转移到含有200μl洗过的链霉亲和素珠子的pcr板时,将pcr板保持在65℃,缓慢地上下抽吸,直到珠子完全混合。
4.3.3密封pcr板后,在96孔板混合器上混合孵育,在室温下剧烈搅拌(1400-1800rpm)30分钟,确保样品充分混合。
4.3.4简单离心后,将板放入磁选装置中收集磁珠。待溶液澄清后,取出并弃上清液。
4.3.5在200μl的washbuffer1中重新沉淀珠子。上下抽吸,直到珠子完全重新悬浮。
4.3.6将样品在室温下孵育15分钟后,重复步骤4.3.4一次。
4.3.7用washbuffer2清洗磁珠:在65℃预热的200μl的washbuffer2中重悬磁珠。上下抽吸直至珠子完全悬浮。热循环器上65℃孵育样品板10分钟后,放入磁选装置中。等溶液清澈后,去除上清液。共洗涤3次,确保washbuffer在最后的操作中被完全去除。
4.3.8每个样品孔中加入30μl无核酸酶水,抽吸混匀,重悬磁珠,置于冰上备用(用于步骤5.1.5)。
五、样品indexing及捕获后pcr文库
5.1用indexingprimers扩增捕获的文库
此步骤中,dna文库在pcr反应中被扩增,pcr反应中包含适合每个样品的indexingprimer。
5.1.1为每个样本分配适当的index。获得用于在这个步骤中扩增dna文库的8bpindexes从a01到h12的indexingprimers的部分序列。在同一条lane上使用不同的indexingprimers对每个样品进行测序。
5.1.2准备适当体积的pcr反应混合物,如表10所示,在冰上制备,涡流混合器上混合。
表10捕获后pcr反应混合物的制备
5.1.3在新的pcr板中,每个样品孔加入31μl捕获后pcr反应混合物。
5.1.4选取不同的indexingprimer,往步骤5.1.3中的pcr板中每孔添加5μl。
5.1.5将dna文库样品添加到pcr反应中:从冰中取出含有30μl富集靶dna磁珠样品的pcr板(步骤4.3.8中获得),将每个dna样品上下抽吸直至珠悬浮液均匀,然后将14μl的样品转移到含有pcr反应混合物和indexingprimer的pcr板中,混匀。将剩余磁珠样品储存在-20℃以备将来使用。
5.1.6将pcr板转移到热循环器,并运行表11所示的pcr扩增程序。
表11捕获后pcr扩增程序
5.1.7pcr程序结束后,简单地旋转pcr板。
5.2样品纯化:使磁珠在室温下孵育30分钟后,混匀,每个含50μl扩增dna样品的孔中加入90μl清洗磁珠,抽吸10次充分混匀。室温孵育5分钟后,直至溶液清澈,弃去每孔中的上层清澈液体。再将板放入磁分选装置中5分钟。将板转移到磁性支架上,在每个样品中加入200μl新配的70%乙醇,静置1分钟后,去除乙醇。添加乙醇和去除乙醇的步骤重复一次。在热循环器上干燥样品,将样品保持在37℃,持续3至5分钟,直到残余乙醇完全蒸发,再加入32μl无核酸酶(nuclease-free)的水到每个样品中,混匀,室温下孵育2分钟。将板放在磁性支架中,放置3分钟,直到溶液澄清为止。然后将上清液(约30μl)移至新鲜pcr板,弃去磁珠。
5.3文库质量和数量评估,操作流程如步骤3.3
5.4调整样品池的量和最终浓度到合适状态。
六、上机测序
库检合格,根据文库的有效浓度及数据产出需求进行illuminahiseq平台测序。
七、数据分析与处理
经过数据比对、生物信息学序列分析,个性化数据过滤和解读;最终确定目标基因中具有致病性的snp位点,包括风险位点、与药物治疗剂量相关位点等。
八、sanger测序验证panel检测结果的准确性
选取通过基因panel捕获后测序检出的阳性位点,作为本发明panel检测肺血栓栓塞症遗传信息的有效结果,并设计对应的引物组合验证位点的可靠性。
实施例3应用实施例
利用实施例2基因panel液相芯片系统捕获并检测出的致病位点信息,制备对应的引物组合,验证结果。
下表12为本发明实施方案中对应于基因panel捕获并检测出的致病位点信息的一组引物序列:
表12引物序列
上述引物的设计是本领域技术人员利用现有的工具可以处理的。利用引物对受试者的dna进行扩增调取对应的基因序列进行测序。基因扩增及基因序列测序为本领域技术人员熟知。根据测序结果分析患者的基因突变情况,验证确认panel对目标区域的捕获测序结果的准确性。图2-5显示了利用本发明的试剂盒(针对肺血栓栓塞症的基因panel)对患者对应基因扩增后的部分测序验证结果,其中箭头指向位点为突变位点。其中图2显示的是serpine2(与血栓风险因素相关的基因)有突变的情况,图3显示的是serpine2没有突变的情况;图4显示的是反向测序结果,其中proc(与凝血相关的基因)有突变;图5显示的是反向测序的结果,其中proc没有突变。
本发明提供了一种针对肺血栓栓塞症的基因panel试剂盒(液相芯片系统),利用该液相基因panel捕获试剂盒可以捕获目标基因的外显子区域,可以利用该捕获系统获得基因的遗传信息,然后通过测序分析基因突变情况,完成基因突变的风险评估、凝血缺陷的遗传致病性评估和用药相关基因的遗传信息检测,为遗传咨询、风险预测及用药提供参考与指导。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!