官能化纳米结构和包括光伏器件的器件的制作方法
提供了包含纳米结构的组合物和器件、及相关方法,所述纳米结构包含异苯并富烯物类和/或茚满物类。
背景技术:
具有本体异质结(BHJ)活性层的聚合物太阳能电池因其大的表面与体积比、可调谐性、可加工性和潜在的低成本而引起了显著的研究工作。对BHJ中组分的结构和特性进行研究和优化以产生可观的功率转换效率(PCE)。在对p型共轭聚合物的研究主要集中在减小带隙以吸收大部分太阳光谱的同时,已开发了与其p型对应物在电子和形态上相容的许多n型受体,包括小分子和富勒烯。共价官能化的富勒烯例如PCBM([6,6]-苯基-C61-丁酸甲酯)和ICBA(茚-C60双加合物)是广泛使用的n型分子,并且显示出与合适的聚合物对应物结合产生有前景的PCE。特别地,已经观察到P3HT:ICBA BHJ太阳能电池显著高的开路电压(VOC)并将其归因于ICBA的高位LUMO能级,原因是有机太阳能电池的VOC被认为与有效带隙HOMOD–LUMOA(A:受体,D:供体)线性相关。因此,已经设计并研究了用于高VOC器件的具有高LUMO能级的新受体。
应用于富勒烯的大多数共价官能化方法通常通过破坏富勒烯表面的完全共轭来降低其电子亲和力并提高LUMO能级。然而,在对不同的富勒烯衍生物进行比较时可以看到,变化程度可取决于附加物的结构特性和电子特性。在先前的四烷基环丁二烯–C60加合物的研究中,C60与附加物的π轨道之间的共面相互作用显示出引起富勒烯LUMO能级的显著变化。茚-C60加合物也因靠近C60表面的芳香族部分而表现出显著的共面相互作用。
技术实现要素:
提供了包括光伏器件的器件。在一些实施方案中,所述器件包括:组合物,其包含含有经取代的异苯并富烯基或经取代的茚满基的碳纳米结构;和与所述组合物电化学连通的至少一个电极。
在一些实施方案中,所述器件是光伏器件,其包括电子供体材料;和与电子供体材料接触的电子受体材料,并且所述电子受体材料包含经取代的异苯并富烯基或经取代的茚满基。
还提供了用于制造器件的方法,所述方法包括使碳纳米结构与异苯并富烯基前体反应以产生包含经取代的异苯并富烯基的官能化碳纳米结构;以及将所述官能化碳纳米结构布置成与电极电化学连通。
还提供了包含碳纳米结构的组合物。在一些实施方案中,所述碳纳米结构包含芳香族环的稠合网状结构,所述稠合网状结构任选地包含其所终止处的边界,其中所述碳纳米结构包括以下结构,
其中:
A包含碳纳米结构的芳香族环的稠合网状结构;并且
R1至R8可以相同或不同,并且为氢、羟基、卤素、烷基、杂烷基、烯基、杂烯基、芳基、杂芳基或杂环基,其中任一者任选地被取代,前提条件是R1至R8中的至少一者不为氢;或者,R3和R4连接在一起形成任选地经取代的环。
附图说明
图1示出附带有异苯并富烯物类和/或茚满物类的碳纳米结构的结构。
图2示出以下物质的合成:(a)经异苯并富烯基取代的C60;(b)经两个异苯并富烯基取代的C60;(c)经环氧化异苯并富烯基取代的C60;(d)经异苯并富烯基和环氧化异苯并富烯基取代的C60;以及(e)经两个环氧化异苯并富烯基取代的C60。
图3示出以下物质的循环伏安图:(a)PCBM、IBF–单和IBF–双;(b)PCBM、IBF–单和IBF–Ep;以及(c)PCBM、IBF–双、IBF–双–Ep1和IBF–双–Ep2(在氮气下,甲苯/乙腈(4:1)中的0.1M Bu4NPF6,Pt(WE),Pt丝(CE),Ag/AgNO3(RE),扫描速率0.1V/秒,Fc/Fc+内标E1/2在0.20V)。
图4示出以下物质在CHCl3中的UV–可见吸收光谱:(a)PCBM(2.4×10-5M)、IBF–单(2.2×10-5M)、IBF–双(2.4×10-5M)和IBF–Ep(2.3×10-5M);以及(b)PCBM(2.4×10-5M)、IBF–双–Ep1(2.4×10-5M)和IBF–双–Ep2(2.2×10-5M)。
图5示出以下物质的分子轨道(MO)能级图:(a)多种C60加合物,例如IBF-单、IBF-双和IBF-Ep;以及(b)IBF-双、IBF-双-Ep1和IBF-双-Ep2。
图6示出(a)与常规P3HT:PCBM相比,对于以P3HT作为电子供体的太阳能电池的BHJ结构中的富勒烯,电流密度随所施加的电压的变化;和(b)由(a)中的器件获得的VOC值的盒须图,其中须为第10至第90百分点并且盒为包含中间值和平均值(虚线)的第25和第75百分点。
图7示出包含多种富勒烯加合物的薄膜的(a)稳态光谱UV-可见吸收光谱和(b)稳态光谱光致发光发射;以及并入多种富勒烯加合物的器件的(c)光谱外量子效率(EQE)和(d)光谱内量子效率(IQE)。
图8示出在该研究中所分析的器件在(a)1微米和(b)10微米尺度下的原子力显微镜断层照相图像。
图9示出P3HT:PCBM和P3HT:IBF–Ep器件在短路下的瞬态光电流。
图10示出用瞬态光电压和瞬态光电流(TPV/TPC)测量的复合寿命随平均过剩电荷密度的变化。
当结合附图考虑时,本发明的其他方面、实施方案和特征将通过以下详细说明而变得明显。附图是示意性的并且不旨在按比例绘制。为清楚起见,在不需要说明来使本领域普通技术人员理解本发明的情况下,没有对每幅图中每个组分进行标记,也没有示出本发明每个实施方案的每个组分。通过引用并入本文的所有专利申请和专利均通过引用整体并入。在冲突的情况下,以本说明书(包括定义)为准。
具体实施方式
本文中描述的实施方案提供了用于各种器件的官能化碳纳米结构,所述器件包括光伏器件(例如,太阳能电池)。包含这样的材料的器件可表现出提高的效率、提高的开路电势、高电子/空穴迁移率和/或低电阻。
在一些情况下,提供了这样的碳纳米结构,其具有一个或更多个能够增强碳纳米结构的电子特性的官能团。组合物可包含官能团,所述官能团经选择并被布置成与碳纳米结构的一部分和/或与碳纳米结构接触的另一个组分(例如,聚合物)相互作用,从而增强碳纳米结构的一种或更多种特性。例如,碳纳米结构可包含布置成物理上紧邻碳纳米结构的π体系的官能团,产生有利的共面π轨道相互作用,这影响碳纳米结构的电子特性。在一些情况下,官能团可影响(例如,增加、减小)碳纳米结构的电子亲和力。在一些情况下,官能团可以影响(例如,增加、减小)碳纳米结构的最低未占据分子轨道(LUMO)的能级。作为一个说明性实施方案,碳纳米结构可为富勒烯(例如,C60),其包含附接至富勒烯表面并被布置成紧邻富勒烯表面的烯烃官能团,从而允许烯烃与富勒烯之间的共面π轨道相互作用。这样的相互作用可以有效地增加富勒烯的LUMO能级并且提高器件的开路电压。如以下更全面地描述的,在一些实施方案中,碳纳米结构的电子亲和力和/或LUMO能级可通过烯烃官能团的进一步官能化(例如,环氧化)来调整。
在一些实施方案中,提供了包含碳纳米结构的组合物,所述碳纳米结构被经取代的异苯并富烯基和/或经取代的茚满基取代(图1)。在一些情况下,碳纳米结构包含一个或更多个经取代的异苯并富烯基。异苯并富烯基可包含布置成与碳纳米结构的表面相对的碳-碳双键和/或苯基,使得在碳纳米结构与碳-碳双键和/或苯基之间可发生π-π相互作用。在一些情况下,碳纳米结构包含一个或更多个经取代的茚满基。在一些情况下,碳纳米结构包含经取代的异苯并富烯基和经取代的茚满基的组合。例如,碳纳米结构可包含芳香族环的稠合网状结构,所述稠合网状结构任选地包含其所终止处的边界,使得经取代的异苯并富烯基和/或经取代的茚满基通过网状结构的至少一个环原子附接至所述网状结构。在一些情况下,经取代的异苯并富烯基和/或经取代的茚满基通过网状结构的两个环原子(例如,网状结构的两个相邻环原子)附接至所述网状结构。在一些实施方案中,经取代的异苯并富烯基和/或经取代的茚满基可与碳纳米结构直接键合,即,经取代的异苯并富烯基和/或经取代的茚满基的环原子可与芳香族环的网状结构的环原子形成共价键。在一些情况下,至少一个经取代的异苯并富烯基和/或至少一个经取代的茚满基的两个环原子与芳香族环的网状结构的两个环原子形成共价键。相比之下,如果存在连接经取代的异苯并富烯基和/或经取代的茚满基与碳纳米结构的另一个原子或基团(例如,亚甲基、芳基、金属原子等),则经取代的异苯并富烯基和/或经取代的茚满基不与碳纳米结构直接键合。
可以对经取代的异苯并富烯基和/或经取代的茚满基进行选择,使得经取代的异苯并富烯基和/或经取代的茚满基的一部分被布置在相对于碳纳米结构基本固定的位置上。即,经取代的异苯并富烯基和/或经取代的茚满基的一部分不可自由旋转,使得所述部分可以布置在距碳纳米结构不同距离范围处。在一些情况下,经取代的异苯并富烯基和/或经取代的茚满基的一部分可布置在距离碳纳米结构约3埃(例如,3.1埃)的基本固定的位置上。例如,富勒烯可通过两个键与经取代的异苯并富烯基稠合,使得经取代的异苯并富烯基的一部分(例如,苯环)布置在富勒烯上方基本固定的位置上。在一些情况下,所述部分包括碳-碳双键,所述碳-碳双键布置成足够接近碳纳米结构以通过共面π相互作用与所述碳纳米结构相互作用。在一些情况下,虽然经取代的异苯并富烯基和/或经取代的茚满基的环原子可布置在相对于碳纳米结构基本固定的位置上,但是所述经取代的异苯并富烯基和/或经取代的茚满基的一个或更多个取代基可自由旋转。
在一些情况下,如本文所述用经取代的异苯并富烯基和/或经取代的茚满基对碳纳米结构进行官能化,可减小所述碳纳米结构的电子亲和力,并因而增加碳纳米结构的LUMO能级。在一些情况下,相对于([6,6]-苯基-C61-丁酸甲酯)(PCBM)的LUMO能级,被经取代的异苯并富烯基和/或经取代的茚满基取代的碳纳米结构可以表现出约20meV、50meV、约100meV(例如,90meV)、约150meV、约200meV、约250meV(例如,260meV)、约300meV、约350meV、约400meV或约450meV的LUMO能级增加。
在一些实施方案中,包含官能化碳纳米结构的组合物可作为溶液提供。在一些实施方案中,组合物可作为固体或基本为固体的物质(例如,凝胶)提供。例如,组合物可形成为固态膜。所述膜可使用本领域内已知的方法形成,包括溶液涂覆、喷墨印刷、旋涂、浸涂、喷涂等。在一些实施方案中,所述膜的至少一部分的厚度可为约1nm至约1mm,或约1nm至约500um,或约1nm至约500nm,或约100nm至约500nm,或约100nm至约300nm。在一组实施方案中,所述膜的至少一部分的厚度为75nm。膜厚度可通过本领域内已知的方法(包括椭圆光度法)来测定。在一些情况下,可对膜(例如在硅基板上制备的膜)使用椭圆光度法来测量所述膜厚度。
如本文所述的包含官能化碳纳米结构的组合物可被并入各种应用中,包括光伏器件(例如,太阳能电池)、蓄电池、电容器、晶体管、催化剂体系、或者化学或生物传感器。可将所述组合物布置成与外部能源、一个或更多个电极、电解质、隔板材料、样品入口和出口、样品池、基板、探测器、电源和/或适用于特定应用的其他器件组件连接。例如,可将组合物布置成与电极材料电化学连通,使得电势或电压可施加于所述组合物。在一些情况下,组合物可用作器件中的光活性材料。在一些情况下,可将组合物布置成暴露于怀疑包含分析物(例如化学或生物分析物)的样品。在一些情况下,组合物可以包含在用于电催化的电极材料中。
在一些情况下,所述器件为光伏电池,例如太阳能电池。光伏电池通常包括含有电子受体/电子供体材料的光活性材料,和至少两个电极(例如,阳极和阴极)。所述器件还可包括基板(例如,在其上形成光活性材料、阳极和/或阴极)、电子阻挡膜和/或电子传输膜、电路、电源和/或电磁辐射源。在一些情况下,包含官能化碳纳米结构的组合物可用作光伏器件中的电子受体材料或n型材料。例如,光伏器件可包括含有与电子供体材料接触的电子受体材料的光活性材料,所述电子受体材料包含如本文所述的官能化碳纳米结构,其中所述光活性材料被放置成与两个电极接触。可对电子供体和电子受体材料进行布置以形成本体异质结,并且具有充足的供体-受体界面面积以促进激子离解和经分离的电荷向相应电极的有效传输。
本领域普通技术人员能够选择合适的电子供体材料以用于本文描述的实施方案中。在一些情况下,电子供体材料可为聚合物。例如,聚合物可为导电聚合物。在一些实施方案中,导电聚合物是半导电聚合物。导电聚合物的实例包括聚苯胺、聚噻吩、聚吡咯、聚亚苯基、聚亚芳基、聚(双噻吩亚苯基)、梯形聚合物、聚(亚芳基亚乙烯基)、聚(亚芳基亚乙炔基)及其金属衍生物或其经取代的衍生物。在一些情况下,聚合物可为低带隙聚合物,例如包含一个或更多个杂芳基的聚合物。在一些实施方案中,聚合物包含含氮杂芳基。杂芳基的实例包括三唑、咔唑、吡咯、噻二唑、苯并三唑、苯并噻二唑、苯并二噻吩或咪唑。
适合用作电子供体材料的聚合物的一些具体实例包括聚(3-己基噻吩)(P3HT)、聚(苯并[1,2-b:4,5-b’]二噻吩–噻吩并[3,4-c]吡咯-4,6-二酮)(PBDTTPD)、聚({4,8-双[(2-乙基己基)氧基]苯并[1,2-b:4,5-b’]二噻吩-2,6-二基}{3-氟-2-[(2-乙基己基)羰基]噻吩并[3,4-b]噻吩二基})(PTB7)、聚[2,6-(4,4-双-(2-乙基己基)-4H-环戊二烯并[2,1-B;3,4-B’]二噻吩)-交替-4,7(2,1,3-苯并噻二唑)](PCPDTBT)、和聚{[4’-(4,8-二(2-乙基己基氧基)苯并[1,2-b:4,5-b’]二噻吩-2-基)-2’,1’,3’-苯并噻二唑-6,7’-二基]-共聚-[4’-(4,8-二(2-乙基己基氧基)苯并[1,2-b:4,5-b’]二噻吩-2-基)-(1-辛基壬基)-苯并三唑-6,7’-二基]}。
一些实施方案可涉及电子供体材料与电子受体材料之间的有利相互作用以改善器件性能。在一些情况下,电子供体材料可包含供电子物类而电子受体材料可包含吸电子物类,其中供电子物类和吸电子物类相互作用。例如,电子供体材料可包含含有环氧基的富勒烯物类,而电子受体材料可包含含有杂环基(例如,三唑)的低带隙聚合物,其中环氧基和三唑基通过例如氢键、静电相互作用或其他相互作用而彼此相互作用。在另一些实施方案中,电子供体材料可包含吸电子物类而电子受体材料可包含供电子物类,其中吸电子物类和供电子物类相互作用。
在一些情况下,可能有利的是,包含产生与官能化碳纳米结构相关的偶极子,和/或促进电子供体材料与电子受体材料之间界面处的偶极组织的官能团。例如,向官能化碳纳米结构(例如,富勒烯)中引入极性基团(例如,含氧基团,如环氧基)可增强电荷离开该界面的传输,导致复合速率更慢。这样的特性可能有利于优化光伏器件的VOC、电荷传递(JSC)和/或PCE。
光伏器件还可包括电极和/或布置成与电子供体和电子受体材料接触或相连的其他组件。可使用本领域普通技术人员已知的方法使光伏器件暴露于光。光可与光活性材料相互作用,引起电子从电子供体材料(例如,聚合物)转移至n型材料或电子受体材料(例如,官能化碳纳米结构)。n型材料中的电子可以被传输至阳极,并且相应的空穴可以通过空穴供体材料被传输至阴极。
光伏器件的组件可以布置成各种构造。在一些情况下,电子受体材料可以以簇分散在整个电子供体材料中。在一些情况下,所述簇可以基本上被电子供体材料包围。在一些情况下,电子供体材料和电子受体材料可以相对于彼此无规分散,从而形成异质材料。在一些情况下,电子供体材料和/或电子受体材料可以形成膜层。在一些情况下,可以使用具有不同组合物和不同形态或不同布置的不同器件的阵列。在一些实施方案中,可对器件进行配置使得电子供体/电子受体材料放置在两个电极(例如,阴极和阳极)之间。例如,可以对器件的构件进行布置以形成“正常”或“常规”太阳能电池结构,即,其中正电流可从太阳能电池器件的阴极流至外电路。通常,将氧化铟锡(ITO)布置成“正常”太阳能电池结构中的阴极,尽管其他材料也可用作阴极。“正常”太阳能电池结构的一个实例是ITO阴极/电子阻挡层/活性层/空穴阻挡层/Al阳极,其中活性层包含如本文所述的电子受体材料和/或电子供体材料。在一个说明性实施方案中,器件结构可为如下:玻璃/ITO/PEDOT:PSS/P3HT:富勒烯/Ca/Al。
在一些实施方案中,可以对器件的组件进行布置以形成“倒置”太阳能电池结构。在“倒置”太阳能电池结构中,正电流可从外电路流进太阳能电池器件的阳极。通常,将ITO布置成“倒置”太阳能电池结构中的阳极。例如,所述结构可包括以下布置:ITO/空穴阻挡层/活性层/电子阻挡层/Ag或Au,其中Ag或Au为阴极并且活性层包含如本文所述的电子受体材料和/或电子供体材料。在一个说明性实施方案中,器件结构可为如下:玻璃/ITO/ZnO/聚合物:富勒烯/Al/MoO3/Ag。
本文所述的光伏器件相对于先前的光伏器件可表现出增强的性能。如本文所述,相对于未经取代的碳纳米结构,并入含有经取代的异苯并富烯基和/或经取代的茚满基的碳纳米结构可提高电子受体材料的LUMO能级,从而提高所述器件的开路电势(VOC)和效率。在一些实施方案中,在基本相同的条件下,相对于缺少经取代的异苯并富烯基和/或经取代的茚满基的基本相同的光伏器件,所述光伏器件表现出更高的效率。在一些实施方案中,在基本相同的条件下,与缺少经取代的异苯并富烯基和/或经取代的茚满基的基本相同的光伏器件相比,所述光伏器件表现出高出约1%、约3%、约5%、约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%,或者在一些情况下高出约100%的效率。
如本文所述,暴露于“条件”或“一组条件”可包括例如,暴露于特定温度、pH、溶剂、化学试剂、气氛类型(例如,氮气、氩气、氧气等)、外部能源(例如,电压)等。一些实施方案可涉及包括暴露于外部能源的一组条件。能源可包括电磁辐射、电能、声能、热能或化学能。在一些实施方案中,“条件”可包括暴露于特定电势、溶剂、化学物类和/或官能团前体。在“基本相同的条件”下比较第一器件和第二器件意指,将第一和第二器件置于基本相同的温度、pH、溶剂、化学试剂、气氛类型、外部能源等下,持续基本相同的时间段并观察第一器件和第二器件的性能或行为。如果与第二器件相比,例如第一器件暴露于更高的温度、不同的pH、不同的化学试剂等,或者可能相同的化学试剂但处于不同浓度,则器件未置于“基本相同的条件”下。
在一些实施方案中,在基本相同的条件下,相对于缺少经取代的异苯并富烯基或经取代的茚满基的基本相同的光伏器件,所述光伏器件表现出更高的开路电势。在一些实施方案中,在基本相同的条件下,与缺少经取代的异苯并富烯基或经取代的茚满基的基本相同的光伏器件相比,所述光伏器件表现出高出约1%、约3%、约5%、约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%,或者在一些情况下高出约100%的开路电势。
在一些实施方案中,经取代的异苯并富烯基或经取代的茚满基被供电子基团取代。在一些实施方案中,经取代的异苯并富烯基或经取代的茚满基被吸电子基团取代。
在一些情况下,碳纳米结构包括以下结构,
其中:
A包含碳纳米结构的芳香族环的稠合网状结构;并且
R1至R8可以相同或不同,并且为氢、羟基、卤素、烷基、杂烷基、烯基、杂烯基、芳基、杂芳基或杂环基,其中任一者任选地被取代,前提条件是R1至R8中的至少一者不为氢;或者,R3和R4连接在一起形成任选地经取代的环。在一些情况下,R1和R2各自独立地为烷基。在一些情况下,R5至R8各自为氢。在一些情况下,R1至R8不为羟基。在一些情况下,R1至R8不为卤素。例如,在一些实施方案中,R1至R8相同或不同并且为氢、烷基、杂烷基、烯基、杂烯基、芳基、杂芳基或杂环基,其中任一者任选地被取代,前提条件是R1至R8中的至少一者不为氢;或者,R3和R4连接在一起形成任选地经取代的环。
在一组实施方案中,碳纳米结构具有如式(I)的结构,其中R1和R2各自为甲基并且R5至R8各自为氢。
在另一组实施方案中,碳纳米结构具有如式(II)的结构,其中R1、R2和R5至R8可以相同或不同,并且为氢、羟基、卤素、烷基、杂烷基、烯基、杂烯基、芳基、杂芳基或杂环基,其中任一者任选地被取代,并且R3和R4连接在一起形成环氧化物环。在一些情况下,碳纳米结构具有如式(II)的结构,其中R1和R2各自为甲基,R3和R4连接在一起形成环氧化物环,并且R5至R8各自为氢。
在一些情况下,碳纳米结构是富勒烯,例如C36、C50、C60、C61、C70、C76、C84、其金属衍生物、其经取代的衍生物或其混合物。
在一个说明性实施方案中,器件可包含附带有经取代的异苯并富烯基的富勒烯和聚合物电子供体材料。在经取代的异苯并富烯基的烯烃部分和/或苯基部分与富勒烯表面上芳香族环的稠合网状结构之间可发生共面π相互作用,导致相对于由包含PCBM而不是包含含有经取代的异苯并富烯基的富勒烯的相似器件所获得的那些,LUMO能级显著升高并且VOC更高。
在一些情况下,器件可包含附带有含环氧部分的茚满基的富勒烯。这样的器件可表现出相对高的IQE,及因此改善的JSC。在一些情况下,相对于包含PCBM的器件,这样的器件可表现出更慢的复合过程,导致VOC增加。如一个说明性实施方案,相对于包括P3HT:PCBM标准电池的器件,观察到包括以下活性层P3HT:IBF–Ep(图2C)的器件JSC增加,导致PCE增加约15%。
碳纳米结构可为例如富勒烯、纳米管、石墨烯或石墨。在一些实施方案中,碳纳米结构是单壁纳米管。在一些实施方案中,碳纳米结构是多壁纳米管,例如双壁纳米管。在一些实施方案中,碳纳米结构是富勒烯。在一些情况下,碳纳米结构包含一个、两个、三个、四个、五个或六个经取代的异苯并富烯基和/或经取代的茚满基。应理解,碳纳米结构可以包含任何数目的任选经取代的异苯并富烯基和/或经取代的茚满基,并且本领域普通技术人员将能够选择合适的反应条件以产生具有期望数目的经取代的异苯并富烯基和/或经取代的茚满基的碳纳米结构。
在一些实施方案中,碳纳米结构包含被至少一个烷基取代的异苯并富烯基。在一些实施方案中,碳纳米结构包含被至少一个烷基取代的茚满基(例如,在茚满部分的2位取代)。在一些实施方案中,碳纳米结构是包含一个、两个或三个经至少一个(例如,两个)烷基取代的异苯并富烯基的富勒烯。在一些实施方案中,碳纳米结构包括包含一个、两个或三个经至少一个(例如,两个)烷基取代的异苯并富烯基的富勒烯。
还提供了用于合成官能化碳纳米结构的方法,以及用于将这样的材料并入器件的方法。如本文中使用的术语“经取代”和“官能化”以其在本领域中的普通含义给出,并且是指经改变(例如,经反应)使得新官能团(例如,原子或化学基团)与其键合的物类。在一些情况下,官能团可与碳纳米结构的一个原子(例如,环原子)成键。在一些情况下,官能团可通过碳纳米结构的两个原子(例如,两个环原子)与所述碳纳米结构稠合。
可使用各种方法用异苯并富烯部分对碳纳米结构进行官能化。所述方法可涉及碳纳米结构与异苯并富烯基前体进行反应以产生包含经取代的异苯并富烯基的官能化碳纳米结构。在一些情况下,所述反应涉及周环反应,例如狄尔斯-阿尔德(Diels-Alder)反应。在一些情况下,异苯并富烯基前体或由异苯并富烯基前体产生的中间体可充当狄尔斯-阿尔德反应中的二烯,并且碳纳米结构(例如,富勒烯)可用作亲二烯体。所述反应可在可增强和/或促进周环反应的添加剂的存在下进行。
一些实施方案可涉及原位形成异苯并富烯基前体,接着添加碳纳米结构以形成经异苯并富烯基(例如,经取代的异苯并富烯基)官能化的碳纳米结构。异苯并富烯基前体可为在与碳纳米结构的狄尔斯-阿尔德反应中用作二烯的物类。在一些情况下,原位制备的异苯并富烯基前体具有以下结构,
其中R1、R2和R5至R8可以相同或不同,并且为氢、羟基、卤素、烷基、杂烷基、烯基、杂烯基、芳基、杂芳基或杂环基,其中任一者任选地被取代,前提条件是R1、R2和R5至R8中的至少一者不为氢。
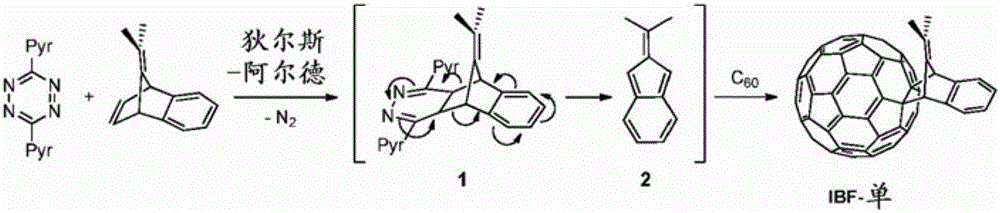
图2A示出一个说明性实施方案,其中可充当二烯的异苯并富烯基前体通过以下来原位产生:使9-异亚丙基苯并降冰片-二烯与3,6-二-2-吡啶基-1,2,4,5-四嗪反应,接着进行N2的电环化断裂。向反应混合物中添加亲二烯体C60可产生包含经取代的异苯并富烯基的C60加合物。在一些情况下,狄尔斯-阿尔德反应可在低温(例如,0℃至室温)下进行。所述反应可在一种或更多种溶剂(包括有机溶剂)存在下进行。可使用已知技术来分离产物,例如柱色谱法。
碳纳米结构可包含一个或更多个官能团,所述官能团可进一步反应以使另外的基团附接至所述碳纳米结构。例如,经取代的异苯并富烯基和/或经取代的茚满基可用作可并入(例如,与碳纳米结构结合)碳纳米结构的各种附加官能团的前体。这使得可以容易地调整碳纳米结构的各种特性,包括稳定性、溶解度、溶混性、生物相容性、光学特性、电子特性(例如,电子亲和力)、结合特性、表面亲和力等。在一组实施方案中,可用各种烷基对碳纳米结构进行官能化,这可增加碳纳米结构在有机溶剂(例如氯仿、二氯甲烷和甲苯)中的溶解度。在一些实施方案中,碳纳米结构的官能化是易于可逆的,这可以用于例如碳纳米结构的剥离或解聚等应用。
在一些情况下,官能化碳纳米结构可进一步反应以附接另外的官能团和/或用新原子或基团替换现有官能团。即,官能化碳纳米结构的至少一个原子或化学基团可用不同的第二原子或化学基团替换,或者官能化碳纳米结构的至少一个原子或化学基团可与不同的第二原子或化学基团连接。在一些实施方案中,碳纳米结构可首先用经取代的异苯并富烯基官能化,所述经取代的异苯并富烯基可以例如通过异苯并富烯基的双键进一步反应。
官能化碳纳米结构的进一步官能化或反应(例如,通过经取代的异苯并富烯基)可使用本领域内已知的各种化学反应来进行,其中对反应组分进行选择使其以产生期望化学键的方式一起反应。这些反应是本领域内已知的,例如在Carey和Sundberg的“Advanced Organic Chemistry”以及Jerry March的“Advanced Organic Chemistry”中,其内容通过引用并入本文。可用于本文所述方法的反应的一些具体实例包括取代反应、消除反应、加成反应、缩合反应、芳香族取代反应、周环反应和环加成反应、光化学反应、热反应、维蒂希反应(Wittig reaction)、金属催化反应、重排反应、还原反应、氧化反应等。在一些情况下,官能化碳纳米结构可通过加热、暴露于酸或碱、或通过光化学反应而反应。
在一些实施方案中,所述方法可涉及在致使经取代的异苯并富烯基转化为经取代的茚满基的条件下使官能化碳纳米结构反应。例如,可使官能化碳纳米结构暴露于含过氧化物的试剂,导致经取代的异苯并富烯基的环氧化。各种含过氧化物的试剂在本领域内是已知的,包括间氯过苯甲酸(mCPBA)。
可选择在反应期间与可能存在的其他官能团相容(例如,对其呈惰性)的化学反应。在一些实施方案中,可选择与碳纳米结构相容的化学反应。在一些实施方案中,可使用保护基团以防止在除了期望反应位点以外的位点处发生反应。如本文中使用的短语“保护基团”是指保护可能反应的官能团不发生不期望的化学转化的临时取代基。这样的保护基团的实例包括羧酸的酯、醇的甲硅烷基醚、醛和酮各自的缩醛和缩酮。已经对保护基团化学领域进行了综述(Greene,T.W.;Wuts,P.G.M.Protective Groups in Organic Synthesis,第二版;Wiley:New York,1991)。在一些情况下,保护基团可以赋予另一些有益特性,包括化合物在特定溶剂中改善的溶解度。
本领域普通技术人员将能够选择一组合适的条件,在所述条件下进行反应以产生特定的期望产物。该组条件可包括例如,特定温度、pH、溶剂、化学试剂、气氛类型(例如,氮气、氩气、氧气等)、存在或不存在水、所用试剂的相对比例、反应时间等。例如,反应组分的化学稳定性可影响反应条件的选择。在一些情况下,在基本不含水分的条件下进行反应可能是有利的。在一些情况下,反应可以以相对短的反应时间(例如,2小时或更短)和/或在相对低的温度(例如,0℃至室温)下有利地进行。
用于光伏器件的电子供体材料可包括导电聚合物。导电聚合物是指包含共轭骨架(例如,π-共轭骨架、σ-共轭骨架等)的延伸分子结构,其中“骨架”是指聚合物的最长连续键路径。聚合物还可包括低聚物。通常,导电聚合物包含电子密度或电子电荷可以沿其传导的至少一个部分,其中电子电荷是离域的。例如,在π-共轭体系中,一个单体的p轨道与相邻单体的p轨道充分重叠使得电子电荷可以离域。在一些情况下,共轭π-骨架包含直接参与共轭的原子的平面,其中所述平面由使p轨道重叠最大化的p轨道的优选排列产生,从而使共轭和电子传导最大化。导电聚合物可为均聚物、共聚物(包括无规共聚物和嵌段共聚物)等。导电聚合物的实例包括聚苯胺、聚噻吩、聚吡咯、聚亚苯基、聚亚芳基、聚(双噻吩亚苯基)、梯形聚合物、聚(亚芳基亚乙烯基)、聚(亚芳基亚乙炔基)、其金属衍生物或其经取代的衍生物。
在一些实施方案中,导电聚合物可为聚噻吩或其经取代的衍生物。聚(噻吩)通常包含以下重复单元:
其中Ra’和Rb’可以相同或不同,并且各自可以独立地为氢、烷基、杂烷基、芳基、杂芳基、芳基烷基、芳基杂烷基、杂芳基烷基,各自任选地被取代;并且n可为2至100,000,000之间的任何整数。在一些实施方案中,Ra’和Rb’中的至少一者不为氢。在一些情况下,聚噻吩具有以下结构,
其中Ra’、Rb’、Rc’和Rd’可以相同或不同,并且各自可以独立地为氢、烷基、杂烷基、芳基、杂芳基、芳基烷基、芳基杂烷基、杂芳基烷基,各自任选地被取代;并且n和m可以相同或不同,并且可为2至100,000,000之间的任何整数。聚(噻吩)的实例包括烷基取代的聚(噻吩)(例如,聚(3-己基噻吩)、聚(3,4-亚乙基二氧噻吩)(PEDOT)等)。在一个说明性实施方案中,聚合物是聚(3-己基噻吩)。
如本文所述,电子供体材料还可包括低带隙聚合物。
在一些情况下,基板可包含导电材料。在一些情况下,基板可包含涂覆有导电材料的材料,使得光活性材料可以形成为与导电材料接触。适合用作基板的材料的实例包括但不限于金属,例如镍、铬、金、钼、钨、铂、钛、铝、铜、钯、银,其他金属和/或金属化合物,其合金,其金属间化合物等。还可使用其他材料,包括氧化铟锡(ITO)。
基板还可包含柔性材料,例如塑料(如,聚合物)、聚合物膜、柔性玻璃膜、金属箔、纸、织造材料、其组合等。例如,基板可为涂覆有导电材料的柔性材料。基板可以例如通过本领域技术人员已知的多种微机械加工方法之一来制备。这些方法的实例包括例如,光刻、蚀刻、放电加工、电化学加工、激光束加工、线放电磨削加工(Wire electrical discharge grinding)、聚焦离子束加工、微铣削、微超声加工和微冲压。基板的尺寸可为具体最终用途所期望的任何长度、宽度和厚度,并且可为矩形、圆形或其他形状。
如本文中使用的术语“富勒烯”以其在本领域中的普通含义给出,并且是指基本为球形的分子,其通常包含五元和/或六元芳香族环的稠合网状结构。例如,C60是类似于足球形状的富勒烯。术语富勒烯还可包括形状与球形相关(例如,椭球形)的分子。应理解,富勒烯可包含除五元和六元环以外的环。在一些实施方案中,富勒烯可包含七元环或更大的环。富勒烯可包括C36、C50、C60、C61、C70、C76、C84、其金属衍生物、其经取代的衍生物等。在一些实施方案中,所述器件可包含不同富勒烯的混合物。富勒烯还可在其内腔中包含独立的原子、离子、金属、纳米颗粒和/或簇,即,可为内嵌式富勒烯。可用作n型材料的经取代的富勒烯的一个非限制性实例为苯基-C61-丁酸甲酯。
如本文中使用的术语“供电子基团”是指与相同位置的氢原子相比吸引更少电子至自身的官能团。示例性供电子基团包括烷基、氨基、甲氧基等。
术语“吸电子基团”为本领域所公认,并且如本文中使用的意指与相同位置的氢原子相比吸引更多电子至自身的官能团。示例性吸电子基团包括硝基、氰基、羰基(例如,醛、酮、酯等)、磺酰基、三氟甲基等。
如本文中使用的术语“反应”是指在两个或更多个组分之间形成键以产生稳定、可分离的化合物。例如,第一组分和第二组分可反应形成一种包含通过共价键连接的第一组分和第二组分的反应产物。术语“反应”还可包括使用溶剂、催化剂、碱、配体或可用于促进组分之间发生反应的其他物质。“稳定、可分离的化合物”是指分离的反应产物,而不是指不稳定的中间体或过渡态。
术语“烷基”是指饱和脂肪族基团的基团,包括直链烷基、支链烷基、环烷基(脂环基)、经烷基取代的环烷基、和经环烷基取代的烷基。如下文更全面地描述的,烷基可任选地被取代。烷基的实例包括但不限于甲基、乙基、丙基、异丙基、丁基、异丁基、叔丁基、2-乙基己基、环丙基、环丁基、环戊基、环己基等。“杂烷基”基团是其中至少一个原子为杂原子(例如,氧、硫、氮、磷等)而其余原子为碳原子的烷基。杂烷基的实例包括但不限于烷氧基、聚(乙二醇)-、经烷基取代的氨基、四氢呋喃基、哌啶基、吗啉基等。
术语“烯基”和“炔基”是指类似于上述烷基,但分别包含至少一个双键或三键的不饱和脂肪族基团。“杂烯基”和“杂炔基”是指其中一个或更多个原子为杂原子(例如,氧、氮、硫等)的如本文所述的烯基和炔基。
术语“芳基”是指芳香族碳环基团,其具有单环(例如,苯基)、多环(例如,联苯基)或其中至少一个为芳香族的多稠环(例如,1,2,3,4-四氢萘基、萘基、蒽基或菲基),全部任选地被取代。“杂芳基”是其中芳香族环中的至少一个环原子为杂原子,而其余环原子为碳原子的芳基。杂芳基的实例包括呋喃基、噻吩基、吡啶基、吡咯基、N低级烷基吡咯基、吡啶基N氧化物、嘧啶基、吡嗪基、咪唑基、吲哚基等,全部任选地被取代。
术语“胺”和“氨基”是指未经取代和经取代的胺二者,例如,可以由通式:N(R’)(R”)(R”’)表示的部分,其中R’、R”和R”’各自独立地表示按化合价规则所允许的基团。
术语“酰基”、“羧基”或“羰基”为本领域所公认,并且可包括如可由以下通式表示的这类部分:
其中W为H、OH、O-烷基、O-烯基或其盐。W为O-烷基时,该式表示“酯”。W为OH时,该式表示“羧酸”。一般地,当上式的氧原子被硫替换时,该式表示“硫代羰基”基团。当W为S-烷基时,该式表示“硫代酯”。当W为SH时,该式表示“硫代羧酸”。另一方面,当W为烷基时,上式表示“酮”基。当W为氢时,上式表示“醛”基。
如本文中使用的术语“杂环”或“杂环基”是指单环或多环杂环,其为饱和环或不饱和非芳香族环。通常,杂环可包括3元至14元环。在一些情况下,3元杂环可包含多至3个杂原子,而4元至14元杂环可包含1至约8个杂原子。每个杂原子可以独立地选自可被季铵化的氮;氧;和硫,包括亚砜和砜。如下文更全面地描述的,术语“杂环”或“杂环基”可包括杂芳香族基团或杂芳基基团。杂环可通过任何杂原子环原子或碳环原子来附接。代表性杂环包括吗啉基、硫代吗啉基、吡咯烷酮基、吡咯烷基、哌啶基、哌嗪基、乙内酰脲基、戊内酰胺基、环氧乙烷基、氧杂环丁烷基、四氢呋喃基、四氢吡喃基、四氢吡啶基、四氢嘧啶基、四氢噻吩基、四氢噻喃基等。杂原子可被本领域普通技术人员已知的保护基团取代,例如,氮上的氢可被叔丁氧基羰基取代。此外,杂环基可任选地被一个或更多个取代基(包括但不限于卤素原子、烷基基团或芳基基团)取代。
如本文中使用的术语“杂芳香族”或“杂芳基”意指单环或多环杂芳香族环(或其基团),其包含碳原子环成员和一个或更多个杂原子环成员(例如,氧、硫或氮)。通常,杂芳香族环具有5至约14个环成员,其中至少1个环成员为选自氧、硫和氮的杂原子。在另一个实施方案中,杂芳香族环为5元或6元环并可包含1至约4个杂原子。在另一个实施方案中,杂芳香族环体系具有7至14个环成员并可包含1至约7个杂原子。代表性杂芳基包括吡啶基、呋喃基、噻吩基、吡咯基、唑基、咪唑基、吲嗪基、噻唑基、异唑基、吡唑基、异噻唑基、哒嗪基、嘧啶基、吡嗪基、三嗪基、三唑基、吡啶基、噻二唑基、吡嗪基、喹啉基、异喹啉基、吲唑基、苯并唑基、苯并呋喃基、苯并噻唑基、吲嗪基、咪唑并吡啶基、异噻唑基、四唑基、苯并咪唑基、苯并唑基、苯并噻唑基、苯并噻二唑基、苯并二唑基、咔唑基、吲哚基、四氢吲哚基、氮杂吲哚基、咪唑并吡啶基、喹唑啉基、嘌呤基、吡咯并[2,3]嘧啶基、吡唑并[3,4]嘧啶基、苯并(b)噻吩基等。这些杂芳基可任选地被一个或更多个取代基取代。
术语“经取代”意图包括有机化合物的所有允许的取代基,“允许的”在本领域普通技术人员已知的化合价化学规则的背景下。在一些情况下,“经取代”通常可指用如本文所述的取代基替换氢。然而,如本文中使用的“经取代”不包括替换和/或改变通过其确定分子的关键官能团,例如,使得“经取代”的官能团通过取代变成不同的官能团。例如,“经取代的苯基”必须仍包含苯基部分并且在该定义中不能通过取代改变成为例如杂芳基(如,吡啶基)。在一个宽泛的方面中,允许的取代基包括有机化合物的无环和环状的、支化和非支化的、碳环和杂环的、芳香族和非芳香族的取代基。说明性取代基包括例如本文所述那些。允许的取代基对合适的有机化合物可为一个或更多个并且相同或不同。出于本发明的目的,杂原子(例如,氮)可以具有氢取代基和/或满足杂原子化合价的本文所述有机化合物任何允许的取代基。本发明不旨在以任何方式受限于有机化合物允许的取代基。
取代基的实例包括但不限于烷基、芳基、芳烷基、环烷基、杂环烷基、羟基、烷氧基、芳氧基、全卤代烷氧基、芳烷氧基、杂芳基、杂芳氧基、杂芳基烷基、杂芳烷氧基、叠氮基、氨基、卤素、烷硫基、氧基、酰基、酰基烷基、羧基酯基、羧基、酰胺基、硝基、酰氧基、氨基烷基、烷基氨基芳基、烷基芳基、烷基氨基烷基、烷氧基芳基、芳基氨基、芳烷基氨基、烷基磺酰基、酰胺基烷基芳基、酰胺基芳基、羟基烷基、卤代烷基、烷基氨基烷基羧基、氨基酰胺基烷基、烷氧基烷基、全卤代烷基、芳基烷氧基烷基等。
至此已经描述了本发明的一些实施方案的多个方面,应理解,本领域技术人员将容易地进行各种改变、修改和改进。这些改变、修改和改进视为本公开内容的一部分,并且视为在本发明的精神和范围内。因此,前述描述和附图仅作为实例。
实施例和实施方案
材料。C60购自SES Research。PC61BM和P3HT购自Sigma–Aldrich。PEDOT/PSS购自Ossila。3,6-二-2-吡啶基-1,2,4,5-四嗪购自Alfa Aesar。所有购自商业来源的化合物均按原样使用。包括溶剂和电解质盐的其他材料均可商购。无水溶剂由溶剂纯化系统(Innovative Technologies)获得。
测量。包含富勒烯多加合物的反应混合物通过安装在Agilent Technologies ProsStar 210高压液相色谱(HPLC)系统中的来自Nacalai Tesque,Inc.的5PBB Cosmosil柱(10mm×250mm)来分离。1H NMR和13C NMR谱在Varian Inova–500光谱仪上取得。化学位移以ppm记录,并且参照残留的溶剂峰(CD2Cl2:对于1H为5.33ppm,对于13C为53.84ppm;CDCl3:对于1H为7.26ppm,对于13C为77.16ppm)。Bruker Daltonics Omniflex MALDI–TOF质谱仪用于质量测定,不使用基质。UV–可见吸收光谱使用Cary 4000UV-可见分光光度计获得。在手套箱中,在氮气下使用Autolab PGSTAT 10或PGSTAT 20恒电位仪(Eco Chemie)以三电极电池配置进行电化学测量。在0.1M六氟磷酸四丁基铵(TBAPF6)甲苯/乙腈(4:1)溶液中,Pt纽扣(直径1.6mm)电极、Pt丝和浸没在乙腈中0.01M AgNO3/0.1M TBAPF6的准内部Ag丝分别用作工作电极、对电极和参比电极。二茂铁/二茂铁盐(Fc/Fc+)氧化还原对用作内标物,相对于甲苯/乙腈(4:1)溶液中的Ag/Ag+,观测到其半波电势为0.193V至0.205V。差示扫描量热法(DSC)在TA Instruments Q1000DSC上以10℃/分钟的扫描速率在25℃至200℃或35℃至200℃的范围内进行测量。
合成。如图2所示合成多种经取代的富勒烯。在低温(例如,0℃至室温)下使用相对于C60为两当量的异苯并富烯试剂进行[4+2]-环加成反应。反应混合物由单加合物和双加合物组成。主要产物异苯并富烯单加合物(IBF–单)通过用CS2/己烷溶剂混合物洗脱的二氧化硅柱色谱法来容易地纯化。当异苯并富烯与代替C60作为亲二烯体的IBF-单反应时,双加合物(IBF–双)的产率增加(图1B)。如通过NMR观察到的,双加合物由多种区域异构体(regioisomer)构成,并且相对于单加合物表现出在多种有机溶剂(包括二氯甲烷、氯仿、甲苯和邻二氯苯)中提高的溶解度。双加合物通过HPLC使用5PBB Cosmosil柱用甲苯洗脱进行纯化。如对其他富勒烯双加合物所观测到的,与单加合物的LUMO能级和VOC相比,预期具有56个π电子的所述双加合物具有升高的LUMO能级和更高的VOC。
单加合物的环氧化顺利地进行并产生如图2C所示的产物(IBF–Ep)。与IBF–单相比,IBF–Ep示出在有机溶剂中增加的溶解度,原因至少部分在于环氧基氧赋予其更高的极性。还合成了具有一个或两个环氧化异苯并富烯部分的IBF–双的环氧衍生物,以利用56个π电子体系的高VOC特性,并且观察环氧基对JSC的影响(图2-D-E)。为了最佳产率及易于纯化,通过向IBF–Ep支架中添加异苯并富烯附加物来合成IBF–双–Ep1,并且通过IBF–双的完全环氧化来制备IBF–双–Ep2。
实施例1:9-异亚丙基苯并降冰片二烯的合成
根据Lombardo,L.;Wege,D.;Wilkinso.Sp Aust J Chem 1974,27,143中所述过程的修改版制备该化合物。向1,2-二氯乙烷(40mL)中的6,6-二甲基富烯(5.00g,5.7mL,47mmol)和亚硝酸异戊酯(8.3g,9.5mL,71mmol)的回流溶液中逐滴添加30mL丙酮中的邻氨基苯甲酸(9.7g,71mmol)溶液。然后使混合物回流90分钟,之后在减压下除去溶剂并用沸腾的己烷萃取。产物在硅胶柱上进行色谱层析(己烷,Rf=0.25)并且作为无色粉末回收(3.4g,40%)。
实施例2:IBF–单的合成
在200mL圆底烧瓶中,将3,6-二-2-吡啶基-1,2,4,5-四嗪(396mg,1.67mmol)溶解于二氯甲烷(25mL)中并在空气中在0℃下搅拌。将9-异亚丙基苯并降冰片二烯(305mg,1.67mmol)溶解在甲苯(10mL)中并逐滴添加至四嗪溶液中。将该溶液搅拌30分钟并使其变浅,然后添加C60(602mg,0.835mmol)的甲苯/邻二氯苯(70mL/10mL)溶液。在搅拌过夜后,使所述溶液在减压下蒸发。将乙醇(400mL)倒入反应混合物中以析出棕色固体。所述固体通过SiO2柱色谱法用CS2/己烷(1:3v/v)洗脱进行纯化,并且获得170mg(23.2%)产物。
1H NMR(500MHz,CD2Cl2/CS2,δ):7.67(dd,2H),7.46(dd,2H),5.43(s,2H),2.20(s,6H)13C NMR(500MHz,CDCl3/CS2,δ):192.35(CS2),155.63,153.70,147.08,146.12,146.01,146.00,145.92,145.86,145.55,145.43,145.22,145.19,145,18,145.10,144.95,144.94,144.45,144.26,142.47,142.43,142.34,142.13,142.00,141.87,141.73,141.60,141.50,139.81,139.53,137.81(1C),137.16(1C),127.11(2C),123.21(2C),120.13(2C),77.11(CDCl3),75.16(2C),57.96(2C),20.75(2C).MS(MALDI-TOF,m/z):[M+H]+对C72H12的计算值,877.1017;实测值,876.9678
实施例3:IBF-双的合成
在100mL圆底烧瓶中,将3,6-二-2-吡啶基-1,2,4,5-四嗪(40mg,0.17mmol)溶解于二氯甲烷(8mL)中并在室温下搅拌。将9-异亚丙基苯并降冰片二烯(31mg,0.17mmol)溶解在甲苯中并逐滴添加至四嗪溶液中。将该溶液搅拌30分钟,并且添加IBF-单(150mg,0.17mmol)的CS2溶液(10mL)。在搅拌过夜后,使所述溶液在减压下蒸发。将反应混合物溶解在甲苯中并且通过HPLC用5PBB Cosmosil柱(甲苯/己烷1∶1洗脱)进行纯化。为了进一步纯化,使产物通过用CS2/己烷(1∶3v/v)洗脱的SiO2柱,并且获得40mg(22.8%)产物。
1H NMR(500MHz,CD2Cl2/CS2,δ):7.94-7.24(m,8H),5.74-5.02(m,4H),2.40-1.89(12H).13C NMR(500MHz,CD2Cl2/CS2,δ):192.92(CS2),160-140(C60,sp2),140-130(烯烃),130-115(芳香族),80-70(C60,sp3),60-55(桥头),30.47(脂),22-20(CH3).MS(MALDI-TOF,m/z):[M]+对C84H24的计算值,1032.1878;实测值,1032.5122
实施例4:IBF-Ep的合成
将IBF-单(170mg,0.194mmol)溶解在100mL圆底烧瓶中的CS2(25mL)中,在室温下向其中逐滴添加二氯甲烷(20mL)中的3-氯过苯甲酸(最大纯度77%,130mg,0.753mmol)溶液。在搅拌过夜后,在TLC板上检测到主要产物的斑点。在减压下干燥反应混合物,将其再次溶解于二氯甲烷(30mL)中,并用NaOH水溶液萃取数次。将有机层用MgSO4干燥并在真空中浓缩。在用1∶1至3∶1甲苯/己烷洗脱的梯度二氧化硅柱之后,分离出94.0mg(54.3%)产物。
1H NMR(500MHz,CD2Cl2/CS2,δ):7.75(dd,2H),7.55(dd,2H),4.78(s,2H),1.87(s,6H).13C NMR(500MHz,CD2Cl2/CS2,δ):192.92(CS2),155.07,153.74,147.78,146.81,146.66,146.61,146.54,146.19,146.13,146.00,145.89,145.79,145.78,145.69,145.68,145.09,144.91,144.61,143.39,143.11,143.02,142.45,142.40,142.38,142.25,142.20,14.062,140.29,137.90,137.60(2C),128.33(2C),125.18(2C),87.59(1C),72.99(2C),66.01(1C),58.42(2C),30.46(脂),23.74(2C).MS(MALDI-TOF,m/z):[M]+对C72H12O的计算值,892.0888;实测值,892.4482
实施例5:IBF-双-Ep的合成
在50mL圆底烧瓶中,将3,6-二-2-吡啶基-1,2,4,5-四嗪(10.9mg,0.046mmol)溶解在二氯甲烷(2mL)中并在空气中在0℃下搅拌。将9-异亚丙基苯并降冰片二烯(8.4mg,0.046mmol)也溶解在二氯甲烷(5mL)中并逐滴添加至四嗪溶液中。将该溶液搅拌1小时并使其变浅,然后将溶解在CS2(5mL)中的IBF-Ep(41mg,0.046mmol)逐滴添加至所述溶液中。在搅拌过夜后,在真空下浓缩溶液。产物通过二氧化硅柱色谱法经由二氯甲烷/己烷(1∶2)洗脱进行纯化,并且通过HPLC用5PBB Cosmosil柱经由甲苯/己烷(1∶1)洗脱进一步纯化。获得产率为22.8%的经纯化的产物(11mg)。
1H NMR(500MHz,CD2Cl2,δ):7.61-7.32(m,8H),5.13-4.33(m,4H),2.05-1.61(12H).13C NMR(500MHz,CD2Cl2,δ):160-140(C60,sp2),140-130(烯烃),130-115(芳香族),90-70(环氧化物),70-65(C60,sp3),60-55(桥头),25-20(CH3).MS(MALDI-TOF,m/z):[M]+对C84H24O的计算值,1048.1827;实测值,1048.3863
实施例6:IBF-双-Ep2的合成
将IBF-双(26mg,0.025mmol)溶解在50mL圆底烧瓶中的二氯甲烷(10mL)中,在室温下向其中逐滴添加二氯甲烷(10mL)中的3-氯过苯甲酸(最大纯度77%,34mg,0.197mmol)溶液。在搅拌过夜后,在TLC板上检测到主要产物斑点。将反应混合物用NaOH水溶液萃取数次。将有机层用MgSO4干燥并在真空下浓缩。在用2∶1二氯甲烷/己烷和100%二氯甲烷洗脱的梯度二氧化硅柱之后,分离出14mg(52.2%)产物。
1H NMR(500MHz,CD2Cl2,δ):7.91-7.34(m,8H),4.79-4.35(m,4H),2.05-1.70(12H).13C NMR(500MHz,CD2Cl2,δ):160-140(C60,sp2),140-120(芳香族),90-85(环氧化物),75-70(C60,sp3),70-65(环氧化物),60-55(桥头),25-20(CH3).MS(MALDI-TOF,m/z):[M+H]+对C84H24O2的计算值,1065.1855;实测值,1065.4214
实施例7:器件制造和表征
在PEDOT:PSS层的沉积之前立即将预图案化的经氧化铟锡(ITO)涂覆的玻璃基板(Thin Film Devices,Inc.)在去离子水(10分钟)、丙酮(10分钟)和异丙醇(10分钟)中进行超声处理,并且进行氧等离子体清洗(3分钟)。在氮气下以4000rpm旋涂PEDOT:PSS(在水中2重量%至5重量%,Aldrich)并且在150℃(使用热板)下退火20分钟。对于活性层,在氮气下将氯苯(CB)中1∶1 P3HT∶富勒烯的25mg/mL溶液以1000rpm旋涂在PEDOT:PSS层上,并且在氮气下在150℃热板上退火20分钟。最后通过热蒸镀沉积25nm Ca、随后沉积100nm Al电极。
在黑暗中和在光照下均通过Keithley 6487皮可安培计记录电流密度-电压(J-V)的测量。使用Oriel 91191 150W全光谱太阳模拟器通过玻璃基板照射器件。光照强度使用NREL认证的硅光电二极管校准至100mW/cm2。器件的光学吸收光谱和光致发光光谱通过使用Cary 5E UV-可见-NIR双光束分光光度计测量各自在玻璃基板上的透射率和反射率来获得。为了测量外量子效率谱,通过石英钨卤素灯产生入射光,在40Hz下斩截,通过单色仪分散,并且通过光纤传导至样品表面。光强度使用Newport硅光电探测器(用于400nm至800nm波长)进行校准,并且用Stanford Research SR830锁定放大器测量短路条件下的光电流。用作为第二光源来提供方波调制的光照的由Agilent33220A函数发生器驱动的Newport激光二极管(830nm)进行瞬态光电流和复合寿命测量。在该光照到达器件之前通过中性密度滤光器对其进行过滤以确保小光照扰动。在Tektronix TDS 3054B数字示波器上记录Voc衰变瞬态。
实施例8:电化学特性
在无水、无空气条件下用二茂铁/二茂铁盐(Fc/Fc+)内标物进行循环伏安法以测量实施例2至6中的C60衍生物的相对还原电势。在0.1M TBAPF6甲苯/乙腈(4∶1)溶液中,每种化合物显示出四个可逆的氧化还原峰,并且使用起始还原电势的相对位置比较富勒烯的LUMO能级。图3示出以下物质的循环伏安图:(a)PCBM、IBF–单和IBF–双;(b)PCBM、IBF–单和IBF–Ep;及(c)PCBM、IBF–双、IBF–双–Ep1和IBF–双–Ep2(在氮气下,甲苯/乙腈(4:1)中的0.1M Bu4NPF6,Pt(WE),Pt丝(CE),Ag/AgNO3(RE),扫描速率0.1V/秒,Fc/Fc+内标物E1/2为0.20V)。相对于PCBM,IBF–单和IBF–双的还原起始电势向负电势偏移了约60mV和180mV,与茚-C60单加合物和双加合物类似(分别为50mV和170mV)(图3A)。图5示出官能化富勒烯的HOMO–LUMO能级图,MO能级相对于设定为零的真空能级按比例绘制。渐增的负还原电势对应于升高的LUMO能级、增加的BHJ太阳能电池的有效带隙和VOC。不希望受理论约束,C60表面与所附接的官能团(例如,异苯并富烯基的芳香族环和双键)之间的π-π相互作用可有助于大幅降低富勒烯的电子亲和力。
IBF–单的环氧化基本消除了C60与异苯并富烯部分的双键之间的π-π相互作用,导致IBF–Ep的还原电势相对于IBF–单略微增加(图3A)。这可能至少部分归因于减弱的π-π相互作用与存在吸电子的环氧基的联合效应。对IBF–双的环氧衍生物观察到类似现象。在图3C中,相对于PCBM绘制IBF–双、IBF–双–Ep1和IBF–双–Ep2的氧化还原行为。这三种化合物的第一还原峰和起始还原电势位置非常靠近,但存在如通过用于视觉辅助的虚线所标记的细微差异。随着更多的环氧基并入该结构,富勒烯的电子亲和力增加而LUMO能级降低(图5B)。
实施例9:光物理和热特性
由于受体对可见光的吸收可有助于增加太阳能电池的JSC,因此采用UV–可见光谱学来研究溶液状态的经取代的富勒烯光学特性。绘制实施例2至6中的C60衍生物和PCBM在400nm至800nm范围内的比较吸收光谱。图4示出以下物质在CHCl3中的UV–可见吸收光谱:(a)PCBM(2.4×10-5M)、IBF–单(2.2×10-5M)、IBF–双(2.4×10-5M)和IBF–Ep(2.3×10-5M);及(b)PCBM(2.4×10-5M)、IBF–双–Ep1(2.4×10-5M)和IBF–双–Ep2(2.2×10-5M)。单加合物(IBF–单、IBF–Ep)在430nm至440nm附近显示出弱尖峰,这是通过1,2-加成反应形成的富勒烯衍生物的特征。单加合物的尖峰和吸收起始波长λ起始相对于PCBM发生红移。双加合物因其为区域异构体混合物形式而显示出比单加合物更宽的吸收特征,并且降低的富勒烯对称性赋予双加合物更高的吸光系数。与单加合物相比,观察到双加合物的起始波长更长并且带隙更小。这些带隙用于估计富勒烯的HOMO能级(例如,通过从得自循环伏安法的LUMO能级中减去带隙)。将由上述实验获得的值汇总在表1中,并且将富勒烯的MO能级图描绘在图5中。
表1.由UV–可见吸收和循环伏安法计算的富勒烯衍生物的HOMO和LUMO能级
[a]半波电势,0.5(Ep.a.+Ep.c.);Ep.a.,阳极峰电势;Ep.c.,阴极峰电势;[b]起始还原电势;[c]LUMO(eV)=-e(E起始+4.60);[d]起始吸收波长;[e]HOMO=LUMO-E带隙[eV];[f]带隙=hc/λ起始,将[J]转换为[eV];h,
普朗克常数;c,光速。
通过差示扫描量热法(DSC)实验从25℃至200℃检测富勒烯的热稳定性。只有以购自商业来源的形式使用的PCBM在140℃附近显示出小吸热峰,这可能是由于残留甲苯的消耗。所有其他富勒烯衍生物在三次DSC循环中均未显示出明显的吸热或放热特征,证实了该化合物的热稳定性及其与常用于有机光伏器件制造过程的热退火工艺的相容性。在对IBF–双、IBF–Ep和IBF–双–Ep1的第一次DSC循环中从120℃至180℃观察到非常小的放热特征,这可能归因于在高温下较少的逆狄尔斯–阿尔德反应(这对富勒烯环加合物很典型)。
实施例10:光伏特性
在该实施例中,将IBF–单、IBF–双、IBF–Ep、IBF–双–Ep1和IBF–双–Ep2用作具有P3HT供体的BHJ太阳能电池的电子受体,并将其性能与常规P3HT:PCBM器件进行比较。制造器件的实验细节可见于实施例7中。图6示出(a)与常规P3HT:PCBM相比,对于以P3HT作为电子供体的太阳能电池的BHJ结构中的富勒烯,电流密度随所施加的电压的变化;和(b)由(a)中的器件获得的VOC值的盒须图,其中须为第10至第90百分点并且盒为包含中间值和平均值(虚线)的第25和第75百分点。图6的有关参数在表2中列出。
除P3HT:IBF–单以外,所有具有富勒烯的器件的中值VOC高于常规P3HT:PCBM器件。用IBF–单和IBF–双替换PCBM通常使JSC降低。特别地,IBF–单具有比其他富勒烯加合物更低的溶解度,并因此更倾向于电流损耗和低再现性。如IBF–双和IBF–双–Ep1/IBF–双–Ep2之间的电流差所示,异苯并富烯部分的环氧化显著提高了JSC。此外,IBF–单的环氧化(以产生IBF–Ep)不仅在器件中产生比P3HT:PCBM高得多的电流,还增加了IBF–单的溶解度和J–V图的再现性。
如图6B中的盒须图所示,包含富勒烯加合物的大部分器件表现出比P3HT:PCBM器件更大的中值VOC。IBF–双的衍生物和PCBM之间的VOC差异通过大的LUMO能级差来反映(如图5所示和表1中所列出的)。尽管IBF–Ep和PCBM的LUMO能级相似,但是P3HT:IBF–Ep器件产生比P3HT:PCBM器件大46mV的VOC。然而,慢的复合动力学可有利于P3HT:IBF–Ep器件的大VOC。对于所研究的所有材料还观察到相似的填充因子(FF),表明着传输/复合特性的相似组合。
表2.图6A中器件的OPV特性。定义:短路电流密度,JSC;开路电压,VOC;填充因子,FF;PCE,η。
实施例11:光学和电子特性
为了理解控制本文所述用富勒烯衍生物制造的器件的JSC的机理,使用稳态光谱对薄膜和器件进行了研究。在与用于图3A中的器件相同的条件下制备薄膜。
对于不同的富勒烯加合物,图7A示出薄膜的稳态光谱UV-可见吸收光谱并且图7B示出稳态光谱光致发光发射。用单色仪光以500nm激发薄膜并对薄膜的吸收进行归一化。当与P3HT共混时,除了IBF–单涉及高水平的辐射激发复合以外,所有富勒烯加合物均表现出淬灭的光致发光(PL)。这样的复合可有助于观察到P3HT:IBF–单器件的低JSC。图7C示出器件的光谱外量子效率(EQE)。在该实施例的器件中观察到P3HT:IBF–单器件表现出最低的EQE,随后是P3HT:IBF–双器件。IBF–单和IBF–双的环氧化产生表现出更高EQE的器件,如JSC值所反映的。图7D示出通过对经由吸收得到的EQE进行归一化而获得的光谱内量子效率(IQE)。P3HT:IBF–Ep器件表现出最高的IQE并因此在该实施例的器件中表现出最高的JSC。IBF–双–Ep2器件显示出与IBF–双–Ep1器件相似的性能。
从图7A中绘制的薄膜的稳态UV–可见吸收观察到,与P3HT:PCBM相比所有具有新富勒烯衍生物的器件吸收降低(在相同厚度下)。P3HT:IBF–单和P3HT:IBF–双降低的吸收有助于观察到较低的JSC。然而,P3HT:IBF–Ep器件的较低吸收表明观察到的较高JSC可能归因于其他因素,下文详述。
除了降低的吸收以外,P3HT:IBF–单器件表现出高辐射复合,如图7B中的稳态光致发光(PL)发射光谱所示。BHJ中的电子供体的PL发射的淬灭反映出从供体至受体的有效电荷转移。除P3HT:IBF–单以外,在所有BHJ共混物中观察到了淬灭的发射,这表明P3HT:IBF–单膜中辐射激发-复合的高速率。这样的高复合可有助于P3HT:IBF–单器件的低JSC。如图8所示,在10μm尺度下的原子力显微镜(AFM)形貌图表明P3HT与IBF–单区域的亚最佳相分离(与P3HT:PCBM器件相反),这可能由IBF–单的低溶解度引起。
还研究了器件的外量子效率(EQE)的稳态光谱响应,如图7C所示。如由在UV–可见和PL光谱中的观测所预期的,P3HT:IBF–单器件表现出最低的EQE。IBF–单和双的环氧化导致器件(P3HT:IBF–Ep和P3HT:IBF–双–Ep1)更高的EQE和JSC。由于IBF–双的环氧化引起的EQE最大值的红移可表明从某些带内态增强的电荷提取。对通过吸收得到的EQE进行归一化而获得的稳态光谱内量子效率(IQE)进行进一步分析。如图7D所示,P3HT:IBF–Ep表现出最高的IQE,其导致在具有不同富勒烯的器件中最大的JSC。这可能至少部分归因于由供体-受体界面处IBF–Ep的环氧基所诱导的偶极子,所述偶极子可在促进电荷分离中发挥重要作用。最后,IQE光谱的特征形状很可能归因于器件的厚度,其可影响由太阳光谱的一部分(~500nm)所产生的光电荷的收集。
实施例12:瞬态测量
通常采用瞬态光电压(TPV)和光电流(TPC)来评估在开路下的电荷载流子复合,并且将VOC的幅度与电荷载流子复合动力学联系起来。测量开路下的复合寿命随着过剩电荷载流子密度的变化。图9示出P3HT:PCBM和P3HT:IBF–Ep器件在短路下的瞬态光电流,表明P3HT:PCBM器件中的迁移率可能更高。在相同的平均过剩电荷密度下,与其他器件相比,P3HT:PCBM器件表现出最短的复合寿命。在两种器件的有效带隙表1相似时(图5),P3HT:IBF–Ep比P3HT:PCBM器件复合得更慢可导致P3HT:IBF–Ep的VOC更大。
此外,所有基于IBF–C60的器件的特征在于相似的复合动力学,这表明其在与P3HT的界面处不同于PCBM的电子特性。由于基于IBF–C60的器件中的复合动力学相似,VOC的差异可以至少部分归因于LUMO能级差,如图5至图6与表1和表2中所示,P3HT:IBF–单除外。P3HT:IBF–单的低再现性导致VOC值的大变化和低中值VOC。总而言之,由IBF–C60衍生物与P3HT之间改善的电子界面行为所引起的较慢复合动力学可以引起相应器件的大VOC的产生。
图10示出用瞬态光电压和光电流(TPV/TPC)测量的复合寿命随着平均过剩电荷密度的变化。在相同的平均过剩电荷密度下进行比较,P3HT:PCBM器件表现出最快的复合寿命。相对于P3HT:PCBM器件,P3HT:IBF–Ep器件更慢的复合导致更大的VOC。此外,基于IBF–C60的器件的特征在于相似的复合速率,表明其在与P3HT的界面处相似的电子行为。观察到的不同VOC值可以受LUMO能级差的影响。
实施例13
制造具有以下结构(“倒置”结构)的太阳能电池:玻璃/ITO/ZnO/聚合物:IBF-Ep/Al/MoO3/Ag。在使用之前,用洗涤剂和水清理图案化的经ITO涂覆的玻璃基板,然后在丙酮和异丙醇中各超声处理15分钟。根据Po等在“From lab to fab:how must the polymer solar cell materials design change?–an industrial perspective,”Energy Environ.Sci.2014,7,925-943中所述的方法(其内容通过引用整体并入本文用于所有目的),通过旋涂来沉积ZnO层。将聚{[4’-(4,8-二(2-乙基己基氧基)苯并[1,2-b:4,5-b’]二噻吩-2-基)-2’,1’,3’-苯并噻二唑-6,7’-二基]-共聚-[4’-(4,8-二(2-乙基己基氧基)苯并[1,2-b:4,5-b’]二噻吩-2-基)-(1-辛基壬基)-苯并三唑-6,7’-二基]}和IBF-Ep(1:2w/w)溶解在氯苯(总浓度18mg/ml)中并在70℃下搅拌过夜。然后使溶液通过5微米特氟隆过滤器进行过滤,然后在氮气下以1000rpm旋涂在ZnO层上并在氮气下在150℃热板上退火20分钟。
通过真空沉积来沉积10nm MoO3缓冲层和100nm铝层。使用16mm2的阴影掩模测量光伏参数。在手套箱中在室温下进行器件的电表征。使用太阳模拟器(Sun 2000,Abet Technologies)照射太阳能电池,并且使用经认证的KG-5过滤硅太阳能电池在AM1.5照射条件(100mW cm-2)下校准光功率强度。电流–电压曲线用Keithley 2602源-测量取得。
比较例1:使用相同过程测试共混物聚{[4’-(4,8-二(2-乙基己基氧基)苯并[1,2-b:4,5-b’]二噻吩-2-基)-2’,1’,3’-苯并噻二唑-6,7’-二基]-共聚-[4’-(4,8-二(2-乙基己基氧基)苯并[1,2-b:4,5-b’]二噻吩-2-基)-(1-辛基壬基)-苯并三唑-6,7’-二基]}:PCBM。
比较例2:使用相同程序测试共混物聚{[4’-(4,8-二(2-乙基己基氧基)苯并[1,2-b:4,5-b’]二噻吩-2-基)-2’,1’,3’-苯并噻二唑-6,7’-二基]-共聚-[4’-(4,8-二(2-乙基己基氧基)苯并[1,2-b:4,5-b’]二噻吩-2-yl)-(1-辛基壬基)-苯并三唑-6,7’-二基]}:ICBA。
表3示出对该实施例中器件的光伏参数的汇总。
表3.光伏参数汇总
- 还没有人留言评论。精彩留言会获得点赞!