一种钴酸镍纳米立方体材料及其制备方法和应用与流程
本发明涉及纳米材料制备领域,具体涉及一种钴酸镍纳米立方体材料及其制备方法和应用。
背景技术:
钴酸镍(NiCo2O4)为反尖晶石结构的AB2O4型复合氧化物,其中镍离子占据八面体空隙,钴离子占据全部的四面体空隙及半数的八面体空隙。钴酸镍中存在Ni3+/Ni2+和Co3+/Co2+两种氧化还原电对,因此导电性及电化学活性远高于单一的镍、钴氧化物,可用于锂离子电池电极材料或超级电容电极材料,具有很高的应用价值。
在作为锂离子电池负极材料时,钴酸镍材料在循环过程中会产生一定的体积膨胀,造成材料粉化极片脱落,影响电极的循环稳定性。针对这个问题,常采取的改善方式有:将材料与碳基材料复合(Peng L,Zhang H,Fang L,et al.ACS applied materials&interfaces,2016,8(7):4745-4753.)、纳米化(Li J,Xiong S,Liu Y,et al.ACS applied materials&interfaces,2013,5(3):981-988.)以及构建特殊形貌(Mondal A K,Su D,Chen S,et al.ACS applied materials&interfaces,2014,6(17):14827-14835.)等。其中,纳米化的材料可以有效缓冲材料在循环过程中的体积变化,同时缩短锂离子的传输路径,提高电化学活性,是一种十分有效地改善材料电化学性能的方法。
目前对于纳米钴酸镍的合成方法的研究有很多,例如,CN 102259936 A公开了一种纳米钴酸镍的制备方法,通过在制备前驱体的过程中加入有机溶剂,采用水相和有机相混合相为溶剂,共沉淀法获得高纯度、颗粒尺寸均一和结晶性良好的纳米钴酸镍。CN 105439213 A公开了一种纳米钴酸镍及其制备方法,步骤如下:(1)将硝酸镍、硝酸钴和尿素加入到无水乙醇中,常温下搅拌,使溶液混合均匀,得溶液A;(2)在溶液A中加入失水山梨醇脂肪酸酯S-20和失水山梨醇脂肪酸酯S-40,超声使之混合均匀,得溶液B;(3)将溶液B转移至反应釜中,进行溶剂热反应,洗涤,烘干,得到前驱体;(4)将前驱体在空气中经350-375℃恒温热处理后,得到纳米钴酸镍。CN 104269552 A公开了一种二维珊瑚状纳米钴酸镍及其制备方法。将氧化石墨烯置于水中超声分散,硝酸钴和硝酸镍加入到水中搅拌溶解,然后将二种体系混合搅拌均匀,之后将混合体系冷冻干燥,最后将干燥后的粉末进行热处理,获得二维珊瑚状纳米钴酸镍。上述现有技术中往往使用有机溶剂或模板剂进行制备,增加了生产成本的同时还会对环境造成一定污染,不利于大规模生产。
技术实现要素:
鉴于现有技术中存在的问题,本发明提供了一种钴酸镍纳米立方体材料的制备方法,制备过程以水作为溶剂,不使用任何模板剂,通过特定的工艺得到具有特殊立方体形貌的钴酸镍纳米材料。该材料尺寸均一、颗粒分布均匀,作为锂离子电池负极材料时,首次充放电可逆比容量为800-1200mAh/g,也可以作为超级电容器电极材料应用在储能领域。
为达此目的,本发明采用以下技术方案:
第一方面,本发明提供一种钴酸镍纳米立方体材料的制备方法,所述方法包括以下步骤:
(1)将镍源和钴源按照摩尔比1:2溶解于去离子水中,制成溶液A;
(2)将溶液A转移至反应釜中,在加热搅拌的条件下将碱性溶液B滴加至溶液A中进行反应,滴加完成后,升高温度继续搅拌;
(3)将步骤(2)得到的产物进行陈化处理,得到钴酸镍纳米立方体材料的前驱体;
(4)将步骤(3)得到的前驱体进行热处理,得到钴酸镍纳米立方体材料。
根据本发明,步骤(1)所述镍源为氯化镍、硫酸镍或硝酸镍中的任意一种或至少两种的组合,例如可以是氯化镍、硫酸镍或硝酸镍中的任意一种,典型但非限定性的组合为:氯化镍和硫酸镍,氯化镍和硝酸镍,硫酸镍和硝酸镍,氯化镍、硫酸镍和硝酸镍。
根据本发明,步骤(1)所述钴源为氯化钴、硫酸钴或硝酸钴中的任意一种或至少两种的组合,例如可以是氯化钴、硫酸钴或硝酸钴中的任意一种,典型但非限定性的组合为:氯化钴和硫酸钴,氯化钴和硝酸钴,硫酸钴和硝酸钴,氯化钴、硫酸钴和硝酸钴。
根据本发明,步骤(1)所述溶液A中镍离子的浓度为0.1-3mol/L,例如可以是0.1mol/L、0.5mol/L、1mol/L、1.5mol/L、2mol/L、2.5mol/L或3mol/L,以及上述数值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
根据本发明,步骤(1)所述溶液A中钴离子的浓度为0.2-6mol/L,例如可以是0.2mol/L、0.8mol/L、1.4mol/L、2mol/L、2.6mol/L、3.2mol/L、3.8mol/L、4.4mol/L、5mol/L、5.4mol/L或6mol/L,以及上述数值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
根据本发明,步骤(2)所述碱性溶液B为氢氧化钠溶液、氢氧化钾溶液、氢氧化钡溶液或氨水中的任意一种或至少两种的组合,例如可以是氢氧化钠溶液、氢氧化钾溶液、氢氧化钡溶液或氨水中的任意一种,典型但非限定性的组合为:氢氧化钠溶液和氢氧化钾溶液,氢氧化钠溶液和氢氧化钡溶液,氢氧化钠溶液和氨水,氢氧化钾溶液和氢氧化钡溶液,氢氧化钾溶液、氢氧化钡溶液和氨水,氢氧化钠溶液、氢氧化钾溶液、氢氧化钡溶液和氨水等,限于篇幅及出于简明的考虑,本发明不再穷尽列举。
本发明所述碱性溶液B是通过将上述碱性溶液相对应的碱性氢氧化物或氨水溶解于去离子水中配制而成的。
在滴加溶液进行反应过程中,当将碱性溶液B滴加至溶液A时,溶液A的pH值逐渐升高,有利于镍、钴离子充分反应;当将溶液A滴加至碱性溶液B时,会使溶液pH值逐渐降低,不利于镍、钴离子的沉淀,因此滴加顺序的选择是本发明获得具有钴酸镍纳米立方体材料的关键。
根据本发明,步骤(2)所述碱性溶液B中氢氧根离子的浓度为1-8mol/L,例如可以是1mol/L、2mol/L、3mol/L、4mol/L、5mol/L、6mol/L、7mol/L或8mol/L,以及上述数值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
根据本发明,步骤(2)所述滴加完成后溶液A中金属离子的总浓度与碱性溶液B中的氢氧根离子的浓度比为0.5-10,例如可以是0.5、1、2、3、4、5、6、7、8、9或10,以及上述数值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
根据本发明,步骤(2)所述加热搅拌的温度30-100℃,例如可以是30℃、40℃、50℃、60℃、70℃、80℃、90℃或100℃,以及上述数值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
根据本发明,步骤(2)所述滴加的速度为2-50mL/min,例如可以是2mL/min、5mL/min、10mL/min、15mL/min、20mL/min、25mL/min、30mL/min、35mL/min、40mL/min、45mL/min或50mL/min,以及上述数值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
滴加速度过快时,会使反应过于迅速,难以生长为大小均匀的颗粒;滴加速度过慢时,则会导致成核速度过慢,降低反应效率。
根据本发明,步骤(2)所述升高温度为将温度升高至70-150℃,例如可以是70℃、80℃、90℃、100℃、110℃、120℃、130℃、140℃或150℃,以及上述数值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
上述升高温度指在所述加热搅拌的温度的基础上进行升温,例如,当加热搅拌的温度为50℃时,可以升温至70-150℃继续搅拌;当加热搅拌的温度为90℃时,可以升温至90℃以上150℃以下或150℃继续搅拌。
根据本发明,步骤(2)所述加热搅拌和升高温度继续搅拌的速率为500-1500r/min,例如可以是500r/min、600r/min、700r/min、800r/min、900r/min、1000r/min、1100r/min、1200r/min、1300r/min、1400r/min或1500r/min,以及上述数值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
根据本发明,步骤(2)所述升高温度继续搅拌的时间为0.5-24h,例如可以是0.5h、1h、3h、5h、7h、9h、10h、12h、14h、16h、18h、20h、22h或24h,以及上述数值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
滴加完成后升高温度继续搅拌,有利于促进反应充分进行,提高沉淀晶体的均匀性。
根据本发明,步骤(3)所述陈化的温度为70-150℃,例如可以是70℃、80℃、90℃、100℃、110℃、120℃、130℃、140℃或150℃,以及上述数值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
根据本发明,步骤(3)所述陈化的时间为2-48h,例如可以是2h、5h、10h、15h、20h、25h、30h、35h、40h、45h或48h,以及上述数值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
陈化是本发明的关键步骤,能够使沉淀晶体生长,增大晶体粒径,并使其粒径分布比较均匀,形成具有立方体形貌的钴酸镍纳米材料。
根据本发明,步骤(4)所述热处理的温度为200-600℃,例如可以是200℃、250℃、300℃、350℃、400℃、450℃、500℃、550℃或600℃,以及上述数值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
根据本发明,步骤(4)所述热处理的时间为0.5-10h,例如可以是0.5h、1h、2h、3h、4h、5h、6h、7h、8h、9h或10h,以及上述数值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
本发明所述的钴酸镍纳米立方体材料是由溶剂的选择、滴加顺序、加热搅拌和后续升温搅拌步骤、陈化处理以及热处理等众多工艺条件综合制备得到的,当任意一个步骤缺失或工艺发生变化,都不能得到具有立方体形貌的钴酸镍纳米材料。
第二方面,本发明提供一种根据第一方面所述的制备方法制备得到的钴酸镍纳米立方体材料。
本发明通过特定的工艺,得到了尺寸均一,分布均匀并且具有特殊形貌(立方体)的纳米钴酸镍材料,达到了纳米化和构建特殊形貌的双重目的,进而解决了钴酸镍材料在循环过程中易产生体积膨胀的问题,同时使其获得了优异的电化学性能。
第三方面,本发明提供如第二方面所述的钴酸镍纳米立方体材料作为锂离子电池负极材料或超级电容器电极材料的应用。
与现有技术方案相比,本发明至少具有以下有益效果:
(1)制备过程以水为溶剂,不会造成污染,同时降低了成本。
(2)制备过程不使用任何模板剂,得到了尺寸均一、颗粒分布均匀且具备立方体形貌的钴酸镍纳米材料。
(3)制备过程操作简单、灵活,反应条件温和,适用于工业化生产。
(3)制备得到的钴酸镍纳米立方体材料作为锂离子电池负极材料时,具有优异的电化学性能,其首次充放电可逆比容量为800-1200mAh/g,也可以作为超级电容器电极材料应用在储能领域。
附图说明
图1为实施例1所得的钴酸镍纳米立方体材料的扫描电镜照片。
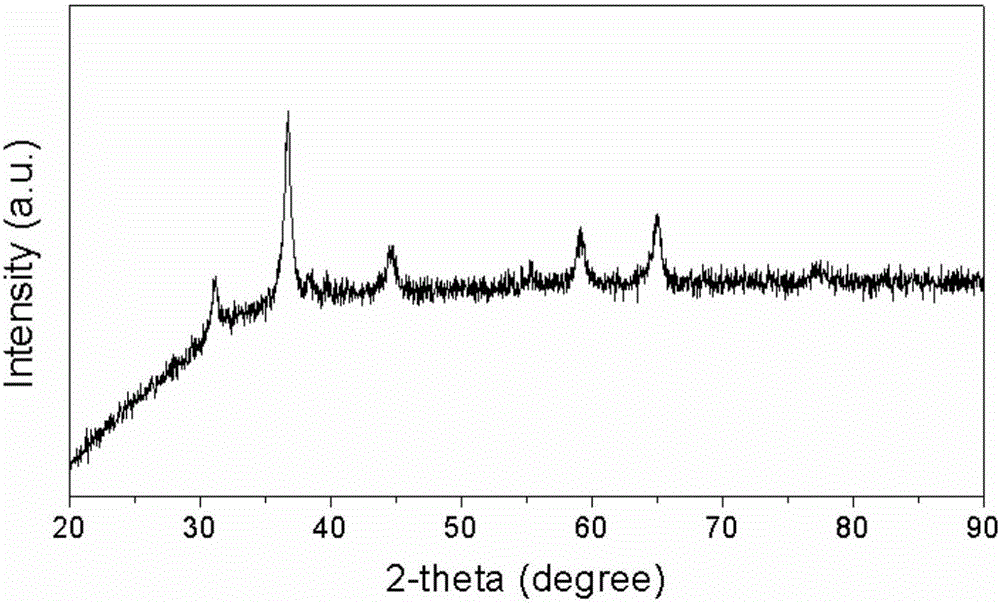
图2为实施例1所得的钴酸镍纳米立方体材料的XRD图谱。
图3为实施例1所得的钴酸镍纳米立方体材料作为锂离子电池负极材料的充放电曲线。
下面对本发明进一步详细说明。但下述的实例仅仅是本发明的简易例子,并不代表或限制本发明的权利保护范围,本发明的保护范围以权利要求书为准。
具体实施方式
为更好地说明本发明,便于理解本发明的技术方案,本发明的典型但非限制性的实施例如下:
实施例1
(1)将氯化镍和氯化钴按照摩尔比1:2溶解于去离子水中,搅拌均匀,制成金属离子总浓度为1.5mol/L的溶液A;将氨水溶解于去离子水中,搅拌均匀,制成氢氧根离子浓度为3mol/L的碱性溶液B;
(2)将1000mL溶液A转移至反应釜中,在75℃搅拌条件下,将500mL碱性溶液B逐滴滴入反应釜,滴加的时间为10min,滴加完成后,升温至100℃继续搅拌1h;
(3)将步骤(2)所得产物转移至烘箱,在120℃下陈化10h,得到前驱体;
(4)将步骤(3)所得前驱体置于马弗炉中,在450℃下热处理3h,得到钴酸镍纳米立方体材料。
将所得NiCo2O4材料作为锂离子电池负极材料进行电化学性能测试,极片配比为NiCo2O4材料:乙炔黑:PVDF=70:15:15。以锂片为参比电极,制备CR2016型纽扣电池。在0.01-3.0V电压窗口,100mA/g电流密度下,首次循环放电比容量和充电比容量分别为1400mAh/g和1188mAh/g。
图1为本实施例制备的钴酸镍纳米立方体材料的扫描电镜照片。由图可知,通过本方案合成的钴酸镍材料具有立方体形貌,大小均匀,颗粒尺寸约为100nm。
图2为本实施例制备的钴酸镍纳米立方体材料的XRD图谱。由图可知,通过本方案合成的钴酸镍材料为纯相,无明显杂质,空间群为Fd-3m(227)。
图3为本实施例制备的钴酸镍纳米立方体材料作为锂离子电池负极材料的充放电曲线。由图可知,通过本方案合成的钴酸镍材料在作为锂离子电池负极材料时,表现出较高的可逆比容量。首次放电比容量为1400mAh/g左右,首次充电比容量为1200mAh/g左右。第二次循环中放电比容量为1300mAh/g左右,充电比容量为1200mAh/g左右(图中,横坐标为可逆比容量,纵坐标为相对于参比电极锂片的充放电电压)。
实施例2:
(1)将硫酸镍和硫酸钴按照摩尔比1:2溶解于去离子水中,搅拌均匀,制成金属离子总浓度为0.3mol/L溶液A;将氢氧化钠溶解于去离子水中,搅拌均匀,制成氢氧根离子浓度为2mol/L溶液B;
(2)将1000mL溶液A转移至反应釜中,在50℃搅拌条件下,将300mL碱性溶液B逐滴滴入反应釜,滴加的时间为15min,滴加完成后,升温至80℃继续搅拌2h;
(3)将步骤(2)所得产物转移至烘箱,90℃下陈化24h,得到前驱体;
(4)将步骤(3)所得前驱体置于马弗炉中,在320℃下热处理2h,得到钴酸镍纳米立方体材料。
将所得NiCo2O4材料作为锂离子电池负极材料进行电化学性能测试,极片配比为NiCo2O4材料:乙炔黑:PVDF=75:15:10。以锂片为参比电极,制备CR2016型纽扣电池。在0.01-3.0V电压窗口,100mA/g电流密度下,首次循环放电比容量和充电比容量分别为1300mAh/g和1100mAh/g。
实施例3:
(1)将硝酸镍和硝酸钴按照摩尔比1:2溶解于去离子水中,搅拌均匀,制成金属离子总浓度为6mol/L溶液A;将氢氧化钾溶解于去离子水中,搅拌均匀,制成氢氧根离子浓度为8mol/L碱性溶液B;
(2)将1000mL溶液A转移至反应釜中,在80℃搅拌条件下,将250mL碱性溶液B逐滴滴入反应釜,滴加的时间为50min,滴加完成后,升温至140℃继续搅拌20h;
(3)将步骤(2)所得产物转移至烘箱,在140℃下陈化48h,得到前驱体;
(4)将步骤(3)所得前驱体置于马弗炉中,在400℃下热处理2h,得到钴酸镍纳米立方体材料。
将所得NiCo2O4材料作为锂离子电池负极材料进行电化学性能测试,极片配比为NiCo2O4材料:乙炔黑:PVDF=80:10:10。以锂片为参比电极,制备CR2016型纽扣电池。在0.01-3.0V电压窗口,100mA/g电流密度下,首次循环放电比容量和充电比容量分别为1000mAh/g和850mAh/g。
实施例4:
(1)将硝酸镍和氯化钴按照摩尔比1:2溶解于去离子水中,搅拌均匀,制成金属离子总浓度为1mol/L的溶液A;将氢氧化钡溶解于去离子水中,搅拌均匀,制成氢氧根离子浓度为4mol/L的碱性溶液B;
(2)将1000mL溶液A转移至反应釜中,在80℃搅拌条件下,将50mL碱性溶液B逐滴滴入反应釜,滴加的时间为20min,滴加完成后,升温至120℃继续搅拌20h;
(3)将步骤(2)所得产物转移至烘箱,在120℃下陈化14h,得到前驱体;
(4)将步骤(3)所得前驱体置于马弗炉中,在350℃下热处理4h,得到钴酸镍纳米立方体材料。
将所得NiCo2O4材料作为锂离子电池负极材料进行电化学性能测试,极片配比为NiCo2O4材料:乙炔黑:PVDF=80:15:5。以锂片为参比电极,制备CR2016型纽扣电池。在0.01-3.0V电压窗口,100mA/g电流密度下,首次循环放电比容量和充电比容量分别为900mAh/g和800mAh/g。
实施例5:
(1)将硝酸镍和氯化钴按照摩尔比1:2溶解于去离子水中,搅拌均匀,制成金属离子总浓度为4.5mol/L的溶液A;将氨水和氢氧化钠溶解于去离子水中,搅拌均匀,制成氢氧根离子浓度为3mol/L的碱性溶液B;
(2)将1000mL溶液A转移至反应釜中,在70℃搅拌条件下,将150mL碱性溶液B逐滴滴入反应釜,滴加的时间为30min,滴加完成后,升温至80℃继续搅拌4h;
(3)将步骤(2)所得产物转移至烘箱,在100℃下陈化6h;
(4)将步骤(3)所得前驱体置于马弗炉中,在600℃下热处理0.5h,得到钴酸镍纳米立方体材料。
将所得NiCo2O4材料作为锂离子电池负极材料进行电化学性能测试,极片配比为NiCo2O4材料:乙炔黑:PVDF=70:20:10。以锂片为参比电极,制备CR2016型纽扣电池。在0.01-3.0V电压窗口,100mA/g电流密度下,首次循环放电比容量和充电比容量分别为1050mAh/g和900mAh/g。
对比例1
与实施例1相比,除了将步骤(1)中“将氯化镍和氯化钴按照摩尔比1:2溶解于去离子水中”替换为“将氯化镍和氯化钴按照摩尔比1:2溶解于乙二醇中”外,其他部分与实施例1均相同。即将溶剂由水变为乙二醇。
热处理后得不到颗粒大小均匀的立方体形钴酸镍材料。
对比例2
与实施例1相比,除了将步骤(2)中“将1000mL溶液A转移至反应釜中,在75℃搅拌条件下,将500mL碱性溶液B逐滴滴入反应釜”替换为“将500mL碱性溶液B转移至反应釜中,在75℃搅拌条件下,将1000mL溶液A逐滴滴入反应釜”外,其他部分与实施例1均相同。即更换溶液A和碱性溶液B的滴加顺序。
热处理后得不到颗粒大小均匀的立方体形钴酸镍材料。
对比例3
与实施例1相比,除了将步骤(3)去掉外,其他部分与实施例1均相同。即去掉陈化的步骤,直接将步骤(2)得到的产物进行热处理。
热处理后得不到颗粒大小均匀的立方体形钴酸镍材料。
以上详细描述了本发明的优选实施方式,但是,本发明并不限于上述实施方式中的具体细节,在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,这些简单变型均属于本发明的保护范围。
另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合,为了避免不必要的重复,本发明对各种可能的组合方式不再另行说明。
此外,本发明的各种不同的实施方式之间也可以进行任意组合,只要其不违背本发明的思想,其同样应当视为本发明所公开的内容。
- 还没有人留言评论。精彩留言会获得点赞!