一种具有表面增强拉曼散射功能的复合纳米材料及其制备方法与流程
本发明涉及医药技术领域,具体地涉及一种具有表面增强拉曼散射功能的复合纳米材料及其制备方法,使用所述复合纳米材料在较低的待检测癌细胞浓度下仍可实现高灵敏的检测。
背景技术:
肿瘤的早期诊断及预后是挽救患者生命的关键,然而,恶性肿瘤早期时缺乏明显症状,发现时多数已属中晚期。正如弗吉尼亚大学放射系主任NCI临床试验合作团队ACRIN创始者Bruce J.Hillman教授所说,传统的临床影像学诊断方法(如MRI、CT、PET等)很难实现有效的肿瘤早期诊断[N.Engl.J.Med.,2010,363,4-6]。若能在癌症早期检测到循环肿瘤细胞(CTCs),就可以在转移灶出现前采取手术治疗,从而大大提高患者的存活率。CTCs的检测及评估有助于理解肿瘤转移机制,并指导肿瘤治疗,从而为推断预后提供可靠参考,此外,还有助于判断治疗效果以及监测肿瘤的转移或复发,因此是一种具有高度可行性且高信息含量的新型诊断手段。
拉曼光谱作为表征分子振动能级的指纹光谱,在物理学、化学、生物学以及材料科学等领域一直扮演着重要的角色。表面增强拉曼散射(SERS)的发现可大大提高基底与分子间的能量转移,避免了荧光背景的干扰,使拉曼散射光谱检测的精度产生飞跃。SERS的超高灵敏度检测为生命科学及单分子研究提供了一种很好的手段。由于在肿瘤早期时人体外周血中的CTC浓度很低,具有超高灵敏度的SERS技术是检测CTC的最佳手段之一。
现有的用于检测CTC的具有表面增强拉曼散射功能的纳米材料普遍存在检测灵敏度低且要求待检液具有较高的待检癌细胞浓度,这无疑在一定程度上限制了肿瘤的早期发现和预后。
综上所述,本领域急需开发一种新型的具有更高检测灵敏度的用于检测CTC的具有表面增强拉曼散射功能的复合纳米材料。
技术实现要素:
本发明的目的在于提供一种新型的具有更高检测灵敏度的用于检测CTC的具有表面增强拉曼散射功能的复合纳米材料。
本发明的第一方面,提供了一种复合纳米材料,所述复合纳米材料包括:
作为核心的贵金属纳米粒子,所述贵金属纳米粒子表面固定(或吸附)拉曼信号分子;
高分子,所述高分子具有多个与所述贵金属纳米粒子进行结合的结合官能团,并且所述高分子通过多个所述结合官能团结合于所述贵金属纳米粒子;和
位于外层的靶分子,所述靶分子偶联于所述高分子。
在另一优选例中,所述靶分子为能与癌细胞表面抗原或受体发生特异性相互作用的抗体或配体。
在另一优选例中,所述的结合官能团(binding functional group)选自下组:巯基、氨基、或其组合。
在另一优选例中,所述的高分子构成介于贵金属纳米粒子和所述靶分子之间的中间层。
在另一优选例中,所述的复合纳米材料具有以下层结构:
作为核心的吸附有拉曼信号分子的贵金属纳米粒子;
作为中间层的高分子层;和
作为外层的靶分子层。
在另一优选例中,所述的高分子具有选自下组的多个结合官能团:巯基、氨基、羧基、羟基、或其组合。
在另一优选例中,所述高分子“平躺式”地与所述贵金属纳米粒子结合。
在另一优选例中,所述“平躺式”指所述高分子中的每个分子均通过多个结合官能团与所述贵金属纳米粒子在n个位置发生连接,其中n为≥3的正整数,较佳地n≥5个,较佳地≥10个,更佳地≥20个或≥50个。
在另一优选例中,所述高分子的分子量≥1000道尔顿,较佳地≥5000道尔顿,更佳地≥10000道尔顿。
在另一优选例中,所述的高分子的分子量通常≤1000000道尔顿,较佳地≤100000道尔顿。
在另一优选例中,所述贵金属纳米粒子选自下组:金、银、铂、或其组合; 和/或
所述贵金属纳米粒子的形状选自下组:球形、棒形、星形、三角片、立方体、三角锥、或其组合。
在另一优选例中,所述贵金属纳米粒子选自下组:金纳米球、金纳米立方体、金纳米星、金纳米棒、银纳米球、银纳米三角片、铂纳米球、铂纳米片、金包银纳米球、金包银纳米星、银包金纳米球、或其组合。
在另一优选例中,所述贵金属纳米粒子的粒径为10-1000nm,较佳地为10-200nm,更佳地为10-100nm,最佳地为10-80nm。
在另一优选例中,所述“固定(或吸附)”为化学键合和/或物理吸附。
在另一优选例中,所述拉曼信号分子的含量或密度为:50-200μM,较佳地为80-150μM,更佳地为100-125μM。
在另一优选例中,所述拉曼信号分子为在拉曼光谱中具有明显共轭振动的有机分子。
在另一优选例中,所述有机分子选自下组:4-巯基苯甲酸、巯基吡啶、4-巯基苯胺、巯基萘、对氟硫酚、罗丹明、结晶紫、耐尔蓝、或其组合。
在另一优选例中,所述高分子为线性高分子,且所述高分子的各分子链通过多个“金属-S键”和/或“金属-N键”与所述贵金属纳米粒子化学键合。
在另一优选例中,所述的高分子包括带有巯基的多肽。
在另一优选例中,所述的多肽的长度≥20个氨基酸,较佳地≥50个氨基酸;≥100个氨基酸,如50-2000个氨基酸,较佳地100-1000个氨基酸。
在另一优选例中,所述的高分子包括还原型BSA蛋白。
在另一优选例中,所述的高分子为具有巯基和/或氨基的聚合物(包括直链和支链的聚合物)。
在另一优选例中,所述高分子的各分子链基本平铺于所述贵金属纳米粒子表面,和/或所述高分子的各分子链基本平行于所述贵金属纳米粒子的表面。
在另一优选例中,所述高分子在所述贵金属纳米粒子表面的覆盖率为≥50%,较佳地≥70%,更佳地≥80%,最佳地≥90%或100%。
在另一优选例中,所述高分子选自下组:寡肽、多肽、蛋白质、多糖、聚醚类改性化合物、聚酯类改性化合物、或其组合。
在另一优选例中,所述改性化合物具有选自下组的基团:氨基、羧基、羟基、或其组合。
在另一优选例中,所述高分子选自下组:聚谷氨酸、聚天门冬氨酸、含谷氨酸化合物、含天门冬氨酸化合物、聚赖氨酸、聚精氨酸、含赖氨酸化合物、含精氨酸化合物、或其组合。
在另一优选例中,所述多糖选自下组:壳聚糖、葡聚糖、甲壳素、纤维素、淀粉、琼脂、或其组合。
在另一优选例中,所述靶分子通过选自下组的基团与所述高分子偶联:氨基、羧基、羟基、或其组合。
在另一优选例中,所述的靶分子为多肽类物质、或非多肽类物质(如叶酸)。
在另一优选例中,所述靶分子选自下组:单克隆抗体、叶酸、半乳糖胺、或其组合。
在另一优选例中,所述单克隆抗体选自下组:EPCAM抗体、CD44抗体、或其组合。
在另一优选例中,所述靶分子通过酰胺键与所述高分子共价键合。
在另一优选例中,所述复合纳米材料的粒径为10-1100nm。
在另一优选例中,所述复合纳米材料的粒径为20-1000nm,较佳地为30-300nm,更佳地为50-200nm。
在另一优选例中,所述复合纳米材料的形状选自下组:球形、棒形、星形、三角片、立方体、三角锥、或其组合。
在另一优选例中,所述贵金属纳米粒子、拉曼信号分子、高分子、靶分子的质量比为60-100:5-30:1-50:1-20,较佳地为70-90:5-20:1-40:1-15,更佳地为80-90:5-25:1-20:1-10。
在本发明的第二方面,提供了一种组合物,所述组合物包括:
本发明第一方面所述的复合纳米材料;和
装载于所述复合纳米材料中的抗肿瘤药物和/或医学造影剂。
在本发明的第三方面,提供了一种检测癌细胞的方法,所述方法包括步骤:
用本发明第一方面所述的复合纳米材料与样品混合,从而使得所述的复合纳米材料与待检测的癌细胞形成复合物;
通过检测所述复合物的拉曼信号,确定所述癌细胞的存在与否和/或数量。
在另一优选例中,所述样品选自下组:血液、培养液、腹腔水。
在另一优选例中,所述癌细胞选自下组:循环肿瘤细胞、循环肿瘤栓、转移灶、或其组合。
在另一优选例中,所述方法为非治疗性的、非诊断性的。
在另一优选例中,所述方法具有选自下组的一个或多个特征:
i)当待检癌细胞为循环肿瘤细胞时,其检测灵敏度为1-500个/mL,较佳地为3-50个/mL;
ii)当待检癌细胞为循环肿瘤细胞时,待检液中循环肿瘤细胞的含量最低为1个/mL,较佳地为3个/mL,更佳地为5个/mL;
iii)当待检癌细胞为循环肿瘤细胞时,待检液中循环肿瘤细胞的含量最低为10个/2.3×106个细胞(如HepG2细胞)。
在本发明的第四方面,提供了一种本发明第一方面所述的复合纳米材料的制备方法,所述方法包括如下步骤:
1)提供第一混合液、第二溶液、第三混合液和第四溶液,其中,
所述第一混合液含有第一溶剂和所述贵金属纳米粒子;
所述第二溶液含有第二溶剂和溶于第二溶剂中的所述拉曼信号分子;
所述第三混合液含有第三溶剂和所述高分子,且所述高分子具有多个与所述贵金属纳米粒子进行结合的结合官能团;
所述第四溶液含有第四溶剂和所述的靶分子;
2)将所述第二溶液加入所述第一溶液中进行反应;
3)将所述第三混合液加入步骤2)所得产物中进行反应;
4)在催化剂作用下,将所述第四溶液加入步骤3)所得产物中进行反应,得到本发明第一方面所述的复合纳米材料。
在另一优选例中,所述贵金属纳米粒子是如下制备的:
a-1)加热贵金属化合物的水溶液至沸腾,然后加入还原剂的水溶液进行反应,得到所述贵金属纳米粒子。
在另一优选例中,在步骤a-1)之前还包括如下步骤:先将所述还原剂的水溶液加入所述贵金属化合物的水溶液中后再进行加热,得到所述贵金属纳米粒子。
在另一优选例中,所述贵金属化合物选自下组:氯金酸、氯化金、氯化亚金、氯金酸钾、氯金酸钠、硝酸银、醋酸银、三氟乙酸银、三氟甲烷磺酸银、六氟锑酸银、四氟硼酸银、或其组合。
在另一优选例中,所述还原剂选自下组:柠檬酸三钠、硼氢化钠、柠檬酸、柠檬酸三钠、草酸钠、没食子酸、抗坏血酸、水合肼、葡萄糖酸钠、葡聚糖、过氧化氢、或其组合。
在另一优选例中,在步骤a-1)之后还包括如下步骤:
a-2)提供生长液,所述生长液含有贵金属化合物和还原剂;
a-3)将步骤a-1)所得产物加入步骤a-2)所述生长液中,制得所述贵金属纳米粒子。
在另一优选例中,步骤a-2)所述生长液还包含保护剂。
在另一优选例中,在步骤a-1)之后还任选地包括如下步骤:避光处理步骤a-1)所得产物。
在另一优选例中,所述保护剂选自下组:十六烷基三甲基溴化铵(Hexadecyl trimethyl ammonium Bromide,CTAB)、聚乙烯吡咯烷酮(PVP)、柠檬酸、柠檬酸三钠、吐温、十二烷基硫酸钠(SDS)、或其组合。
在另一优选例中,所述高分子和/或靶分子经活化剂活化。
在另一优选例中,所述活化剂选自下组:EDAC、NHS(N-羟基丁二酰亚胺)、EDC、或其组合。
在另一优选例中,所述贵金属纳米粒子、高分子的质量比为60-100:1-50。
在另一优选例中,所述第一混合液中所述贵金属纳米粒子的浓度为0.070-0.200mg/mL。
在另一优选例中,所述第二溶液中所述拉曼信号分子的浓度为0.001-0.04mg/mL。
在另一优选例中,所述第三混合液中所述高分子的浓度为0.001-0.09mg/mL。
在另一优选例中,所述第四溶液中所述的靶分子的浓度为0.001-0.02mg/mL。
在另一优选例中,所述第一溶剂、第二溶剂、第三溶剂和第四溶剂可相同或不同,分别选自下组:水、四氢呋喃、乙醇、己烷、或其组合。
在本发明的第五方面,提供了一种本发明第一方面所述复合纳米材料的用途,用于制备检测靶细胞(如癌细胞)的试剂或药剂。
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
图1是本发明复合纳米材料的制备过程示意图,其中代表贵金属纳米粒子、代表具有苯环结构的拉曼信号分子、代表具有多氨基或巯基的高分子、代表与肿瘤细胞有特异性相互作用的靶分子。
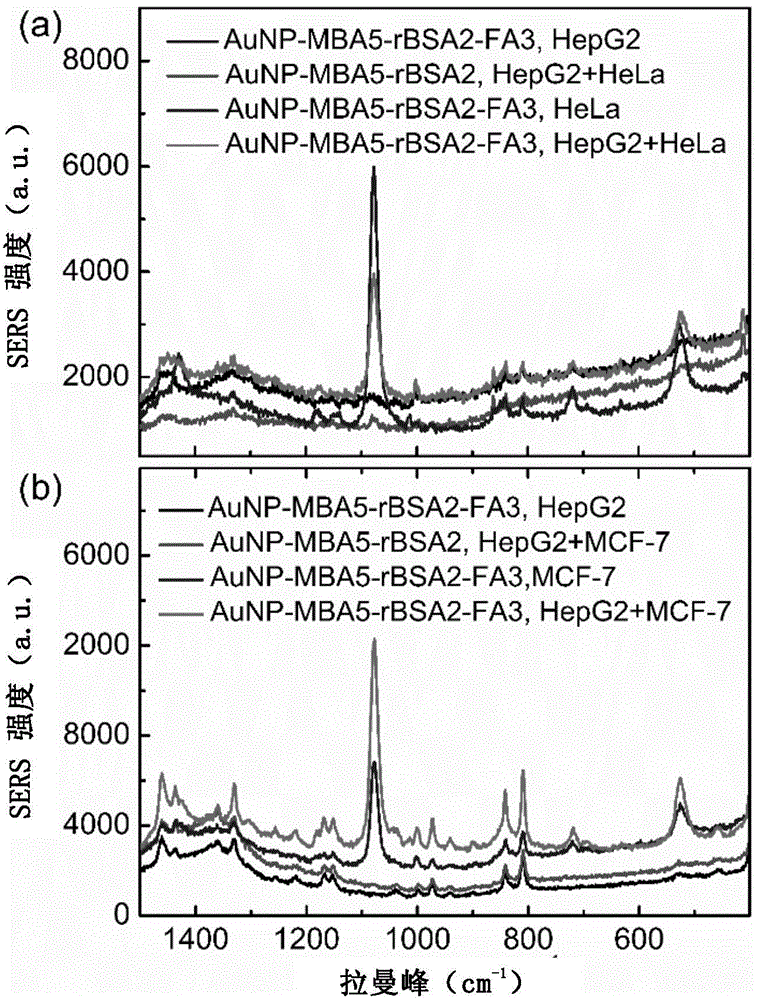
图2是本发明实施例41中所述复合纳米材料检测癌细胞的选择性初步验证结果,(a)为所述复合纳米材料对HeLa细胞的选择性检测结果,(b)为所述复合纳米材料对MCF-7细胞的选择性检测结果。
图3是本发明实施例41中所述复合纳米材料检测癌细胞的灵敏度初步验证结果,其中(a)和(b)为所述复合纳米材料对HeLa细胞的灵敏度检测结果,(c)为所述复合纳米材料对MCF-7细胞的灵敏度检测结果。
图4是本发明实施例42中所述复合纳米粒子在兔血中对癌细胞的检测灵敏度结果,其中(a)和(b)为所述复合纳米材料对HeLa细胞的灵敏度检测结果,(c)为MCF-7细胞个数和1076cm-1处的拉曼信号强度线性关系图。
图5是本发明实施例42中所述复合纳米粒子在兔血中检测癌细胞时在检测限为5个/ml的选择性结果。
具体实施方式
本发明人经过长期而深入的研究,首次意外地制得了一种具有新型结构和高检测灵敏度的用于检测CTC的具有表面增强拉曼散射功能的复合纳米材料。具体地,本发明人通过采用线性高分子与贵金属纳米粒子“平躺式”结合的连接方式,可极大地减薄位于所述贵金属纳米粒子表面的高分子层的厚度,进而显著地提高所述复合纳米材料对待检测癌细胞的检测灵敏度。基于上述发现,发明人完成了本发明。
复合纳米材料
本发明提供了一种复合纳米材料,所述复合纳米材料包括:
作为核心的贵金属纳米粒子,所述贵金属纳米粒子表面固定(或吸附)拉曼信号分子;
高分子,所述高分子具有多个与所述贵金属纳米粒子进行结合的结合官能团,并且所述高分子通过多个所述结合官能团结合于所述贵金属纳米粒子;和
位于外层的靶分子,所述靶分子偶联于所述高分子。
在本发明中,所述拉曼信号分子、高分子、靶分子的分子量没有特别限制,可根据需要适当调整。
在另一优选例中,所述靶分子为能与癌细胞表面抗原或受体发生特异性相互作用的抗体或配体。
代表性地,所述的结合官能团(binding functional group)包括(但并不限于):巯基、氨基、或其组合。
在另一优选例中,所述的高分子构成介于贵金属纳米粒子和所述靶分子之间的中间层。
在另一优选例中,所述的复合纳米材料具有以下层结构:
作为核心的吸附有拉曼信号分子的贵金属纳米粒子;
作为中间层的高分子层;和
作为外层的靶分子层。
代表性地,所述的高分子具有包括(但并不限于)的多个结合官能团:巯基、氨基、羧基、羟基、或其组合。
在另一优选例中,所述高分子“平躺式”地与所述贵金属纳米粒子结合。
在另一优选例中,所述“平躺式”指所述高分子中的每个分子均通过多个结合官能团与所述贵金属纳米粒子在n个位置发生连接,其中n为≥3的正整数,较佳地n≥5个,较佳地≥10个,更佳地≥20个或≥50个。
在另一优选例中,所述高分子的分子量≥1000道尔顿,较佳地≥5000道尔顿,更佳地≥10000道尔顿。
在另一优选例中,所述的高分子的分子量通常≤1000000道尔顿,较佳地≤100000道尔顿。
在本发明中,所述贵金属纳米粒子的种类、形状和粒径没有特别限制。
贵金属纳米粒子对拉曼信号有显著的增强作用,一般可达到103-106倍,并且在<1.0μm时,拉曼信号很强。
代表性地,所述贵金属纳米粒子包括(但并不限于):金、银、铂、或其组 合;和/或
所述贵金属纳米粒子的形状包括(但并不限于):球形、棒形、星形、三角片、立方体、三角锥、或其组合。
代表性地,所述贵金属纳米粒子包括(但并不限于):金纳米球、金纳米立方体、金纳米星、金纳米棒、银纳米球、银纳米三角片、铂纳米球、铂纳米片、金包银纳米球、金包银纳米星、银包金纳米球、或其组合。
在另一优选例中,所述贵金属纳米粒子的粒径为10-1000nm,较佳地为10-200nm,更佳地为10-100nm,最佳地为10-80nm。
在另一优选例中,所述“固定”为化学键合和/或物理吸附。
在另一优选例中,所述拉曼信号分子的含量或密度为:50-200μM,较佳地为80-150μM,更佳地为100-125μM。
在另一优选例中,所述拉曼信号分子为在拉曼光谱中具有明显共轭振动的有机分子。
代表性地,所述有机分子包括(但并不限于):4-巯基苯甲酸、巯基吡啶、4-巯基苯胺、巯基萘、对氟硫酚、罗丹明、结晶紫、耐尔蓝、或其组合。
在本发明中,所述高分子为线性高分子,且所述高分子的各分子链通过多个“金属-S键”和/或“金属-N键”与所述贵金属纳米粒子化学键合。
在另一优选例中,所述的高分子包括带有巯基的多肽。
在另一优选例中,所述的多肽的长度≥20个氨基酸,较佳地≥50个氨基酸;≥100个氨基酸,如50-2000个氨基酸,较佳地100-1000个氨基酸。
在另一优选例中,所述的高分子包括还原型BSA蛋白。
在另一优选例中,所述的高分子为具有巯基和/或氨基的聚合物(包括直链和支链的聚合物)。
在另一优选例中,所述高分子的各分子链基本平铺于所述贵金属纳米粒子表面,和/或所述高分子的各分子链基本平行于所述贵金属纳米粒子的表面。
在另一优选例中,所述高分子在所述贵金属纳米粒子表面的覆盖率为≥50%,较佳地≥70%,更佳地≥80%,最佳地≥90%或100%。
代表性地,所述高分子包括(但并不限于):寡肽、多肽、蛋白质、多糖、聚醚类改性化合物、聚酯类改性化合物、或其组合。
代表性地,所述改性化合物具有包括(但并不限于)的基团:氨基、羧基、羟基、或其组合。
代表性地,所述高分子包括(但并不限于):聚谷氨酸、聚天门冬氨酸、含谷氨酸化合物、含天门冬氨酸化合物、聚赖氨酸、聚精氨酸、含赖氨酸化合物、含精氨酸化合物、或其组合。
代表性地,所述多糖包括(但并不限于):壳聚糖、葡聚糖、甲壳素、纤维素、淀粉、琼脂、或其组合。
在本发明中,所述靶分子通过包括(但并不限于)下组的基团与所述高分子偶联:氨基、羧基、羟基、或其组合。
代表性地,所述的靶分子为多肽类物质、或非多肽类物质(如叶酸)。
代表性地,所述靶分子包括(但并不限于):单克隆抗体、叶酸、半乳糖胺、或其组合。
典型地,所述单克隆抗体包括(但并不限于):EPCAM抗体、CD44抗体、或其组合。
在另一优选例中,所述靶分子通过酰胺键与所述高分子共价键合。
在本发明中,所述复合纳米材料的粒径为10-1100nm。
在另一优选例中,所述复合纳米材料的粒径为20-1000nm,较佳地为30-300nm,更佳地为50-200nm。
在另一优选例中,所述复合纳米材料的形状包括(但并不限于):球形、棒形、星形、三角片、立方体、三角锥、或其组合。
在另一优选例中,所述贵金属纳米粒子、拉曼信号分子、高分子、靶分子的质量比为60-100:5-30:1-50:1-20,较佳地为70-90:5-20:1-40:1-15,更佳地为80-90:5-25:1-20:1-10。
组合物
本发明还提供了一种组合物,所述组合物包括:
所述的复合纳米材料;和
装载于所述复合纳米材料中的抗肿瘤药物和/或医学造影剂。
检测方法
本发明还提供了一种检测癌细胞的方法,所述方法包括步骤:
用所述的复合纳米材料与样品混合,从而使得所述的复合纳米材料与待检测的癌细胞形成复合物;
通过检测所述复合物的拉曼信号,确定所述癌细胞的存在与否和/或数量。
代表性地,所述样品包括(但并不限于):血液、培养液、腹腔水。
代表性地,所述癌细胞包括(但并不限于):循环肿瘤细胞、循环肿瘤栓、转移灶、或其组合。
在另一优选例中,所述方法为非治疗性的、非诊断性的。
在本发明中,所述方法具有选自下组的一个或多个特征:
i)当待检癌细胞为循环肿瘤细胞时,其检测灵敏度为1-500个/mL,较佳地为3-50个/mL;
ii)当待检癌细胞为循环肿瘤细胞时,待检液中循环肿瘤细胞的含量最低为1个/mL,较佳地为3个/mL,更佳地为5个/mL;
iii)当待检癌细胞为循环肿瘤细胞时,待检液中循环肿瘤细胞的含量最低为10个/2.3×106个细胞(如HepG2细胞)。
制备方法
本发明还提供了一种所述的复合纳米材料的制备方法,所述方法包括如下步骤:
1)提供第一混合液、第二溶液、第三混合液和第四溶液,其中,
所述第一混合液含有第一溶剂和所述贵金属纳米粒子;
所述第二溶液含有第二溶剂和溶于第二溶剂中的所述拉曼信号分子;
所述第三混合液含有第三溶剂和所述高分子,且所述高分子具有多个与所述贵金属纳米粒子进行结合的结合官能团;
所述第四溶液含有第四溶剂和所述的靶分子;
2)将所述第二溶液加入所述第一溶液中进行反应;
3)将所述第三混合液加入步骤2)所得产物中进行反应;
4)在催化剂作用下,将所述第四溶液加入步骤3)所得产物中进行反应,得到所述的复合纳米材料。
在另一优选例中,所述贵金属纳米粒子是如下制备的:
a-1)加热贵金属化合物的水溶液至沸腾,然后加入还原剂的水溶液进行反应,得到所述贵金属纳米粒子。
在另一优选例中,在步骤a-1)之前还包括如下步骤:先将所述还原剂的水溶液加入所述贵金属化合物的水溶液中后再进行加热,得到所述贵金属纳米粒子。
代表性地,所述贵金属化合物包括(但并不限于):氯金酸、氯化金、氯化亚金、氯金酸钾、氯金酸钠、硝酸银、醋酸银、三氟乙酸银、三氟甲烷磺酸银、六氟锑酸银、四氟硼酸银、或其组合。
代表性地,所述还原剂包括(但并不限于):柠檬酸三钠、硼氢化钠、柠檬酸、柠檬酸三钠、草酸钠、没食子酸、抗坏血酸、水合肼、葡萄糖酸钠、葡聚糖、过氧化氢、或其组合。
在另一优选例中,在步骤a-1)之后还包括如下步骤:
a-2)提供生长液,所述生长液含有贵金属化合物和还原剂;
a-3)将步骤a-1)所得产物加入步骤a-2)所述生长液中,制得所述贵金属纳米粒子。
在另一优选例中,步骤a-2)所述生长液还包含保护剂。
在另一优选例中,在步骤a-1)之后还任选地包括如下步骤:避光处理步骤a-1)所得产物。
代表性地,所述保护剂包括(但并不限于):十六烷基三甲基溴化铵(Hexadecyl trimethyl ammonium Bromide,CTAB)、聚乙烯吡咯烷酮(PVP)、柠檬酸、柠檬酸三钠、吐温、十二烷基硫酸钠(SDS)、或其组合。
在另一优选例中,所述高分子和/或靶分子经活化剂活化。
代表性地,所述活化剂包括(但并不限于):EDAC、NHS(N-羟基丁二酰亚胺)、EDC、或其组合。
在本发明中,所述贵金属纳米粒子、高分子的质量比为60-100:1-50。
在另一优选例中,所述第一混合液中所述贵金属纳米粒子的浓度为0.070-0.200mg/mL。
在另一优选例中,所述第二溶液中所述拉曼信号分子的浓度为0.001-0.04mg/mL。
在另一优选例中,所述第三混合液中所述高分子的浓度为0.001-0.09mg/mL。
在另一优选例中,所述第四溶液中所述的靶分子的浓度为0.001-0.02mg/mL。
在另一优选例中,所述第一溶剂、第二溶剂、第三溶剂和第四溶剂可相同或不同,分别选自下组:水、四氢呋喃、乙醇、己烷、或其组合。
与现有技术相比,本发明具有以下主要优点:
(1)所述复合纳米材料可在极低的待检癌细胞浓度下,仍可实现高灵敏性地检测癌细胞;
(2)所述复合纳米材料由于高分子层的包覆,可有效地避免与非癌细胞相互作用,且具有强度拉曼信号,高的检测灵敏度,即使在使用小分子靶分子(如叶酸)的情况下,也可获得非常高的检测灵敏度;
(3)所述复合纳米材料对癌细胞具有高的靶向性和/或选择性;
(4)所述制备方法简单、成本低、便于大面积推广。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。
除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明方法中。文中所述的较佳实施方法与材料仅作示范之用。
实施例1
(1)具有SERS功能的金纳米球(AuNPs)的制备
把10mL5mM氯金酸加入到30mL超纯水中,加热至沸,再加入10mL1%柠檬酸三钠,待反应溶液的颜色变为紫色,停止反应,自然冷却至室温,溶液变为酒红色,便制得AuNPs,4℃保存。
(2)连接有拉曼信号分子的金纳米球(AuNP-MBA)的制备
把4-巯基苯甲酸(4-MBA)溶在四氢呋喃溶剂中,配制浓度为50mM的4-巯基苯甲酸的四氢呋喃溶液。
取3mL(1)所述的金纳米球,加入到9mL超纯水中,混合均匀,再加入30.0μL4-巯基苯甲酸溶液,待反应一定时间后,便制得AuNP-MBA材料,4℃保存。
(3)含有二硫键的高分子牛血清白蛋白(BSA)的还原及包裹有高分子的金纳米球(AuNP-MBA-BSA)的制备
配制1mg/mL的BSA水溶液,取10mL1mg/mLBSA,向其中加入65μL0.1M硼 氢化钠水溶液,室温反应1h,再70℃水浴至无气泡产生,将制备的还原牛血清白蛋白(rBSA)稀释至0.5mg/mL,4℃保存。
取120μL0.5mg/mLrBSA加入到12mLAuNP-MBA溶液中,待反应一定时间后,制得AuNP-MBA-rBSA材料,4℃保存。
(4)还原BSA表面配体叶酸(FA)的偶联
在EDAC(1-乙基-(3-二甲基氨基丙基)碳二亚胺)的催化下,利用叶酸的羧基与还原BSA表面的氨基之间的化学反应,在还原BSA表面偶联能够特异性靶向作用于脑癌、肾癌、乳癌、肺癌、卵巢癌、子宫癌、鼻咽癌等组织的配体叶酸。
活化叶酸具体制备方法简述如下:取40mg/mL叶酸(90.4μmol-COOH),32.0mgEDC(83.2μmol),19.2mgNHS(83.2μmol),溶于磷酸缓冲液(PBS)中,避光反应8h。
取0.2mL活化叶酸和1.8mLPBS混合均匀,加入到12mLAuNP-MBA-rBSA中,反应16h,在使用超滤离心管(MWCO3.0kDa)浓缩离心,将14mLAuNP-MBA-rBSA-FA浓缩至2mL,即可获得表面偶联有配体叶酸的AuNP-MBA-rBSA-FA复合纳米材料。
实施例2
(1)具有SERS功能的金纳米棒(AuNRPs)的制备
第一步,金种的制备,7.5mLCTAB和0.5mL5mM氯金酸混合均匀,再快速加入0.6mL0.01M硼氢化钠,待溶液变为棕色,即可值得金种,4℃保存。
第二步,生长液制备,100mL0.1MCTAB和0.1mL20mM硝酸银混合,加入12mL5mM氯金酸搅拌均匀,再加入0.48mL抗坏血酸水溶液,待溶液变为无色后,加入0.2mL金种,避光反应,待颜色变为深蓝色,便可制得具有SERS功能的金纳米棒(AuNRPs)。
(2)在纳米粒子表面连接拉曼信号分子、生物分子的二硫键的还原、在纳米粒子表面包裹还原生物高分子、还原生物高分子表面配体叶酸的偶联与实施例1相同,即可制备一种具有SERS功能可用于检测血液中循环肿瘤细胞的金纳米棒复合材料。
实施例3
(1)具有SERS功能的金纳米星(AuNS)的制备
第一步,金种的制备,把3mL5mM氯金酸加入到45mL超纯水中,加热至沸,再快速加入2.5mL1%柠檬酸三钠,待颜色变为紫色时停止反应,自然冷却至室温,液体颜色变为酒红色,4℃保存。第二步,生长液制备,1.0mL0.1MCTAB、2.75mL5mM氯金酸加入到45mL超纯水中,再加入50μL50mM硝酸银溶液,而后加入0.565mL10mg/mL抗坏血酸,待液体颜色变为无色时,加入50μL金种,待颜色变为深蓝色,便可制得具有SERS功能的金纳米棒(AuNS)。
(2)在纳米粒子表面连接拉曼信号分子、生物分子的二硫键的还原、在纳米粒子表面包裹还原生物高分子、还原生物高分子表面配体叶酸的偶联与实施例1相同,即可制备一种具有SERS功能可用于检测血液中循环肿瘤细胞的金纳米星复合材料。
实施例4
(1)具有SERS功能的银纳米球(AgNPs)的制备
把1mL20mM硝酸银加入到97mL超纯水中,再加入1mL保护剂(30mM柠檬酸三钠),再加入1mL0.1M硼氢化钠,待反应一定时间后,便可制得颜色为黄色的银纳米球(AgNPs)。
(2)在纳米粒子表面连接拉曼信号分子、生物分子的二硫键的还原、在纳米粒子表面包裹还原生物高分子、还原生物高分子表面配体叶酸的偶联与实施例1相同,即可制备一种具有SERS功能可用于检测血液中循环肿瘤细胞的银纳米球复合材料。
实施例5
(1)具有SERS功能的银纳米三角片(AgNRPs)的制备
把6mL30mM柠檬酸三钠、6mL0.7mM聚乙烯吡咯烷酮加入到99.5mL超纯水中,搅拌混合,向其中加入0.5mL20mM硝酸银和0.24mL30%过氧化氢,搅拌均匀。快速加入1mL0.1M硼氢化钠,避光反应一定时间后,待颜色变为蓝色后,便可制得具有SERS功能的银纳米三角片(AgNRPs)。
(2)在纳米粒子表面连接拉曼信号分子、生物高分子的二硫键的还原、在纳米粒子表面包裹还原生物高分子、还原生物高分子表面配体叶酸的偶联与实施例1相同,即可制备一种具有SERS功能可用于检测血液中循环肿瘤细胞的银纳米三角片复合材料。
实施例6
将实施例1步骤(1)中具有SERS功能的金纳米球(AuNPs)的制备方法改为10mL5mM氯金酸加入到30mL超纯水中,再加入10mL1%柠檬酸三钠,加热至沸,待反应液的颜色变为紫色,停止反应,自然冷却至室温,溶液变为酒红色,便制得AuNPs,4℃保存。
在纳米粒子表面连接拉曼信号分子、生物高分子的二硫键的还原、在纳米粒子表面包裹还原生物高分子、还原生物高分子表面配体叶酸的偶联与实施例1相同,即可制备一种具有SERS功能可用于检测血液中循环肿瘤细胞的银纳米三角片复合材料。
实施例7
将实施例1步骤(1)中具有SERS功能的金纳米球(AuNPs)的还原剂改为柠檬酸,利用柠檬酸还原制备金纳米球(AuNPs),具体制备方法简述如下:把10mL5mM氯金酸加入到30mL超纯水中,加热至沸,再加入10mL1%柠檬酸,待反应溶液的颜色变为紫色,停止反应,自然冷却至室温,溶液变为酒红色,便制得AuNPs,4℃保存。
在纳米粒子表面连接拉曼信号分子、生物高分子的二硫键的还原、在纳米粒子表面包裹还原生物高分子、还原生物高分子表面配体叶酸的偶联与实施例1相同,即可制备一种具有SERS功能可用于检测血液中循环肿瘤细胞的银纳米三角片复合材料。
实施例8
将实施例6中具有SERS功能的金纳米球(AuNPs)的制备方法改为10mL5mM氯金酸加入到30mL超纯水中,再加入10mL1%柠檬酸,加热至沸,待反应液的颜色变为紫色,停止反应,自然冷却至室温,溶液变为酒红色,便制得AuNPs,4℃保存。
在纳米粒子表面连接拉曼信号分子、生物高分子的二硫键的还原、在纳米粒子表面包裹还原生物高分子、还原生物高分子表面配体叶酸的偶联与实施例1相同,即可制备一种具有SERS功能可用于检测血液中循环肿瘤细胞的银纳米三角片复合材料。
实施例9
将实施例1步骤(1)中具有SERS功能的金纳米球(AuNPs)的还原剂改为硼氢化钠,利用硼氢化钠还原制备金纳米球(AuNPs),具体制备方法简述如下:把8mL5mM氯金酸加入到89mL超纯水中,搅拌均匀,再加入2.4mL0.1M硼氢化钠,待反应溶液变为酒红色,便制得AuNPs,4℃保存。
在纳米粒子表面连接拉曼信号分子、生物高分子的二硫键的还原、在纳米粒子表面包裹还原生物高分子、还原生物高分子表面配体叶酸的偶联与实施例1相同,即可制备一种具有SERS功能可用于检测血液中循环肿瘤细胞的银纳米三角片复合材料。
实施例10
将实施例1步骤(1)中具有SERS功能的金纳米球(AuNPs)的还原剂改为抗坏血酸,利用抗坏血酸还原制备金纳米球(AuNPs),4℃保存。
在纳米粒子表面连接拉曼信号分子、生物高分子的二硫键的还原、在纳米粒子表面包裹还原生物高分子、还原生物高分子表面配体叶酸的偶联与实施例1相同,即可制备一种具有SERS功能可用于检测血液中循环肿瘤细胞的银纳米三角片复合材料。
实施例11
将实施例1步骤(1)中具有SERS功能的金纳米球(AuNPs)的还原剂改为没食子酸,利用没食子酸还原制备金纳米球(AuNPs),4℃保存。
在纳米粒子表面连接拉曼信号分子、生物高分子的二硫键的还原、在纳米粒子表面包裹还原生物高分子、还原生物高分子表面配体叶酸的偶联与实施例1相同,即可制备一种具有SERS功能可用于检测血液中循环肿瘤细胞的银纳米三角片复合材料。
实施例12
将实施例1步骤(1)中具有SERS功能的金纳米球(AuNPs)的还原剂改为草酸钠,利用草酸钠还原制备金纳米球(AuNPs),4℃保存。
在纳米粒子表面连接拉曼信号分子、生物高分子的二硫键的还原、在纳米 粒子表面包裹还原生物高分子、还原生物高分子表面配体叶酸的偶联与实施例1相同,即可制备一种具有SERS功能可用于检测血液中循环肿瘤细胞的银纳米三角片复合材料。
实施例13
将实施例1步骤(1)中具有SERS功能的金纳米球(AuNPs)的还原剂改为水合肼,利用水合肼还原制备金纳米球(AuNPs),4℃保存。
在纳米粒子表面连接拉曼信号分子、生物高分子的二硫键的还原、在纳米粒子表面包裹还原生物高分子、还原生物高分子表面配体叶酸的偶联与实施例1相同,即可制备一种具有SERS功能可用于检测血液中循环肿瘤细胞的银纳米三角片复合材料。
实施例14
将实施例1步骤(1)中具有SERS功能的金纳米球(AuNPs)的还原剂改为葡萄糖酸钠,利用葡萄糖酸钠还原制备金纳米球(AuNPs),4℃保存。
在纳米粒子表面连接拉曼信号分子、生物高分子的二硫键的还原、在纳米粒子表面包裹还原生物高分子、还原生物高分子表面配体叶酸的偶联与实施例1相同,即可制备一种具有SERS功能可用于检测血液中循环肿瘤细胞的银纳米三角片复合材料。
实施例15
将实施例1步骤(1)中具有SERS功能的金纳米球(AuNPs)的还原剂改为葡聚糖,利用葡聚糖还原制备金纳米球(AuNPs),4℃保存。
在纳米粒子表面连接拉曼信号分子、生物高分子的二硫键的还原、在纳米粒子表面包裹还原生物高分子、还原生物高分子表面配体叶酸的偶联与实施例1相同,即可制备一种具有SERS功能可用于检测血液中循环肿瘤细胞的银纳米三角片复合材料。
实施例16
将实施例3步骤(1)中具有SERS功能的金纳米星(AuNS)的制备方法改为无保护剂制备金纳米星(AuNS),具体制备方法简述如下:第一步,金种制备与实 施例3步骤(1)的金种制备方法相同。第二步,把1mL5mM氯金酸水溶液、10μL1M盐酸溶液、50μL金种加入到9mL超纯水中,加入100μL5mM硝酸银,再加入200μL10mg/mL抗坏血酸,待反应一定时间后,液体颜色变蓝,便可制得无保护剂金纳米星,4℃保存。
在纳米粒子表面连接拉曼信号分子、生物高分子的二硫键的还原、在纳米粒子表面包裹还原生物高分子、还原生物高分子表面配体叶酸的偶联与实施例1相同,即可制备一种具有SERS功能可用于检测血液中循环肿瘤细胞的银纳米三角片复合材料。
实施例17
将实施例4步骤(1)中具有SERS功能的银纳米球(AgNPs)的还原剂改为抗坏血酸,利用抗坏血酸还原制备银纳米球(AgNPs),4℃保存。
在纳米粒子表面连接拉曼信号分子、生物高分子的二硫键的还原、在纳米粒子表面包裹还原生物高分子、还原生物高分子表面配体叶酸的偶联与实施例1相同,即可制备一种具有SERS功能可用于检测血液中循环肿瘤细胞的银纳米三角片复合材料。
实施例18
将实施例4步骤(1)中具有SERS功能的银纳米球(AgNPs)的还原剂改为水合肼,利用水合肼还原制备银纳米球(AgNPs),4℃保存。
在纳米粒子表面连接拉曼信号分子、生物高分子的二硫键的还原、在纳米粒子表面包裹还原生物高分子、还原生物高分子表面配体叶酸的偶联与实施例1相同,即可制备一种具有SERS功能可用于检测血液中循环肿瘤细胞的银纳米三角片复合材料。
实施例19
将实施例1步骤(1)中的具有SERS功能的金纳米球(AuNPs)改为金@银纳米球,金@银纳米球也具有SERS功能。
在纳米粒子表面连接拉曼信号分子、生物高分子的二硫键的还原、在纳米粒子表面包裹还原生物高分子、还原生物高分子表面配体叶酸的偶联与实施例1相同,即可制备一种具有SERS功能可用于检测血液中循环肿瘤细胞的银纳米 三角片复合材料。
实施例20
将实施例1步骤(1)中的具有SERS功能的金纳米球(AuNPs)改为银@金纳米球,银@金纳米球也具有SERS功能。
在纳米粒子表面连接拉曼信号分子、生物高分子的二硫键的还原、在纳米粒子表面包裹还原生物高分子、还原生物高分子表面配体叶酸的偶联与实施例1相同,即可制备一种具有SERS功能可用于检测血液中循环肿瘤细胞的银纳米三角片复合材料。
实施例21
将实施例1步骤(4)中还原BSA表面偶联的靶分子改为半乳糖胺,在EDAC的催化下,利用半乳糖胺的氨基与白蛋白纳米球表面的羧基之间的化学反应,在还原BSA表面偶联能够特异性靶向作用于肝癌的配体半乳糖胺。具体制备方法简述如下:用PBS作溶剂配制500μg/mL的半乳糖胺溶液,将50mgEDAC溶于10mL半乳糖胺溶液(冰浴),然后取2mL活化半乳糖胺溶液加入到12mLAuNP-MBA-rBSA中,反应4-24h,即可获得表面偶联有配体半乳糖胺的AuNP-MBA-rBSA复合纳米材料。其他步骤与实施例1相同,即可制得一种基于SERS检测肝癌循环肿瘤细胞的纳米复合材料。
实施例22
将实施例2中还原BSA表面偶联的靶分子改为半乳糖胺,具体制备方法与实施例21相同,其他步骤与实施例2相同,即可制得一种基于SERS检测肝癌循环肿瘤细胞的纳米复合材料。
实施例23
将实施例3中还原BSA表面偶联的靶分子改为半乳糖胺,具体制备方法与实施例21相同,其他步骤与实施例3相同,即可制得一种基于SERS检测肝癌循环肿瘤细胞的纳米复合材料。
实施例24
将实施例4中还原BSA表面偶联的靶分子改为半乳糖胺,具体制备方法与实施例21相同,其他步骤与实施例4相同,即可制得一种基于SERS检测肝癌循环肿瘤细胞的纳米复合材料。
实施例25
将实施例5中还原BSA表面偶联的靶分子改为半乳糖胺,具体制备方法与实施例21相同,其他步骤与实施例5相同,即可制得一种基于SERS检测肝癌循环肿瘤细胞的纳米复合材料。
实施例26
将实施例6中还原BSA表面偶联的靶分子改为半乳糖胺,具体制备方法与实施例21相同,其他步骤与实施例6相同,即可制得一种基于SERS检测肝癌循环肿瘤细胞的纳米复合材料。
实施例27
将实施例7中还原BSA表面偶联的靶分子改为半乳糖胺,具体制备方法与实施例21相同,其他步骤与实施例7相同,即可制得一种基于SERS检测肝癌循环肿瘤细胞的纳米复合材料。
实施例28
将实施例8中还原BSA表面偶联的靶分子改为半乳糖胺,具体制备方法与实施例21相同,其他步骤与实施例8相同,即可制得一种基于SERS检测肝癌循环肿瘤细胞的纳米复合材料。
实施例29
将实施例9中还原BSA表面偶联的靶分子改为半乳糖胺,具体制备方法与实施例21相同,其他步骤与实施例9相同,即可制得一种基于SERS检测肝癌循环肿瘤细胞的纳米复合材料。
实施例30
将实施例10中还原BSA表面偶联的靶分子改为半乳糖胺,具体制备方法 与实施例21相同,其他步骤与实施例10相同,即可制得一种基于SERS检测肝癌循环肿瘤细胞的纳米复合材料。
实施例31
将实施例11中还原BSA表面偶联的靶分子改为半乳糖胺,具体制备方法与实施例21相同,其他步骤与实施例11相同,即可制得一种基于SERS检测肝癌循环肿瘤细胞的纳米复合材料。
实施例32
将实施例12中还原BSA表面偶联的靶分子改为半乳糖胺,具体制备方法与实施例21相同,其他步骤与实施例12相同,即可制得一种基于SERS检测肝癌循环肿瘤细胞的纳米复合材料。
实施例33
将实施例13中还原BSA表面偶联的靶分子改为半乳糖胺,具体制备方法与实施例21相同,其他步骤与实施例13相同,即可制得一种基于SERS检测肝癌循环肿瘤细胞的纳米复合材料。
实施例34
将实施例14中还原BSA表面偶联的靶分子改为半乳糖胺,具体制备方法与实施例21相同,其他步骤与实施例14相同,即可制得一种基于SERS检测肝癌循环肿瘤细胞的纳米复合材料。
实施例35
将实施例15中还原BSA表面偶联的靶分子改为半乳糖胺,具体制备方法与实施例21相同,其他步骤与实施例15相同,即可制得一种基于SERS检测肝癌循环肿瘤细胞的纳米复合材料。
实施例36
将实施例16中还原BSA表面偶联的靶分子改为半乳糖胺,具体制备方法与实施例21相同,其他步骤与实施例16相同,即可制得一种基于SERS检测 肝癌循环肿瘤细胞的纳米复合材料。
实施例37
将实施例17中还原BSA表面偶联的靶分子改为半乳糖胺,具体制备方法与实施例21相同,其他步骤与实施例17相同,即可制得一种基于SERS检测肝癌循环肿瘤细胞的纳米复合材料。
实施例38
将实施例18中还原BSA表面偶联的靶分子改为半乳糖胺,具体制备方法与实施例21相同,其他步骤与实施例18相同,即可制得一种基于SERS检测肝癌循环肿瘤细胞的纳米复合材料。
实施例39
将实施例19中还原BSA表面偶联的靶分子改为半乳糖胺,具体制备方法与实施例21相同,其他步骤与实施例19相同,即可制得一种基于SERS检测肝癌循环肿瘤细胞的纳米复合材料。
实施例40
将实施例20中还原BSA表面偶联的靶分子改为半乳糖胺,具体制备方法与实施例21相同,其他步骤与实施例20相同,即可制得一种基于SERS检测肝癌循环肿瘤细胞的纳米复合材料。
实施例41
(1)具有SERS功能的复合纳米粒子(AuNP-MBA-rBSA-FA)检测癌细胞的选择性初步验证
把105个人宫颈癌细胞(HeLa细胞)掺入2.3×106人肝癌细胞(HepG2细胞)中,溶在3mLDMEM培养液中,并加入实施例1制备的100μL具有SERS功能的复合纳米粒子(AuNP-MBA-rBSA-FA),在37℃恒温箱中培养30分钟,使用PBS离心洗涤3次(400×g,5.0min)。
而后利用拉曼光谱仪使用785nm激光器激发检测,在拉曼光谱图中的1076cm-1处有明显信号峰,而不含HeLa细胞或者AuNP-MBA-rBSA-FA的样品在 1076cm-1处没有明显信号峰,如图2(a)所示。
同样把105个人乳腺癌细胞(MCF-7细胞)掺入2.3×106人肝癌细胞(HepG2细胞)中,溶在3mLDMEM培养液中,并加入100μL具有SERS功能的复合纳米粒子(AuNP-MBA-rBSA-FA),在37℃恒温箱中培养30分钟,使用PBS离心洗涤3次(400×g,5.0min)。
而后利用拉曼光谱仪使用785nm激光器激发检测,在拉曼光谱图中的1076cm-1处同样存在有明显信号峰,而不含MCF-7细胞或者AuNP-MBA-rBSA-FA的样品在1076cm-1处没有明显信号峰,如图2(b)所示,所以AuNP-MBA-rBSA-FA对HeLa细胞和MCF-7细胞有良好的选择性。
(2)具有SERS功能的复合纳米粒子(AuNP-MBA-rBSA-FA)检测癌细胞的灵敏度初步验证
把10-10000个HeLa细胞掺入2.3×106HepG2细胞中,溶在3mLDMEM培养液中,并加入100μL具有SERS功能的复合纳米粒子(AuNP-MBA-rBSA-FA),在37℃恒温箱中培养30分钟,使用PBS离心洗涤3次(400×g,5.0min)。
而后利用拉曼光谱仪使用785nm激光器激发检测,在拉曼光谱图中的1076cm-1处有明显信号峰,信号峰强度随着HeLa细胞的减少而减弱,如图3(a),3(b)所示,在2.3×106HepG2细胞中只含有10个HeLa细胞时,也可以检测到明显的信号。
同样把10-500个MCF-7细胞掺入2.3×106HepG2细胞中,溶在3mLDMEM培养液中,并加入100μL具有SERS功能的复合纳米粒子(AuNP-MBA-rBSA-FA),在37℃恒温箱中培养30分钟,使用PBS离心洗涤3次(400×g,5.0min)。
而后利用拉曼光谱仪使用785nm激光器激发检测,在拉曼光谱图中的1076cm-1处有明显信号峰,信号峰强度随着MCF-7细胞的减少而减弱,如图3(c)所示,在2.3×106HepG2细胞中只含有10个MCF-7细胞时,也可以检测到明显的信号。所以在1076cm-1处拉曼信号峰的强度与癌细胞的个数有关,可通过峰强来计算CTCs的数目。
实施例42
(1)具有SERS功能的复合纳米粒子(AuNP-MBA-rBSA-FA)在兔血中检测癌细胞的灵敏度
取2mL兔血,2mLPBS稀释,用把10-10000个MCF-7细胞掺入到稀释血液中,再加入2mL外周血淋巴细胞分离液,离心(400×g,25min)分离单核细胞。将单核细胞(包含有白细胞和MCF-7细胞)取出,并加入200μL具有SERS功能的复合纳米粒子(AuNP-MBA-rBSA-FA),在37℃恒温箱中培养30分钟,使用PBS离心洗涤3次(400×g,5.0min)。
而后利用拉曼光谱仪使用785nm激光器激发检测,在拉曼光谱图中的1076cm-1处有明显信号峰,信号峰强度随着MCF-7细胞的减少而减弱,如图4(a),4(b)所示。
对MCF-7细胞个数和1076cm-1处的拉曼信号强度做线性关系,如图4(c),R2可达到0.9935,可以看出使用本发明所述的复合纳米材料检测癌细胞所得的线性关系图中癌细胞个数与拉曼信号强度具有非常好的线性关系。
具有SERS功能的复合纳米粒子(AuNP-MBA-rBSA-FA)可在兔血中的检测限在5cells/mL时,仍可获得非常高的检测灵敏度。此外,即使是在检测限≤1cells/mL,如0.1-0.5cells/mL时仍可获得非常高的检测灵敏度。
(2)具有SERS功能的复合纳米粒子(AuNP-MBA-rBSA-FA)在兔血中检测癌细胞时在检测限为5个细胞/ml的选择性
取2mL兔血,2mLPBS稀释,用把10个MCF-7细胞掺入到稀释血液中,再加入2mL外周血淋巴细胞分离液,离心(400×g,25min)分离单核细胞。将单核细胞(包含有白细胞和MCF-7细胞)取出,并加入200μL具有SERS功能的复合纳米粒子(AuNP-MBA-rBSA-FA),在37℃恒温箱中培养30分钟,使用PBS离心洗涤3次(400×g,5.0min)。
而后利用拉曼光谱仪使用785nm激光器激发检测,在拉曼光谱图中的1076cm-1处有明显信号峰,而不含MCF-7细胞或者AuNP-MBA-rBSA-FA的样品在1076cm-1处没有明显信号峰,如图5所示,所以在检测限为5个细胞/ml时AuNP-MBA-rBSA-FA对MCF-7细胞有良好的选择性。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种便携式智能拉曼光谱采集设备的制造方法与工艺
- 用于改善基底表面硬度及耐磨性的Ni‑WC复合涂层及其制备的制造方法与工艺
- 一种具有SERS活性的金/银/聚合物/银核壳纳米蘑菇材料及其制备方法和应用与制造工艺
- 用于增强使用无执照射频谱带进行的传输的帧结构和先听后讲规程(LBT)的技术的制造方法与工艺
- 一种基于近邻协同增强的高光谱混合像元分类方法与制造工艺
- 一种单分散银壳磁性微球的制备方法及其SERS应用与制造工艺
- 一种大口径材料表面散射的高速测量装置和方法与制造工艺
- 纳米金比色探针的制备方法及其检测碘离子的方法与制造工艺
- 一种复合型纳米结构拉曼增强基底、制备方法及应用与制造工艺
- 一种CaF2光学基底表面和亚表面损伤探测方法与制造工艺