一种靶向线粒体的造影剂分子作为T2造影剂的用途的制作方法
本发明涉及医学影像领域,特别涉及一种靶向线粒体的造影剂分子作为磁共振T2造影剂的用途,本发明还涉及一种靶向线粒体的造影剂分子,用其标记的磁标记细胞,和磁标记细胞与支架材料的结合体,以及用它们进行磁共振影像(Magnetic Resonance Imaging,MRI)活体示踪方法。
背景技术:
干细胞再生医疗是一个新兴的生物医学领域,其基本思路是通过诱导移植体内的干细胞定向分化,实现对受损组织和器官的再生修复。在干细胞再生医疗过程中,需要实时跟踪干细胞移植体内后的存活、迁移和归巢、定向分化等生理行为,对干细胞进行准确的组织生物学分布示踪,并区分内外源干细胞、自我更新产生的干细胞及分化产生的功能细胞,从而深入认识干细胞在体内的迁移、繁殖、分裂与分化等生理过程,而这对于干细胞生物学基础研究,及在临床上进行疗效观察和功能恢复的评估,都具有非常重要的意义。
磁共振影像作为具有高空间分辨率和软组织对比度且无电离辐射风险的非损伤活体影像技术,是示踪干细胞体内维持与分化过程的最有潜力的技术。磁共振影像是基于不同生物组织中水质子的自旋磁矩在均匀磁场中有序排列过程形成的磁矩受到特定的微波激发后,其纵向弛豫速率(1/T1)或横向弛豫速率(1/T2)可能存在差异,导致回波的信号强度不同在影像中形成的对比度差异实现对生物体的细胞、组织和器官的结构和功能成像。在实际应用时,当不同组织的影像对比度接近时,还可以通过引入磁共振造影剂来改变特定组织如肿瘤组织中的水质子的驰豫速率,实现对该特定组织的成像。利用磁共振影像技术活体示踪干细胞首先也需要对干细胞进行磁标记,从而将它们从其周围的其它组织细胞中区分开来。
磁共振造影剂的引入通常会同时加快其所处组织中水质子的纵向弛豫速率 和横向弛豫速率,但不同的磁共振造影剂加快两个弛豫速率的相对幅度存在较大的差异。这种差异导致有的磁共振造影剂适合用于MRI信号增强,称为T1造影剂,有的适合用于MRI信号减弱,称为T2造影剂。例如,通常情况下,钆络合物对水质子纵向弛豫速率的加速效应比对其横向弛豫速率的加速效应显著,有利于在T1加权像下产生亮信号,增强T1加权像的对比度,因此常被作为T1造影剂使用。超顺磁氧化铁(SPIO)纳米粒子对水质子横向弛豫速率的加速效应比对其纵向弛豫速率的加速效应显著得多,在T2加权成像模式下产生暗信号,增强T2加权像的对比度,是理想的T2造影剂。另外,相同的造影剂分布在不同的生物界面上,其加快两个弛豫速率的相对幅度也可能存在较大的差异。如钆络合物以游离态或囊泡形式分布在细胞质中或在细胞质中与线粒体结合时,其对细胞水质子的纵向和横向弛豫速率的影响存在显著的不同。
以SPIO纳米粒子为代表的T2造影剂具有很高的横向弛豫率,因此,在干细胞活体影像中得到了广泛的研究和应用。但这种基于SPIO纳米粒子的细胞标记技术本质上提供的是SPIO纳米粒子在体内的迁移信息,这种迁移是随携带纳米粒子的母细胞发生,还是母细胞死亡后游离的纳米粒子本身迁移,抑或是被其它细胞如巨噬细胞吞噬后随巨噬细胞发生的迁移,现在的影像方法无法给出明确的结论,成为影像信息分析面临的主要挑战。而且,这种细胞标记无法直观地告诉人们标记的细胞进入体内后仍然是活细胞,抑或已经死亡或者部分死亡。
钆络合物作为T1造影剂在临床医学中已经得到了广泛的应用,目前临床应用的钆络合物造影剂可以分为两类:一类是有环状结构的DOTA及其衍生物,一类是无环结构的DTPA及其衍生物。这种小分子造影剂由于化学结构明确稳定,可以通过化学方法精确控制与靶向分子偶联的过程和结果,因此作为靶向造影剂的结构单元具有很高的可靠性。但是,钆络合物造影剂面临的一个关键问题是其弛豫率远低于T2型SPIO纳米粒子的弛豫率,因此为了获得足够的组织对比度,需要较大的剂量,导致对金属钆离子在体内可能带来毒性等安全问题的关切。
利用钆络合物标记干细胞进行活体磁共振影像示踪也是一个可选的技术方案。但是现有的方法中,使用小分子钆络合物或面向细胞膜结合受体的靶向造影剂遇到的问题除了纵向弛豫率偏低外,其在细胞中滞留的时间太短也是一个 需要克服的问题;使用大分子或纳米粒子负载钆络合物时,又将遇到与SPIO纳米粒子同样的问题,包括在体内清除速度慢及可能被其它细胞摄取导致对影像结果的干扰。
专利US20090214437A1和US20130142735A1公布了一种能与细胞线粒体结合的磁共振造影剂,该磁共振造影剂经静脉注射到体内后,可以在线粒体活跃的肿瘤组织中富集,利用其增强肿瘤组织在T1加权成像模式下的磁共振信号(呈现亮信号),从而提高T1加权像的对比度。这种造影剂作为T1造影剂应用于细胞移植体的活体影像时,无法明确确定出标记细胞在体内的存活和迁移状况,信号增强效应持续的时间也不能满足长期观察的需要。
综上所述,本领域内亟需这样一种用于细胞或移植体标记的磁共振造影剂,不仅能直观地提供所述细胞在体内的存活状态以及所述细胞或移植体的迁移、归巢和分化等信息,还能满足长期观察的需要,又能解决大剂量所带来的毒性问题。
技术实现要素:
本发明基于发明人认识到,钆络合物分布在不同的生物界面上,其对细胞水质子的纵向和横向弛豫速率的影响存在显著的不同,特别是当钆络合物在细胞质中与线粒体结合后,其加速细胞水质子的纵向弛豫速率的能力显著降低,不利于磁共振信号增强,反而是有利于磁共振信号减弱,因此更适合于在T2加权成像模式下产生暗信号。发明人进一步发现,将本发明的标记细胞移植到体内后,所述标记细胞会部分释放出造影剂分子,释放的造影剂分子会使细胞移植体周边的组织在磁共振T2加权像模式下呈现亮信号,从而可以使细胞移植体更清楚地与其周边组织区分开来。
本发明的目的在于提供一种靶向线粒体的造影剂分子作为T2造影剂的用途,所述靶向线粒体的造影剂分子包括靶向单元和造影单元,其中,所述靶向单元是具有-P+(X1)(X2)(X3)结构通式的鏻阳离子,其中X1、X2、X3代表未经取代或者经一个或多个取代基取代的C1-12烷基、C1-12烯基、或C6-10芳基,所述取代基包括1、2或3个卤素原子、C1-12烷基、C6-10芳基、羟基、C1-12烷氧基、卤代-C1-12烷氧基;其中X1、X2、X3可以是相同的基团,也可以是不同的基团;所 述造影单元是超顺磁金属络合物。所述靶向线粒体的造影剂分子与细胞中的线粒体结合后呈现显著的磁共振信号减弱效用,使得所述磁标记细胞在体外和体内的磁共振T2加权像模式下都呈现暗信号;所述靶向单元与多个磁共振造影单元结合并用于细胞标记时,呈现更强的磁共振信号减弱效用,并能持续更长时间。
在本发明的一个优选实施方式中,所述靶向单元是三苯基鏻阳离子或其衍生物。
在本发明的一个优选实施方式中,所述超顺磁金属络合物由超顺磁金属和络合剂形成,其中:所述超顺磁金属是具有超顺磁特性的金属,包括但不限于镧系金属镨(Pr),钕(Nd),钷(Pm),钐(Sm),铕(Eu),钆(Gd),铽(Tb),镝(Dy),钬(Ho),铒(Er),铥(Tm),镱(Yb),镥(Lu),及非镧系金属铬(Cr),锰(Mn),铁(Fe),钴(Co),镍(Ni),铜(Cu),钇(Y),铌(Nb)等;所述络合剂选自DOTA,HP-DO3A,DO3A-butrol,DTPA-BMA,DTPA,DTPA-BMEA,BOPTA,EOB-DTPA或其衍生物及其任意组合。
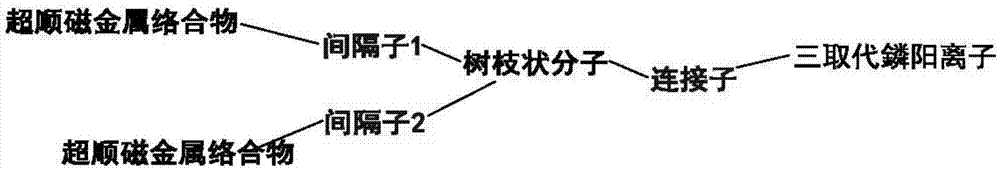
在本发明的一个优选实施方式中,所述靶向单元直接或通过连接子(linker)与树枝型或线型分子连接,所述树枝型或线型分子直接或通过间隔子(spacer)与造影单元连接,其中所述树枝型或线型分子的结构单元是任何可均聚或共聚形成树枝型或线型大分子的单体、优选氨基酸、更优选赖氨酸。
在本发明的一个优选实施方式中,所述的连接子是直链状氨基酸、优选赖氨酸;所述间隔子是直链状氨基酸,优选为NH2(CH2)pCOOH或NH2(CH2CH2O)qCH2COOH,其中p是0~12的整数,q是0~4的整数,当p=0或q=0时代表没有间隔子。
在本发明的一个优选实施方式中,所述的靶向单元通过所述树枝型或线型分子与1-8个造影单元连接。每个所述的-P+(X1)(X2)(X3)阳离子通过树枝型或线型分子与多个超顺磁金属络合物结合,其磁共振信号减弱效应更显著,在T2加权模式下成像时呈现暗信号的时间可以更长。
在本发明的一个优选实施方式中,采用多个靶向单元,优选2个靶向单元通过所述树枝型或线型分子与1-8个造影单元连接,可以增加所述造影剂分子与线粒体结合的强度,进一步延长其在T2加权模式下成像时呈现暗信号的时间。
本发明的另一个目的在于提供一种靶向线粒体的造影剂分子,其包括靶向单元和造影单元,其中:所述靶向单元是具有-P+(X1)(X2)(X3)结构通式的鏻阳离子,其中X1、X2、X3代表未经取代或者经一个或多个取代基取代的C1-12烷基、C1-12烯基、或C6-10芳基,所述取代基包括1、2或3个卤素原子、C1-12烷基、C6-10芳基、羟基、C1-12烷氧基、卤代-C1-12烷氧基;其中X1、X2、X3可以是相同的基团,也可以是不同的基团;所述造影单元是超顺磁金属络合物;所述靶向单元直接或通过连接子与树枝型或线型分子连接,所述树枝型或线型分子直接或通过间隔子与造影单元连接,其中所述树枝型或线型分子的结构单元是任何可均聚或共聚形成树枝型或线型大分子的单体、优选氨基酸、更优选赖氨酸。
在本发明的一个优选实施方式中,所述的连接子选自直链状氨基酸、优选赖氨酸;所述间隔子选自直链状氨基酸,优选为NH2(CH2)pCOOH或NH2(CH2CH2O)qCH2COOH,其中p是0~12的整数,q是0~4的整数,当p=0或q=0时代表没有间隔子。
在本发明的一个优选实施方式中,所述的靶向单元通过所述树枝型或线型分子与1-8个造影单元连接。
在本发明的一个优选实施方式中,采用多个靶向单元,优选2个靶向单元通过所述树枝型或线型分子与1-8个造影单元连接。
本发明还提供一种制备前述靶向线粒体的造影剂分子的方法,其包括:每个所述的-P+(X1)(X2)(X3)阳离子与卤代羧酸或者卤代胺反应生成具有羧基或氨基官能团的-P+(X1)(X2)(X3)阳离子,所述-P+(X1)(X2)(X3)阳离子通过获得的羧基或氨基与树枝型或线型分子连接;所述卤代羧酸是氯代、溴代或碘代脂肪酸或芳香酸;所述超顺磁金属络合物通过其羧基或氨基与树枝型或线型分子连接;所述超顺磁金属络合物的羧基选自乙羧基、丙羧基或丁羧基,所述超顺磁金属络合物的氨基选自乙氨基、丙氨基或丁氨基。
在本发明的一种优选实施方式中,靶向线粒体的造影剂分子通过以下方法合成:使用交叉保护脱保护策略的固相合成方法依次合成带有或不带有连接子或间隔子的树枝型或线型分子、和带有或不带有间隔子的造影单元,然后连接-P+(X1)(X2)(X3)阳离子和造影单元。
在本发明的一种优选实施方式中,将所述-P+(X1)(X2)(X3)阳离子、造影单元 和/或树枝型或线型分子中的一个单元的羧基转化成活泼酯或者经过活化之后与另一单元的氨基、巯基或羟基进行偶联;或者通过点击化学(click chemistry)连接靶向单元、树枝型或线型分子和造影单元。
本发明还提供一种用所述的靶向线粒体的造影剂分子标记的磁标记细胞,所述磁标记细胞是经过靶向线粒体的造影剂分子标记的任何可以用于细胞移植治疗的细胞,选自间充质干细胞、神经干细胞、心肌干细胞、胚胎干细胞、诱导多能干细胞。
本发明还提供一种细胞标记的方法,将靶向线粒体的造影剂分子置入含有所述细胞的培养液中,利用细胞的胞吞或胞饮功能将所述靶向线粒体的造影剂分子引入细胞内,所述的靶向线粒体的造影剂分子会与胞内的线粒体结合,可以有效延长其在所述标记细胞中的滞留时间。
本发明还提供另一种细胞标记的方法,其特征在于:将靶向线粒体的造影剂分子置入含有所述细胞的培养液、电转染缓冲液或生理盐水中,利用脉冲电穿孔的方法将所述的靶向线粒体的造影剂分子引入细胞内。
本发明还提供一种所述磁标记细胞与支架材料的结合体,所述支架材料是任何可以与细胞形成结合体的医用材料,选自胶原蛋白、各种合成高分子或无机支架材料;所述支架材料包含或不包含支持细胞存活和生长的各种营养因子。
本发明还提供一种磁共振影像活体示踪方法,其包括:将所述磁标记细胞或所述磁标记细胞与支架材料的结合体通过定点手术移植/静脉注射到人或动物体内;将上述人或动物置于磁共振影像设备中,在磁共振T2加权模式下成像。
本发明提供的靶向线粒体的造影剂分子作为T2造影剂的用途,可以广泛应用于细胞治疗中活体示踪移植到体内的细胞的存活率及其迁移和归巢等生理过程。这是一个首创性的发现,一方面因为目前还没有有效的方法可以通过活体影像技术明确示踪移植到体内的细胞的存活率及其迁移和归巢等生理过程,另一方面是因为长期以来钆络合物造影剂的应用只专注于其信号增强效应,因此只在T1加权模式下成像,影像对比度不理想,且呈现无规律变化。本发明是基于所述的靶向线粒体的造影剂分子与细胞内的线粒体结合后,会大幅度降低所述磁标记细胞的磁共振信号,长时间呈现稳定有规律的信号减弱效应,因此本发明是在T2加权模式下充分利用钆络合物与线粒体结合后呈现的磁共振信号减 弱效应。更重要的是本发明发现,使用本发明标记的细胞移植到体内后,所述标记细胞会释放出靶向线粒体的造影剂分子,释放的靶向线粒体的造影剂分子会使细胞移植体周边的组织在磁共振T2加权像模式下呈现亮信号,从而可以使细胞移植体更清楚地与其周边组织区分开来。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为本发明提供的一种磁标记细胞用于磁共振影像活体示踪的方法的示意图。
图2为本发明提供的一种靶向线粒体的造影剂分子的结构示意图。
图3为本发明提供的靶向线粒体的造影剂分子的靶向单元即鏻阳离子的结构通式图及本发明实施例中所使用的靶向单元三苯基鏻(TPP)阳离子及其衍生物((对甲苯基)3P)阳离子的结构图。
图4为本发明提供的可用于增强磁共振成像对比度的造影单元超顺磁金属络合物的结构图,其中M代表具有超顺磁特性的金属。
图5为本发明提供的一种靶向线粒体的造影剂分子结构示意图,其中造影单元Gd-DOTA、靶向单元三苯基鏻阳离子均通过羧基与树枝型或线型分子连接。树枝型或线型分子的结构单元是赖氨酸,结构单元个数k可以是0~7的整数;造影单元DOTA的个数是m+n=k+1。
图6为本发明实施例1提供的一种靶向线粒体的造影剂分子TPP-K(Gd-DOTA)-OH,简写为Gd-DOTA-TPP,造影单元为Gd-DOTA,靶向单元TPP和Gd-DOTA均通过羧基与赖氨酸(简写为K)的两个氨基连接。
图7为本发明实施例2提供的一种靶向线粒体的造影剂分子[Gd-DOTA-Acp-K(Gd-DOTA)]2-K(TPP)-OH,简写为(Gd-DOTA)4-TPP,造影单元为Gd-DOTA,靶向单元TPP和Gd-DOTA均通过羧基与树枝型分子相连,树枝 型分子的结构单元是赖氨酸,结构单元个数为k=3,连接子是赖氨酸,其中一个间隔子的长度是NH2(CH2)pCOOH的p=0的情况,另一个间隔子的结构是NH2(CH2)5COOH,即氨基己酸(Acp),长度是NH2(CH2)pCOOH的p=5的情况。
图8为本发明实施例3提供的一种靶向线粒体的造影剂分子[Gd-DOTA-Acp-K(Gd-DOTA)]2-linker-K(TPP)-OH,简写为(Gd-DOTA)4-linker-TPP,造影单元为Gd-DOTA,靶向单元TPP和Gd-DOTA均通过羧基与树枝型分子相连,树枝型分子的结构单元是赖氨酸,结构单元个数为k=3,这里连接子是氨基己酰赖氨酸,其中包含间隔子氨基己酸,其中一个间隔子的长度是NH2(CH2)pCOOH的p=0的情况,另一个间隔子的结构是NH2(CH2)5COOH,长度是NH2(CH2)pCOOH的p=5的情况。
图9为本发明实施例4提供的一种靶向线粒体的造影剂分子[Gd-DOTA-Acp-K(Gd-DOTA)]2-linker-K(TPP)-OH,简写为(Gd-DOTA)4-linker-TPP,造影单元为Gd-DOTA,靶向单元TPP和Gd-DOTA均通过羧基与线型分子相连,线型分子的结构单元是赖氨酸,结构单元个数为k=3,这里连接子是氨基己酰赖氨酸,其中包含间隔子氨基己酸,其中一个间隔子的长度是NH2(CH2)pCOOH所述的p=0的情况,另一个间隔子的结构是NH2(CH2)5COOH,长度是NH2(CH2)pCOOH的p=5的情况。
图10为本发明实施例5提供的一种靶向线粒体的造影剂分子[Dy-DOTA-Acp-K(Gd-DOTA)]2-linker-K(TPP)-OH,简写为(Dy-DOTA)4-linker-TPP,造影单元为Dy-DOTA,靶向单元TPP和Dy-DOTA均通过羧基与树枝型分子相连,树枝型分子的结构单元是赖氨酸,结构单元个数为k=3,这里连接子是氨基己酰赖氨酸,其中包含间隔子氨基己酸,其中一个间隔子的长度是NH2(CH2)pCOOH的p=0的情况,另一个间隔子的结构是NH2(CH2)5COOH,长度是NH2(CH2)pCOOH的p=5的情况。
图11为本发明实施例6提供的一种靶向线粒体的造影剂分子[Gd-DTPA-Acp-K(Gd-DTPA)]2-linker-K(TPP)-OH,简写为(Gd-DTPA)4-linker-TPP,造影单元为Gd-DTPA,靶向单元TPP和Gd-DTPA均通过羧基与树枝型分子相连,树枝型分子的结构单元是赖氨酸,结构单元个数为k=3,这里连接子是氨基己酰赖氨酸,其中包含间隔子氨基己酸,其中一个间隔子的长度是NH2(CH2)pCOOH的p=0的情况,另一个间隔子的结构是NH2(CH2)5COOH,长 度是NH2(CH2)pCOOH的p=5的情况。
图12为本发明实施例7提供的一种靶向线粒体的造影剂分子[Gd-DOTA-Acp-K(Gd-DOTA)]2-linker-K((对甲苯基)3P)-OH,简写为(Gd-DOTA)4-linker-(对甲苯基)3P,造影单元为Gd-DOTA,靶向单元(对甲苯基)3P和Gd-DOTA均通过羧基与树枝型分子相连,树枝型分子的结构单元是赖氨酸,结构单元个数为k=3,这里连接子是氨基己酰赖氨酸,其中包含间隔子氨基己酸,其中一个间隔子的长度是NH2(CH2)pCOOH的p=0的情况,另一个间隔子的结构是NH2(CH2)5COOH,长度是NH2(CH2)pCOOH的p=5的情况。
图13为本发明实施例8提供的一种靶向线粒体的造影剂分子TPP-Lys(TPP)-Lys[DOTA-Acp-Lys(DOTA)-Acp-Lys(DOTA)-Acp-Lys(DOTA)]-NH2,简写为(Gd-DOTA)4-linker-TPP2,造影单元为4个Gd-DOTA分子,4个DOTA接在线性多肽Lys的ε-氨基(侧链)上和多肽N端的氨基上成线性排列;靶向单元为两个TPP分子接在线型分子的同一端,这一端的Lys的羧基被酰胺化;线型分子的结构单元是赖氨酸,结构单元个数为k=3,这里连接子是氨基己酰赖氨酸,其中包含间隔子氨基己酸,其中一个间隔子的长度是NH2(CH2)pCOOH所述的p=0的情况,另一个间隔子的结构是NH2(CH2)5COOH,长度是NH2(CH2)pCOOH的p=5的情况。
图14是本发明实施例10使用(Gd-DOTA)1,4-TPP作为靶向线粒体的造影剂分子标记间充质干细胞的体外磁共振T1加权和T2加权影像效果图。第一排图像是Gd-DOTA标记间充质干细胞在不同细胞繁殖时间节点的T1和T2加权图像。第二、三、四排图像分别是5,10,20mM Gd-DOTA-TPP标记间充质干细胞在不同细胞繁殖时间节点的T1和T2加权图像。第五排图像是20mM(Gd-DOTA)4-TPP标记间充质干细胞在不同细胞繁殖时间节点的T1和T2加权图像。图像下面的数字是细胞标记后继续孵育的过程中,采集影像的时间节点(天)。
图15是本发明实施例10提供的标记细胞经不同时间繁殖后得到的体外T1加权MRI影像信号强度随细胞繁殖时间的变化。
图16是本发明实施例10提供的标记细胞经不同时间繁殖后得到的体外T2加权MRI影像信号强度随细胞繁殖时间的变化。
图17本发明实施例11使用20mM(Gd-DOTA)4-TPP为靶向线粒体的造影剂分子标记间充质干细胞,通过定点手术注射移植到小鼠颅内,在不同时间节点采集的11.7T磁共振T2加权影像效果图。
图18本发明实施例12使用20mM(Gd-DOTA)4-TPP为靶向线粒体的造影剂分子标记间充质干细胞,通过定点注射移植大鼠前腿肌肉中采集的3T磁共振T2加权影像效果图。
图19是本发明实施例13使用(Gd-DOTA)4-TPP2作为靶向线粒体的造影剂分子标记间充质干细胞经不同时间繁殖后得到的体外T2加权MRI影像信号强度随细胞繁殖时间的变化与实施例10部分结果的对比。
图20是本发明实施例10和13提供的标记细胞经不同时间繁殖后得到的体外T2加权MRI影像信号强度与细胞中Gd含量的变化关系。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
本发明提供一种靶向线粒体的造影剂分子作为T2造影剂的用途,所述靶向线粒体的造影剂分子包括靶向单元和造影单元,其中,所述靶向单元是具有-P+(X1)(X2)(X3)结构通式的鏻阳离子,其中X1、X2、X3代表未经取代或者经一个或多个取代基取代的C1-12烷基、C1-12烯基、或C6-10芳基,所述取代基包括1、2或3个卤素原子、C1-12烷基、C6-10芳基、羟基、C1-12烷氧基、卤代-C1-12烷氧基;其中X1、X2、X3可以是相同的基团,也可以是不同的基团;所述造影单元是超顺磁金属络合物。
本发明实施例中,所述的靶向单元三苯基鏻或其衍生物分子的结构可以是图3中所示的任一种,也可以是具有图3中所示结构通式的其它结构衍生物。
本发明实施例中,所述的造影单元超顺磁金属络合物的结构可以是图4中所示的任一种络合物,也可以是图4中所示任一种络合物的衍生物,例如将超顺磁 金属络合物的络合配体中与树枝型或线型分子连接的乙酰基替换为丙酰基或丁酰基,也可以把乙羰基替换为乙氨基、丙氨基、丁氨基等得到的衍生物。
本发明实施例中,所述靶向线粒体的造影剂分子可以通过多肽固相合成技术直接制备;也可以分别合成各个单元,然后将某一单元的羧基转化成NHS活泼酯或者活化之后与另一单元进行连接,或者通过点击化学连接。比如先合成所述的造影单元超顺磁金属络合物的络合配体(带保护基)、所述的三苯基鏻阳离子或其衍生物阳离子和带有氨基的树枝型或线型分子,把造影单元的络合配体的羧基和三苯基鏻或其衍生物阳离子的羧基转化成NHS活泼酯与其树枝型或线型分子的氨基进行连接,脱去保护基之后与超顺磁金属离子络合得到所述的靶向线粒体的造影剂分子。所述的树枝型或线型分子可以提供氨基、巯基、羟基等等连接,也可以提供羧基连接;相应地,所述的超顺磁金属络合物和三苯基鏻或其衍生物阳离子可以通过羧基与树枝型或线型分子连接,也可以通过氨基、巯基、羟基等等与树枝型或线型分子连接;或者是点击化学的叠氮-炔基的环加成反应。
本发明的一个实施方案中,利用Gd-DOTA作为造影单元,靶向单元三苯基鏻分子与Gd-DOTA都通过羧基与树枝型或线型分子相连,树枝型或线型分子的结构单元采用赖氨酸,合成的三苯基鏻磁共振靶向线粒体的造影剂分子的结构如图5所示。树枝型或线型分子的结构单元个数k可以是0~7的整数;造影单元DOTA的个数是m+n=k+1,连接子是赖氨酸,间隔子分子结构采用NH2(CH2)pCOOH,其中p是0~12的整数。
本发明的一个实施方案中,利用Gd-DOTA作为造影单元,靶向单元三苯基鏻分子和Gd-DOTA均通过羧基与赖氨酸的两个氨基相连,合成的三苯基鏻靶向线粒体的造影剂分子的结构如图6所示,对应探针分子Gd-DOTA-TPP。
本发明的一个实施方案中,利用Gd-DOTA作为造影单元,靶向单元三苯基鏻分子和Gd-DOTA均通过羧基与树枝型分子相连,树枝型分子的结构单元采用赖氨酸,结构单元个数k=3,n=2,m=2时,连接子是赖氨酸,其中一个间隔子的长度是0,另一个间隔子的结构是NH2(CH2)5COOH,合成的三苯基鏻靶向线粒体的造影剂分子的结构如图7所示,对应探针分子(Gd-DOTA)4-TPP。
本发明的一个实施方案中,利用Gd-DOTA作为造影单元,靶向单元三苯基 鏻分子和Gd-DOTA均通过羧基与树枝型分子相连,树枝型分子的结构单元采用赖氨酸,结构单元个数k=3,n=2,m=2时,连接子是氨基己酰赖氨酸,其中包含间隔子氨基己酸,其中一个间隔子的长度是0,另一个间隔子的结构是NH2(CH2)5COOH,合成的三苯基鏻靶向线粒体的造影剂分子的结构如图8所示,对应探针分子(Gd-DOTA)4-linker-TPP。
本发明的一个实施方案中,利用Gd-DOTA作为造影单元,靶向单元三苯基鏻分子和Gd-DOTA均通过羧基与线型分子相连,线型分子的结构单元采用赖氨酸,结构单元个数k=3,m=1,n=3时,连接子是氨基己酰赖氨酸,其中包含间隔子氨基己酸,其中一个间隔子的长度是0,另一个间隔子的结构是NH2(CH2)5COOH,合成的三苯基鏻靶向线粒体的造影剂分子的结构如图9所示,对应探针分子(Gd-DOTA)4-linker-TPP。
本发明的一个实施方案中,利用Dy-DOTA作为造影单元,靶向单元三苯基鏻阳离子和Dy-DOTA均通过羧基与树枝型分子相连,树枝型分子的结构单元采用赖氨酸,结构单元个数k=3,n=2,m=2时,连接子是氨基己酰赖氨酸,其中包含间隔子氨基己酸,其中一个间隔子的长度是0,另一个间隔子的结构是NH2(CH2)5COOH,合成的三苯基鏻靶向线粒体的造影剂分子的结构如图10所示,对应探针分子(Dy-DOTA)4-TPP。
本发明的一个实施方案中,利用Gd-DTPA作为造影单元,靶向单元三苯基鏻分子和Gd-DTPA均通过羧基与树枝型分子相连,树枝型分子的结构单元采用赖氨酸,结构单元个数k=3,n=2,m=2时,连接子是氨基己酰赖氨酸,其中包含间隔子氨基己酸,其中一个间隔子的长度是0,另一个间隔子的结构是NH2(CH2)5COOH,合成的三苯基鏻靶向线粒体的造影剂分子的结构如图11所示,对应探针分子(Gd-DTPA)4-linker-TPP。
本发明的一个实施方案中,利用Gd-DOTA作为造影单元,靶向单元三(对甲基苯基)鏻分子((对甲苯基)3P)和Gd-DOTA均通过羧基与树枝型分子相连,树枝型分子的结构单元采用赖氨酸,结构单元个数k=3,n=2,m=2时,连接子是氨基己酰赖氨酸,其中包含间隔子氨基己酸,其中一个间隔子的长度是0,另一个间隔子的结构是NH2(CH2)5COOH,合成的三苯基鏻靶向线粒体的造影剂分子的结构如图12所示,对应探针分子(Gd-DOTA)4-linker-(对甲苯基)3P。
本发明的一个实施方案中,利用Gd-DOTA作为造影单元,2个靶向单元三苯基鏻分子和Gd-DOTA均通过羧基与线型分子相连,线型分子的结构单元采用赖氨酸,结构单元个数k=3,m=1,n=3时,连接子是氨基己酰赖氨酸,其中包含间隔子氨基己酸,其中一个间隔子的长度是0,另一个间隔子的结构是NH2(CH2)5COOH,合成的三苯基鏻靶向线粒体的造影剂分子的结构如图13所示,对应探针分子(Gd-DOTA)4-linker-TPP2。
在本发明的一个实施方案中,提供了一种利用本发明所述的靶向线粒体的磁共振造影剂分子标记的细胞,以及通过脉冲电穿孔利用结合细胞线粒体的靶向线粒体的磁共振造影剂分子标记间充质干细胞方法。
在本发明的一个实施方案中,提供了一种方法通过体外磁共振影像观察结合细胞线粒体的造影剂分子标记的间充质干细胞,在细胞标记后不同时间节点,其T1加权成像和T2加权成像对比度的变化过程。
在本发明的一个实施方案中,提供了一种方法通过定点手术移植/注射,将靶向线粒体的磁共振造影剂分子标记的间充质干细胞移植到小鼠体内,利用11.7T活体磁共振T2加权成像,观察细胞移植体及其周边组织的影像对比度在细胞移植后不同时间节点的变化过程。
在本发明的一个实施方案中,提供了一种方法通过定点手术移植/注射,将靶向线粒体的磁共振造影剂分子标记的间充质干细胞移植到大鼠体内,利用3T活体磁共振T2加权成像,观察细胞移植体及其周边组织的影像对比度。
具体实施例如下:
实施例1:靶向线粒体的造影剂分子Gd-DOTA-TPP的合成(图6)
1、But3DOTA(1,4,7–三(叔丁氧羰甲基)–10-(乙酸)-1,4,7,10–四氮杂环十二烷)的合成。按以下步骤从1,4,7,10–四氮杂环十二烷(Cyclen)开始合成:
a)称取10.0g Cyclen和29.3g NaHCO3置于1L的三口瓶中,加入50mL乙腈。在通风橱内称取37.4g溴乙酸叔丁酯,加20mL乙腈后混合均匀,放入滴液漏斗中。在冰浴和N2保护下将溴乙酸叔丁酯的乙腈溶液缓慢滴加至三口瓶中的反应混合物中。滴加完毕后,室温下继续搅拌30小时。滤除固体,旋转蒸发除去乙腈,用甲苯重结晶2次,得16g白色固体But3DO3A(1,4,7–三(叔丁氧羰甲 基)–1,4,7,10–四氮杂环十二烷)。
b)称取1.38g K2CO3和2.57g But3DO3A置于250mL的三口烧瓶中,加入50mL乙腈,在N2保护和室温搅拌下滴加1.0g溴乙酸乙酯的5mL乙腈溶液,温度升至70℃反应12-24小时。冷却至室温,过滤,旋转蒸发除去溶剂。用CH2Cl2/MeOH(20:1)为展开剂进行柱色谱层析分离,得到2.5g淡黄色粘稠状泡沫状产物1,4,7–三(叔丁氧羰甲基)–10-(乙氧羰甲基)1,4,7,10–四氮杂环十二烷(But3Et-DOTA)。
c)称取1.5g But3Et-DOTA于250mL的三口烧瓶中,加入50mL二氧六环溶解,N2保护下加入25mL 1.2M NaOH水溶液,50-70℃搅拌4小时。旋转蒸发除去二氧六环,用二氯甲烷萃取三次(每次25mL),合并萃取液,用无水硫酸钠干燥。旋转蒸发除去溶剂,用CH2Cl2/MeOH(20:1)为展开剂进行柱色谱层析分离,得到1.0g淡黄色粘稠状泡沫状产物But3DOTA。
2、Ph3P(Br)(CH2)4COOH[溴化(4-羧丁基三苯基鏻)]的合成
称取7.42g三苯基鏻和5.01g 5-溴戊酸置于100mL圆底烧瓶中,加入35mL二甲苯,搅拌溶解。加热至140℃,冷凝回流4小时。冷却至40℃~50℃,在强烈搅拌下用分液漏斗缓慢滴加30mL二甲基醚,得到白色晶体。抽滤,将白色晶体用少量二乙基醚洗两次,得到产物溴化(4-羧丁基三苯基鏻)8.51克,产率68%。
3、用固相合成的方法合成DOTA-TPP:
步骤简述如下:按传统的Fmoc(氯甲酸芴甲酯)法在固相合成仪上合成,按图6所示的结构,从C端向N端依次偶联氨基酸。首先固相载体2-氯三苯甲基树脂1g,依次加入2.0g Fmoc-Lys(Mtt)-OH,1.77g Ph3P(Br)(CH2)4COOH进行缩合,每步的羧基和氨基缩合的条件是以50mL的DMF为溶剂,加入0.96g TBTU、0.41gHOBt缩合剂和2.5mL的碱DIPEA,25℃反应大约24小时,具体时间以茚三酮显色为准来判断羧基和氨基缩合是否结束;缩合结束之后抽干溶剂,分别用50mL甲醇,用DMF、甲醇和二氯甲烷洗三次。加入Ph3P(Br)(CH2)4COOH之前脱除Fmoc的条件:25mL 20%哌啶/DMF室温反应0.5小时,抽干,再加入25mL 20%哌啶/DMF反应0.5小时,抽干,分别用DMF、甲醇、二氯甲烷各洗涤三次。
缩合Ph3P(Br)(CH2)4COOH之后,加入50mL 1%TFA/二氯甲烷脱去保护基团Mtt,抽干。分别用DMF、甲醇、二氯甲烷各洗涤三次。加入1.72g But3DOTA, 50mL的DMF溶剂,0.96g TBTU、0.41g HOBt缩合剂和2.5mL的碱DIPEA,25℃反应,以茚三酮显色判断羧基和氨基缩合结束之后抽干溶剂,分别用50mL甲醇,用DMF、甲醇和二氯甲烷洗三次。加入50mL 50%TFA/二氯甲烷,25℃反应40分钟。过滤,取滤液,用三乙胺将滤液pH调到中性,浓缩至干。加入乙醚,析出白色固体,得粗产品。
粗产品进一步用HPLC纯化,Waters2535_2707_2998_WFC,XBridge Pre C18 5μm 19×150mm,流动相为:溶剂A(0.1%TFA,水),溶剂B(0.1%TFA,CH3CN),溶剂A在25分钟内从50%降到25%;流速10mL/分钟。得到约200mg产品DOTA-TPP,纯度95%以上。
4、将脱保护的DOTA-TPP与Gd3+络合,得到Gd-DOTA-TPP靶向线粒体的造影剂分子。具体如下:将含有35.7mg的GdCl3·6H2O的水溶液约1.0mL滴加到100mg上述DOTA-TPP的水溶液中混合3小时,小心用1.0M氨水调pH值到6左右,室温下静态混合器转动过夜,然后用1.0M氨水和1.0M盐酸小心调pH值到7-8,澄清水溶液冷冻干燥后得到白色粉末Gd-DOTA-TPP靶向线粒体的造影剂分子。用HPLC检测Gd-DOTA-TPP的纯度。HPLC条件,Waters2535_2707_2998,Sapphire C18 5μm 4.6×250mm,流动相为:溶剂A(0.1%TFA,水),溶剂B(0.1%TFA,80%CH3CN,20%水),溶剂B在20分钟内从22%升至42%;流速1.0mL/分钟。纯度95%以上。
实施例2:(Gd-DOTA)4-TPP靶向线粒体的造影剂分子的合成(图7)
1、按照实施例1合成But3DOTA和Ph3P(Br)(CH2)4COOH。
2、用固相合成的方法合成DOTA4-TPP:步骤简述如下:按传统的Fmoc法在固相合成仪上合成,按图7所示的结构,从C端向N端依次偶联氨基酸。首先固相载体2-氯三苯甲基树脂1g,依次加入2.0g Fmoc-Lys(Mtt)-OH,1.77g Ph3P(Br)(CH2)4COOH进行缩合,每步的羧基和氨基缩合的条件是以50mL的DMF为溶剂,加入0.96g TBTU、0.41g HOBt缩合剂和2.5mL的碱DIPEA,25℃反应大约24小时,具体时间以茚三酮显色为准来判断羧基和氨基缩合是否结束;缩合结束之后抽干溶剂,分别用50mL甲醇,用DMF、甲醇和二氯甲烷洗三次。加入Ph3P(Br)(CH2)4COOH之前脱除Fmoc的条件:25mL 20%哌啶/DMF室温反应0.5小时,抽干,再加入25mL 20%哌啶/DMF反应0.5小时,抽干,分别用DMF、甲醇、 二氯甲烷各洗涤三次。
缩合Ph3P(Br)(CH2)4COOH之后,加入50mL 1%TFA/二氯甲烷脱去赖氨酸侧链的保护基团Mtt,抽干溶剂。分别用DMF、甲醇、二氯甲烷各洗涤三次。然后依次加入Fmoc保护的氨基酸进行缩合(2.0g Fmoc-Lys(Fmoc)-OH,4.0g Fmoc-Lys(Mtt)-OH,2.12g Fmoc-ε-Acp-OH)。每步的羧基和氨基缩合的条件是以50mL的DMF为溶剂,加入1.92g TBTU、0.82g HOBt缩合剂和5mL的碱DIPEA,25℃反应大约24小时,具体时间以茚三酮显色为准来判断羧基和氨基缩合是否结束;缩合结束之后抽干溶剂,分别用50mL甲醇,用DMF、甲醇和二氯甲烷洗三次。加入下一个Fmoc保护的氨基酸之前脱除上一个Fmoc的条件:25mL 20%哌啶/DMF室温反应0.5小时,抽干,再加入25mL 20%哌啶/DMF反应0.5小时,抽干,分别用DMF、甲醇、二氯甲烷各洗涤三次。
在最后缩合Fmoc-ε-Acp-OH并且脱掉Fmoc之后,加入100mL 1%TFA/二氯甲烷脱去保护基团Mtt,抽干。分别用DMF、甲醇、二氯甲烷各洗涤三次。加入7gBut3DOTA,200mL的DMF溶剂,4g TBTU、1.64g HOBt缩合剂和10mL的碱DIPEA,25℃反应,以茚三酮显色判断羧基和氨基缩合结束之后抽干溶剂,分别用50mL甲醇,用DMF、甲醇和二氯甲烷洗三次。加入50mL 50%TFA/二氯甲烷,25℃反应40分钟。过滤,取滤液,用三乙胺将滤液pH调到中性,浓缩至干。加入乙醚,析出白色固体,得粗产品。
粗产品进一步用HPLC纯化,Waters2535_2707_2998_WFC,XBridge Pre C18 5μm 19×150mm,流动相为:溶剂A(0.1%TFA,水),溶剂B(0.1%TFA,CH3CN),溶剂A15分钟内从80%降到65%;流速10mL/分钟。得到约200mg产品(DOTA)4-TPP,纯度95%以上。
3、将脱保护的DOTA4-TPP与Gd3+络合,得到(Gd-DOTA)4-TPP靶向线粒体的造影剂分子。具体如下:将含有12.8mg的GdCl3·6H2O的水溶液约0.5mL滴加到100mg上述DOTA4-TPP的水溶液中混合3小时,小心用1.0M氨水调pH值到6左右,室温下静态混合器转动过夜,然后用1.0M氨水和1.0M盐酸小心调pH值到7-8,澄清水溶液冷冻干燥后得到白色粉末(Gd-DOTA)4-TPP靶向线粒体的造影剂分子。用HPLC检测(Gd-DOTA)4-TPP的纯度。HPLC条件,Waters2535_2707_2998,Sapphire C18 5μm 4.6×250mm,流动相为:溶剂A(0.1%TFA,水),溶剂B(0.1%TFA,80%CH3CN,20%水),溶剂B在20分钟内从24%升至44%;流速1.0mL/分钟。纯 度95%以上。
实施例3:(Gd-DOTA)4-linker-TPP靶向线粒体的造影剂分子的合成(这里的spacer为Acp)(图8,树枝型分子)
1、按照实施例1的方法合成分别But3DOTA和Ph3P(Br)(CH2)4COOH。
2、用固相合成的方法合成DOTA4-linker-TPP:
步骤简述如下:按传统的Fmoc法在固相合成仪上合成,按图8所示的结构,从C端向N端依次偶联氨基酸。首先固相载体2-氯三苯甲基树脂1g,依次加入2.0g Fmoc-Lys(Mtt)-OH,1.77g Ph3P(Br)(CH2)4COOH进行缩合,每步的羧基和氨基缩合的条件是以50mL的DMF为溶剂,加入0.96g TBTU、0.41g HOBt缩合剂和2.5mL的碱DIPEA,25℃反应大约24小时,具体时间以茚三酮显色为准来判断羧基和氨基缩合是否结束;缩合结束之后抽干溶剂,分别用50mL甲醇,用DMF、甲醇和二氯甲烷洗三次。加入Ph3P(Br)(CH2)4COOH之前脱除Fmoc的条件:25mL 20%哌啶/DMF室温反应0.5小时,抽干,再加入25mL 20%哌啶/DMF反应0.5小时,抽干,分别用DMF、甲醇、二氯甲烷各洗涤三次。
缩合Ph3P(Br)(CH2)4COOH之后,加入50mL 1%TFA/二氯甲烷脱去赖氨酸侧链的保护基团Mtt,抽干溶剂。分别用DMF、甲醇、二氯甲烷各洗涤三次。然后依次加入Fmoc保护的氨基酸进行缩合(1.06g Fmoc-ε-Acp-OH,2.0g Fmoc-Lys(Fmoc)-OH,4.0g Fmoc-Lys(Mtt)-OH,2.12g Fmoc-ε-Acp-OH)。每步的羧基和氨基缩合的条件是以50mL的DMF为溶剂,加入1.92g TBTU、0.82g HOBt缩合剂和5mL的碱DIPEA,25℃反应大约24小时,具体时间以茚三酮显色为准来判断羧基和氨基缩合是否结束;缩合结束之后抽干溶剂,分别用50mL甲醇,用DMF、甲醇和二氯甲烷洗三次。加入下一个Fmoc保护的氨基酸之前脱除上一个Fmoc的条件:25mL 20%哌啶/DMF室温反应0.5小时,抽干,再加入25mL 20%哌啶/DMF反应0.5小时,抽干,分别用DMF、甲醇、二氯甲烷各洗涤三次。
在最后缩合Fmoc-ε-Acp-OH并且脱掉Fmoc之后,加入100mL 1%TFA/二氯甲烷脱去保护基团Mtt,抽干。分别用DMF、甲醇、二氯甲烷各洗涤三次。加入7g But3DOTA,200mL的DMF溶剂,4g TBTU、1.64g HOBt缩合剂和10mL的碱DIPEA,25℃反应,以茚三酮显色判断羧基和氨基缩合结束之后抽干溶剂,分别用50mL甲醇,用DMF、甲醇和二氯甲烷洗三次。加入50mL 50%TFA/二氯甲 烷,25℃反应40分钟。过滤,取滤液,用三乙胺将滤液pH调到中性,浓缩至干。加入乙醚,析出白色固体,得粗产品。
粗产品进一步用HPLC纯化,Waters2535_2707_2998_WFC,XBridge Pre C18 5μm 19×150mm,流动相为:溶剂A(0.1%TFA,水),溶剂B(0.1%TFA,CH3CN),溶剂A在15分钟从80%降到65%;流速10mL/分钟。得到约200mg产品(DOTA)4-linker-TPP,纯度95%以上。
3、将脱保护的DOTA4-spacer-TPP与Gd3+络合,得到(Gd-DOTA)4-linker-TPP靶向线粒体的造影剂分子。具体如下:将含有12.8mg的GdCl3·6H2O的水溶液约0.5mL滴加到100mg上述DOTA4-linker-TPP的水溶液中混合3小时,小心用1.0M氨水调pH值到6左右,室温下静态混合器转动过夜,然后用1.0M氨水和1.0M盐酸小心调pH值到7-8,澄清水溶液冷冻干燥后得到白色粉末(Gd-DOTA)4-linker-TPP靶向线粒体的造影剂分子。用HPLC检测(Gd-DOTA)4-linker-TPP的纯度。HPLC条件,Waters2535_2707_2998,Sapphire C18 5μm 4.6×250mm,流动相为:溶剂A(0.1%TFA,水),溶剂B(0.1%TFA,80%CH3CN,20%水),溶剂B在20分钟内从24%升至44%;流速1.0mL/分钟。纯度95%以上。
实施例4:(Gd-DOTA)4-linker-TPP靶向线粒体的造影剂分子的合成(这里的spacer为Acp)(图9,线型分子)
1、按照实施例1的方法合成But3DOTA和Ph3P(Br)(CH2)4COOH。
2、按照实施例3合成DOTA4-linker-TPP的方法,按图9所示的结构用固相合成的方法合成线型分子连接的DOTA4-linker-TPP。
3、将脱保护的DOTA4-spacer-TPP与Gd3+络合,得到(Gd-DOTA)4-linker-TPP靶向线粒体的造影剂分子。具体如下:将含有12.8mg的GdCl3·6H2O的水溶液约0.5mL滴加到100mg上述DOTA4-linker-TPP的水溶液中混合3小时,小心用1.0M氨水调pH值到6左右,室温下静态混合器转动过夜,然后用1.0M氨水和1.0M盐酸小心调pH值到7-8,澄清水溶液冷冻干燥后得到白色粉末(Gd-DOTA)4-linker-TPP靶向线粒体的造影剂分子。用HPLC检测(Gd-DOTA)4-linker-TPP的纯度。HPLC条件,Waters2535_2707_2998,Sapphire C18 5μm 4.6×250mm,流动相为:溶剂A(0.1%TFA水),溶剂B(0.1%TFA,80%CH3CN,20%水),溶剂B在20分钟内从24%升至44%;流速1.0mL/分钟。纯度95%以上。
实施例5:(Dy-DOTA)4-linker-TPP靶向线粒体的造影剂分子的合成(这里的linker=Acp)(图10)
1、按照实施例1的方法合成But3DOTA和Ph3P(Br)(CH2)4COOH。
2、按照实施例3的方法合成DOTA4-linker-TPP:
3、将脱保护的DOTA4-linker-TPP与Dy3+络合,得到(Dy-DOTA)4-linker-TPP靶向线粒体的造影剂分子。具体如下:将含有13.0mg的DyCl3·6H2O的水溶液约0.5mL滴加到100mg上述DOTA4-linker-TPP的水溶液中混合3小时,小心用1.0M氨水调pH值到6左右,室温下静态混合器转动过夜,然后用1.0M氨水和1.0M盐酸小心调pH值到7-8,澄清水溶液冷冻干燥后得到白色粉末(Dy-DOTA)4-linker-TPP靶向线粒体的造影剂分子。用HPLC检测(Dy-DOTA)4-linker-TPP的纯度。HPLC条件,Waters2535_2707_2998,Sapphire C18 5μm 4.6×250mm,流动相为:溶剂A(0.1%TFA,水),溶剂B(0.1%TFA,80%CH3CN,20%水),溶剂B在20分钟内从24%升至44%;流速1.0mL/分钟。纯度95%以上。
实施例6:(Gd-DTPA)4-linker-TPP靶向线粒体的造影剂分子的合成(这里的linker=Acp)(图11)
1、按照实施例1的方法合成Ph3P(Br)(CH2)4COOH
2、用固相合成的方法合成DTPA4-linker-TPP:
步骤简述如下:按传统的Fmoc法在固相合成仪上合成,按图10所示的结构,从C端向N端依次偶联氨基酸。首先固相载体2-氯三苯甲基树脂1g,依次加入2.0g Fmoc-Lys(Mtt)-OH,1.77g Ph3P(Br)(CH2)4COOH进行缩合,每步的羧基和氨基缩合的条件是以50mL的DMF为溶剂,加入0.96g TBTU、0.41g HOBt缩合剂和2.5mL的碱DIPEA,25℃反应大约24小时,具体时间以茚三酮显色为准来判断羧基和氨基缩合是否结束;缩合结束之后抽干溶剂,分别用50mL甲醇,用DMF、甲醇和二氯甲烷洗三次。加入Ph3P(Br)(CH2)4COOH之前脱除Fmoc的条件:25mL 20%哌啶/DMF室温反应0.5小时,抽干,再加入25mL 20%哌啶/DMF反应0.5小时,抽干,分别用DMF、甲醇、二氯甲烷各洗涤三次。
缩合Ph3P(Br)(CH2)4COOH之后,加入50mL 1%TFA/二氯甲烷脱去赖氨酸侧链的保护基团Mtt,抽干溶剂。分别用DMF、甲醇、二氯甲烷各洗涤三次。然后 依次加入Fmoc保护的氨基酸进行缩合(1.06g Fmoc-ε-Acp-OH,2.0g Fmoc-Lys(Fmoc)-OH,4.0g Fmoc-Lys(Mtt)-OH,2.12g Fmoc-ε-Acp-OH)。每步的羧基和氨基缩合的条件是以50mL的DMF为溶剂,加入1.92g TBTU、0.82g HOBt缩合剂和5mL的碱DIPEA,25℃反应大约24小时,具体时间以茚三酮显色为准来判断羧基和氨基缩合是否结束;缩合结束之后抽干溶剂,分别用50mL甲醇,用DMF、甲醇和二氯甲烷洗三次。加入下一个Fmoc保护的氨基酸之前脱除上一个Fmoc的条件:25mL 20%哌啶/DMF室温反应0.5小时,抽干,再加入25mL 20%哌啶/DMF反应0.5小时,抽干,分别用DMF、甲醇、二氯甲烷各洗涤三次。
在最后缩合Fmoc-ε-Acp-OH并且脱掉Fmoc之后,加入100mL 1%TFA/二氯甲烷脱去保护基团Mtt,抽干。分别用DMF、甲醇、二氯甲烷各洗涤三次。加入4.0g DTPAA(二乙三胺五乙酸酸酐),200mL的DMF溶剂和10mL的碱DIPEA,25℃反应,以茚三酮显色判断羧基和氨基缩合结束之后抽干溶剂,分别用50mL甲醇,用DMF、甲醇和二氯甲烷洗三次。加入50mL 50%TFA/二氯甲烷,25℃反应40分钟。过滤,取滤液,用三乙胺将滤液pH调到中性,浓缩至干。加入乙醚,析出白色固体,得粗产品。
粗产品进一步用HPLC纯化,Waters2535_2707_2998_WFC,XBridge Pre C18 5μm 19×150mm,流动相为:溶剂A(0.1%TFA,水),溶剂B(0.1%TFA,CH3CN),溶剂A在15分钟内从80%降到65%;流速10mL/分钟。得到约200mg产品(DTPA)4-spacer-TPP,纯度95%以上。
3、将脱保护的DTPA4-linker-TPP与Gd3+络合,得到(Gd-DTPA)4-linker-TPP靶向线粒体的造影剂分子。具体如下:将含有12.8mg的GdCl3·6H2O的水溶液约0.5mL滴加到100mg上述DTPA4-linker-TPP的水溶液中混合3小时,小心用1.0M氨水调pH值到6左右,室温下静态混合器转动过夜,然后用1.0M氨水和1.0M盐酸小心调pH值到7-8,澄清水溶液冷冻干燥后得到白色粉末(Gd-DTPA)4-linker-TPP靶向线粒体的造影剂分子。用HPLC检测(Gd-DTPA)4-linker-TPP的纯度。HPLC条件,Waters2535_2707_2998,Sapphire C18 5μm 4.6×250mm,流动相为:溶剂A(0.1%,TFA水),溶剂B(0.1%TFA,80%CH3CN,20%水),溶剂B在20分钟内从24%升至44%;流速1.0mL/分钟。纯度95%以上。
实施例7:(Gd-DOTA)4-linker-(对甲苯基)3P靶向线粒体的造影剂分子的合成(这里的linker=Acp)(图12)
1、按照实施例1合成But3DOTA。
2、(对甲苯基)3P(Br)(CH2)4COOH[溴化(4-羧丁基三(对甲基苯基)鏻)]的合成
按照实施例1合成Ph3P(Br)(CH2)4COOH的步骤,把原料7.42g的三苯基膦换成8.61g的三对甲苯基膦,其它原料和条件都不变。得产物溴化(4-羧丁基三对甲苯基鏻)8.0克,产率58%。
3、用固相合成的方法合成DOTA4-linker-(对甲苯基)3P:
按照实施例3的合成步骤,把原料1.77g Ph3P(Br)(CH2)4COOH换成1.94g的(对甲苯基)3P(Br)(CH2)4COOH,其它原料和条件以及检测步骤都不变。
4、将脱保护的DOTA4-linker-(对甲苯基)3P与Gd3+络合,得到(Gd-DOTA)4-linker-(对甲苯基)3P靶向线粒体的造影剂分子。按照实施例3的络合步骤,将含有12.6mg的GdCl3·6H2O的水溶液约0.5mL滴加到100mg上述DOTA4-linker-(对甲苯基)3P的水溶液中混合,其它原料和条件以及检测步骤都不变。
实施例8:(Gd-DOTA)4-linker-TPP2靶向线粒体的造影剂分子的合成(图13,这里的linker为Lys(Acp)-NH2,造影单元Gd-DOTA连接在线型多肽分子上,两个靶向单元TPP连接在线型分子的同一端,该Lys的羧基被酰胺化)
1、按照实施例1的方法合成But3DOTA和Ph3P(Br)(CH2)4COOH。
2、按图13所示的结构用固相合成的方法合成线型分子连接的DOTA4-linker-TPP2。本实施例中,连接子赖氨酸的羧基转换成了酰胺基(本发明所述的所有靶向线粒体的造影剂分子的连接子赖氨酸的羧基都可以转换成酰胺基,并且具有同样的造影效果)。
步骤简述如下:按传统的Fmoc法在固相合成仪上合成,按图10所示的结构,从C端向N端依次偶联氨基酸。首先固相载体使用用于生产C端酰胺结尾的多肽的树脂如Rink Amide AM Resin或者Rink Amide MBHA Resin/Knorr Resin 1g,依次加入2.0g Fmoc-Lys(Mtt)-OH、2.0g Fmoc-Lys(Fmoc)-OH、3.54g Ph3P(Br)(CH2)4COOH进行缩合。每步的羧基和氨基缩合的条件、羧基和氨基缩合是否结束的判断标准、缩合结束之后的后处理、加入Ph3P(Br)(CH2)4COOH之 前脱除Fmoc的条件等与实施例3相同。
缩合Ph3P(Br)(CH2)4COOH之后,加入50mL 1%TFA/二氯甲烷脱去赖氨酸侧链的保护基团Mtt,抽干溶剂。分别用DMF、甲醇、二氯甲烷各洗涤三次。然后依次加入1.06g Fmoc-ε-Acp-OH,2.0g Mtt-Lys(Fmoc)-OH,1.72g But3DOTA进行缩合。每步的羧基和氨基缩合的条件是以50mL的DMF为溶剂,加入1.92g TBTU、0.82g HOBt缩合剂和5mL的碱DIPEA,25℃反应大约24小时,具体时间以茚三酮显色为准来判断羧基和氨基缩合是否结束;缩合结束之后抽干溶剂,分别用50mL甲醇,用DMF、甲醇和二氯甲烷洗三次。加入下一个分子缩合之前脱除上一个Fmoc的条件:25mL 20%哌啶/DMF室温反应0.5小时,抽干,再加入25mL 20%哌啶/DMF反应0.5小时,抽干,分别用DMF、甲醇、二氯甲烷各洗涤三次。这样完成一个造影单元络合剂DOTA的线性连接。再重复此过程两次,完成三个造影单元络合剂DOTA的线性连接;最后一个造影单元络合剂DOTA的线性连接与上述过程相同,但是所加的缩合分子只加入1.06g Fmoc-ε-Acp-OH,1.72g But3DOTA进行缩合,不加Mtt-Lys(Fmoc)-OH分子。
全部缩合之后加入50mL 50%TFA/二氯甲烷,25℃反应40分钟。过滤,取滤液,用三乙胺将滤液pH调到中性,浓缩至干。加入乙醚,析出白色固体,得粗产品。
粗产品进一步用HPLC纯化,Waters2535_2707_2998_WFC,XBridge Pre C18 5μm 19×150mm,流动相为:溶剂A(0.1%TFA,水),溶剂B(0.1%TFA,CH3CN),溶剂A在15分钟内从80%降到65%;流速10mL/分钟。得到约200mg产品(DTPA)4-spacer-TPP,纯度95%以上。
3、将脱保护的DOTA4-linker-TPP2与Gd3+络合,得到(Gd-DOTA)4-linker-TPP2靶向线粒体的造影剂分子。具体如下:将含有12.8mg的GdCl3·6H2O的水溶液约0.5mL滴加到100mg上述DOTA4-linker-TPP2的水溶液中混合3小时,小心用1.0M氨水调pH值到6左右,室温下静态混合器转动过夜,然后用1.0M氨水和1.0M盐酸小心调pH值到7-8,澄清水溶液冷冻干燥后得到白色粉末(Gd-DOTA)4-linker-TPP2靶向线粒体的造影剂分子。用HPLC检测(Gd-DOTA)4-linker-TPP2的纯度。HPLC条件,Waters2535_2707_2998,Sapphire C18 5μm 4.6×250mm,流动相为:溶剂A(0.1%TFA水),溶剂B(0.1%TFA,80%CH3CN,20%水),溶剂B在20分钟内从24%升至44%;流速1.0mL/分钟。纯 度95%以上。
实施例9:三苯基鏻靶向线粒体的造影剂分子标记的间充质干细胞的制备方法
1、将冻存在液氮里的人源骨髓间充质干细胞(hMSCs)取出,在37℃水浴中迅速解冻。在超净台中,用1mL移液枪将解冻后细胞的冻存液取出并置于10mL灭菌离心管中,同时加入2mL完全培养基(基础培养基DMEM-F12 80%~90%,澳洲胎牛血清10%~20%,双抗1%),1000转每分钟离心5分钟,吸去培养基。加3mL完全培养基于离心管中,将细胞沉淀吹散,取出细胞悬液,置于100×20mm培养皿中,继续加入5mL完全培养基,轻轻晃动培养皿,使细胞均匀分散于完全培养基中。再放入37℃,5%二氧化碳的培养箱中培养。细胞复苏第二天,更换培养基,继续培养。当贴壁细胞密度达到80%~90%,吸去培养基。用2mL无菌PBS溶液轻轻洗涤长满细胞的培养皿,再加入1mL PBS和1mL胰蛋白酶,显微镜下及时观察细胞形态,待细胞消化完全后,吸去胰酶,用含4m完全培养基吹打细胞,一分为二转移至两个100×20mm培养皿中,再分别加入6mL完全培养基继续培养。实验取用6-9代的细胞。
2、细胞处理:当贴壁细胞密度达到80%~90%时,用2ml无菌PBS溶液轻轻洗涤长满细胞的培养皿,再加入1mL PBS和1mL胰蛋白酶,显微镜下及时观察细胞形态,待细胞消化完全后,吸去胰蛋白酶。用4mL完全培养基吹打细胞,将细胞悬液转移至10mL灭菌离心管,1000转每分钟离心5分钟,吸去培养基得到细胞沉淀。再用4mL PBS进行同样的重悬操作。
3、电穿孔标记细胞
将按照本发明方法制备的三苯基鏻靶向线粒体的造影剂分子溶于生理盐水,配成1、2、5、10、20、40mM的浓度系列。取100μL样品溶液置于细胞沉淀中(100μL含细胞量为100万~200万个),吹散细胞,将吹散的细胞置于96孔板中,采用壹达电转染仪器及电压120V,脉宽100μs,间隔1000ms,重复6次的电击实验条件,将所述靶向线粒体的造影剂分子导入细胞质中,在施加一定的电脉冲进行实验时,需保证96孔板中的细胞是均匀分散在生理盐水中,而不是已经沉积在96孔板的底部。
实施例10:三苯基鏻靶向线粒体的造影剂分子标记的间充质干细胞的体外 MRI影像方法
1、用实施例1和2制备的三苯基鏻靶向线粒体的造影剂分子,按照实施例9的方法标记间充质干细胞,每种探针浓度标记的细胞一半转移至10mL离心管中,并用3mL PBS洗培养皿,同样移至离心管中。1200转每分钟离心5分钟,除掉PBS。用外径1.3mm的毛细管将细胞转移至内径为1.5mm的一端封口的毛细管中,1500转每分钟离心10分钟,将细胞密堆积于毛细管的底部,用于体外MRI影像试验。
2、另一半细胞继续培养,直到细胞的数量翻倍后,再将其中一半细胞密堆积于毛细管的底部,用于体外MRI影像试验。另一半细胞继续培养,直到细胞的数量翻倍。依此直到体外细胞MRI影像实验结果没有差异。
3、将毛细管中的细胞在11.7T磁共振谱仪中进行T1加权和T2加权成像。T1加权像采用的是饱和恢复序列,TE=5.2ms,TR=500ms,FOV=12×12mm2,矩阵=96×96,层面厚度=0.8mm,层面间隔=0.2mm,累加次数=4;T2加权像采用的是多层面回波,TR=3000ms,TE=80ms,20个回波,FOV=12×12mm2,矩阵=96×96,层面厚度=0.8mm,层面间隔=0.2mm,累加次数=1。
图14是本实施例利用不同结构的含三苯基鏻的靶向线粒体的造影剂分子在不同探针浓度下标记间充质干细胞,细胞标记后再经不同时间繁殖后得到的体外T1加权和T2加权MRI影像结果。实施例中也包括用不具细胞结合能力的Gd-DOTA标记细胞作为体外MRI影像实验参考对比。
图15是本实施例得到的磁标记细胞经不同时间繁殖后得到的体外T1加权MRI影像信号强度随细胞繁殖时间的变化。可以看到:(1)细胞刚被标记时,Gd-DOTA标记细胞的T1加权MRI影像信号增强效应显著,经含三苯基鏻的靶向线粒体的造影剂分子标记的磁标记细胞的T1加权MRI影像信号增强效应不显著,甚至呈现信号减弱效应;(2)伴随磁标记细胞的繁殖,所有磁标记细胞的T1加权MRI影像信号强度都迅速恢复(1~2天之内)到无标记细胞的信号强度水平,表明磁共振T1加权模式下长时间示踪移植细胞体的局限性。
图16是本实施例得到的磁标记细胞经不同时间繁殖后得到的体外T2加权MRI影像信号强度随细胞繁殖时间的变化。可以看到:(1)细胞刚被标记时,Gd-DOTA标记的磁标记细胞的T2加权MRI影像信号呈现显著的增强效应,经含三苯基鏻的靶向线粒体的造影剂分子标记的磁标记细胞的T2加权MRI影像信号 呈现显著的信号减弱效应,随细胞标记时探针浓度的增加,信号减弱程度越显著,甚至能到达乃至低于噪音水平;(2)伴随磁标记细胞的繁殖,经含三苯基鏻的靶向线粒体的造影剂分子标记的磁标记细胞的T2加权MRI影像信号强度恢复速度明显慢于其T1加权MRI影像信号增强效应的恢复速度,约5天内仍然处于噪声水平,约10天内仍与无标记细胞呈现显著的对比度差异(暗信号),需要约16天才达到无标记细胞的信号强度水平,表明磁共振T2加权模式下长时间示踪移植细胞体的可行性。
实施例11:三苯基鏻靶向线粒体的造影剂分子标记的间充质干细胞移植小鼠体内的11.7T活体磁共振T2加权影像
1、按实施例9的方法,利用(Gd-DOTA)4-TPP靶向线粒体的造影剂分子通过脉冲电穿孔方法标记间充质干细胞,靶向线粒体的造影剂分子浓度为20mM;
2、将约3×105个磁标记的细胞通过定点注射的方法移植到小鼠颅内,并在细胞移植后不同时间点(D0~D10)对细胞移植位置进行11.7T磁共振T2加权成像(S是影像的片层序号)。使用直径为38mm的鸟笼线圈,采用RARE序列参数设置:TE=7ms,TR=125、300、500、750、1000、1500、3000、5000ms,FOV=20×20mm2,矩阵=128×128,层面厚度=0.5mm,平均数=4。得到的影像效果如图17所示:移植细胞一部分位于颅内,并长时间(D0~D10)呈现显著的暗信号(白色箭头指示位置);一部分位于脑室内,该部分细胞在移植后的当天(D0)就在脑室内快速迁移并呈现显著的暗信号,随后(D1~D4)该细胞移植体开始释放靶向线粒体的造影剂分子并使其所处周边组织呈现显著的亮信号(灰色箭头指示位置)。一周后细胞开始死亡,死亡细胞的细胞膜破裂后释放的靶向线粒体的造影剂分子也使其所处周边组织呈现显著的亮信号(黑色箭头指示位置)。这是本发明提供的磁共振靶向线粒体的造影剂分子及影像方法的一个显著特点,在实际应用中可以明确地将细胞移植体与其周边的组织区分开来。
实施例12:三苯基鏻靶向线粒体的造影剂分子标记的间充质干细胞移植大鼠体内的3T活体磁共振T2加权影像
1、按实施例9的方法,利用(Gd-DOTA)4-TPP靶向线粒体的造影剂分子通过脉冲电穿孔方法标记间充质干细胞,靶向线粒体的造影剂分子浓度为20mM;
2、将约1×107个磁标记细胞通过定点注射的方法移植到小鼠前腿肌肉中, 并在磁标记细胞移植后对磁标记细胞移植位置进行3T磁共振T2加权成像,得到的影像效果如图18所示,细胞移植体呈现显著的暗信号,说明本发明提供的靶向线粒体的造影剂分子、由其标记的磁标记细胞及磁共振影像活体示踪方法在临床影像设备上也具有应用可行性。
实施例13:双三苯基鏻靶向线粒体的造影剂分子标记的间充质干细胞的体外MRI影像
用实施例8制备的双三苯基鏻靶向线粒体的造影剂分子,按照实施例9的方法标记间充质干细胞,按照实施例10的方法进行磁标记细胞的体外T2加权MRI影像。
图19是本实施例得到的磁标记细胞经不同时间繁殖后得到的体外T2加权MRI影像信号强度随细胞繁殖时间的变化与实施例10中部分结果的对比。可以看到:经含双三苯基鏻的靶向线粒体的造影剂分子标记的磁标记细胞的T2加权MRI影像信号强度恢复速度明显慢于经含一个三苯基鏻的靶向线粒体的造影剂分子标记的磁标记细胞,表明前者在磁共振T2加权模式下可以在更长的时间范围内活体示踪移植细胞体。
图20是本实施例得到的磁标记细胞经不同时间繁殖后得到的体外T2加权MRI影像信号强度与细胞中Gd含量变化的关系,表明要使磁标记细胞在T2加权MRI影像信号强度降到噪声水平所需要的最少细胞Gd含量可以低至5×109Gd/细胞。
以上所述仅为本发明的较佳实施例而已,并非用于限定本发明的保护范围。凡在本发明的精神和原则之内所作的任何修改、等同替换、改进等,均包含在本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!