黄芪散在制备预防或治疗阿尔茨海默病的药物中的应用的制作方法
本发明属于中药领域,涉及黄芪散,具体来说是黄芪散在制备预防或治疗阿尔茨海默病的药物中的应用。
背景技术:
阿尔茨海默病(Alzheimer’s disease,AD),是一种最常见的中枢神经系统退行性疾病,也是老年痴呆的最常见类型,AD临床病理主要表现为持续性认知能力下降,进行性记忆能力减退,运动功能障碍,性格改变,语言功能障碍,最终发展为痴呆。阿尔茨海默病的神经病理学特征主要表现为沉积在细胞外的老年斑(Senile plaques,SPs),细胞内聚集的神经纤维缠结(Neurofibrillary tangles,NFTs)以及特定脑区的神经元死亡。这种疾病最早是在1906年11月3日,由德国精神病医生阿尔兹海默(Alois Alzheimer)在德国西南地区精神病医师学会第37届大会上首次报道的,他采用Bielschowsky银染技术研究了病人的脑组织,发现在痴呆病人的脑内存在两种罕见的银染呈深色的沉积:一种是位于特定脑区的胞外沉积,现在被称作淀粉样蛋白斑;另一种是位于胞内的沉积,阿尔兹海默将其描述为神经纤维缠结。后来,Kraepelin便以发现者的名字命名了该疾病:阿尔兹海默病。自从阿尔兹海默医生发现AD病人脑内存在这两种异常沉积后,科学家们便开始研究它们的组成成分。目前,关于AD的发病原因及其病理机制了解还不清楚,并且尚没有有效的治疗方法。上世纪60年代,利用电子显微镜技术,Michael Kidd和Robert Terry分别独立的描述了老年斑的精细结构,老年斑主要是由具有淀粉样结构的物质组成。所谓的“淀粉样结构”是指具有反式β-折叠结构的直径在10纳米左右的细丝(fibril)。由于反式β-折叠结构的物质很容易与染料结合从而被着色,所以可以通过一些染料来标记老年斑,Thioflavine S是其中较为常用的,用于标记淀粉样蛋白斑的一种染料。而神经纤维缠结的主要成分是高度磷酸化的微管蛋白。
随着世界人口的不断老龄化,AD的发病率也呈现出了不断上升的趋势,根据现有人口及患病率可以推算,到2020年全球的AD患者将到达4230万。2040年,患者将突破8110万人口。如此庞大的患者数量,将给社会造成极大的负担。由于AD发病时间较晚,并且没有特异性指标,在早期是很容易被忽略的,因而会错过了最佳的治疗时期,当被确诊时通常已经到了晚期。AD已经成为了继心血管疾病、肿瘤和脑卒中之后的第4位杀手,严重的危害老年人的身体健康和老年人的生活质量,成为当前老年医学所面临的最为严峻的问题之一。关于AD的流行病学调查,揭示了多个与AD相关的因素,如衰老、性别、基因多态性、心脑血管疾病史、脑外伤和受教育水平等。其中衰老是最主要的因素。随着年龄的增长,AD的发病率及病情的恶化程度也会呈明显上升趋势。据统计,65岁人群中的平均患病率为1%,75岁为5%,85岁为18%,95岁上升至53%,也就是说每两个人中至少有一个人为老年痴呆患者。
β-淀粉样多肽(β-amyloid peptid,Aβ)是一种分子量略大于4KDa的多肽,关于Aβ的生理作用,目前尚不清楚。早期文献报道,低浓度的Aβ可以促进神经元存活和突触可塑性。近来文献报道,Aβ可以促进海马神经元突触前释放神经递质。关于Aβ的毒性也得到了很多方面证据支持。人们首先在培养的细胞中发现Aβ可以导致神经元死亡,之后在APP转基因小鼠中发现Aβ可以导致突触的丢失,另外Aβ也可以通过位于星形胶质细胞和小胶质细胞上的受体,激活星形胶质细胞和小胶质细胞,使其释放细胞因子和炎症因子等,反过来作用于神经元,导致神经元的死亡。到底是细胞内还是细胞外的Aβ有神经毒性仍存在争议。在AD病人脑内,Aβ的构象发生了改变,形成了β-折叠二级结构而易于发生聚集。Aβ是生理代谢的自然产物,由β-淀粉样多肽前体蛋白(amyloid precursor protein,APP)剪切产生的。APP是一种分子量在110-130KDa的单次跨膜的Ⅰ型膜蛋白,包含有一个大的N端胞外结构域和一个短小的C端胞内结构域,有三种蛋白酶参与了APP的蛋白加工过程(APP processing),根据酶切位点发现的早晚顺序分别称为α-分泌酶、β-分泌酶和γ-分泌酶(如图1所示)。APP的剪切过程有淀粉样途径和非淀粉样途径两种途径,淀粉样途径是由β-分泌酶剪切,APP被剪切为游离形式的N-端蛋白片段(sAPPβ)和留在膜上的含β-淀粉样多肽的C-端(C99),因其所含的氨基酸个数而被称为C99,C99片段被膜上的γ-分泌酶复合体进一步剪切,产生Aβ和APP胞内结构域片段(APP intracellular domain,AICD)。由于γ-分泌酶可以在多个位点剪切APP,导致了产生的Aβ的长度是可变的,比较常见的是40或42个氨基酸残基的多肽片段,命名为Aβ40和Aβ42。大部分全长的Aβ是由40个氨基酸组成的,有一小部分(大约10%)是由42个氨基酸组成的。由于Aβ42多了两个疏水的氨基酸残基而更易于聚集。
非淀粉样途径是由α-分泌酶剪切APP,产生游离形式的N-端sAPPα和C-端片段C83,C83片段进一步被γ-分泌酶复合体剪切生成P3和AICD,由于α-分泌酶的酶切位点位于Aβ的结构域内部,所以不会产生Aβ。Aβ可以自发的聚集,形成多种共存的形式。可以由2-6个多肽形成寡聚体,并进一步融合形成中间聚集体;也可形成纤维,并列为β-折叠片,进一步形成不可溶性纤维。在AD病人的脑组织中,构象发生改变的Aβ聚集并在细胞外沉积,与变性的神经突起构成了老年斑,并且在老年斑的周围常常伴随有胶质细胞的激活。可溶性的寡聚体和淀粉样中间聚集体是Aβ毒性最高的两种形式。
目前研究的比较多的常染色体上的三个基因的突变会导致家族性遗传阿尔兹海默病(familiar Alzheimer disease,FAD),分别是位于21号染色体上的APP基因、位于14号染色体上的早老素1(presenilin 1,PS1)基因以及位于1号染色体上的早老素2(presenilin2,PS2)基因。在APP基因上目前发现大约有25个与AD相关的突变。其中的一些突变如K670N/M671L的Swedish突变,可增加APP被β-分泌酶的剪切;另一些突变如1716V的Florida突变或V7171的London突变,可促进γ-分泌酶的切割产生更多的Aβ42;还有一些突变如E693G的Arctic突变,可促进Aβ的聚集,产生更多的更具有毒性的寡聚体。这些在FAD中发现的基因突变为AD的转基因动物模型提供了理论依据,使得研究者可以在动物水平研究AD的病理过程。我们在该实验中所用到的AD转基因动物模型就是过表达人类APP蛋白的Swedish突变(K595N/M596L)和PS1的第9个外显子敲出突变的转基因小鼠(APPswe/PS1ΔE9)。这种转基因的小鼠通常在6个月龄时就会出现老年斑,并且9个月龄时老年斑就已经比较多。
图1显示了淀粉样途径:β-分泌酶将APP剪切成两个片段,游离形式的N-端蛋白片段(sAPPβ)和留在摸上的含β淀粉样多肽的C-端(C99)。C99片段进一步被γ-分泌酶复合体剪切,产生Aβ和APP胞内结构域片段(AICD)。
图1同时显示了非淀粉样途径:APP经由α-分泌酶剪切,产生游离形式的N-端sAPPα和C-端片段C83,C83片段进一步被γ-分泌酶复合体剪切生成P3和AICD。
除了家族性遗传的早发性AD病人,绝大多数的AD病人属于散发型。AproE的多态性是与散发型AD关联性最好的遗传因子,因此AproE被称为AD的危险因子。AproE是一个与胆固醇运输和代谢相关的载脂蛋白,在脑内主要是由星形胶质细胞和小胶质细胞分泌,可以将胆固醇从星形细胞运输到神经元,神经元则表达其受体。ApoE包含299个氨基酸,包含有三种形式,AproE2、AproE3以及AproE4。在AD病人中AproE4的比例显著提高,说明ApoE4的升高可能导致AD的发病。AproE4基因突变体是目前已知最具危险性的散发型AD的遗传性因素之一,40%~60%的AD患者是该基因变异型的携带者,说明ApoE4基因与AD的发病密切相关,它可能增加了患者对AD的易感性,从而增加发生AD的危险性,但关于ApoE4基因增加AD易感性的确切机制目前还不清楚,相反ApoE2则具有保护功能。综上所述,APP、PS1和PS2基因的突变可导致家族性AD的发生,ApoE4则是散发型AD的危险因子。
下面描述AD的发病机理:
目前关于AD的发病机理有很多假说,包括淀粉样级联假说、Tau蛋白假说、炎症与免疫假说、钙稳态失衡假说、早老素假说和胆碱能假说等。其中淀粉样级联假说占主导地位,淀粉样级联假说认为,遗传或环境因素可导致Aβ的产生和清除之间的不平衡状态,以及Aβ的聚集,会导致Aβ的过度积累,当Aβ过度积累则会发生聚集、形成寡聚体的纤维丝。寡聚体形式的Aβ毒性最强。可导致神经突起的损伤和突触功能的异常,引起神经元内离子浓度失衡,细胞产生氧化应激;打破蛋白激酶和磷酸酶的平衡,导致Tau蛋白的过度磷酸化,产生神经元纤维缠结。最终,Aβ会引起突触和神经元的死亡,神经环路的破坏,最终导致痴呆。Aβ的过度产生和积累,被认为是导致AD的主要原因。近年来,可溶性形式的、寡聚体的以及胞内的Aβ在促进阿尔兹海默病中的机制也越来越受到重视。Tau蛋白是一种微管相关蛋白,主要存在于神经元的轴突中,是由352-441个氨基酸组成的。在AD病人脑中神经元内纤维缠结(NFTs)的主要成分就是过度磷酸化的tau蛋白,异常tau蛋白的病理性沉积导致了NFTs的形成,而NFTs作为大脑早老化的标志之一是随着AD病程的发展而逐渐增多的,并与临床上患者的痴呆程度相关的。越来越多的证据表明tau蛋白在AD的进程中发挥着关键的作用,特别是tau蛋白水平及其磷酸化修饰对线粒体功能的影响。Tau蛋白在嗅皮质和海马至整个大脑皮质聚集的扩散,与AD的病程相关性也深受学者们的重视,体外的实验也已经证实tau蛋白可以在细胞间扩散。现在的大多研究主要集中在Aβ生成的机制上,包括β-分泌酶和γ-分泌酶的功能研究。Aβ生成量的增加可解释一部分的病例,主要是携带突变的APP和早老素1或早老素2基因的患者。随着对AD的深入研究,越来越多的研究者认为,很多AD患者可能是由于脑内清除Aβ的功能出现障碍,导致生命过程中生成的Aβ无法被及时清除,从而使Aβ聚集,导致了AD。遗传有载脂蛋白E4(ApoE4)等位基因的个体更容易患AD,通过对病因的研究发现,携带ApoE4等位基因的个体Aβ的生成量并没有增加,在细胞水平上共表达APP和ApoE4也没有改变细胞Aβ的生成量。根据人的神经病理性损伤分析和动物模型研究,发现ApoE能使脑中的Aβ总体水平稳定升高,可能是因为增加了Aβ的纤维形成能力和/或是降低了Aβ的清除。尽管它的具体机制还尚未研究清楚,但ApoE介导的大脑中Aβ水平的增高至少示提了细胞在Aβ清除方面可能存在功能障碍。
关于中药治疗阿尔兹海默病的研究:
目前对于AD的治疗,尚缺乏疗效满意的治疗药物.针对病因不清、多因素相关的复杂性疾病,中医药多靶点、多环节治疗的特点可能比单靶点治疗具有优势。目前用于临床治疗AD的药物主要是胆碱酯酶抑制剂和谷氨酸受体激动剂,但其作用还很有限,且有副作用。中草药资源在我国含量丰富,有着悠久的治疗疾病历史。研究表明,有些中草药成分能够改善动物模型的认知和记忆能力,但是具体的作用机制尚不清楚。AD属于中医学“呆证”、“痴证”、“虚劳”、“善忘”等范畴,中医学对AD的认识由来已久。近年来大量的实验研究也证明中医药在治疗AD时有着显著的调节神经递质、减轻炎症与免疫反应、减少神经元的凋亡、抑制Aβ和tau蛋白的过度沉积等作用。目前认为神经原纤维缠结和老年斑均是AD的病理学标志物,它们究竟与中医病理的哪个环节关系更为密切,可能会成为将来研究的一个方向。随着对中医药治疗AD机制的深入研究,探索AD中医病理与西医病理之间的交叉点,发现两者之间的内在联系,可成为筛选有效治疗AD中药的有效途径。
李林等人的研究发现中药复方和单味中药的提取物都可以作用在AD发病机制的多靶点和多途径,特别是部分补肾中药,如何首乌二苯乙烯苷、山茱萸环烯醚萜苷、淫羊藿苷等,具有神经保护和神经营养再生作用,对于治疗AD具有比较明显的特点和优势。张云玲等人通过观察黄芪提取物对Aβ25-35所致阿尔兹海默病模型大鼠的学习记忆能力及脑内海马神经元Bcl-2和Bcl-xl表达的影响,发现黄芪提取物能改善AD模型大鼠的学习记忆能力,对海马组织有一定的保护作用,其机制可能是通过增加Bcl-2和Bcl-xl的表达而抑制海马神经元的凋亡。鲁国等利用β-淀粉样肽(Aβ25-35)右侧杏仁核注射制备AD大鼠模型,发现葛根素可显著改善AD模型大鼠的空间记忆障碍,提高其脑内神经元Bcl-2的表达,降低Bax表达,说明葛根素能对抗β-淀粉样肽的神经毒性,机制可能与抑制神经元凋亡有关。朱燃等人利用双基因转染细胞模型探究了黄芪总皂苷、天麻素、三七总皂苷、盐酸川芎嗪、葛根素、蛇床子素、淫羊藿黄苷、人参皂苷Rb1、隐丹参酮和芍药苷这10种对动物脑认知和记忆损伤有改善作用的中药活性成分,筛选结果表明,其中的黄芪总皂苷、天麻素、隐丹参酮和芍药苷4种中草药成分对细胞模型分泌到细胞培养液中的Aβ水平有明显的降低作用,而且这种降低作用呈剂量依赖性。2006年北京中医药大学学报报道了银杏叶中提取的一种混合物EGb761,能够通过抑制β淀粉样蛋白前体蛋白的mRNA表达,抑制Aβ激活胶质细胞,降低皮层和海马中星形胶质细胞的增生,改善AD大鼠的认知记忆能力。也有报道指出黄芪三仙汤、中药地黄饮子夜可抑制神经胶质细胞的激活、减少炎症细胞因子的表达,从而改善AD模型大鼠的学习记忆能力。这些研究表明,很多中药的有效成分都能够通过抑制中枢神经系统的免疫炎症级联反应以及降低Aβ的量,来预防和治疗AD。现在临床上以及仍处在实验研究阶段的药物大都是针对AD的一个靶点设计的,这也可能是现有药物疗效并不是那么好的原因所在。
黄芪散出自《圣济总录》組方为黄芪,葛根,桑白皮(1:2:1)。其主治三消渴疾,肌肤瘦弱、饮水不休,小便不止。用法为黄耆锉桑根白皮锉细各一两葛根锉二两捣罗为散,每服三钱匕(引自原文),煎杀猪汤,澄清调下,不拘时。
技术实现要素:
针对现有技术中的上述技术问题,本发明提供了黄芪散的新的用途,所述的这种黄芪散的新的用途要解决现有技术中的中药防治阿尔茨海默病的效果不佳的技术问题。
本发明提供了黄芪散在制备预防或治疗阿尔茨海默病的药物中的应用,所述的黄芪散由黄芪、葛根和桑白皮组成,黄芪、葛根和桑白皮的质量比为1:2:1。
本发明和已有技术相比,其技术进步是显著的。本发明源自北宋《圣济总录》,全方由葛根、黄芪、桑白皮组成,其主治三消渴疾,肌肤瘦弱、饮水不休,小便不止。通过药效学试验证明本发明黄芪散有抑制阿尔茨海默病发生,改善阿尔茨海默病的任职减退等功能,并具有标本兼治之功,能有效地防治阿尔茨海默病。
附图说明
图1为APP的加工过程示意图。
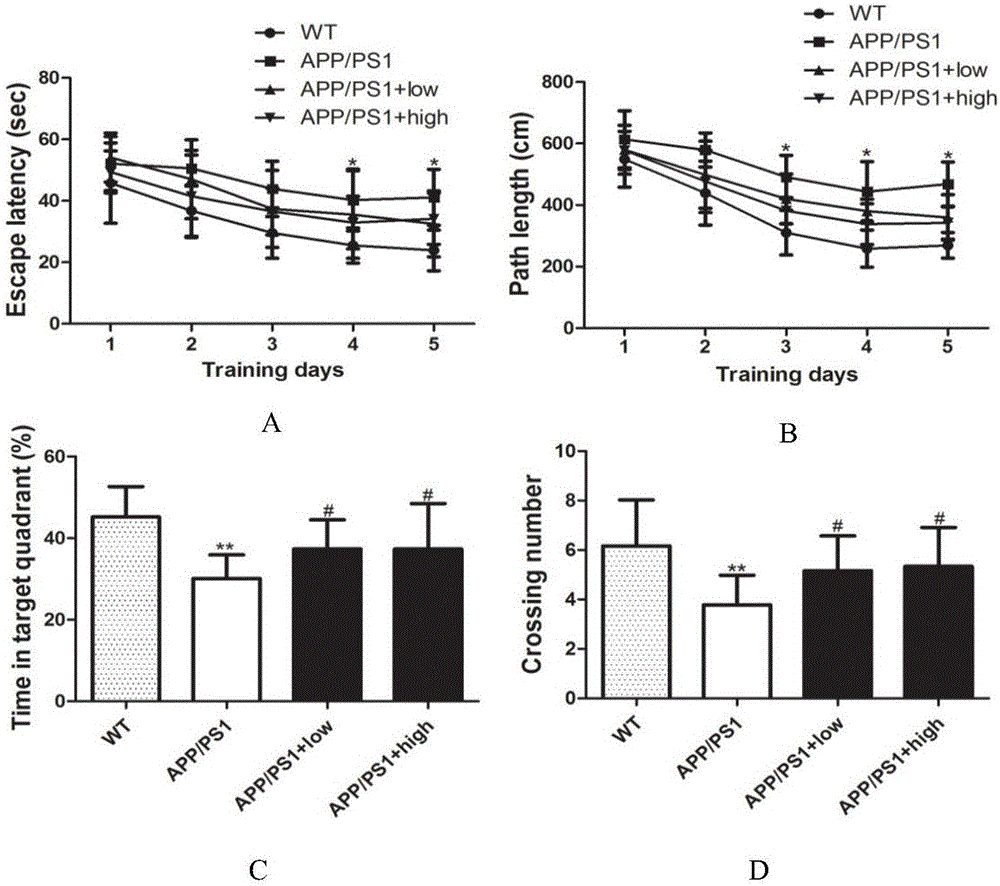
图2显示了中药复方HQ201508能改善APP/PS1小鼠的空间学习记忆能力;图A和B:中药复方HQ201508饲料干预6个月后,对小鼠进行Morris水迷宫实验,统计训练阶段不同组小鼠寻找水中平台所用的平均时间,即A图显示的潜伏期。以及统计了小鼠找到平台的平均距离,即B图中显示的路径距离,每组有10~12只小鼠。APP/PS1小鼠与野生型小鼠(WT)比较*P<0.05。图C和D:撤去平台后,统计了不同组小鼠在平台所处象限停留的时间比例(C)和小鼠穿越平台所在区域的次数(D)。与WT小鼠比较*P<0.05,与模型组的APP/PS1小鼠比较#P<0.05。
图3示了中药复方HQ201508改善APP/PS1小鼠自主性活性以及对新事物识别的行为;图A:各组小鼠在旷场实验中5min内活动的总路程;图B:各组小鼠在旷场试验中5min内活动的平均速度;图C:各组小鼠在旷场试验中5min内在周围区域所停留的时间占总时间的百分比。每组有10~12只小鼠。与WT小鼠比较***P<0.0001,与模型组的APP/PS1小鼠比较#P<0.05。图D:新事物识别试验中小鼠对新物体的鉴别指数;图E:新事物识别实验中训练阶段和测试阶段,小鼠对物体的识别的总时间,小鼠在每组有10~12只小鼠。与WT小鼠比较**P<0.001,与模型组的APP/PS1小鼠比较#P<0.05。
图4显示了中药复方HQ201508能提高APP/PS1小鼠的探索性行为和好奇性行为;A和B:中药复方HQ201508药饲料干预6个月后,对各组小鼠进行Y-迷宫实验,统计小鼠在第二次检测时,8分钟内,小鼠进入目标臂中的次数(A)和小鼠在目标臂中停留的时间(B),每组小鼠10~12只,与野生型组的WT小鼠比较**P<0.001,与AD模型组的APP/PS1小鼠比较#P<0.05。
图5显示了中药复方黄芪散减少APP/PS1小鼠脑中的β淀粉样蛋白的累积,其中,图A:中药复方HQ201508饲料干预6个月后,用Thioflavine S染料标记各组小鼠大脑皮层和海马中的β淀粉样蛋白斑。标尺为50μm。图B:对不同分组中的小鼠大脑皮层和海马中的β淀粉样蛋白斑分别进行定量,用比例表达。每组有5只小鼠,与APP/PS1转基因AD模型组比较*P<0.05。图C:对不同分组中的小鼠大脑皮层和海马中的β淀粉样蛋白斑分别进行定量,用绝对值表达。每组有5只小鼠,与APP/PS1转基因AD模型组比较*P<0.05。
图6显示了中药复方HQ201508能减少APP/PS1小鼠脑中小胶质细胞的激活;图A和C:中药复方HQ201508饲料干预6个月后,对小鼠脑片进行Iba1抗体的免疫组织化学染色。A图显示的是大脑皮层的染色,C图显示的是海马的染色。标尺为50μm。图B和D显示的是大脑皮层(B)和海马(D)的Iba1免疫组化阳性小胶质细胞的计数统计结果。每组有5只小鼠,与WT小鼠比较*P<0.05,与APP/PS1小鼠比较#P<0.05。
图7显示了中药复方HQ201508能减少APP/PS1小鼠脑中星形胶质细胞的激活;A和C表示加药饲料干预6个月后,对小鼠脑片进行GFAP抗体的免疫组织化学染色。A图显示的是大脑皮层的染色,C图显示的是海马的染色。标尺为50μm。B和D显示的是大脑皮层(B)和海马(D)的Iba1免疫组化阳性星形胶质细胞的计数统计结果。每组有5只小鼠,与WT小鼠比较*P<0.05,与APP/PS1小鼠比较#P<0.05。
图8显示了中药复方HQ201508能减少APP/PS1小鼠脑中Aβ40和Aβ42的水平;中药复方HQ201508饲料干预6个月后,各组APP/PS1小鼠皮层和海马中可溶性和不可溶性Aβ42和Aβ40的Elisa检测结果。A,皮层和海马中可溶性形式的Aβ42水平;B,皮层和海马中可溶性形式的Aβ40;C,皮层和海马中不可溶性形式的Aβ42水平,D,皮层和海马中不可溶性形式的Aβ40水平。每组有5只小鼠,与APP/PS1小鼠比较*P<0.05。
图9显示了中药复方HQ201508能减少APP/PS1小鼠脑中Aβ40和Aβ42的水平;中药复方HQ201508饲料干预6个月后,各组APP/PS1小鼠脑组织皮层和海马中APP和Bace1蛋白检测结果。A,皮层中的APP和Bace1蛋白检测结果;B,皮层中的APP和Bace1蛋白分析结果;C海马中的APP和Bace1蛋白检测结果;D,海马中的APP和Bace1蛋白分析结果。每组中有5只小鼠。
具体实施方式
下面结合实施例对本发明作进一步描述。
本发明实施例所用的葛根、黄芪、桑白皮均符合中国药典2005年版一部正文各药材项下的有关各项规定。各药材已经过净制、切制、炮制、粉碎等加工处理,投料前,通过鉴定,各味药材实物与名称相符,质量符合国家药典标准(具体药材鉴定办法参照药典标准执行)。本发明所用的试剂及抗体如下:
本发明的主要试剂如下:
PB缓冲液:NaH2PO4.2H2O 4.37g/L;Na2HPO4.12H2O 25.79g/L;PH7.2;
PBS缓冲液:PB溶液100ml、NaCL 9g溶入1L水中,调节PH至7.2;
麻醉剂:12%的水合氯醛,溶剂用Ⅰ级水;
多聚甲醛:用PB溶液配制4%的PFA,70℃,搅拌4~5小时至澄清;
生理盐水:0.9%NaCL(每只小鼠灌注50ml);
High PB溶液:NaCl 24.04g/L;KCl/L 0.604;Na2HPO4.12H2O 10.74g/L;
KH2PO4 0.708g;
RIPA buffer:150mM NaCl;50mM Tris PH8.0;1.0%Nonidet P-40;0.1%SDS;
0.5%Sodium deoxycholic aci;
TBST溶液:20ml 1mol/L Tris-Hcl PH7.6,8g NaCl,0.5ml Tween20。
实施例1
1.1转基因小鼠模型:
本发明所使用的阿尔兹海默病双转基因小鼠模型APPswe/PS1dE9(APPswe,瑞士家族性AD诱发突变型,presenilin1,早老素1))模型购自南京模式动物研究所。饲养于上海中医药大学动物房。Jackson Laboratory的株名:B6C3-Tg(APPswe,PSEN1dE9)85Dbo/J;序号004462。这种双转基因阿尔兹海默病模型小鼠表达人源APP的瑞士家族性AD诱发突变型的突变体和人源删除第九个内显子突变位点的PS1的突变体,这两个基因突变在这种小鼠中遗传共分离。这种小鼠模型通常在6个月龄时脑内开始出现淀粉样蛋白斑沉积,9个月龄时出现学习和记忆障碍,具有类似于阿尔兹海默病的病理表现。饲养于SPF级鼠房,给予充足的水和饲料,鼠房温度维持在23℃,12小时光照,12小时黑暗,实验所用的阿尔兹海默病转基因小鼠是由APP/PS1双转基因阿尔兹海默病小鼠模型与C57BL/6J背景的小鼠繁殖自主培育并鉴定的。本实验中所有动物实验均遵守实验动物管理及动物使用规定。
1.2转基因小鼠的鉴定:
在小鼠出生后3周左右,利用剪脚趾法对小鼠进行标记,收集剪下的组织用来进行基因型鉴定;选择APP/PS1阳性的雄性小鼠入实验组。并以同窝野生型C57BL/6J雄性小鼠作为正常对照组。此外,在饲养结束后处死小鼠进行取材的时,剪取小鼠尾(3-5mm)进行基因型的重新鉴定;两次鉴定的结果进行比较,在统计数据时应去除基因型为假阳性的小鼠数据。
1.3基因组DNA的提取:
1)配制裂解液:500uL lysis buffer+120uL 0.5M pH8.0EDTA+10uL 20mg/ml蛋白酶K,共630uL,可用2个样品。把收集的组织(小鼠脚趾),用裂解液裂解,在55℃加热(烘箱)过夜。每只老鼠300ul裂解液裂解。
2)次日向EP管中加入100uL蛋白沉淀剂(Protein Precipitation Solution),最高转速涡旋20秒,或者上下颠倒EP管剧烈摇晃,然后冰上放置10min。
3)离心机4℃,转速13000rpm,离心40-60min,将上清转移至新的1.5mL EP管中。或可先离心30min,转移上清于新EP管后,再离心30min取上清。可得上清约350-400uL。
4)向管中加入300-400uL异丙醇(等体积的异丙醇),上下颠倒数次混匀(不要剧烈摇晃,以免DNA链断裂),可见白色絮状沉淀。置于-20度冷冻2h,沉淀会更多。
5)离心机4℃,转速13000rpm,离心20min。可见管底透明沉淀,弃上清。
6)加入800uL70%的乙醇,上下颠倒数次,沉淀变白,更加明显;
7)离心机4℃,转速13000rpm离心10min,倒掉上清,在吸水纸上晾干,根据沉淀的量估计确定下一步骤加水的量,室温干燥30min(使酒精和水充分挥发)。
8)用20-50uL ddH2O溶解DNA,于4℃保存,以备PCR用。
1.4 PCR鉴定基因型:
1)APP、PS1引物由生工生物工程有限公司合成
①APP扩增引物为:
转入基因的正意基因链(Transgene sense)
5’GACTGACCACTCGACCAGGTTCTG3’
转入基因的反意基因链(Transgene Antisense):
5’CTTGTAAGTTGGATTCTCATATCCG3’
内参阳性对照正向基因链(Internal Positive Control Forward):
5‘CTAGGCCACAGAATTGAAAGATCT3’
内参阳性对照反向基因链(Internal Positive Control Reverse):
5‘GTAGGTGGAAATTCTAGCATCATCC3’
②PS1扩增引物为
转入基因的正意基因链(Transgene sense):
5’AATAGAGAACGGCAGGAGCA3’
转入基因的反意基因链(Transgene Antisense):
5’GCCATGAGGGCACTAATCAT3’
内参阳性对照正向基因链(Internal Positive Control Forward):
5‘CTAGGCCACAGAATTGAAAGATCT3’
内参阳性对照反向基因链(Internal Positive Control Reverse):
5‘GTAGGTGGAAATTCTAGCATCATCC3’
2)PCR反应体系:
3)PCR反应条件:
PCR循环参数设置:94℃预变性3min;94℃变性30sec;引物54℃复性1min;72℃延伸1min;35个循环后;72℃延伸2min;10℃维持。
4)琼脂糖凝胶电泳:
用去离子水配制1.5%的琼脂糖凝胶,取7μl PCR反应产物,140V,跑胶15分钟,EB曝光。PCR反应产物长度APP Transgene=350bp,Internal positive control=324bp;PS1Transgene=~608bp,Internal positive control=324bp
上述实验证实实验所用小鼠是由APP/PS1双转基因的阿尔兹海默病小鼠模型。
实施例2
2.1中药提取及饲料制备
本发明由黄芪、葛根和桑白皮组成,黄芪、葛根和桑白皮的质量比为1:2:1,葛根、黄芪、桑白皮三味药材均购自上海华宇药业有限公司,葛根、黄芪、桑白皮一起粉碎后用质量百分比浓度为70%的乙醇回流提取2次,每次提取2小时,100目过滤后,合并2次提取液,减压浓缩至2g/ml,75℃真空干燥至干浸膏,得786.5g,得率为19.66%。(下述的实验均采用此组份喂养)
本实验制备了两个剂量的本发明小鼠饲料:1)低剂量饲料,按每千克饲料中添加20g黄芪、40g葛根、20g桑白皮生药的浸膏制作成低剂量的小鼠饲料。2)高剂量饲料,按低剂量饲料的3倍剂量制作,即按每千克饲料中添加60g黄芪、120g葛根、60g桑白皮生药的浸膏制作成高剂量的小鼠饲料。实验中基础饲料中所添加的本发明的浸膏量是根据人和动物体表面积折算系数法确定。
2.2小鼠分组及中药干预方式
将满3个月龄的APP/PS1双转基因雄性小鼠,随机分为模型组、本发明低剂量组以及本发明高剂量组,并以同窝野生型C57BL/6J雄性小鼠作为正常对照组,每组12只,本发明干预组的小鼠分别饲喂添加有低剂量本发明的饲料和添加有高剂量本发明的饲料,模型组和正常对照组饲喂普通的小鼠饲料,连续喂养6个月,即在小鼠9月龄时,对其进行行为学实验---Morris水迷宫实验,Y迷宫实验以及旷场和新事物识别实验,行为学实验检测之后进行取材(脑组织)。
2.3行为学检测:
2.3.1 Morris水迷宫(Morris water maze)
Morris水迷宫实验是英国心理学家Morris于20世纪80年代初设计的一种主要用于测试动物的空间学习记忆能力的实验手段。水迷宫实验原理:老鼠是天生的游泳健将,但小鼠却很厌恶在水中的环境,在水中小鼠会寻找出路,它们通常会沿水池壁的周围寻找出路,因此水迷宫实验中,训练的第一天通常会看到小鼠沿着水池壁绕圈,目的是能是找到隐藏在水下的平台,最终从水中逃脱出来。这一行为中涉及到复杂的记忆过程,包括信息的收集和空间定位相关的视觉信息,以及对信息处理,记忆以及整理的过程。水迷宫实验的具体操作方法如下:在一个直径为120厘米,高50厘米的圆形池中注入深约30厘米的水,水温控制在21-23℃,并在水中加入白色素搅拌均匀使水浑浊,以便于对黑色小鼠进行追踪标记。将该池水平面划分为四个等分的象限,然后把一直径为5厘米的平台放置于第四象限的水下1.5厘米处,确保小鼠看不到平台。用黑色窗帘围绕水池,窗帘上有三个不同形状不同颜色的物体(圆形,三角形,正方形),便于小鼠用来记忆位置。在整个实验过程中,平台始终处于相同的位置。其它实验条件也维持原样不变。从其中的一个象限开始,使小鼠面向池壁,温和的把小鼠放入水中,使它在60秒内寻找水下的平台,记录下找到平台时所花费的时间,当小鼠自己爬上平台时,让它在平台上停留30秒再把它取出放入单独的笼中,开始下一个象限时休息约60分钟。如果小鼠在规定的时间内没有找到平台,实验操作者应引导小鼠至平台上,人为的让小鼠在平台上停留30秒。训练小鼠找平台5天,自动摄像机同步记录小鼠的运动轨迹,第5天训练结束后撤去平台,观察小鼠在60s内穿越平台区域的次数。
2.3.1.1本发明能改善APP/PS1小鼠的空间学习记忆能力
阿尔兹海默病的病人通常会表现出认知能力下降以及记忆功能的丧失,同样的在APP/PS1转基因小鼠中也存在着类似的空间学习记忆能力的下降。这一行为学的异常是可以通过Morris水迷宫实验来进行验证的。本发明饲料干预6个月后,我们对各组小鼠进行了Morris水迷宫实验,统计结果发现模型组中的APP/PS1转基因小鼠在训练学习的5天里,与野生型小鼠相比寻找平台比较困难,且其潜伏期以及找到平台所需的平均运动距离明显高于野生型组(*P<0.05)(图2A和B),而且当撤掉平台后,模型组中的APP/PS1转基因小鼠对平台所在象限及平台的具体位置的记忆也相对的较差,模型组中的APP/PS1转基因小鼠在目标象限中的时间比例及穿过平台所在区域的次数明显小于野生型小鼠,且差异显著(**P<0.001)(图2C和D)。但无论是低剂量本发明饲料喂养组还是高剂量本发明饲料喂养组的APP/PS1小鼠对平台位置的学习和记忆能力都要好于APP/PS1转基因模型小鼠,潜伏期以及寻找平台的所需运动的平均距离低于模型组小鼠,在目标象限中的时间比例以及穿过平台所在区域的次数明显高于模型组(#P<0.05)。这一结果说明本发明能够改善APP/PS1转基因小鼠的学习记忆能力。
2.3.2新事物识别实验(Object recognition task)
新事物识别实验是由高25cm的木板组装成的,旷场有效区域为38x38cm的方形区域,内部为白色。实验分为三个阶段:习惯阶段、训练阶段和测试阶段。在整个实验过程中,保持实验环境和参照体系尽量一致。习惯阶段主要是为了使实验小鼠熟悉新的环境,同时检测小鼠的自主活动。该阶段可以作为旷场实验来记录,旷场有效区平均划分为9个方形区域(3x3)。每只小鼠在中间区域放入,记录5分钟内小鼠运动的总路程/平均速度以及进入中间区域的时间和次数。次日开始新事物识别实验的训练阶段,在旷场中放入两个颜色和形状完全相同的塑料玩具(底面积5cm2,高4cm),玩具放置在与旷场壁相距12cm的对角处,物体粘牢固,以防被随意的移动。放入小鼠,使小鼠适应两个相同的玩具5分钟。1h后把其中一个玩具换为形状不同的新玩具,检测小鼠的学习和识别记忆能力,记录小鼠5分钟内的识别行为。24h后再次检测小鼠识别新玩具的时间和频率。自发识别行为被认为是实验小鼠用鼻子嗅或是用前爪接触物体的行为,其它行为如小鼠坐在物体上或是围绕着物体转圈都不算是识别行为,当小鼠鼻子靠近玩具2cm内即为识别该物体。在每只小鼠实验完成后,均需要用70%的酒精擦拭物体及旷场内部,以防止气味干扰下一只小鼠的识别行为。实验测定的鉴别指数是指小鼠识别新事物的时间与识别的总时间比值,即新事物识别时间/识别总时间×100%。鉴别指数越高则表明实验小鼠对物体的识别记忆能力越好。
2.3.2.1本发明对APP/PS1小鼠新事物识别行为的影响
小鼠对新事物的识别行为可以用鉴别指数(识别新事物的时间/总的识别时间×100%)。为了评估不同实验组小鼠的自发活动行为,我们在新事物识别实验的习惯阶段,记录了小鼠在5分钟内活动的总距离、平均速度以及在中央区域的停留时间。实验结果表明AD模型组中的APP/PS1小鼠与野生型小鼠相比,运动的总路程和平均速度均明显降低(*P<0.0001),低剂量本发明饲料和高剂量本发明饲料干预6个月后的实验组APP/PS1小鼠的总路程和平均速度均明显高于模型组中的APP/PS1小鼠,且低剂量本发明干预组与模型组AD模型小鼠相比,统计学差异显著(#P<0.05),高剂量本发明干预组与模型组AD模型小鼠相比,统计学差异不显著。这些数据表明,APP/PS1小鼠的自主活动性比野生型组小鼠自主活动性降低,而本发明饲料干预6个月,能够改善APP/PS1小鼠的自主活动性(图3A和B)。小鼠天生具有趋避性,且畏惧未知开阔的场所,具有喜好沿周边区域活动的天性。所以从小鼠在周围区域停留的时间的百分比上来看,都大于90%以上,并且各组之间均没有显著性的差异(图3C)。这表明,本发明干预后,并不会影响小鼠的趋避性。
小鼠在新事物识别实验中,本发明干预6个月后,各组小鼠在识别事物的总时间上并没有显著的变化,但在识别新事物的时间上有差异,APP/PS1小鼠的鉴别指数明显低于野生型组的小鼠,而低剂量本发明和高剂量的本发明组小鼠的鉴别指数则明显高于模型组中的APP/PS1小鼠,低剂量本发明干预组与模型组APP/PS1小鼠相比,其统计学差异显著(#P<0.05),但高剂量本发明干预组与APP/PS1小鼠比较,差异不显著(图3D)。各组小鼠新事物识别实验的训练阶段和测试阶段,对物体的识别的总时间是没有显著变化的(图3E)。
2.3.3 Y迷宫(A two--trial recognition Y--maze)
Y迷宫实验是方位记忆检测中常见的实验方式,它是对短期记忆的检测,也通常被用来测试啮齿类动物的空间认知能力。Y迷宫又称三等分辐射式迷路箱,包括三个等长的臂和连接区域,三臂互为120°角,臂长30厘米,宽10厘米,高15厘米。实验的具体操作如下,三个臂设为三个区域,首次检测时,其中一个臂用挡板关闭(目标臂),小鼠从一个臂末端(起始臂)放入,8分钟内让小鼠在开放的起始臂和剩余臂两个臂中自由活动,然后取出小鼠,放回笼中。一个小时后把小鼠从同样的位置放入,同时把关闭的挡板打开,使小鼠在三个臂中自由探索8分钟,摄像系统记录小鼠在8分钟内进入各个臂中的频率和停留时间,每当检测完一次小鼠后,都需用70%的乙醇擦拭设备,以减少气味的干扰[81]。具有正常空间记忆的小鼠相比于进入已探索过的臂,它更倾向于进入未探索过的臂中,而空间记忆受损伤的小鼠既会探索已探索过的臂同样的也会探索未探索过的臂。已被证实,小鼠在目标臂中停留的时间反应了小鼠的探索性行为,而进入目标臂中的次数,表示小鼠的好奇行为。
2.3.3.1本发明能改善APP/PS1小鼠的空间工作记忆能力
利用Y-迷宫实验检测了各组小鼠空间辨别的定位学习记忆能力,在一个“Y”字形的设备中进行检测,通常具有正常空间记忆的小鼠相比于进入已探索过的臂,它更倾向于进入未探索过的臂中,而空间记忆受损伤的小鼠既会探索已探索过的臂同样的也会探索未探索过的臂。实验结果统计显示,与野生型组的小鼠比较,模型组APP/Ps1小鼠进入目标臂的次数和在目标臂中停留的时间均明显减少,且差异显著,具有统计学差异(**P<0.001),这表明APP/PS1模型小鼠的探索性行为和好奇性行为明显降低,低剂量本发明饲料和高剂量本发明饲料干预后的实验组APP/PS1小鼠,进入目标臂中的次数则明显升高,且与模型组中的APP/PS1小鼠相比,差异显著,有统计学意义(#P<0.05)(图4A和B)。这说明本发明能改善APP/PS1小鼠的空间工作记忆能力,可以明显提高APP/PS1小鼠的探索性行为和好奇性行为。
实施例3免疫组织化学及定量
3.1小鼠脑组织的固定、切片
本发明饲料喂养APP/PS1阿尔兹海默病转基因小鼠6个月后,通过腹腔注射12%的水合氯醛(400mg/Kg)对小鼠进行麻醉,待小鼠深度麻醉后,迅速打开胸腔,暴露心脏,心脏灌流50mL 0.9%的氯化钠水溶液后继续灌注100mL的固定液(4%的多聚甲醛),快速剥离脑组织后,将剥离的脑组织放入固定液中继续后固定24小时,然后把脑组织放入30%的蔗糖溶液中。待脑组织沉降后,在滑动切片机(Lecia公司)上进行冰冻切片。我们主要研究了脑片的海马和皮层区域(从bregma-1.92到-4.36mm),脑片厚度为25μm,隔6取1放置于同一孔内,可以得到6套脑组织的切片用于染色。
3.1.1本发明能减少APP/PS1小鼠脑内β--淀粉样蛋白沉积
在AD病人中,β-淀粉样蛋白沉积是一个重要的病理特征,所以我们在本发明饲料干预6个月后,对各组小鼠脑中β淀粉样蛋白的沉积状况,进行了检测。小鼠麻醉后,打开胸腔,心脏灌注生理盐水后,再灌注4%的多聚甲醛固定,取脑组织,后固定及30%蔗糖沉降处理完毕后,做脑组织冰冻切片。然后我们采用硫黄素S(Thioflavine S)染色,对小鼠脑片中的蛋白斑进行了染色,并对皮层和海马中的蛋白斑分别进行了定量。通过染色我们发现正常的对照组野生型小鼠脑中并没有蛋白斑的沉积,而模型组中的APP/PS1双转基因小鼠的脑内,在海马和皮层中都有大量的蛋白斑沉积,低剂量本发明和高级量本发明干预组中小鼠脑内蛋白斑沉积相对减少(图5A)。统计结果显示,低剂量本发明饲料和高剂量本发明饲料干预后的APP/PS1双转基因AD小鼠无论是大脑皮层中还是海马中的β淀粉样蛋白斑均明显少于使用普通饲料喂养的APP/PS1转基因AD小鼠,且差异显著,有统计学意义(*P<0.05)(图5B)。
3.2免疫组织化学ABC法染色方法
1)3%的过氧化氢溶液(PBS:甲醇:30%过氧化氢=5:4:1),室温下处理脑片30分钟。用磷酸盐缓冲液(PBS)洗涤3次,每次10分钟;
2)0.1%Triton-X 100,室温处理脑片10分钟。磷酸盐缓冲液(PBS溶液)洗涤3次,每次10分钟;
3)抗体封闭液(1%牛血清白蛋白)封闭,室温摇床震荡2小时;
4)脑切片转入一抗(1%牛血清白蛋白)溶液,Iba1抗体,GFAP抗体均按1:1000稀释,4℃孵育摇床震荡过夜。第二天磷酸盐缓冲液洗涤3次,每次10分钟;
5)脑切片转入二抗溶液(羊抗小鼠或羊抗兔,1:1000)室温孵育摇床震荡2小时。磷酸盐缓冲液洗涤3次,每次10分钟;
6)脑切片转入辣根过氧化物酶标记的链亲和素(HRP,1:1000)溶液,室温孵育摇床震荡2小时。磷酸盐缓冲液洗涤3次,每次10分钟;
7)0.05%的DAB磷酸盐缓冲液(25mg/mL储液,使用时1:50稀释),加入终浓度为0.03%的过氧化氢,显色适当的时间。磷酸盐缓冲液洗涤3次,每次10分钟;
8)贴片,晾干后,脱水透明处理,中性树脂封片,显微镜下观察,拍照。所得图片经Photoshop 9.0软件编辑得到实验结果图片。
3.3.1免疫组织化学定量分析
不同倍数视野下拍摄脑片海马和皮层的相同的部位,选取适当的视野拍摄图片,用Image J软件进行定量分析。首先将图片转换为8位字节形式,划出用于定量的区域,调节阈值使免疫组织化阳性信号被选中,测量所选区域内阳性信号的像素,以及所选区域的面积,得到单位面积阳性信号的像素值,用于统计分析。
3.3.2 Tioflavine S染色
1)脑片贴到预选经明胶包被的载玻片上,晾干。
2)贴好的脑片放入50%酒精配制的0.05%硫黄素S的染缸中避光染色8分钟。
3)在80%的酒精中放置10秒钟。重复一次
4)用大量蒸馏水洗4-5遍
5)脑片在高浓度的磷酸缓冲液中(high PB)孵育30分钟分钟以上,4℃摇床震荡孵育30分钟以上。
6)用蒸馏水洗涤4-5遍
7)用荧光封片剂封片,注意避光
8)片子在荧光显微镜下观察,拍照。
3.3.3本发明能降低APP/PS1小鼠脑中的胶质细胞的激活
在AD病人和AD模型小鼠的脑组织中,通常可以发现有小胶质细胞和星形胶质细胞的大量激活,主要表现为胶质细胞的胞体增大和突起增多变粗,并且通常胶质细胞会聚集在β-淀粉样蛋白斑的周围。激活的胶质细胞会分泌炎症因子和细胞因子,并且具有神经毒性,从而会加重AD的病情。因此我们研究了本发明加药饲料干预后不同分组中的小鼠大脑中小胶质细胞和星形胶质细胞的激活状况。
我们用Iba1抗体做免疫组化染色,标记了小胶质细胞,观察了本发明饲料干预后,不同分组中的小鼠大脑皮层和海马区域的Iba1阳性的小胶质细胞的激活状况。野生型组中WT小鼠的大脑皮层和海马中,Iba1阳性的小胶质细胞激活数目较少,而在模型组中的APP/PS1双转基因AD模型小鼠的大脑皮层和海马中可以看到小胶质细胞的明显激活(*P<0.05),主要表现为胞体的增大和突起的增多,相比较之下低剂量本发明饲料和高剂量本发明饲料干预6月后的APP/PS1转基因小鼠的大脑皮层和海马中的小胶质细胞激活数目比模型组中小鼠明显减少(图6A和C)。统计结果表明,低剂量本发明饲料干预组和高剂量本发明干预组的APP/PS1小鼠大脑皮层和海马中的小胶质细胞激活程度与AD模型组中大脑皮层和海马中的小胶质细胞激活程度相比,有明显的差别,且统计学差异显著(#P<0.05)(图6B和D)。这一实验结果表明本发明干预可以减少小胶质细胞的激活。
接着我们又用GFAP抗体标记星形胶质细胞,进行免疫组化染色。同样的,免疫组化图片显示,在野生型组中的正常WT小鼠大脑皮层和海马中的星形胶质细胞激活较少,而在APP/PS1转基因AD模型小鼠中激活明显增多(图7A和C),低剂量本发明饲料和高剂量本发明饲料干预6月后的APP/PS1转基因小鼠的大脑皮层和海马中的星形胶质细胞与模型组AD小鼠相比,星形胶质细胞的激活程度明显减少,有统计学意义(#P<0.05)(图7B和D),说明本发明干预可以降低星形胶质细胞的活化程度。
3.4 Aβ酶联免疫吸附检测(ELISA)
酶联免疫吸附检测定量检测Aβ的原理:96孔板上包被有特异性识别Aβ的N端区域单克隆抗体,可特异性的结合待测溶液中的Aβ40和Aβ42,加入C端特异性的Aβ40或Aβ42的兔源多克隆抗体后,4℃孵育过夜,与Aβ的C端结合。经过充分洗涤后,加入偶联了辣根过氧化物酶的羊抗兔抗体,孵育30min后充分洗涤,加入辣根过氧化物酶的底物进行显色,在读板仪上测定标准品和样品的光吸收值,根据标准品做出标准曲线,比较样品的光吸收值,就可以得到样品中Aβ的含量。人源的Aβ40和Aβ42的ELISA试剂盒均购自Invitrogen公司。本实验主要检测小鼠脑组织中的人源的RIPA溶液可溶性形式和不可溶性形式的Aβ40和Aβ42。样品制备过程以及酶联免疫吸附检测的步骤如下:
1.取脑组织:小鼠深度麻醉后,迅速打开胸腔,暴露出心脏,心脏灌流50毫升0.9%的氯化钠水溶液以去除脑组织中的血液。并快速分离出脑组织的海马和皮层,组织投入液氮速冻。
2.样品制备:称重按照质量(mg):体积(μl)=1:9的比例加入组织中RIPA buffer裂解液。冰上裂解30分钟,并不时摇晃。100000g转速,4℃离心60分钟,取上清也就是溶于RIPA的组分,用于检测可溶性形式的Aβ40和Aβ42。沉淀部分加入与RIPA buffer等体积的5M guanineHCl溶液(pH8.0的50mM的TrisHCl溶液配制,含蛋白酶抑制剂)匀浆,室温下震荡3-4小时混匀。100000g转速,4℃离心60分钟,取上清再用BSAT-DPBS溶液(0.2g/L KCl,0.2g/L KH2PO4,8.0g/L NaCl,1.150g/L Na2HPO4,5%BSA,0.03%Tween-20,pH7.4)1:100稀释,样品保存于-80℃冰箱。开始ELISA检测之前,取出样品冰上化冻,先用RIPA或BSAT-DPBS溶液1:5稀释,再加入等体积的标准品,用于不可溶性形式的Aβ40和Aβ42的ELISA检测。
3.Aβ的ELISA检测
1)配制Aβ1-40、Aβ1-42的标准品:向标准品中加入55mM的NaHCO3(pH9.0),配制成100ng/mL的储液,然后用标准品稀释液等比例稀释到不同浓度1000pg/mL,500pg/mL,250pg/mL,125pg/mL,62.5pg/mL,31.25pg/mL,15.63pg/mL,分装保存于-80℃冰箱。临用前,取出冰上融化,并加入等体积的样品稀释液(RIPA或BSAT-DPBS溶液)。
2)将标准品和样品依次加入试剂盒提供的96孔板,每孔50μl,然后立刻加入试剂盒提供的检测抗体(Detection antibody)50μl,室温孵育3小时或是4℃摇床上孵育过夜。
3)第二天,取出96孔板,弃去样品溶液,用去离子水稀释试剂盒提供的洗液(25X),每孔加入200μl的洗液,摇动30秒后,弃去洗液,在吸水纸上排干,洗涤5次。
4)用HRP稀释液配制检测用的兔抗体(1:100),每孔加入100μl室温下摇床振动孵育30分钟后,弃去溶液,洗涤5次。
5)每孔加入100μl显色液,避光室温下孵育30分钟。
6)加入100μl终止液终止显色反应,在450nm波长下测量光密度值,根据试剂盒提供的标准品计算得到的标准曲线,计算出待测样品中的Aβ含量。
3.4.1本发明能减少APP/PS1小鼠脑中不可溶性形式的Aβ40和Aβ42蛋白含量
为了检测本发明饲料干预后,各组小鼠脑组织中的Aβ40和Aβ42水平,我们利用酶联免疫吸附(ELISA)实验,检测了小鼠脑中的可溶性和不可溶性形式的Aβ40和Aβ42的水平,目前认为可溶性形式的Aβ主要反映的是单体和寡聚体的水平,而不可溶性形式的Aβ则表示的是β-淀粉样蛋白沉积水平。Elisa实验检测结果显示,本发明饲料干预后,APP/PS1小鼠脑中的可溶性形式的Aβ40和Aβ42水平均有所降低。统计结果显示,皮层中的可溶性形式的Aβ40和Aβ42水平与模型组中APP/PS1小鼠相比,无显著性差异;海马中的可溶性形式的Aβ40和Aβ42水平与模型组中APP/PS1小鼠相比,有显著性差异(*P<0.05)(图8A和B)。本发明饲料干预后,皮层中的不可溶性形式的Aβ40和Aβ42水平下降,高剂量本发明干预组的不可溶性形式的Aβ42水平与模型组APP/PS1小鼠比较有统计学差异(*P<0.05),不可溶性形式的Aβ40水平与模型组APP/PS1小鼠比较无统计学差异;低剂量本发明干预组皮层中不可溶性形式的Aβ40和Aβ42水平与模型组中APP/PS1小鼠相比无统计学差异;海马中的不可溶性形式的Aβ40和Aβ42水平与模型组中APP/PS1小鼠比较均降低,高剂量本发明干预组的不可溶性形式的Aβ40水平与模型组APP/PS1小鼠比较有统计学差异(*P<0.05),低剂量本发明干预组的不可溶性形式的Aβ40水平与模型组APP/PS1小鼠比较有统计学差异(*P<0.05)(图8C和D)。这说明本发明可以降低海马中可溶性形式的Aβ40和Aβ42水平,明显减少不可溶性形式的Aβ40和Aβ42水平,但对皮层中溶性形式的Aβ40和Aβ42水平影响不明显。
实施例4
4.1免疫印迹实验
小鼠的脑组织,用RIPA buffer(150mM NaCl,50mM Tris(PH8.0),1%NP-40,0.1%SDS,0.5%Deoxycholic acid sodium,蛋白酶抑制剂(1:100)提取总蛋白,冰上裂解30分钟,小鼠脑组织匀浆后,冰上放置10-20分钟,期间数次混匀样品。14000g,4℃离心60分钟,收集上清,-80℃保存。按BCA试剂盒(购自Pierce)的方法测定每个样品的总蛋白浓度,调平各个样品的蛋白浓度,取等体积的样品加入上样缓冲液(loading buffer,6x),煮沸10分钟后,冷却至室温。样品采用十二烷基磺酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分离,凝胶的浓度是12%。采用湿转法转膜,硝酸纤维素膜(购自Schleicher&Schuell公司)的孔径为0.2μm。转膜后用TBST溶液充分洗涤,溶于TBST的5%脱脂奶粉室温下封闭1小时,转入一抗(primary antibody)溶液,用含5%牛血清白蛋白TPBST溶液稀释抗体,一抗按1:1000稀释,GADPH的单克隆抗体按1:20000稀释。4℃孵育过夜后,TBST溶液充分洗涤,转入辣根过氧化物耦连的相应二抗溶液,室温孵育1小时,TBST充分洗涤。加入ECL溶液(购自GE health care公司)显色,曝光。利用image-J软件对图片条带的密度进行定量测定。
4.1.1本发明对APP和Bace1蛋白含量的影响
淀粉样前体蛋白(APP)是一种单次跨膜的Ⅰ型膜蛋白,包含一个大的N端胞外结构域和一个短小的C端胞内结构域。APP与阿尔茨海默病有着密切的联系。APP可以被α-,β-,γ-分泌酶分解;其中β-分泌酶(Bace1)和γ-分泌酶的连续分解作用,可以把APP分解并产生Aβ。Aβ可以导致脑内老年斑的形成和神经细胞的凋亡,是导致阿尔茨海默病的重要因素。为了检测本发明对APP和Bace1总蛋白含量的影响,我们运用蛋白免疫印迹的方法检测APP和Bace1蛋白的含量,利用APP-C端抗体检测全长的APP的含量,Bace1抗体检测Bace1蛋白含量,检测统计结果显示,本发明干预后APP/PS1小鼠脑组织皮层和海马中的APP和Bace1总蛋白的含量变化并不明显,与对照组的APP/PS1模型小鼠脑组织皮层和海马中的APP和Bace1总蛋白的含量无统计学差异;同样的,Bace1蛋白的含量也没有明显变化(图9A-D)。这一结果说明,本发明可能对APP/PS1小鼠脑组织皮层和海马中的APP和Bace1总蛋白的含量没有太大影响。
统计分析
本实验采用Graphpad Prism 4.0软件分析实验数据,实验中的所有数据的统计均使用mean±SD,数据组间比较是通过单因素方差分析(one-way ANOVA)中的Newman-Keuls Multiple Comparison Test实现的,P<0.05时认为有显著性差异,P<0.001表示差异极显著;两组数据间的比较是通过t tests分析。
序列表
<110> 上海中医药大学
<120> 黄芪散在制备预防或治疗阿尔茨海默病的药物中的应用
<160> 8
<170> PatentIn version 3.5
<210> 1
<211> 24
<212> DNA
<213> 转入基因的正意基因链
<400> 1
gactgaccac tcgaccaggt tctg 24
<210> 2
<211> 25
<212> DNA
<213> 转入基因的反意基因链
<400> 2
cttgtaagtt ggattctcat atccg 25
<210> 3
<211> 24
<212> DNA
<213> 内参阳性对照正向基因链
<400> 3
ctaggccaca gaattgaaag atct 24
<210> 4
<211> 25
<212> DNA
<213> 内参阳性对照反向基因链
<400> 4
gtaggtggaa attctagcat catcc 25
<210> 5
<211> 20
<212> DNA
<213> 转入基因的正意基因链
<400> 5
aatagagaac ggcaggagca 20
<210> 6
<211> 20
<212> DNA
<213> 转入基因的反意基因链
<400> 6
gccatgaggg cactaatcat 20
<210> 7
<211> 24
<212> DNA
<213> 内参阳性对照正向基因链
<400> 7
ctaggccaca gaattgaaag atct 24
<210> 8
<211> 25
<212> DNA
<213> 内参阳性对照反向基因链
<400> 8
gtaggtggaa attctagcat catcc 25
- 还没有人留言评论。精彩留言会获得点赞!