一种抑制多药耐受基因表达的靶向抗肿瘤纳米药物的制作方法
本发明属于纳米药物载体技术领域,具体涉及一种抑制多药耐受基因表达的靶向化疗抗肿瘤纳米药物的制备方法及其应用。
背景技术:
在全世界70多亿人口中,每年新产生约1400多万癌症患者,死亡人数达820多万,癌症已成为许多国家或地区居民的主要死亡原因。近年来,将化学疗法与纳米技术相结合而产生的纳米药物被广泛的应用于肿瘤治疗,主要原因是其具有可控的药物释放特点,易于向肿瘤组织渗透,并且能减少药物的全身毒性等。但是,由于纳米药物递送效率较低,阻碍了致死剂量的药物在肿瘤组织中停留足够长的时间,从而限制了其进一步广泛的应用。
普朗尼克共聚物是一类应用于药物制剂的高分子,能有效抑制P-糖蛋白的药物外排功能,并具有良好的生物相容性和极低的免疫原性。透明质酸是细胞外基质中广泛存在的多糖成分,对在肿瘤细胞上过表达的CD44有很好的亲和性,可利用透明质酸介导纳米粒子进入靶细胞。目前,纳米粒子表面进行双功能化新策略来提高肿瘤细胞或组织中抗癌药物浓度的报道较少,制备并开展普朗尼克共聚物和透明质酸表面双功能化纳米药物的研究还没有开展。
技术实现要素:
有鉴于此,本发明的目的之一在于提供一种抑制多药耐受基因表达的靶向化疗抗肿瘤纳米药物的制备方法;本发明的目的之二在于提供上述纳米药物的应用。
为实现上述发明目的,技术方案为:
一种抑制多药耐受基因表达的靶向化疗抗肿瘤纳米药物,其制备方法包含以下步骤:
1)将聚乳酸-羟基乙酸共聚物、普朗尼克F127和姜黄素共同溶于二氯甲烷-甲醇共溶剂中;
2)将步骤1)的溶液逐滴加入到聚乙烯醇和壳聚糖混合溶液中;
3)将步骤2)得到的溶液立即放入冰浴中,超声处理6次,每次超声10 s,以促使形成水包油的乳液;
4)将步骤3)得到的乳液迅速倒入含有聚乙烯醇水相溶液中,形成乳浊液;
5)在低真空条件下,使得步骤4)的乳浊液中的有机溶剂进行蒸发;
6)将步骤5)之后的溶液进行离心处理,收集得到纳米粒子,并用去离子水洗涤3次;
7)将步骤6)的纳米粒子涡旋分散在2-(N-吗啉)乙磺酸一水合物缓冲液中,得到纳米粒子悬浮液;
8)利用1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐/N-羟基琥珀酰亚胺对透明质酸的羧基基团进行活化,得到活化后的透明质酸溶液;
9)将步骤8)的活化后的透明质酸溶液加入到步骤7)的纳米粒子悬浮液中,所得混合物在室温下搅拌2小时;
10)将步骤9)的溶液进行高速离心,收集得到纳米粒子,并用去离子水洗3次;
11)将步骤9)的纳米粒子重新分散在含少量海藻糖的水溶液中,形成纳米粒子水溶液;
12)将步骤11)得到的纳米粒子水溶液进行冷冻干燥,可以得到具有抑制多药耐受基因表达的靶向化疗抗肿瘤纳米药物,将其储存在–20摄氏度的密闭容器中备用。
优选的,所述步骤1)中,聚乳酸-羟基乙酸和普朗尼克F127质量比为1:0.5~1:1,聚乳酸-羟基乙酸和姜黄素的质量比为100mg:6 mg~100 mg:12 mg,二氯甲烷-甲醇溶液的比例为5:5~8:2;所述步骤2)中,聚乙烯醇和壳聚糖水溶液的总体积为2~6 mL,两者的浓度范围分别是2~5%和0.2~0.5%,壳聚糖分子量为1.8×104;所述步骤3)中超声的参数为超声振幅30~80%。
优选的,所述步骤4)中,聚乙烯醇水溶液的总体积为10~200 mL,浓度范围是0.05~0.5%;所述步骤6)和步骤10)中,离心速率为8000~20000 rpm,离心时间为8~30 min;所述步骤11中,海藻糖水溶液的浓度为3~10%;所述步骤12)中,冷冻干燥按照以下方法进行:在-80℃冷冻过夜后置于冻干机中冻干12~36 h。
相对于现有的技术,本发明的优点在于:
1. 本发明以聚乳酸-羟基乙酸共聚物为基材,并用普朗尼克 F127和透明质酸进行表面双功能化,制备方法为水包油的溶剂挥发法,整个制备过程简单快捷,制备周期短,产率高。
2. 本发明引入了普朗尼克共聚物,第一,它能通过抑制由MDR1基因编码的P-糖蛋白在肿瘤细胞表面的活性,抑制药物外排功能,从而逆转肿瘤细胞的多药耐受性;第二,普朗尼克共聚物具有良好的生物相容性和极低的免疫原性,使得它适用于对生物体局部或全身给药;第三,普朗尼克共聚物中亲水性的聚环氧乙烷,不仅能阻止纳米粒子聚集和血液蛋白成份在纳米粒子表面吸附,而且还能防止被网状内皮系统识别吞噬。
3. 本发明引入了透明质酸,透明质酸对肿瘤细胞表面高度过量表达的CD44具有很高的亲和性,从而达到药物的定位释放。
4. 本发明提出对纳米粒子表面进行双功能化新策略来提高肿瘤细胞或组织中抗癌药物浓度,是对现有单一表面修饰的一个突破和重要创新。
5. 本发明首次提出、制备并开展普朗尼克共聚物和透明质酸表面双功能化纳米粒子对抗癌效果的协同效应研究,这将有助于我们更好揭示纳米粒子表面功能化的机理和规律,同时为在分子水平上设计具有优异抗癌效果的载药纳米粒子提供理论依据。
附图说明
为了使本发明的目的、技术方案和优点更加清楚,下面将结合附图对本发明作进一步的详细描述。
图1为普朗尼克和透明质酸表面双功能化纳米粒子的扫描电镜图(a)和粒径分布图(b)。
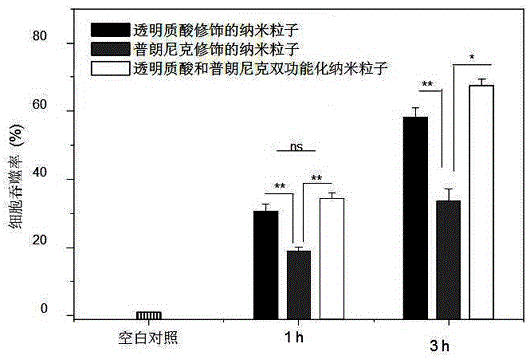
图2为不同纳米粒子与结肠-26细胞共培养1 h和3 h后,细胞吞噬纳米粒子图。
图3为不同纳米粒子处理细胞后,细胞MDR1 mRNA表达水平图。
图4为小鼠静脉注射不同纳米粒子后,肿瘤数量图。
具体实施方式
以下将参照附图,对本发明的优选实施例进行详细的描述。
实施例
实施例提供一种抑制多药耐受基因表达的靶向化疗抗肿瘤纳米药物的制备方法,即普朗尼克和透明质酸表面双功能化纳米粒子的制备方法,包括以下步骤:
1)称量50 mg聚乳酸-羟基乙酸共聚物,25 mg普朗尼克,5 mg姜黄素共同溶于1 mL 二氯甲烷-甲醇(8:2)溶剂中;
2)将上述有机溶液逐滴加入4 mL 5%聚乙烯醇和0.5%壳聚糖水溶液中;
3)将上述溶液立即放入冰浴中,进行超声,超声的参数为超声振幅50%,每次10s,超声6次;
4)将上述乳浊液迅速倒入100 mL 0.3%的聚乙烯醇水溶液中;
5)在低真空条件下,将上述乳浊液中有机溶剂蒸发;
6)离心收集上述纳米粒子,离心速率为12000 rpm,离心时间为20 min,并用去离子水洗涤3次;
7)将纳米粒子涡旋分散在2-(N-吗啉)乙磺酸一水合物缓冲液中;
8)利用1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐/N-羟基琥珀酰亚胺对透明质酸的羧基基团进行活化;
9)将透明质酸溶液加入到纳米粒子悬浮液中,所得混合物在室温下搅拌2小时;
10)高速离心收集纳米粒子,离心速率为12000 rpm,离心时间为20 min,并用去离子水洗三次;
11)将上述纳米粒子重新分散在少量5%海藻糖的水溶液中;
12)冷冻干燥后储存在–20摄氏度的密闭容器中。
比较例1
比较例1 普朗尼克功能化纳米粒子的制备方法,包括以下步骤:
1)称量50 mg聚乳酸-羟基乙酸共聚物,25 mg普朗尼克同溶于1 mL 二氯甲烷-甲醇(8:2)溶剂中;
2)将上述有机溶液逐滴加入4 mL 5%聚乙烯醇和0.5%壳聚糖水溶液中;
3)将上述溶液立即放入冰浴中,进行超声,超声的参数为超声振幅50%,每次10s,超声6次;
4)将上述乳浊液迅速倒入100mL 0.3%的聚乙烯醇水溶液中;
5)在低真空条件下,将上述乳浊液中有机溶剂蒸发;
6)离心收集上述纳米粒子,离心速率为12000 rpm,离心时间为20 min,并用去离子水洗涤3次;
7)将上述纳米粒子重新分散在1mL含5%海藻糖的水溶液中;
8)将上述纳米粒子冻干,存于-20摄氏度的密闭容器中。
比较例2
比较例2透明质酸表面功能化的纳米粒子制备方法,包括以下步骤:
1)称量50 mg聚乳酸-羟基乙酸共聚物溶于1 mL 二氯甲烷-甲醇(8:2)溶剂中;
2)将上述有机溶液逐滴加入4 mL 5%聚乙烯醇的水溶液中;
3)将上述溶液立即放入冰浴中,进行超声,超声的参数为超声振幅50%,每次10s,超声6次;
4)将上述乳浊液迅速倒入100 mL 0.3%的聚乙烯醇水溶液中;
5)在低真空条件下,将上述乳浊液中有机溶剂蒸发;
6)离心收集上述纳米粒子,离心速率为12000 rpm,离心时间为20 min,并用去离子水洗涤3次;
7)将纳米粒子涡旋分散在2-(N-吗啉)乙磺酸一水合物缓冲液中;
8)利用1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐/N-羟基琥珀酰亚胺对透明质酸的羧基基团进行活化;
9)将透明质酸溶液加入到纳米粒子悬浮液中,所得混合物在室温下搅拌2小时;
10)高速离心收集纳米粒子,离心速率为12000 rpm,离心时间为20 min,并用去离子水洗三次;
11)将上述纳米粒子重新分散在少量5%海藻糖的水溶液中;
12)冷冻干燥后储存在–20摄氏度的密闭容器中。
图1为纳米粒子的扫描电镜图(a)和粒径分布图(b)。如图1所示,扫描电镜图片可以看出,制得的纳米粒子是球形的,表面光滑,粒径均匀,结合粒径分布图,粒径分布范围较窄,粒径分布在250 nm至330 nm之间。
图2为不同纳米粒子与结肠-26细胞共培养1 h和3 h后,细胞吞噬纳米粒子图。如图2所示,载姜黄素浓度相同的条件下,用透明质酸和普拉尼克双功能化纳米粒子处理过的细胞吞噬药物量最多,透明质酸修饰的纳米粒子次之。这表明,用普朗尼克 F127和透明质酸进行表面修饰的纳米粒子抑制癌细胞表面P型糖蛋白,同时由于透明质酸可以介导细胞吞噬作用,有效加强了细胞对纳米粒子的吞噬效率。而随着时间的增长,细胞的吞噬率增加,这说明细胞持续吞噬纳米粒子,没有明显的外排作用。
图3为不同纳米粒子处理细胞后,结肠肿瘤细胞中MDR1 mRNA表达水平图。如图3所示,透明质酸和普朗尼克双功能化的纳米粒子处理组MDR1 mRNA的表达水平最低,这可以说明,透明质酸和普朗尼克双功能化纳米粒子有效抑制了MDR1 mRNA表达,普朗尼克 F127在引入到纳米粒子之后保留了抑制细胞表面P型糖蛋白作用的能力。
图4为小鼠尾静脉注射不同纳米粒子后,原位结肠肿瘤数量图。如图4所示,与空白对照组对比,不同组成的纳米粒子处理的小鼠肿瘤数量都有所下降,其中透明质酸和普朗尼克双功能化的纳米粒子处理组的肿瘤数目最少,表明双功能化的纳米粒子抑制肿瘤生长的效果最好,而且透明质酸和普朗尼克在抑制肿瘤生长方面起协同作用。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种靶向锚定剂及其制备方法和应用与流程
- 一种超低分子量插层抑制剂及其制备方法与流程
- 具有胶原特异结合能力的神经再生抑制分子的拮抗蛋白CBD-PlexinB1LBD及应用的制作方法与工艺
- 具有胶原特异结合能力的神经再生抑制分子的拮抗蛋白CBD-EphA4LBD及应用的制作方法与工艺
- 一种KDM1A小分子抑制剂在抑制肿瘤细胞生长和转移中的应用的制作方法与工艺
- 一种抑制多药耐受基因表达的靶向抗肿瘤纳米药物的制作方法与工艺
- MALT1靶向抑制物在制备MALT1依赖性肿瘤治疗药物中的应用的制作方法与工艺
- 作为ASGPR靶向剂的被取代的‑6,8‑二氧杂双环[3.2.1]辛烷‑2,3‑二醇化合物的制作方法与工艺
- 小分子C‑Myc抑制剂的制作方法与工艺
- 一种RNA抑制剂及其在肿瘤中的应用的制作方法与工艺