胸腺素α1用于囊性纤维化治疗的用途的制作方法
本发明涉及胸腺素α1(tα1)用于在囊性纤维化的治疗中的用途。更特别地,本发明涉及胸腺素α1作为cftr校正剂、cftr增效剂和消炎药用于在囊性纤维化的治疗中的用途。
背景技术:
囊性纤维化(cf,omim219700)是一种威胁生命的遗传性疾病,主要影响肺部和消化系统。它是一种限制生命的常染色体隐性疾病,影响着全世界70,000人。纵观有此疾病的患者多年来已经稳步好转,主要由于更早的诊断、更积极的治疗、和在专门的中心(1)提供的照顾。研究人员如今对以cf为基础的分子生物学的缺陷具有更完整的理解,这引起了治疗的新方法。
cf是由基因编码的cf跨膜传导调节因子(cftr)中的突变引起的,cf跨膜传导调节因子调节呼吸道和胃肠道中的上皮表面液体分泌。cftr细胞的处理包含翻译、在内质网处的折叠、高尔基体的运输、翻译后的修饰、顶端质膜的定位、以及核内体的循环和提取。质膜cftr通过内吞作用内化,然后被循环至质膜或定向用于溶酶体降解(2,3)。
大约2,000种变体已被报道至囊性纤维化突变数据库(4)。这些突变被分为六类:i类突变体包括删除、移码和无义突变,其导致过早地截断的cftr蛋白质产品,ii类突变体在胞内运输中是有缺陷的,iii类突变体是全长的蛋白质,几乎没有或没有离子通道活性,iv类突变体导致cftr中仅有轻微降低的通道活性,并且v类突变体蛋白是功能性的但以降低的水平表达,而vi类突变体以野生型水平表达,但展示了质膜中降低的稳定性(5)。尽管cftr疾病等位基因的数目众多,但北欧起源的cf患者的绝大多数(>90%)至少具有一种单突变等位基因的副本,δf508,它编码了在位置508处缺少苯丙氨酸的cftr分子。在cftr中位置508处(δf508)的苯丙氨酸的删除导致了温度敏感的折叠缺陷、内质网中蛋白质的滞留,并且随后定位至蛋白酶体用于过早退化(6)。δf508-cftr折叠是无效的,有超过99%的δf508-cftr目标是在到达高尔基体之前用于蛋白酶体降解。
通过对蛋白质折叠、加工、和蛋白水解的干预,改变了错误折叠的cftr的细胞内命运,显示出打断“下游病理”有成功的希望。识别特定目标以更正有缺陷的δf508-cftr折叠或细胞加工(校正剂)并且通道控制(增效剂)提供了用于治疗cf的策略以校正潜在的缺陷。校正剂可以作为“药类分子伴侣”,通过与f508del-cftr本身的相互作用,促进其折叠和细胞加工,或者作为“蛋白内稳态调节蛋白”,通过调节细胞质量控制机制来改变δf508-cftr的识别和加工(7)。与目前的治疗方法如抗生素、消炎药、粘液溶解剂、喷雾型高渗食盐水、和胰酶置换相比,它们对cf疾病的临床表现、校正剂和增效剂进行治疗,校正了潜在的阴离子通道缺陷。
到目前为止,许多cftr增效剂已被识别并证实在体外和体内的研究中都是有效的(9),但是大部分校正剂的效率有些令人失望。2012年,美国食品及药物管理局认可了依伐卡托(ivacaftor)(vx-770,kalydeco,vertexpharmaceuticals),一种可以增加cftr-媒介氯化物运输的增效剂,用于具有只产生控制缺陷的g551d-cftr突变的cf患者的治疗(10)。kalydeco还在几乎没有临床效益的纯合f508del-cftr患者中进行测试,因为只有少量的f508del-cftr是针对细胞质膜的。此后,增效剂(鲁玛卡托(lumacaftor),由vertexpharmaceuticals提供)/依伐卡托联合治疗(orkambi)在纯合f508del-cftrcf患者中进行测试。该药物组合改善了肺功能3到4个百分比并将恶化减少至35%(11)。尽管这项研究确认了急性依伐卡托/鲁玛卡托联合治疗可以提高鲁玛卡托的δf508-cftr活性,但也被报道了令人沮丧的结果。特别是一些控制增效剂(包括依伐卡托)可能会降低鲁玛卡托的校正效果,可能是因为通过依伐卡托校正的δf508-cftr不稳定(12)。
依伐卡托的废除作用对于鲁玛卡托的校正效果表明需要进一步优化增效剂使得cf中校正剂-增效剂联合治疗的临床效益最大化。
此外,考虑到δf508不应该被看作简单的ii类突变体,而是具有ii、iii、和v类的性质的混合突变体,这表明必须考虑或设计更加复杂的治疗策略以校正由单一δf508突变体引起的多个蛋白质加工缺陷(6)。
更多地,识别逆转慢性阶段肺病的治疗策略没有取得显著的进展。因此,如果补救氯离子通道功能足够逆转慢性cf肺病的炎症性病理,这仍然是待解决的问题(13)。
实际上,cf基因缺陷(或突变)导致不正常工作的cftr蛋白质对肺部的上皮和炎症细胞都有影响,导致氯化物流出减小和炎症反应增加(14)。
关于cf气道中的严重炎症,高度炎症反应是慢性感染的结果还是cftr功能紊乱的主要结果仍是一个争论的问题(15)。
由cftr突变引起的有缺陷离子和流体运输导致陷于cf气道中的粘液和物质清除不充分。保留的物质导致气道堵塞、炎症、和感染的循环。因此,cf中的肺部免疫反应的特征在于先天免疫系统的早期和无消退活化作用(non-resolvingactivation),它们在几个水平上都是调节异常的(16),不会导致增强的细菌或真菌的清除(17),并在cf肺病的发病机理中扮演关键角色(18)。在生命早期被破坏消灭的细菌引起了以中性为主的炎症反应,损害了肺并促进了气道重建和气道堵塞。尽管集中用抗生素治疗(19),慢性cf肺部感染异常顽固,这激发出一些创新方法,在这种情况下阐明cf肺病中的初始气道炎症反应成为转化研究的优先领域(20)。有证据表明,针对特定的炎症性/抗炎性路径可以在实验的cf中提出有效的治疗策略(21,22)。
迄今为止,在两年的时间里只有一种消炎药(非甾体类药物布洛芬)被证明具有提高fev1的递减速率效果和有益的风险预测效果;因此它被作为对7至18岁患者的有益治疗推荐(23)。
发展cf中的抗炎治疗是具有挑战性的,因为它们的作用机理可能是避免长期的临床下降,而不是在更常用的临床结果对策中产生急性的变化,如肺功能或肺恶化的频率。尽管有这些挑战,几种治疗目前已进入第2阶段时期。三个施用例包括n-乙酰半胱氨酸、二十二烷六烯酸、和西地那非。n-乙酰半胱氨酸是一种口服的抗氧化药物,其显示出,第2阶段试验中在患有cf和基线炎症的患者中影响炎症性措施,假设通过中性粒细胞中的氧化还原失衡出现了一种作用(24)。近期n-乙酰半胱氨酸的2b阶段临床试验确实证明肺功能的影响,但是没有再产生对炎症的影响(24)。类似地,二十二烷六烯酸是一种ω-3脂肪酸,在2003年的一个简短的临床试验中证明了抗炎活性,并在婴儿中已完成第2阶段的试验;结果即将出现。西地那非的第2阶段试验目前正在评估这种口服的磷酸二酯酶抑制剂对气道炎症的标记物的效果(25)。
鉴于上文,因此明显需要为囊性纤维化(cf)提供能够克服已知治疗方法的缺点的新的治疗方法,已知治疗方法包括有效的消炎药、激素,它们天生具有重要的副作用,特别是对儿童的生长和肾上腺素的抑制(26)。
技术实现要素:
cf疗法的普遍共识是,未来疗法将致力于避免,而不是改善,现有的器官损伤,包括致病性炎症,在患者有症状之前。
明确的是理想的cf药物治疗应该不仅能够补救膜-cftr蛋白质,而且能够缓解过度的炎症反应并可能地减弱慢性cf肺病的发展。有双重校正剂和增效剂活性,以及抗炎活性的单一化合物的识别将在本领域被高度期待。
胸腺素α1(tα1)是天然存在的28个氨基酸的多肽,由goldstein等人于1972年首次描述和表征。医学领域内已知tα1在一些体外和体内的试验中的免疫调节性质(27)。
tα1之前的使用情况已经知道。多肽已经作为治疗人类疾病的辅助剂或免疫治疗试剂在世界范围内使用,人类疾病包括病毒性感染、免疫缺陷、和恶性肿瘤(28,29)。该多肽可以提高t-细胞、树突细胞和抗体反应,调节细胞因子和趋化因子的产生并阻碍类固醇诱导的胸腺细胞凋亡。它在调节树突细胞功能和激活对不同功能有不同贡献的多种信号通路的中心作用可以为其多效性反应提供貌似可信的解释。此外,激活吲哚胺2,3-肠黏膜上双酵素-赋予移植期间免疫耐受性和抑制恶性循环从而延续慢性炎症-已成为转折点,提出了一种潜在的、特定的免疫功能(30)。因此,tα1近期被证明可以促进免疫重组并改善i/ii阶段临床试验中hla匹配的同胞t细胞耗尽的干细胞的患者的生存(31)。
根据本发明的描述,已发现tα1在cf患者中具有抗炎作用。事实上,tα1能够纠正具有运输/稳定性缺陷的δf508-cftr突变体的误加工;恢复氯离子通道的活性并更改鼠类cf中的炎症性/抗炎性平衡,通过抑制炎症性(il1β和il1α)细胞因子的生产,增加炎性阻塞细胞因子il-1ra的生产,提升保护性的th1/treg耐受性轴,同时抑制涉及cf肺部炎症的炎症性th17/th2轴。总之,结果表明tα1校正可以达到影响气道上皮细胞功能的水平,因此可以具有临床意义。除其固有的抗炎活性外,这使得tα1成为cf治疗的理想选择。
因此,用于治疗囊性纤维化的胸腺素α1是本发明的特定主题。事实上,胸腺素α1可以被有利用作为受囊性纤维化影响的患者的cftr校正剂、cftr增效剂和消炎药。本发明还涉及胸腺素α1和选自由抗生素、抗真菌剂、cftr校正剂、cftr增强剂组成的组中的至少一种试剂的组合,用于囊性纤维化的治疗的分开或连续的用途,所述cftr校正剂或增效剂不同于胸腺素α1。
根据本发明所述的组合物,抗生素剂可以例如选自由妥布霉素、环丙沙星、粘菌素组成的组;抗真菌剂可以例如选自由伊曲康唑、两性霉素b组成的组;最后,不同于胸腺素α1的cftr校正剂或增效剂可以例如选自由依伐卡托、鲁玛卡托组成的组。
本发明的进一步的主题是包含作为有效成分的胸腺素α1与赋形剂和/或共辅助剂中的一种或多种或由作为有效成分的胸腺素α1与赋形剂和/或共辅助剂中的一种或多种组成的药物组合物,囊性纤维化的治疗的用途。
根据本发明所述的药物组合物可以进一步包含选自由抗生素、抗真菌剂、cftr校正剂、cftr增效剂组成的组中的至少一种试剂,所述cftr校正剂或增效剂不同于胸腺素α1。
如上所述,抗生素剂可以例如选自由妥布霉素、环丙沙星、粘菌素组成的组;抗真菌剂可以例如选自由伊曲康唑、两性霉素b组成的组;最后,不同于胸腺素α1的cftr校正剂或增效剂可以例如选自由依伐卡托、鲁玛卡托组成的组。
如上所述,胸腺素α1显示出受囊性纤维化影响的患者的抗炎作用。
因此,本发明的进一步主题是胸腺素α1,用于治疗和/或预防受囊性纤维化影响的患者的用途。
本发明还涉及胸腺素α1的组合物与选自由抗生素、抗真菌剂、cftr校正剂、cftr增效剂组成的组的至少一种试剂,用于治疗和/或预防受囊性纤维化影响的患者的炎症的分开或连续的用途,所述cftr校正剂或增效剂不同于胸腺素α1。
根据本发明所述的组合物,抗生素剂可以例如选自由妥布霉素、环丙沙星、粘菌素组成的组;抗真菌剂可以例如选自由伊曲康唑、两性霉素b组成的组;最后,不同于胸腺素α1的cftr校正剂或增效剂可以例如选自由依伐卡托、鲁玛卡托组成的组。
本发明的进一步主题是包含作为有效成分的胸腺素α1与赋形剂和/或共辅助剂中的一种或多种或由作为有效成分的胸腺素α1与赋形剂和/或共辅助剂中的一种或多种组成的药物组合物,用于治疗和/或预防受囊性纤维化影响的患者的炎症的用途。
根据本发明的药物组合物可以进一步包含选自由抗生素、抗真菌剂、cftr校正剂、cftr增效剂组成的组中的至少一种试剂,所述cftr校正剂或增效剂不同于胸腺素α1。
如上所述,抗生素剂可以例如选自由妥布霉素、环丙沙星、粘菌素组成的组;抗真菌剂可以例如选自由伊曲康唑、两性霉素b组成的组;最后,不同于胸腺素α1的cftr校正剂或增效剂可以例如选自由依伐卡托、鲁玛卡托组成的组。
根据发明所述的用途,术语“治疗”或“处理”具有其通常含义,包括预防、阻止、缓解、抑制、改善、停止、控制、放慢或逆转炎症媒介疾病的严重程度的进程、活化或还原。
根据本发明,“分开使用”被理解为以不同的药物学形态同时施用两种或更多种根据发明的组合的化合物。“连续使用”被理解为连续施用两种或更多种根究本发明的组合的化合物,每种均为不同的药物学形态。
在治疗炎症反应的努力中,施用tα1的有效量为预防、阻止、缓解、改善、停止、控制、放慢或逆转进程的量,或降低所述炎症反应的严重性的量,按照初级护理医师的判断,施用的日剂量将取决于患者的体重、年龄和一帮情况。
tα1可以以药物组合物与药类可接受的载体或赋形剂的组合的形式被施用,它的比例和性质由选择的载体和/或赋形剂中化合物的溶解度和化学性质,所选的施用路线和标准的药类实践决定。
载体或赋形剂可以是固体、半固体、或液体材料,他们可以用作活性组分的媒介物或中间物。合适的载体或赋形剂在本领域内已知。药物组合物可以适用于口服、吸入、肠胃外、或局部使用,并且可以以片剂、胶囊、喷雾剂、吸入剂、栓剂、溶液、悬浊液、脂质体或类似物的形态给患者服用。
附图说明
本发明现在将通过说明性的,但非限制性的方式,根据其优选的实施方式,结合所附附体的特别参考进行描述,其中:
图1示出了cf肺病的病理生理学模型。根据这个模型,由cftr变体产生的有缺陷的离子和流体运输导致了粘液和陷于cf气道中的材料清除不充分。保留的材料导致气道阻塞、炎症、和感染的循环。cftr,囊性纤维化跨膜传导调节因子。
图2示出了细胞总蛋白的代表性免疫印迹,来自用tα1处理的对照(hbewt)和δf508(hbeδf508)细胞(a);tα1增加了δf508cftr在pm处的表达(b);cftr(c波段)在pm处的密度测量用pm/cftr总比值表示(c);tα1在5分之3(第1、2和5号患者)的患者中增加了的cftr(波段c)的表达(d)。
图3示出了tα1使δf508cftr细胞的氯离子渗透性增加了大约70%,与cfbe41o-细胞(a)和来自cf患者(b)的hbe细胞中的对照(考虑到参考值100%的对照)相比。
图4示出了暴露4小时后,tα1显著增加了对照和cf细胞中的tmem16a表达。然而,当对照细胞中的tmem16a表达在24小时内恢复到基础水平时,它在cf细胞(a)中仍会提高。
图5示出了tα1增加了f508-转染细胞(a,代表细胞总蛋白的免疫印迹。cftr波段通过密度测定定量,并表示为c/b比率)中cftr的成熟形态(由c表示)相对于不成熟形态(由b表示)的表达。箭头表示基于相对迁移率cftr的b形态和c形态的位置。tα1,或者单独或者与依伐卡托的组合tα1,使δf508cftr细胞的氯离子渗透性相对于对照增加了60至70%(考虑到wt对照的100%的参考值)(b,通过荧光分析对fosforkolin、fsk的刺激进行分析)。与鲁玛卡托相比,tα1在cfbe41o-细胞中表达f508cftr(b)的活性较低,但与cf患者(c)的hbe中的活性相似。与鲁玛卡托的组合,tα1未增加鲁玛卡托(b和c)的活性。
图6示出了cf小鼠易患炎症性病理的感染。一种持续又稳固的炎症反应,特征是在bal(a)和肺部(b和c)补充嗜中性粒细胞(pmn)和嗜酸性球(eos),在cftr标记的小鼠中观察到炎症的程度在感染之前已经可见(c,不同dpi的肺组织(过碘酸-希夫染色反应和插图中的格默里染色法))。单核细胞(mnc)、pmn细胞和eos的不同细胞计数由感染后(dpi)不同天数的maygrunwald吉姆沙染色剂测定。数值代表每组三只小鼠的平均+sem值,并且是3个实验的代表。照片用高分辨率显微镜奥林巴斯dp71拍摄,使用a×20物镜。比例尺200μm。(c)gr1+阳性细胞的数量通过不同dpi的总肺细胞上的流式细胞术评估。*p<0.05
图7示出了tα1,保护cf小鼠免受炎症病理感染。tα1,而不是乱序的肽,显著地减少了c57/bl6两种小鼠,甚至cftr标记的小鼠中的局部炎症细胞补充和肺部病理,表明肺部(a)和bal(b)内炎症细胞(主要是pnm,见插图)的补充减少。(a)肺部组织(过碘酸-希夫染色反应和插图中的细胞补充)。照片用高分辨率显微镜奥林巴斯dp71拍摄,使用a×20物镜。比例尺200μm。(b)感染后(dpi)7天进行bal形态测量。单核细胞(mnc)、多形核细胞(pmn)和嗜酸性球(eos)的微分细胞计数由maygrunwald吉姆沙染色剂测定。数值代表每组三只小鼠的平均±sem值,并且是3个实验的代表。*p<0.05;**p<0.01;***p<0.001。
图8示出了有曲霉病的cf小鼠中的tα1下调细胞炎性因子。il-1β、il-1α和il-1ra在bal中的水平在感染七天后由elisa(pg/ml)测量。所得结果为两个实验的汇总数据。*p<0.05;**p<0.01;***p<0.001。
图9示出了tα1在有曲霉病的cf小鼠中调节th细胞平衡。tα1降低了th17(减小的il-17a和th17转录因子rorc的水平)、th2(低il-4和gata3)细胞活化作用,同时增加了th1(增大的ifn-γ和tbet)和调节性t细胞(增大的il-10和foxp3)的细胞活性。所得结果为两个实验的汇总数据。未注明出版日期未完成。*p<0.05;**p<0.01;***p<0.001
具体实施方式
esempio1:囊性纤维化的研究涉及胸腺素α1作为cftr校正剂和增效剂和消炎药的作用。
材料和方法
细胞。细胞系和细胞培养--人支气管上皮(hbe)细胞,δf508突变的纯合子,其同基因的野生型由肺移植(cf患者)或肺切除(非cf患者)得到(由意大利囊性纤维化基金会的ljgalietta友情提供)。使细胞保存在空气中含5%的co2的37℃加湿保温箱中,实验将在移植后5天完成(21,22)。亲本cfbe41o-细胞(δf508/δf508)的基于慢病毒的稳定转导,最初由d.gruenert博士和同事们(32)用wt-cftr或δf508-cftr标本化和表征,由tranzyme公司完成(伯明翰,al)。将转导的cfbe41o-细胞保存在含50单位/ml的青霉素、50μg/ml链霉素、2mml-谷谷氨酰胺、10%胎牛血清、和1μg/ml灭瘟素(wt-cftr)或2μg/ml嘌呤霉素(δf508-cftr)的5%co2,95%空气的37℃的保温箱中。将亲本cfbe41o-细胞保存在相同的培养条件下,不含灭瘟素或嘌呤霉素。为建立极化的单分子层,将cfbe41o-细胞种植在直径24mm的2×106碳酸脂膜可渗透支架(0.4mm孔径;科宁公司,科宁,纽约),并在37℃的气液界面培养生长6-9天,然后在27℃下生长36小时。在测定cftr蛋白质的表达和功能之前,细胞或与tα1100ng/ml(cribi生物技术,帕多瓦,见下文)、3μmvx-809(鲁玛卡托,aurogene罗马,意大利)、1μmvx-770(依伐卡托,aurogene)单独或组合孵化24小时。孵化单独的dmso媒介物(体积比0.1%)24小时用作对照。
小鼠。野生型(wt)近亲交配的c57bl6小鼠,8至12周大,购买自查尔斯河繁殖实验室(calco,意大利)。在意大利米兰的圣拉斐尔医院,基因工程纯合子cftr标记的小鼠(33)在囊性纤维化核心动物设施中饲养。实验的施用遵循机构动物委员会批准的协议,并与欧洲经济共同体委员会指令和机构动物护理和使用指南一致。
感染与治疗。鼻内滴注2×107a.烟曲霉菌(af293)之前,通过腹腔注射2.5%的三溴乙醇(sigmachemicalco,st.louis,mo)使小鼠麻醉,搁置分生孢子/20μl生理食盐水。在组织学上,石蜡包埋组织用过碘酸-希夫染色反应(pas)染色,bal液体收集通过以下所述完成(21,22)。治疗方法如下:为tα1和杂乱的多肽提供纯净(内毒素水平<0.03pg/ml,通过标准鲎溶解产物分析)无菌、冻干、乙酰化的多肽。序列如下:ac-ser-asp-ala-ala-val-asp-thr-ser-ser-glu-ile-thr-thr-lys-asp-leu-lys-glu-lys-lys-glu-val-val-glu-glu-ala-glu-asn-o(tα1)(seqidno:1)和ac-ala-lys-ser-asp-val-lys-ala-glu-thr-ser-ser-glu-ile-asp-thr-thr-glu-leu-asp-glu-lys-val-glu-val-lys-ala-asn-glu-oh(scrambledpeptide)(seqidno:2)。冻干粉在无菌水中重新合成,从感染的那一天开始连续6天每天服用200μg/kg/i.p.。
流式细胞术。细胞抗原表达的染色通过以下所述完成(21,22)。用配有cellquesttm软件的fac扫描流动细胞荧光计(bectondickinson,mountainview,ca)分析细胞。在进行标记之前施用fcr阻塞。控制细胞的染色,使用不相关的抗体获得背景荧光值。数据表示为阳性细胞占总分析细胞的百分比。
cftr免疫印迹分析。免疫印迹技术使用抗-cftr抗体(克隆cf3,abcam),用于测量frt、hek-293、或hbe细胞中的cftr成熟,表达cftr或f508del-cftr(34)。在孵化后,在冰冷的d-pbs溶液(不含钙和镁)中回收细胞,并在4℃下使其形成1000×g的颗粒。细胞颗粒溶解在1%诺乃清洁剂p-40、0.5%脱氧胆酸钠、200mmnacl、10mmtris、ph7.8、和1mmedta加蛋白酶抑制剂混合物(1:250;roche),置于冰上30分钟。将溶解产物在4℃下以10000×g旋转10分钟从而将核和不可溶物质制成颗粒状。将大约12μg总蛋白在含5%β-硫基乙醇的laemmli缓冲溶液中37℃下加热5分钟并装载到3%至8%的tris-醋酸盐凝胶上(invitrogen)。这种凝胶被转移至硝化纤维处并通过对-肌动蛋白使用单克隆或多克隆的cftr抗体加工免疫印迹(santacruzbiotechnology)。印记由增强的化学发光产生。liteablotplus化学发光基质(euroclones.p.a.),使用chemidoctmxrs+成像系统(bio-rad实验室),印记的定量通过使用图像实验室311软件(bio-rad)进行光密度图像分析得到。
cftr的活化作用。因为cftr通道能够渗透碘负离子,所以可以测定这种离子来自之前装载的细胞的流出,通过使用spq(6-甲氧基-n-(3-磺丙基)喹啉鎓)荧光探针的比色测定(35)。
逆转录-聚合酶链反应(rt-pcr)。总rna的提取和合成以及cdna的pcr在总肺细胞上完成,如(21,22)所述。放大效率得到了验证并对磷酸甘油醛脱氢酶进行了标准化。荧光染料绿色实时pcr的热剖面达到95℃3分钟,随后在95℃下变性作用30s,循环40次,然后是60℃下30s的退火/延展的步骤。通过分析扩增图谱对每个数据点进行完整性检测。与那些未受刺激的细胞相比,mrna-标准化数据以处理过的细胞中相关的mrna表示。
通过elisa的细胞因子检测。来自处理过和未处理过的小鼠的肺组织中的细胞因子水平通过细胞因子特异elisa(r&dsystems,inc.spaceimport-exportsrl,milan,italy)测定,如(21,22)所述。
统计分析。学者配对的t测试用于检测实验性施用例中的数值的重要性(重要性被定义为p<0.05)。使用mann-whitneyu测试分析生存数据。在由6种动物组成的活体团体中。除非另有说明,数据为平均值±se。数据通过graphpadprism4.03程序(graphpad软件)分析。
结果
tα1通过增加cf细胞中δf508-cftr的细胞表面表达而起到校正剂的作用。
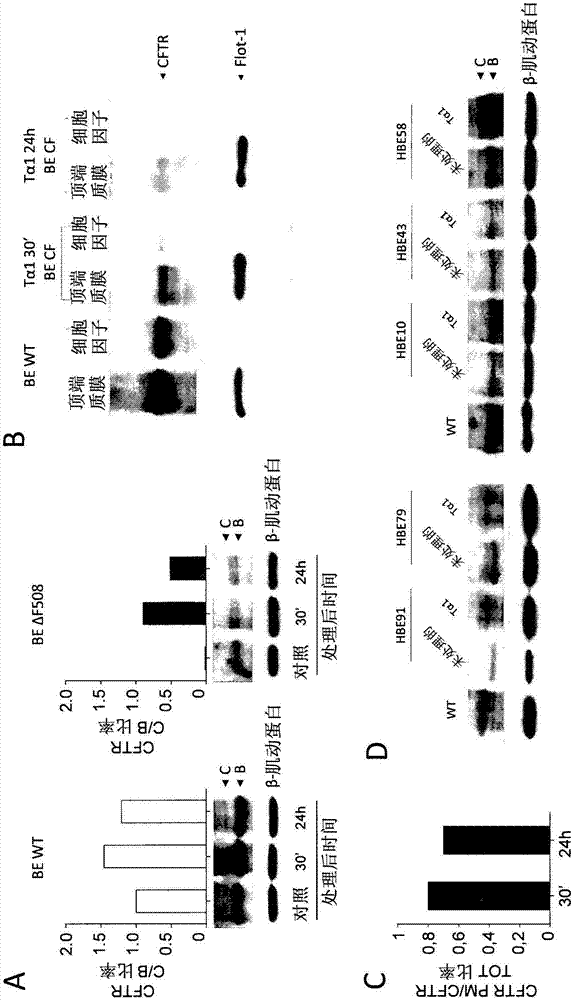
使用sv40变形的cf气道上皮细胞系(cfbe41o-),δf508-cftr突变的纯合子(32)。稳定表达δf508cftr或wtcftr的cfbe41o-细胞用100ng/ml的tα1处理30分钟至24小时。图2示出了细胞总蛋白的典型免疫印迹,来自用tα1(面板a,图2)处理的对照(hbewt)和δf508(hbeδf508)细胞。免疫印迹技术用于测量从内质网撤出的δf508-cftr和穿过高尔基体的通路,其特征是作为糖基化的结果,cftr的分子量增加(由135-140-kda波段至170-180-kda波段)。cftr被高尔基体加工之后,成熟的复杂糖基化的cftr形态传递至细胞表面。tα1稳固地增加了δf508成熟cftr(由c表示)的细胞表达,从早在暴露30分钟后直到24小时后,与wtcftr相反。cftr波段通过光密度法定量并表示为c/b比率。在图2中,箭头表示cftr的c(成熟的)和b(不成熟的)形态基于相对迁移率的位置。为证明δf508cftr的表达增加与其在质膜(pm)处的运输和稳定性增加相关,pm蛋白质由用tα1如上处理的细胞的细胞溶质组分纯化。这些片段用抗-cftr抗体分析,flot1(克隆c-2santacruzbiotechnology)用于确认细胞表面蛋白质特异定位。结果表明tα1增强了δf508cftr在pm(面板b,图2)处的表达。cftr(c波段)在pm处的光密度法测量表达为cftrpm/cftr总比率(面板c,图2)。为评估tα1是否也增加了cftr在cf患者中的表达,来自5个cf患者的支气管肺泡细胞(hbe,人be)用100ng/ml的tα1处理24小时,然后评估cftr蛋白质表达。结果表明tα1在5分之3(第1、2和5号患者)的患者(面板d,图2)中增加了cftr(波段c)的表达。这些结果表明tα1增加了δf508cftr的成熟,导致细胞表面密度和稳定性增加,确认了tα1为校正剂。
tα1通过增加δf508-cftr在cf细胞中的功能活性来充当增效剂。
增效剂的目的在于在细胞表面恢复突变体cftr的camf-依赖氯离子通道活性。相信恢复活体(5至30%)中甚至低于30%的cftr功能可以通过改善肺功能(36)给予cf患者至少部分临床效益。为评估tα1的cl-通道活性,来自cf患者的cfbe41o-细胞和hbe细胞用100ng/ml的tα1处理24小时,然后通过使用卤化物敏感的荧光探针(6-甲氧基-n-(-磺丙基)喹啉鎓(spq)评估氯离子传输,刺激毛喉素以激活cftr穿过camp/pka路径(35)。结果表明,相对于来自cf患者(面板b,图3)的cfbe41o-细胞(面板a,图3)和hbe细胞中的对照(考虑到wt对照的100%的参考值),tα1将δf508cftr细胞的氯离子渗透性增加了大约70%。因此,tα1显著地增加了cftr-媒介的氯离子渗透性,与膜相关cftr的水平增加有关。
tα1引起替代的离子通道tmem16a的表达。
离子传输缺陷的药类校正,以突变体cftr、或可以补偿cftr的功能紊乱的替代的离子通道为目标,长期地被认为是一种原因性cf治疗的有吸引力的方法(37)。tmem16a,一种ca2+激活的cl-通道,设计钙-依赖氯离子电流(38),尽管不同于cftr,但其显示了与cftr的功能和分子相互作用(39)。tmem16a与药类试剂的活化作用可以规避cf中的主要缺陷,而不考虑cftr的基因类型(40)。dna微列阵分析表明tmem16a的表达在用tα1(未发表结果)治疗肺曲霉病的小鼠中显著增加。基于这些调查结果来评估tmem16a的表达是否是由来自对照或cf患者的hbe细胞上的tα1引起的。为此细胞被暴露至100ng/ml的tα1中24小时,并通过来自细胞的全部rna上的rt-pcr来评估tmem16amrna的表达。结果表明暴露4小时后的对照和cf细胞中tα1显著增加了tmem16a的表达。然而,当对照细胞中tmem16a表达在24小时回到基线水平,它cf细胞中仍在保持高水平(图4a)。这些结果显示出通过诱导可替换的cl-通道tmem16a的表达可以进一步改善cf的离子通道活性。
tα1,无论是单独还是与增效剂依伐卡托的组合,补救δf508cftr活性在一定程度上与校正剂鲁玛卡托类似。
tα1的活性,无论是单独还是与依伐卡托的组合,用在表达f508cftr的cfbe41o-细胞上和在来自cf患者的hbe细胞上的鲁玛卡托进行比较评估。为此,用tα1(100ng/ml)、vx-770(1μm)或vx-809(3μm)的单独或组合处理细胞24小时,然后评估cftr蛋白质的表达和功能。结果表明,与鲁玛卡托相似,在δf508-转染细胞(a,细胞总蛋白(图5)的典型免疫印迹。cftr波段通过光密度法定量并表示为c/b比率。)中相对于cftr的不成熟形态(由b表示),tα1增加了cftr的成熟形态(由c表示)的表达。图5中的箭头指出cftr的b形态和c形态基于相对迁移率的位置)。依伐卡托没有增加cftr的表达,但tα1/依伐卡托的组合却实现了。在离子通道活性方面,tα1,无论是单独或还是与依伐卡托的组合,都将δf508cftr细胞的氯离子渗透性相对于对照(考虑到wt对照的100%的参考值)增加了60至70%(b,通过荧光试验用fosforkolin、fsk同时评估)。与鲁玛卡托相比,tα1的活性在表达f508cftr(b)的cfbe41o-细胞中较低,但与来自cf患者(c)的hbe细胞中的相似。与鲁玛卡托的组合,tα1没有增加鲁玛卡托(b和c)的活性。这些结果表明tα1增加cftr的表达的能力可以比得上鲁玛卡托的,并可以利用依伐卡托进行联合治疗。
cf小鼠易受感染的炎症性病理影响。
为评估cf中tα1的治疗活性,已评估c57bl/6和cftr-/-标记的小鼠对于与烟曲霉素的感染有关的炎症病理的敏感性,烟曲霉素为cf患者的气道的一种已知微生物殖菌(41)。c57bl/6和cftr-/-标记的小鼠被活的a.烟曲霉菌分生孢子鼻内感染,并用炎症的参数评估。一种持续又稳固的炎症反应,特征是特征是在bal(面板a,图6)和肺部(面板b和c,图6)补充嗜中性粒细胞(pmn)和嗜酸性球(eos),在cftr-/-标记的小鼠中观察到炎症的程度在感染之前已经可见(c,不同dpi的肺组织(过碘酸-希夫染色反应和插图中的格默里染色法))。单核细胞(mnc)、pmn细胞和eos的不同细胞计数由感染后(dpi)不同天数的maygrunwald吉姆沙染色剂测定。数值代表每组三只小鼠的平均+sem值,并且是3个实验的代表。照片用高分辨率显微镜奥林巴斯dp71拍摄,使用a×20物镜。比例尺200μm。(c)gr1+阳性细胞的数量通过不同dpi的总肺细胞上的流式细胞术评估。*p<0.05
tα1保护cf小鼠不受炎症病理影响。
cf小鼠易患与曲霉属真菌的感染和过敏有关的炎症反应,从而代表了评估tα1效果的使用模型。
曲霉属真菌感染的小鼠用每日200μg/kg/i.p.的tα1处理,自感染的那一天起连续处理6天。在感染后7天监控小鼠肺部的感染病理和细胞补充。tα1,而不是杂乱的多肽,显著地减少了c57/bl6两种小鼠,甚至cftr-/-标记的小鼠中的局部炎症细胞补充和肺部病理,表明肺部(面板a,图7)和bal(面板b,图7)内炎症细胞(主要是pnm,见插图)的补充减少。这些数据表明tα1在感染期间对cf小鼠肺部的炎症细胞补充的限制是有效的。(a)肺部组织(过碘酸-希夫染色反应和插图中的细胞补充)。照片用高分辨率显微镜奥林巴斯dp71拍摄,使用a×20物镜。比例尺200μm。(b)感染后(dpi)7天进行bal形态测量。单核细胞(mnc)、多形核细胞(pmn)和嗜酸性球(eos)的微分细胞计数由maygrunwald吉姆沙染色剂测定。数值代表每组三只小鼠的平均±sem值,并且是3个实验的代表。*p<0.05;**p<0.01;***p<0.001。
tα1下调有曲霉病的cf小鼠的炎症性细胞因子。
c57bl/6和cftr-/-标记的小鼠被活的a.烟曲霉菌分生孢子鼻内感染,并每日用200μg/kg/i.p。tα1处理,自感染的那一天起连续处理6天。结果在图8中显示。它们表明,与感染期间bal中il-1β和il-1α的c57/bl6相比,cftr-/-标记的小鼠中加重的和未解决的炎症反应与较高水平有关。在tα1的处理下,任意类型小鼠中的il-1β和il-1α两者的水平都急剧下降,极有趣的是,炎症阻塞细胞因子(il-1ra)增强。考虑到在患有cf的患者(42)中观察到il-1β和il-1α的水平较高,这些数据表明在患有cf的患者中tα1可能有助于局部炎症性/抗炎性细胞因子平衡。il-1β、il-1α和il-1ra在bal中的水平在感染后7天由elisa(pg/ml)测量。所得结果来自两个实验的汇总数据。*p<0.05;**p<0.01;***p<0.001。
tα1调节有曲霉病的cf小鼠中的th细胞平衡。
炎症性th17路径涉及cf肺部炎症(21,22,43),而th2路径则与cf真菌过敏症有关(44)。为评估tα1在th细胞活化作用方面的效果,肺部th细胞因子的水平和引流胸腔淋巴结中相应的转录因子的水平在c57bl/6和cftr-/-标记的小鼠中测量,c57bl/6和cftr-/-标记的小鼠用tα1如上感染和处理。tα1降低了th17(减小的il-17a和th17转录因子rorc的水平)、th2(低il-4和gata3)细胞活化作用,同时增加了th1(增大的ifn-γ和tbet)和调节性t细胞(增大的il-10和foxp3)两者的细胞活性。结果表明tα1是cf中抗炎性th1/treg轴的有效活化剂,同时抑制了炎症性th17/th2细胞的活化作用(图9)。在肺组织中(通过elisa或rt-pcr)和引流胸腔淋巴结中相应th转录因子的表达(通过rt-pcr)评估细胞因子水平。所得结果来自两个实验的汇总数据。未注明出版日期未完成。*p<0.05;**p<0.01;***p<0.001。
参考文献
1.o′sullivanbp,freedmansd.cysticfibrosis.lancet2009;373:1891-1904.
2.welshmj,smithae.molecularmechanismsofcftrchloridechanneldysfunctionincysticfibrosis.cell.1993;73:1251-1254.
3.gugginowb,stantonba.newinsightsintocysticfibrosis:molecularswitchesthatregulatecftr.naturerev.mol.cell.biol.2006;7:426-436.
4.cysticfibrosisfoundation.cysticfibrosisfoundationpatientregistryannualdatareport2011.cysticfibrosisfoundation;2012.
5.thecysticfibrosisgenotype-phenotypeconsortiumcorrelationbetweengenotypeandphenotypeinpatientswithcysticfibrosis.n.engl.j.med.1993;329:1308-1313.
6.cuttinggr.cysticfibrosisgenetics:frommolecularunderstandingtoclinicalapplicationnatrevgenet.2015;16:45-56.
7.mallma,galiettalj.targetingionchannelsincysticfibrosis.jcystfibros.2015.pii:s1569-1993(15)00150-2.
8.pettitrs,fellnerc.cftrmodultatorsforthetreatmentofcysticfibrosis.p&t2014;39:500-511.
9.yangh,mat.f508del-cysticfibrosistransmembraneregulatorcorrectorsfortreatmentofcysticfibrosis:apatentreview.expertopin.ther.patents2015;
10.ramseybw,daviesj,mcelvaneyng,tullise,bellsc,
11.wainwrightce,elbornjs,ramseybw,marigowdag,huangx,cipollim,colomboc,daviesjc,deboeckk,flumepa,konstanmw,mccolleysa,mccoyk,mckoneef,muncka,ratjenf,rowesm,waltzd,boylemp;trafficstudygroup;transportstudygroup.lumacaftor-ivacaftorinpatientswithcysticfibrosishomozygousforphe508delcftr.nengljmed.2015;373:220-31.
12.cholondm,quinneynl,fulcherml,esthercrjr,dasj,dokholyannv,randellsh,boucherrc,gentzschm.potentiatorivacaftorabrogatespharmacologicalcorrectionofδf508cftrincysticfibrosis.scitranslmed.2014;6:246ra96.
13.corvolh,thompsonke,tabaryo,lerouzicp,guillotl.translatingthegeneticsofcysticfibrosistopersonalizedmedicine.translres.2015apr15.pii:s1931-5244(15)00131-0.
14.belchercn,vijn.proteinprocessingandinflammatorysignalingincysticfibrosis:challengesandtherapeuticstrategies.currmolmed.2010;10:82-94.
15.cantinam,hartld,konstanmw,chmieljf.inflammationincysticfibrosislungdisease:pathogenesisandtherapy.jcystfibros.2015jul;14:419-30).
16.hartld,gaggara,brusciae,etal.innateimmunityincysticfibrosislungdisease.jcystfibros2012;11:363-382.
17.mizgerdjp,lupamm,koganms,etal.nuclearfactor-kappabp50limitsinflammationandpreventslunginjuryduringescherichiacolipneumonia.amjrespircritcaremed2003;168:810-817.
18.cohents,princea.cysticfibrosis:amucosalimmunodeficiencysyndrome.natmed2012;18:509-519.
19.hoffmanlr,ramseybw.cysticfibrosistherapeutics:theroadahead.chest2013;143:207-213.
20.ramseyb,banks-schlegels,accursof,etal.futuredirectionsinearlycysticfibrosislungdiseaseresearch.amjrespircritcaremed2012;185:887-892.
21.lannittirg,carvalhoa,cunhac,etal.th17/tregimbalanceinmurinecysticfibrosisislinkedtoindoleamine2,3-dioxygenasedeficiencybutcorrectedbykynurenines.amjrespircritcaremed2013;187:609-620.
22.lannittirg,casagrandea,delucaa,etal.hypoxiapromotesdanger-mediatedinflammationviareceptorforadvancedglycationendproductsincysticfibrosis.amjrespircritcaremed2013;188:1338-1350.
23.landslc,stanojevics.oralnon-steroidalanti-inflammatorydrugtherapyforlungdiseaseincysticfibrosis.cochranedatabasesystrev.2013jun13;6:cd001505.
24.conradc,lympj,thompsonv,dunnc,daviesz,chatfieldb,nicholsd,clancyj,venderr,eganme,quittelll,michelsonp,antonyv,spahrj,rubensteinrc,mossrb,herzenbergla,gossch,tirouvanziamr.long-termtreatmentwithoraln-acetylcysteine:affectslungfunctionbutnotsputuminflammationincysticfibrosissubjects.aphaseiirandomizedplacebo-controlledtrial.jcystfibros.2015;14:219-27.
25.p.j.mogayzeljr.,e.t.naureckas,k.a.robinson,g.mueller,d.hadjiliadis,j.b.hoag,etal.cysticflbrosispulmonaryguidelines.chronicmedicationsformaintenanceoflunghealthamjrespircritcaremed.2013187.680-689.
26.debenedictisfm,busha.corticosteroidsinrespiratorydiseasesinchildren.amjrespircritcaremed.2012;185:12-23.
27.goldsteinal,guhaa,zatzmm,etal.purificationandbiologicalactivityofthymosin,ahormoneofthethymusgland.procnatlacadsciusa1972;69:1800-1803.
28.garacie.,picaf.,rasig.,etalcombinationtherapywithbrmincancerandinfectionsdisease.mech.ageingdev,1997,96,103-116.
29.tuthillc,riosi,mcbeathr.thymosinalpha1:pastclinicalexperienceandfuturepromise.annnyacadsci2010;1194:130-135.
30.romanil,bistonif,perrucciok,etal.thymosinalpha1activatesdendriticcelltryptophancatabolismandestablishesaregulatoryenvironmentforbalanceofinflammationandtolerance.blood2006;108:2265-2274.
31.perrucciok,bonifazip,topinif,etal.thymosinalpha1toharnessimmunitytopathogensafterhaploidenticalhematopoietictransplantation.annnyacadsci2010;1194:153-161.
32.brusciae,sangiuolof,sinibaldip,gonczkk,novellig,gruenertdc.isolationofcfcelllinescorrectedatdeltaf508-cftrlocusbysfhr-mediatedtargeting.genether.2002;9:683-5.
33.zhoul,deycr,wertse,etal.correctionoflethalintestinaldefectinamousemodelofcysticfibrosisbyhumancftr.science1994;266:1705-1708.
34.vangoorf,hadidas,grootenhuispd,burtonb,stackjh,straleyks,deckercj,millerm,mccartneyj,olsoner,winejj,frizzellra,ashlockm,negulescupa.correctionofthef508del-cftrproteinprocessingdefectinvitrobytheinvestigationaldrugvx-809.procnatlacadsciusa.2011;108:18843-8.
35.munkongef1,altonew,anderssonc,davidsonh,dragomira,edelmana,farleyr,hjeltel,mclachlang,sternm,roomansgm.
measurementofhalideeffluxfromculturedandprimaryairwayepithelialcellsusingfluorescenceindicators.jcystfibros.2004;3suppl2:171-6.
36.ramalhoas1,becks,meyerm,penqued,cuttinggr,amaralmd.fivepercentofnormalcysticfibrosistransmembraneconductanceregulatormrnaamelioratestheseverityofpulmonarydiseaseincysticfibrosis.amjrespircellmolbiol.2002;27:619-27).
37.mallma,galiettalj.targetingionchannelsincysticfibrosis.jcystfibros.201523.pii:s1569-1993(15)00150-2.
38.caputoa1,cacie,ferreral,pedemonten,barsantic,sondoe,pfefferu,ravazzolor,zegarra-morano,galiettalj.tmem16a,amembraneproteinassociatedwithcalcium-dependentchloridechannelactivity.science.2008;322:590-4.
39.ousingsawatj,kongsupholp,schreiberr,kunzelmannk.cftrandtmem16aareseparatebutfunctionallyrelatedcl-channels.cellphysiolbiochem.2011;28(4):715-24).
40.sondoe,cacie,galiettalj.thetmem16achloridechannelasanalternativetherapeutictargetincysticfibrosis.intjbiochemcellbiol.2014;52:73-6.
41.feltonic,simmondsnj.aspergillusandcysticfibrosis:olddisease-newclassifications.curropinpulmmed2014;20:632-638.
42.tanga,sharmaa,jenr,etal.inflammasome-mediatedil-1betaproductioninhumanswithcysticfibrosis.plosone2012;7:e37689.
43.dubinpj,mcallisterf,kollsjk.iscysticfibrosisath17disease?inflammres2007;56:221-227.
44.kreindlerjl,steelec,nguyenn,etal.vitamind3attenuatesth2responsestoaspergillusfumigatusmountedbycd4+tcellsfromcysticfibrosispatientswithallergicbronchopulmonaryaspergillosis.jclininvest2010;120:3242-3254。
序列表
<110>路易吉娜·罗马尼
恩里科·加拉奇
<120>胸腺素α1用于囊性纤维化治疗中的用途
<130>pct30251
<150>rm2015a000056
<151>2015-02-09
<150>102015000053089
<151>2015-09-18
<160>2
<170>patentin版本3.5
<210>1
<211>28
<212>prt
<213>智人
<400>1
seraspalaalavalaspthrsersergluilethrthrlysaspleu
151015
lysglulyslysgluvalvalgluglualagluasn
2025
<210>2
<211>28
<212>prt
<213>人工
<220>
<223>seqidno:1的乱序的多肽
<400>2
alalysseraspvallysalagluthrsersergluileaspthrthr
151015
gluleuaspglulysvalgluvallysalaasnglu
2025
- 还没有人留言评论。精彩留言会获得点赞!