一种用DSC作为活化剂的细菌多糖蛋白结合疫苗的制备方法与流程
本发明属于疫苗制备技术领域,尤其涉及一种用dsc作为活化剂的细菌多糖蛋白结合疫苗的制备方法。
背景技术:
目前国内外在细菌多糖蛋白结合疫苗制备时,使用的细菌多糖活化剂为溴化氰(cnbr)、1-氰基-4-二甲氨基吡啶四氟硼酸酯(cdap)、高碘酸钠、碳二亚胺(edac),此四种多糖活化剂在活化细菌多糖时都有一些不足。如,cnbr为剧毒物品,其用于细菌多糖活化时,对环境造成一定的污染以及存在一些使用的安全隐患;cdap虽其毒性没有cnbr强,但cdap价格较为昂贵,增加了疫苗制造的成本;高碘酸钠作为多糖活化剂,其将多糖结构破坏,并将多糖的羟基氧化为醛基,且整个反应周期较长,需要14天左右,且高碘酸钠活化法对多糖结构有破坏,步骤繁多;edac作为多糖活化剂,其对多糖结构要求较高,即多糖结构中要含有游离羧基,edac活化多糖中的羧基进而与adh连接,形成多糖-adh衍生物。基于以上问题,有必要研究其他的细菌多糖活化剂。
n,n'-二琥珀酰亚胺基碳酸酯(dsc),英文名为n,n'-disuccinimidylcarbonate,cas登记号为74124-79-1,分子式是c9h8n2o7,分子量为256.169,粉末状,用作脱水剂及医药中间体。根据文献报道,n,n’-二琥珀酰亚胺碳酸酯(dsc)目前主要用于氨基酸、蛋白质的缩合剂。
技术实现要素:
针对现有细菌多糖活化剂存在的不足,本发明提供一种用dsc作为活化剂的细菌多糖蛋白结合疫苗的制备方法。本发明采用n,n’-二琥珀酰亚胺碳酸酯(dsc)作为细菌多糖活化剂,(1)dsc毒性较低,较cnbr环保;(2)dsc商业价格比cdap低,降低疫苗制造的成本。(3)dsc与高碘酸钠相比,其活化多糖时间较短10~30min,且步骤较少,完成多糖活化到多糖与蛋白质结合整个周期4-5天时间。
本发明的技术方案如下:一种用dsc作为活化剂的细菌多糖蛋白结合疫苗的制备方法,所述制备方法中细菌多糖与蛋白共价结合前,细菌多糖首先与n,n’-二琥珀酰亚胺碳酸酯(dsc)在ph为8.0-9.5碱性水溶液条件下进行活化反应,形成细菌多糖的琥珀酰亚胺碳酸酯。
所述细菌多糖与n,n’-二琥珀酰亚胺碳酸酯(dsc)的质量比为1:1-1:3。
所述活化反应中细菌多糖以1-20mg/ml的浓度溶解于0.1~0.3mol/l的nacl溶液中。
所述细菌多糖为b型流感嗜血杆菌多糖,奈瑟氏脑膜炎球菌血清群a群、肺炎球菌血清型1、2、4、6a、6b、7f、8、9n、9v、10a、11a、14、15b、17f、18c、19a、19f、20、22f、23f、33f,副伤寒沙门菌甲型和副伤寒沙门菌乙型中的任意一种。
所述细菌多糖的琥珀酰亚胺碳酸酯与双功能链接剂反应形成细菌多糖衍生物,细菌多糖衍生物再与载体蛋白在缩合剂的作用下共价结合,形成细菌多糖蛋白结合物。
进一步地,所述双功能链接剂为1,6-己二酰肼(adh)。
进一步地,所述载体蛋白为破伤风类毒素(tt)、白喉毒素(dt)和白喉毒素无毒变异体(crm197)中的任意一种。
作为优选,所述方法包括以下步骤:
步骤(1)细菌多糖与n,n’-二琥珀酰亚胺碳酸酯(dsc)在ph为8.0-9.5碱性水溶液条件下进行活化反应,形成细菌多糖的琥珀酰亚胺碳酸酯;
步骤(2)在ph为8.0-9.5碱性水溶液条件下,加入双功能链接剂与细菌多糖琥珀酰亚胺碳酸酯进行单端共价连接,得到细菌多糖衍生物;
步骤(3)细菌多糖衍生物经1-30kd的膜超滤浓缩至多糖浓度为1-15mg/ml,得到超滤浓缩后的细菌多糖衍生物;
步骤(4)将超滤浓缩后的细菌多糖衍生物中加入载体蛋白,并在缩合剂作用下反应,形成细菌多糖蛋白结合物,超滤浓缩后的细菌多糖衍生物质量与载体蛋白的质量比为1:0.6-1:2;
步骤(5)用凝胶柱进行纯化,收集v0附近的吸收峰,除菌过滤即获得纯化后的细菌多糖蛋白结合物原液,即为细菌多糖蛋白结合疫苗。
本发明还提供通过所述制备方法得到的细菌多糖蛋白结合疫苗。
本发明最后还提供n,n’-二琥珀酰亚胺碳酸酯在活化细菌多糖中的应用。
本发明的特点在于,现有技术中dsc用于氨基酸、蛋白质的缩合剂,但是由于dsc在水中发生水解反应,容易影响蛋白缩合过程;故蛋白缩合反应一般都在有机溶剂中进行。故本领域技术人员都觉得dsc不适宜在水中参与反应,但本发明发现,虽然dsc在水中会发生部分水解,但是依然能够达到活化细菌多糖的效果,且具有意料不到的优点,如活化时间段、毒性低等。
本发明采用dsc作为细菌多糖活化剂,dsc毒性较低,较cnbr环保;dsc商业价格比cdap低,降低疫苗制造的成本。dsc与高碘酸钠相比,其活化多糖时间较短10~30min,且步骤较少,完成多糖活化到多糖与蛋白质结合整个周期4-5天时间。
与现有技术相比,本发明具有以下有益效果:本发明采用n,n’-二琥珀酰亚胺碳酸酯(dsc)作为细菌多糖活化剂,毒性较低,环保,成本低,降低疫苗制造的成本。活化多糖时间短,且步骤较少,完成多糖活化到多糖与蛋白质结合整个周期4-5天时间。
本发明方法不仅操作简便,成本低,适合工业化生产,而且用该方法活化多糖制备得到的衍生进一步与蛋白载体结合获得的多糖蛋白结合物的各项检测结果均符合《中国药典》2015版的标准要求,游离多糖含量低,动物效力试验结果较好。
附图说明
图1为dsc作为活化剂制备的a群脑膜炎球菌多糖蛋白结合物与a群脑膜炎球菌的效力试验结果对比图;
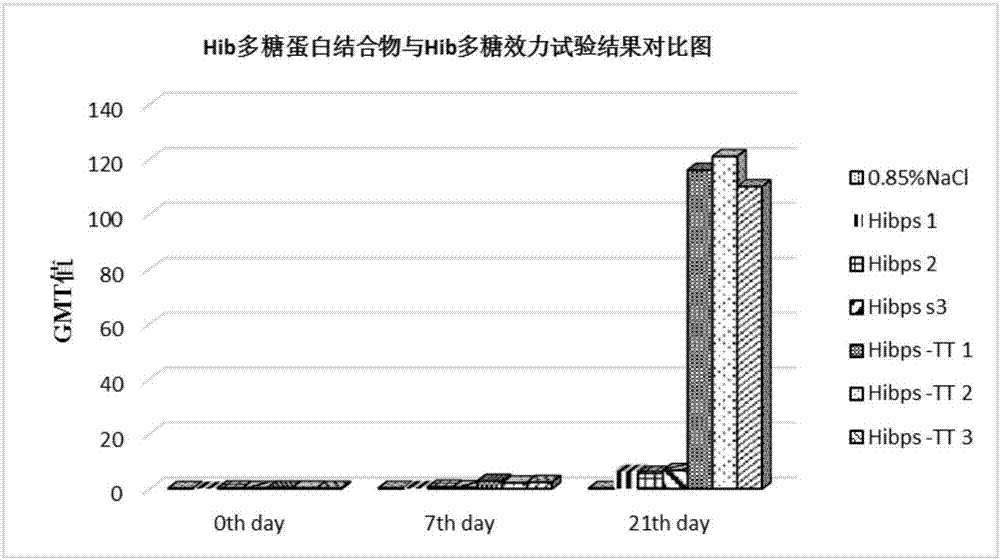
图2为dsc作为活化剂制备的b型流感嗜血杆菌多糖蛋白结合物与b型流感嗜血杆菌多糖的效力试验结果对比图;
图3为dsc作为活化剂制备的肺炎球菌19f型多糖蛋白结合物与肺炎球菌19f型多糖的效力试验结果对比图;
具体实施方式
以下各实施例无特殊说明均为常规技术,各实施例中各种试剂、原料等均为市售产品,各型细菌菌种无特殊说明均购买自中国医学微生物学菌种保藏中心,各种细菌菌多糖、载体蛋均由云南沃森生物技术股份有限公司提供。以下实施例是对本发明的技术方案做进一步详细说明,但并不限制本发明的保护范围。
实施例1a群脑膜炎球菌多糖蛋白结合物的制备及其动物有效性试验
a群脑膜炎球菌多糖衍生物的制备
称取纯化后的a群脑膜炎球菌细菌多糖200mg,用0.2mol/l的nacl溶液溶解为5mg/ml;称取500mg的dsc,用乙腈溶解为100mg/ml;调a群脑膜炎球菌细菌多糖溶液ph值为8.0~9.5,加入dsc粉末,维持ph值为8.0~9.5反应10min,加入800mg的己二酰肼,维持ph值为8.5~9.0反应40min;用30kd的超滤膜超滤浓缩,冻干即得a群脑膜炎球菌多糖衍生物(menaps-adh)。
a群脑膜炎球菌多糖蛋白结合物的制备
称取a群脑膜炎球菌多糖衍生物150mg,溶解于15ml0.2mol/l的nacl中,加入破伤风类毒素溶液15ml(破伤风类毒素蛋白浓度为10mg/ml),然后加入碳二亚胺(edac)至edac浓度为0.1mol/l,维持ph5.5±0.5(2~8℃)反应4小时,得a群脑膜炎球菌多糖蛋白结合物(menaps-tt),然后用凝胶柱进行纯化,收集v0附近的吸收峰,除菌过滤即的a群脑膜炎球菌多糖蛋白结合物原液(menaps-tt)。
a群脑膜炎球菌多糖蛋白结合物的效力试验
balb/c小鼠,12-14g,70只,分7组(a群脑膜炎球菌多糖为阳性对照组设3组,dsc作为活化剂制备的a群脑膜炎球菌多糖蛋白结合疫苗为试验组设3组,阴性组1组:0.85%的生理盐水):大腿内侧皮下注射供试品2.5ug,免疫前采血保留血清(第0天)作为阴性对照,分别于第0,14天、28天各免疫一次;第一针免疫后7天(第7天)采血保留血清,第二针免后7天(第21天)采血保留血清,第三针免后7天(第35天)采血分离血清并处死动物;elisa法测定阳转率及血清抗体水平gmt。(阳性对照组、试验组血清同一块板检测,试验组血清2倍梯度稀释;cutoff值=2.1×阴性对照组od均值;试验组小鼠血清od值大于cutoff值者,判为阳性;最接近且不小于cutoff值的梯度记为本只小鼠的抗体滴度。)
试验结果统计分析
dsc作为活化剂制备的a群多糖蛋白结合物的检测结果见表1。
表1dsc作为活化剂制备的a群多糖蛋白结合物的检测结果
结果检测方法参考《中国药典》2015年版三部,《中国药典》2015年版三部中a群脑脑膜炎球菌多糖蛋白结合物的多糖应不低于50μg/ml,蛋白含量应不55μg/ml,a群游离多糖的含量,应不高于20%。游离载体蛋白含量应不高于5%。a群多糖kd值在0.2以前的洗脱多糖回收率应>60%,鉴别试验阳性。
用dsc作为多糖活化剂制备的a群脑膜炎球菌多糖蛋白结合物的各项检查结果都符合《中国药典》2015年版三部的要求。
dsc作为活化剂制备的a群多糖蛋白结合物的动物免疫原性试验结果如表2和图1所示。
表2
表2结果显示,用dsc作为多糖活化剂制备的a群脑膜炎球菌多糖蛋白结合物(试验组)的鼠免疫原性抗体滴度水平较未结合的a群多糖(阳性对照组)高,且试验组第21天和第35天的抗体滴度水平均与阴性对照组有显著差异(p<0.05)。通过origin软件进行分析,结合物注射第一针后7天的抗体滴度与多糖第一针注射后7天的抗体滴度相比p(0.0628)>0.05,无显著差异;结合物注射第二针后7天的抗体滴度与多糖注射第二针后7天的抗体滴度相比p(0.00012)<0.05,有显著差异;结合物注射第三针后7天的抗体滴度与多糖注射第三针后7天的抗体滴度相比p(0.00004)<0.05,有显著差异。而结合物各针次之间相比,结合物试第一针注射后7天(7thday)的抗体滴度与阴性血清相比p(0.00274)<0.05,有显著差异;第二针注射后7天(21thday)的抗体滴度与第一针相比p(0.00017)<0.05,有显著差异;第三针注射后7天(35thday)的抗体滴度水平与第二针相比p(0.0012)<0.05,有显著差异。
实施例2b型流感嗜血杆菌多糖蛋白结合物的制备及其动物有效性试验
b型流感嗜血杆菌多糖衍生物的制备
称取纯化后的b型流感嗜血杆菌多糖200mg,用0.2mol/l的nacl溶液溶解为5mg/ml;称取400mg的dsc,用乙腈溶解为100mg/ml;调b型流感嗜血杆菌多糖溶液ph值为8.0~9.5,加入dsc,维持ph值为8.0~9.5反应15min,加入800mg的己二酰肼,维持ph值为8.5~9.0反应20min;用30kd的超滤膜超滤浓缩,冻干即得b型流感嗜血杆菌多糖多糖衍生物(hibps-adh)。
b型流感嗜血杆菌多糖蛋白结合物的制备
称取b型流感嗜血杆菌多糖衍生物150mg,溶解于15ml0.2mol/l的nacl中,加入破伤风类毒素溶液15ml(破伤风类毒素蛋白浓度为10mg/ml),然后加入碳二亚胺(edac)至edac浓度为0.1mol/l,维持ph5.5±0.5(2~8℃)反应3小时,得b型流感嗜血杆菌多糖蛋白结合物(hibps-tt),然后用凝胶柱进行纯化,收集v0附近的吸收峰,除菌过滤即得b型流感嗜血杆菌多糖蛋白结合物原液(hibps-tt)。
b型流感嗜血杆菌多糖蛋白结合物的效力试验
参考《中国药典》2015年版三部进行实验,balb/c小鼠12-14g,70只,分7组,每组10只,分别为:b型流感嗜血杆菌多糖为阳性对照组设3组、dsc作为活化剂制备的b型流感嗜血杆菌多糖蛋白结合疫苗为试验组设3组、阴性对照组1组(注射0.85%氯化钠溶液)。分别于第1天,第14天皮下注射两次,每次注射剂量为2.5ug多糖的结合疫苗,于第7天,第21天经眼眶后静脉采血;以elisa法测定阳转率及血清抗体水平gmt。以0.85%氯化钠溶液对照组小鼠血清的吸光度值求出cutoff值(阳性对照组、试验组、阴性对照组血清同一块板检测,试验组血清2倍梯度稀释;cutoff值=2.1×阴性对照组od均值;试验组小鼠血清od值大于cutoff值者,判为阳性;最接近且不小于cutoff值的梯度记为本只小鼠的抗体滴度。)
试验结果统计分析
dsc作为活化剂制备的b型流感嗜血杆菌多糖蛋白结合物的检测结果见表3。
表3
结果检测方法参考《中国药典》2015年版三部,《中国药典》2015年版三部中b型流感嗜血杆菌多糖衍生物衍化率1.6%~4.5%,b型流感嗜血杆菌多糖蛋白结合物的多糖含量应不低于28μg/ml,蛋白含量应不低于48μg/ml,多糖糖蛋白比值0.3~0.59,b型流感嗜血杆菌游离多糖的含量≤20%。b型流感嗜血杆菌多糖kd值应不高于0.2,kd值小于0.2的洗脱液婚纱率应不低于60%,鉴别试验阳性。
用dsc作为多糖活化剂制备的b型流感嗜血杆菌多糖蛋白结合物的各项检查结果都符合《中国药典》2015年版三部的要求。
dsc作为活化剂制备的b型流感嗜血杆菌多糖蛋白结合物的效力试验结果如表4和图2所示。
表4
表4结果显示,用dsc作为多糖活化剂制备的b型流感嗜血杆菌多糖蛋白结合物(试验组)的鼠免疫原性抗体滴度水平均较未结合的b型流感嗜血杆菌多糖(阳性对照组)及阴性组高。通过origin软件进行分析,结合物注射第一针后7天的抗体滴度与多糖第一针注射后7天的抗体滴度相比p(0.01402)<0.05,有显著差异;结合物注射第二针后7天的抗体滴度与多糖注射第二针后7天的抗体滴度相比p(0.00099)<0.05,有显著差异。
而结合物各针次之间相比,结合物第一针注射后7天(7thday)的抗体滴度与阴性血清相比p(0.00713)<0.05,有显著差异;第二针注射后7天(21thday)的抗体滴度与第一针相比p(0.00082)<0.05,有显著差异。
实施例3肺炎球菌19f型多糖蛋白结合物的制备及其动物有效性试验
肺炎球菌19f型多糖衍生物的制备
称取纯化后的肺炎球菌19f型多糖200mg,用0.2mol/l的nacl溶液溶解为5mg/ml;称取300mg的dsc,用乙腈溶解为100mg/ml;调肺炎球菌19f型多糖溶液ph值为8.0~9.5,加入dsc,维持ph值为8.0~9.5反应20min,加入800mg的己二酰肼,维持ph值为8.5~9.0反应20min;用30kd的超滤膜超滤浓缩,冻干即得肺炎球菌19f型多糖衍生物(pn19fps-adh)。
肺炎球菌19f型多糖蛋白结合物的制备
称取肺炎球菌19f型多糖衍生物150mg,溶解于15ml0.2mol/l的nacl中,加入破伤风类毒素溶液15ml(破伤风类毒素蛋白浓度为8mg/ml),然后加入碳二亚胺(edac)至edac浓度为0.15mol/l,维持ph5.5±0.5(2~8℃)反应4小时,得肺炎球菌19f型多糖蛋白结合物(pn19fps-tt),然后用凝胶柱进行纯化,收集v0附近的吸收峰,除菌过滤即得肺炎球菌19f型多糖蛋白结合物原液(pn19fps-tt)。
肺炎球菌19f型多糖蛋白结合物的效力试验
运用新西兰大白兔动物模型,共60只,试验设6组:样品组3组、阳性对照组3组;样品组中结合物含量10ug/ml(每只5微克多糖),阳性对照组多糖含量10ug/ml;每组用兔10只,免前采血保留血清,采用腿弯部淋巴结处皮下注射0.5ml(双侧,每侧0.25ml),第0天、21天、42天各免疫一次,各针次免疫后14天采血分离血清;elisa法测定阳转率及血清抗体水平gmt。(结果判定:免前、免后血清同一块板检测,2倍梯度稀释;以免前od值不超过0.500梯度为基准,cutoff值=2.1×免前od值,免后od值大于cutoff值,判为阳性,小于cutoff值的梯度记为本只兔子的滴度。)
试验结果统计分析
dsc作为活化剂制备的肺炎球菌19f型多糖蛋白结合物的检测结果见表5。
表5
用dsc作为多糖活化剂制备的肺炎球菌19f型多糖蛋白结合物的各项检查结果都达到行业同类结合物疫苗质量控制标准。
dsc作为活化剂制备的肺炎球菌19f型多糖蛋白结合物的动物免疫原性试验结果如表6和图3所示。
表6
表6结果显示,用dsc作为多糖活化剂制备的肺炎球菌19f型多糖蛋白结合物的鼠免疫原性抗体滴度水平较未结合的肺炎球菌19f型多糖高。通过origin软件进行分析,结合物注射第一针后14天(14thday)的抗体滴度与多糖第一针注射后14天(14thday)的抗体滴度相比p(0.01008)>0.05,无显著差异;结合物注射第二针后14天(35thday)的抗体滴度与多糖注射第二针后14天(35thday)的抗体滴度相比p(0.00081)<0.05,有显著差异;结合物注射第三针后14天(56thday)的抗体滴度与多糖注射第三针后14天(56thday)的抗体滴度相比p(0.00091)<0.05,有显著差异。而结合物各针次之间相比,结合物第一针注射后14天(14thday)的抗体滴度与阴性血清相比p(0.00993)<0.05,有显著差异;第二针注射后14天(35thday)的抗体滴度与第一针相比p(0.00090)<0.05,有显著差异;第三针注射后7天(56thday)的抗体滴度水平与第二针相比p(0.00544)<0.05,有显著差异。
综合dsc作为a群脑膜炎球菌多糖、b型流感嗜血杆菌多糖、肺炎球菌19f型多糖活化剂制备的结合物的各项检测结果和结合物的动物免疫原性结果看出,dsc作为多糖活化剂制备的a群脑膜炎球菌多糖、b型流感嗜血杆菌多糖、肺炎球菌19f型多糖蛋白结合物的各项检测结果都符合《中国药典》2015年版三部及行业相关质量控制标准,且各结合物效力试验结果与多糖相比有显著差异,因此,dsc可作为细菌性多糖蛋白结合疫苗的多糖活化剂候选,且dsc活化多糖制备多糖蛋白结合物的方法可用于细菌性多糖蛋白结合疫苗的制备。
- 还没有人留言评论。精彩留言会获得点赞!