新的核苷氨基磷酸脂化合物的组合物及其制备方法与流程
本发明属于药物制剂领域,具体涉及(2S)-2-((([1,1′-联苯基]-4-基氧基)(((2R,3R,4R,5R)-5-(2,4-二氧代-3,4-二氢嘧啶-1(2H)-基)-4-氟-3-羟基-4-甲基四氢呋喃-2-基)甲氧基)磷酰基)氨基)丙酸异丙酯的口服制剂及其制备方法和应用。
背景技术:
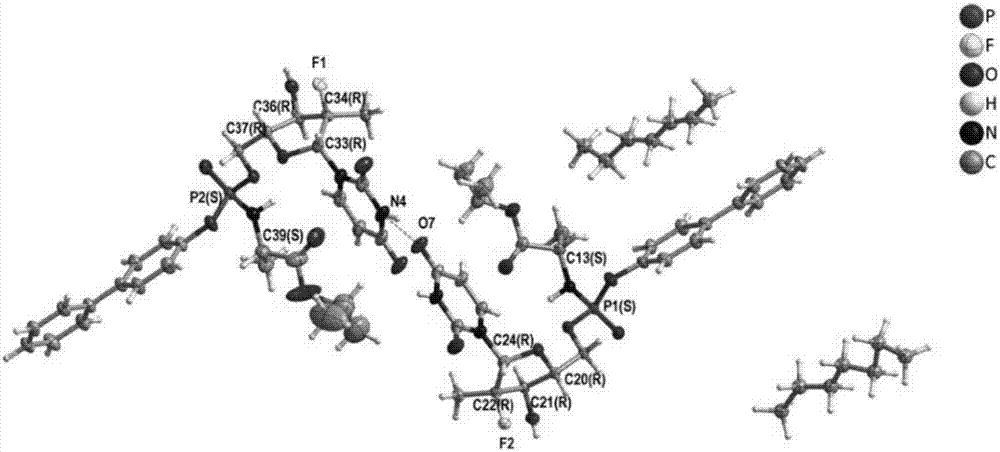
:丙型肝炎病毒(HCV)感染是世界范围内流行的疾病,全球慢性感染者已超过2亿,埃及的慢性感染率为15%,巴基斯坦为4.8%,中国为3.2%,位列世界前三。丙型肝炎病毒感染的临床表现多样,轻至炎症,重至肝硬化、肝癌。慢性丙型肝炎还可以并发某些肝外表现,包括类风湿性关节炎、干燥性结膜角膜炎、扁平苔藓、肾小球肾炎、混合型冷球蛋白血症、B细胞淋巴瘤和迟发性皮肤卟啉症等,可能是机体异常免疫反应所致。且丙肝肝硬化失代偿期时,可以出现各种并发症,如腹水腹腔感染,上消化道出血,肝性脑病,肝肾综合征,肝衰竭等表现。HCV属于黄病毒科肝病毒属病毒,其与黄病毒科中的另外两个属即瘟病毒属和黄病毒属的基因结构相似。目前,治疗HCV感染的标准方法有干扰素以及干扰素和利巴韦林联合疗法。不过,仅50%的治疗者对该方法有反应,且干扰素具有明显的副作用,例如流行性感冒样症状、体重减低以及疲乏无力,而干扰素和利巴韦林联合疗法则产生相当大的副作用,包括溶血、贫血症和疲乏等。另外,已开发的用于治疗HCV感染的药物包括蛋白酶抑制剂、噻唑烷衍生物、噻唑烷和N-苯甲酰苯胺、菲醌、解旋酶抑制剂、核苷聚合酶抑制剂和胶霉毒素、反义硫代磷酸酯寡核苷酸、依赖于IRES的翻译的抑制剂、核酶以及核苷类似物等。目前,核苷磷酸酯类化合物用于治疗黄病毒科病毒尤其是HCV感染是本领域的重要研发方向。CN104031104A公开了一种如式(1)所示的新型核苷氨基磷酸酯化合物,其化学名称为(2S)-2-((([1,1′-联苯基]-4-基氧基)(((2R,3R,4R,5R)-5-(2,4-二氧代-3,4-二氢嘧啶-1(2H)-基)-4-氟-3-羟基-4-甲基四氢呋喃-2-基)甲氧基)磷酰基)氨基)丙酸异丙酯(以下简称“式(1)化合物”),CN104031104A报道了(2S)-2-((([1,1′-联苯]-4-基氧基)(((2R,3R,4R,5R)-5-(2,4-二氧代-3,4-二氢嘧啶-1(2H)-基)-4-氟-3-羟基-4-甲基四氢呋喃-2-基)甲氧基)磷酰基)氨基)丙酸异丙酯具有优异的抗病毒活性,对细胞的毒性小,可用于治疗黄病毒科病毒,尤其是丙型肝炎病毒感染。至今尚未见报导包含该化合物或其药学可接受的盐、异构体、溶剂合物、水合物或结晶的合适的制剂。(2S)-2-((([1,1′-联苯基]-4-基氧基)(((2R,3R,4R,5R)-5-(2,4-二氧代-3,4-二氢嘧啶-1(2H)-基)-4-氟-3-羟基-4-甲基四氢呋喃-2-基)甲氧基)磷酰基)氨基)丙酸异丙酯为前药,通过在肝脏内转化为活性代谢物而发挥其抗病毒作用,因此口服给药剂型可能是较合适的给药剂型。不过,本领域公知,在研究该类制剂的配制中面临许多问题,例如制剂的长期稳定性,有关物质的控制,药物的吸收以及生物利用度等。这些问题是由多种因素决定的,如许多因素影响药物的吸收,包括药物从制剂中的溶出或释放、药物在生理条件下的溶解以及在胃肠道的渗透性等。在初步的处方研究过程中,本发明的发明人发现式(1)化合物的溶解性和渗透性有待提高,在水中易聚集成团,故给该类化合物的制剂处方研究带来巨大的挑战。因此需要提供具有能够完全溶出的,体内吸收好,杂质少,吸湿性低,稳定性好的(2S)-2-((([1,1′-联苯基]-4-基氧基)(((2R,3R,4R,5R)-5-(2,4-二氧代-3,4-二氢嘧啶-1(2H)-基)-4-氟-3-羟基-4-甲基四氢呋喃-2-基)甲氧基)磷酰基)氨基)丙酸异丙酯口服制剂。技术实现要素:本发明一个目的是提供一种包含式(1)化合物或其药学可接受的盐、异构体、溶剂合物、水合物或结晶的口服制剂,该制剂能够完全溶出,稳定性好。本发明的另一个目的是提供一种本发明的口服制剂的制备方法。本发明的再一个目的是提供本发明的口服制剂在制备用于预防和/或治疗黄病毒科病毒尤其是HCV感染的药物中的应用。上述发明目的,通过以下技术方案得以实现。本发明提供一种口服制剂,其包含(a)式(1)化合物或其药学可接受的盐、异构体、溶剂合物、水合物或结晶;和(b)吸附剂。本发明提供式1a的化合物,其是式1化合物的立体异构体,化学名称为(S)-2-[[[(S)-(1,1’-联苯基-4-氧基)]-[((2R,3R,4R,5R)-5-(2,4-二氧代-3,4-二氢嘧啶-1(2H)-基)-4-氟-3-羟基-4-甲基四氢呋喃-2-基)甲氧基]磷酰基]氨基]丙酸异丙酯,适合用于丙型肝炎病毒感染患者的治疗,本发明的发明人使用CN105985355A中实验例1和2的方法测定式1a的化合物对HCV1b和1a复制子的抑制活性,结果显示式1a的化合物对HCV病毒具有明显优于式1的化合物的抑制活性。在一些实施方案中,本发明的口服制剂包含(a)式(1a)的化合物或其药学可接受的盐、溶剂合物、水合物或结晶;和(b)吸附剂。在本发明的口服制剂中,采用式(1a)的化合物的任意形态或无定形和吸附剂的组合,获得的制剂具有非常好的稳定性,尽管无定型物具有亚稳定性质,限制其商业化应用,但是,本发明的发明人意料不到地发现,经加速6个月和长期6个月测试后,制剂性质仍然非常稳定,各项指标未见明显变化。同时,使用式(1a)的化合物的晶型形式,制备的本发明的口服制剂同样非常稳定。因此,在一些具体的实施方案中,根据本发明的口服制剂,其中所述式(1a)的化合物为晶型或无定型物。优选地,本发明的口服制剂为固体形式。在一些实施方案中,本发明的口服制剂包括片剂、胶囊剂、丸剂、颗粒剂、散剂、小丸、锭剂、扁囊剂等。在具体的实施方案中,本发明的口服制剂是片剂、胶囊剂、颗粒剂。在一些实施方案中,本发明的口服制剂还进一步包含崩解剂、润滑剂和/或填充剂。在一些实施方案中,所述崩解剂选自玉米淀粉、羟丙基淀粉、羧甲基纤维素、羧甲基纤维素钠、羧甲基纤维素钙、交联聚维酮、羧甲基淀粉钠、交联羧甲基纤维素钠、低取代的羟丙基纤维素、预胶化淀粉中的一种或多种。更优选的,所述崩解剂选自交联羧甲基纤维素钠、羧甲基淀粉钠、交联聚维酮、低取代的羟丙基纤维素中的一种或多种。在一些实施方案中,所述润滑剂选自硬脂酸镁、硬脂酸、硬脂酸钙、硬脂酸锌、硬脂富马酸钠、滑石粉、聚乙二醇中的一种或多种。在一些实施方案中,所述填充剂选自甘露醇、淀粉类、糖类、纤维素类和无机盐类。在一些实施方案中,根据本发明的口服制剂,其中基于式(1)的化合物的量计,式(1)的化合物或其药学可接受的盐、异构体、溶剂合物、水合物或结晶占制剂片重的约15%-85%(重量/重量),吸附剂占制剂片重的约15%至85%(重量/重量),崩解剂占制剂片重的约0%至20.0%(重量/重量),润滑剂占制剂片重的约0%至15.0%(重量/重量),填充剂占所述制剂片重的约0%至30%(重量/重量)。在一些实施方案中,根据本发明的口服制剂,其中基于式(1)的化合物的量计,式(1)的化合物或其药学可接受的盐、异构体、溶剂合物、水合物或结晶占制剂片重的约20%-50%(重量/重量),吸附剂占制剂片重的约30%至约60%(重量/重量),崩解剂占制剂片重的约5%至15.0%(重量/重量),润滑剂占制剂片重的约0.2%至10.0%(重量/重量),填充剂占所述制剂片重的约10%至20%(重量/重量)。在另一些实施方案中,根据本发明的口服制剂,其中基于式(1)的化合物的量计,式(1)的化合物或其药学可接受的盐、异构体、溶剂合物、水合物或结晶占制剂片重的约30%至约50%(重量/重量),吸附剂占制剂片重的约30%至约50%(重量/重量),崩解剂占制剂片重的约5%至15.0%(重量/重量),润滑剂占制剂片重的约0.5%至5.0%(重量/重量),填充剂占所述制剂片重的约10%至20%(重量/重量)。本发明的吸附剂可以是表面多孔、具有吸附作用的辅料。例如,在一些实施方案中,所述吸附剂选自交联聚维酮、微晶纤维素、乳糖、环糊精、低取代羟丙纤维素、二氧化硅。在一个实施方案中,使用交联聚维酮作为吸附剂,优选地,使用粒径为10-30μm的交联聚维酮作为吸附剂。在另一个实施方案中,使用环糊精作为吸附剂。在另一个实施方案中,使用低取代羟丙纤维素作为吸附剂。低取代羟丙纤维素在片剂生产中可用于湿法制粒中内加,也可外加或内外同时加效果更佳。在另一些实施方案中,使用无机酸盐或无机盐作为吸附剂。无机酸盐包括磷酸钠、磷酸钙、硫酸钾、磷酸二氢钠、磷酸氢二钠;无机盐包括氯化钠、氯化钙、氯化钾。另外,硅藻土、表面多孔的纤维素及其盐、淀粉、糖类等药用辅料亦可用作本发明的吸附剂。本发明提供本发明的口服制剂的制备方法,包括组合本发明的口服制剂中各组分的步骤。本发明的发明人发现,在本发明的制剂中,将式(1)化合物溶解于易溶解的溶剂,然后制成制剂,能够溶出更完全。在一些实施方案中,根据本发明的制剂的制备方法,将式(1)化合物溶解于易溶解的溶剂后,再与吸附剂混合,然后制粒、压片、包衣,制成口服制剂。在另一些实施方案中,根据本发明的制剂的制备方法,将式(1)化合物和吸附剂溶于易溶解的溶剂,然后制粒、压片、包衣,制成口服制剂。在一些实施方案中,通过以下方法制备本发明的口服制剂,所述方法包括:a)将吸附剂在装置中混合均匀;b)在搅拌下将式(1)的化合物或其药学可接受的盐、异构体、溶剂合物、水合物或结晶溶解于溶剂中;和c)将b)步骤的混合物加至a)步骤的吸附剂中,干燥,然后制备颗粒。在一些具体的实施方案中,通过以下方法制备本发明的口服制剂,所述方法包括:a)将吸附剂在装置中混合均匀;b)在搅拌下将式(1)的化合物或其药学可接受的盐、异构体、溶剂合物、水合物或结晶溶解于溶剂中;c)将b)步骤的混合物加至a)步骤的吸附剂中,流化床干燥后制得颗粒;e)任选地将干燥后的颗粒与崩解剂、润滑剂、填充剂混合均匀;f)将混合好的颗粒进行压片;和g)包衣。在一些具体的实施方案中,根据以上本发明的口服制剂的制备方法,其中b)步骤中的溶剂为醇类溶剂,优选地,所述醇类溶剂选自甲醇、乙醇和异丙醇中的一种或多种。在一个更优选的实施方案中,将式(1)化合物药溶解于乙醇中。在一些具体的实施方案中,通过以下方法制备本发明的口服制剂,所述方法包括:a)将处方量的吸附剂在湿法制粒机中混合均匀;b)在搅拌下将式(1)的化合物或其药学可接受的盐、异构体、溶剂合物、水合物或结晶溶解于醇类溶剂中;c)将b)步骤的混合物加至a)步骤的吸附剂中,制备湿颗粒;d)将湿颗粒采用流化床干燥;e)任选地将干燥后的颗粒与崩解剂、润滑剂、填充剂混合均匀;f)将混合好的颗粒进行压片;和g)包衣。在一些实施方案中,通过以下方法制备本发明的口服制剂,所述方法包括:a)将式(1)的化合物或其药学可接受的盐、异构体、溶剂合物、水合物或结晶和吸附剂溶于溶剂中,形成混合溶液;和b)将所述混合溶液干燥,然后制成颗粒。在一些具体的实施方案中,通过以下方法制备本发明的口服制剂,所述方法包括:a)将式(1)的化合物或其药学可接受的盐、异构体、溶剂合物、水合物或结晶和吸附剂溶于溶剂中,形成分散均匀的混合溶液;b)采用喷雾干燥装置将混合溶液干燥制成混合粉末;c)混合粉末与崩解剂、润滑剂混合;和d)压片。在另外一些实施方案中,通过以下方法制备本发明的口服制剂,所述方法包括:a)将式(1)的化合物或其药学可接受的盐、异构体、溶剂合物、水合物或结晶和吸附剂溶于溶剂中,形成分散均匀的混合溶液;b)采用流化床干燥装置将混合溶液干燥制成混合粉末;c)混合粉末与崩解剂、润滑剂混合;和d)压片。在本发明的一个具体实施例中,本发明的发明人将式(1a)的化合物或其药学可接受的盐、异构体、溶剂合物、水合物或结晶和二氧化硅加入乙醇中搅拌分散均匀,然后采用喷雾干燥装置将混合溶液干燥制成混合粉末,然后与崩解剂、润滑剂混合,直接压片。在一些实施方案中,本发明的溶剂优选选自醇类溶剂和二乙二醇单乙基醚。在一个实施方案中,根据本发明的口服制剂,采用粒径3-100μm的交联聚维酮及微晶纤维素作为吸附剂,外加交联羧甲基纤维素钠或羧甲基淀粉钠作为崩解剂。优选地,使用交联羧甲基纤维素钠作为崩解剂。本发明的发明人发现,本发明的口服制剂中使用交联聚维酮作为吸附剂时,当交联聚维酮的粒径变化时,溶出终点有变化。优选地,本发明使用粒径为10-30μm的交联聚维酮。优选地,所述的包衣材料包含羟丙甲纤维素、乳糖、三醋酸甘油酯。根据本发明的制剂,优选地,包衣占所述制剂总重的2~4%(w/w)。在本发明中,还研究了pH值对制剂溶出曲线的影响。结果表明,本发明的制剂在比较宽的pH值范围内均表现出良好的溶出性和稳定性。在同一pH值下,例如pH1.2、pH3.0、pH4.5或pH6.8缓冲液的溶出介质中,本发明的制剂的各批次间溶出曲线一致,批间差异小,工艺较稳定。本发明提供本发明的口服制剂在制备治疗和/或预防黄病毒科病毒,尤其是HCV感染的药物中的应用。当给予本发明的口服制剂时,式(1)的化合物或其药学可接受的盐、异构体、溶剂合物、水合物或结晶在体内转化为活性形式发挥抗病毒作用。在一个实施方案中,本发明提供治疗、预防或控制HCV的方法,所述方法包括口服给予患者本发明的制剂,式(1)的化合物或其药学可接受的盐、异构体、溶剂合物、水合物或结晶的给药量在摩尔量上等于式(1)的化合物的治疗有效量。除非另有说明,本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常理解的相同的含义。在本文,术语“药学上可接受的盐”是指本发明所述的化合物与酸形成的药学上可接受的盐,所述的酸可选自:磷酸、硫酸、盐酸、氢溴酸、柠檬酸、马来酸、丙二酸、扁桃酸、琥珀酸、富马酸、醋酸、乳酸、硝酸、磺酸、对甲苯磺酸、苹果酸、酒石酸、氨基酸、甲烷磺酸或其类似物。术语“溶剂合物”是指通过与溶剂分子配位形成固态或液态的配合物的本发明化合物的形式。水合物是溶剂合物的特殊形式,其中与水发生配位。在本发明范围内,溶剂合物优选是水合物。术语“结晶”是指本发明所述的化合物形成的各种固体形态,包括晶型、无定形。术语“素片”是指本发明所述的制剂是未经过包衣的片剂。本发明的口服制剂稳定性好,能够长期保存,溶出完全,体内吸收好,杂质少,吸湿性低,能简化贮藏和运输条件等。附图说明图1:(S)-2-[[[(S)-(1,1’-联苯基-4-氧基)]-[((2R,3R,4R,5R)-5-(2,4-二氧代-3,4-二氢嘧啶-1(2H)-基)-4-氟-3-羟基-4-甲基四氢呋喃-2-基)甲氧基]磷酰基]氨基]丙酸异丙酯的构型确证图。图2:由实施例9得到的制剂的溶出曲线图,其中pH1.2表示由实施例9得到的制剂在0.05%十二烷基硫酸钠的pH1.2缓冲液中的溶出曲线;pH3.0表示由实施例9得到的制剂在pH3.0缓冲液中的溶出曲线;pH4.5表示由实施例9得到的制剂在pH4.5缓冲液中的溶出曲线;pH6.8表示由实施例9得到的制剂在pH6.8缓冲液中的溶出曲线。具体实施方式下面结合实施例对本发明作进一步详细阐述,但本发明不限于这些实施例。以下实施例中使用的材料,除特殊说明均为商购获得,其中薄膜包衣预混剂为购于卡乐康公司的胃溶型包衣预混粉欧巴代(295K620013)。实施例1:(S)-2-[[[(S)-(1,1’-联苯基-4-氧基)]-[((2R,3R,4R,5R)-5-(2,4-二氧代-3,4-二氢嘧啶-1(2H)-基)-4-氟-3-羟基-4-甲基四氢呋喃-2-基)甲氧基]磷酰基]氨基]丙酸异丙酯的制备步骤1(S)-2-[[(1,1′-联苯基-4-氧基)(五氟苯氧基)磷酰基]氨基]丙酸异丙酯的合成于50L玻璃反应釜中,氮气保护下,加入三氯氧磷(1.53kg,10mol)和二氯甲烷(10L),搅拌,降温至-30℃以下。滴加三乙胺(1.01kg,10mol)的二氯甲烷(5L)溶液,滴加过程,保持内温低于-30℃。滴加完毕,缓慢滴加4-羟基联苯(1.7kg,10mol)的四氢呋喃(3.4L)溶液,滴毕搅拌30min。控制内温低于-30℃,加入L-丙氨酸异丙酯盐酸盐(1.68kg,10mol),滴加三乙胺(2.02kg,20mol)的二氯甲烷(8.0L)溶液,搅拌30min。升温至0℃左右,滴加五氟苯酚(1.84kg,10mol),三乙胺(1.01kg,10mol)的二氯甲烷(7.0L)溶液,滴加过程中,反应放热升温,滴加完毕,內温升至室温,反应完全后,过滤,滤饼用二氯甲烷2.5L×4洗涤,合并滤液,将滤液用25L纯化水洗涤,分液,有机相减压浓缩,加入庚烷5L×2带溶剂,离心,真空干燥,称重,得类白色固体状标题化合物。步骤2(S)-2-[[(S)-(1,1′-联苯基-4-氧基)(五氟苯氧基)磷酰基]氨基]丙酸异丙酯的合成于30L反应釜中,氮气保护下,加入(S)-2-[[(1,1’-联苯基-4-氧基)(五氟苯氧基)磷酰基]氨基]丙酸异丙酯(3.70kg,7.0mol),甲基叔丁基醚(2.40kg),正庚烷(9.0kg),三乙胺(77g,0.7mol),五氟苯酚(43g,0.21mol),加热至40℃,强力机械搅拌。反应完全后,离心,真空干燥,得标题化合物。步骤3(S)-2-[[[(S)-(1,1’-联苯基-4-氧基)]-[((2R,3R,4R,5R)-5-(2,4-二氧代-3,4-二氢嘧啶-1(2H)-基)-4-氟-3-羟基-4-甲基四氢呋喃-2-基)甲氧基]磷酰基]氨基]丙酸异丙酯的合成于50L玻璃反应釜中,加入1-[(2R,3R,4R,5R)-3-氟-4-羟基-5-羟甲基-3-甲基四氢呋喃-2-基]嘧啶-2,4-(1H,3H)-二酮成品(1.30kg,5.0mol),四氢呋喃(15.6L),搅拌,氮气保护,降温至-10℃以下。滴加叔丁基氯化镁溶液(8.0L,8.0mol),滴毕,0~5℃继续反应1h。加入(S)-2-[[(S)-(1,1’-联苯基-4-氧基)(五氟苯氧基)磷酰基]氨基]丙酸异丙酯成品(2.12kg,4.0mol),滴加完毕,5~10℃反应,10~11h后取样,HPLC监控,反应完全后,降温至0℃以下,向反应液中加入2N盐酸(4.0L,8.0mol)淬灭反应。淬灭过程控制温度在0~10℃。滴加完毕,搅拌10min。减压浓缩,蒸干得固液残余物,加入乙酸乙酯(40.0L),和纯化水(20.0L),分液。向有机相中加入5%碳酸钠水溶液(10.0L)洗涤,然后水洗,过滤,旋干,再次加入二氯甲烷7.0L,浓缩,得油状发泡物,向油状发泡物中加入乙酸异丙酯(15.0L),溶清后,降温,析出大量白色沉淀。降温,过滤,干燥滤饼。继续用乙酸异丙酯溶解,加热搅拌。加入活性炭,搅拌30min,趁热过滤,降温,过滤,干燥滤饼,得白色固体。ESI-MSm/z:604.2[M+H]-。1HNMR(300MHz,DMSO-d6)δ:11.48(s,1H),7.67(d,2H),7.64-7.62(m,2H),7.59(d,1H),7.47(t,2H),7.37(t,1H),7.33(d,2H),6.04(d,1H),6.02(d,1H),5.83(d,1H),5.57(d,1H),4.89-4.84(m,1H),4.42-4.39(m,1H),4.29-4.24(m,1H),4.05-4.02(m,1H),3.88-3.82(m,2H),1.29-1.24(m,6H),1.16-1.15(m,6H)。实施例2:(S)-2-[[[(S)-(1,1’-联苯基-4-氧基)]-[((2R,3R,4R,5R)-5-(2,4-二氧代-3,4-二氢嘧啶-1(2H)-基)-4-氟-3-羟基-4-甲基四氢呋喃-2-基)甲氧基]磷酰基]氨基]丙酸异丙酯的构型确证称取15mg实施例1制备的式1a化合物于3mL小瓶中,加入5mL体积比为2∶1的二氯甲烷/正庚烷的混合溶剂体系中,震荡得到的澄清溶液,用封口膜盖住小瓶并在上面扎孔,室温下放置6天,得到晶体。将上述方法得到的单晶样品进行X-ray单晶衍射数据收集并解析其单晶结构。表1列出了式1a化合物正庚烷溶剂合物的单晶结构数据和结构精修参数。单晶结构解析确定了式1a化合物中的手性中心的绝对构型,即如图2所示,P1(S),C20(R),C21(R),C22(R)C24(R),C13(S)。其不对称结构单元中,包含两个式1a化合物分子和两个正庚烷分子。表1:式1a化合物单晶结构数据表实施例3固体口服形式的(S)-2-[[[(S)-(1,1’-联苯基-4-氧基)]-[((2R,3R,4R,5R)-5-(2,4-二氧代-3,4-二氢嘧啶-1(2H)-基)-4-氟-3-羟基-4-甲基四氢呋喃-2-基)甲氧基]磷酰基]氨基]丙酸异丙酯制剂表2.处方式(1a)化合物25.64交联聚维酮38.46微晶纤维素15.38乳糖12.82交联羧甲基纤维素钠7.69总计100.00单位:重量%(w/w)。制备步骤:a.将处方量的式(1a)化合物和交联聚维酮、微晶纤维素在湿法制粒机中混合均匀,加入适量的乙醇,制备湿颗粒;b.将湿颗粒干燥;c.将干燥后的颗粒与乳糖和交联羧甲基纤维素钠混合均匀;d.将混合好的颗粒填充胶囊。该实施例的制剂,在体外溶出实验中能够迅速崩解,并均匀分散。实施例4~6固体口服形式的(S)-2-[[[(S)-(1,1’-联苯基-4-氧基)]-[((2R,3R,4R,5R)-5-(2,4-二氧代-3,4-二氢嘧啶-1(2H)-基)-4-氟-3-羟基-4-甲基四氢呋喃-2-基)甲氧基]磷酰基]氨基]丙酸异丙酯制剂本实施例考察不同比例吸附剂制备的制剂,在体外的溶出情况,以是否能够分散作为体外溶出情况的指标。表3.处方单位:重量%(w/w)制备步骤:a)将式(1a)化合物和二氧化硅、微晶纤维素、乳糖、交联羧甲基纤维素钠、硬脂酸镁混合均匀;b)压片。实验结果表明:实施例4~6的制剂,在体外溶出实验中均能够迅速崩解,均匀分散。实施例7固体口服形式的(S)-2-[[[(S)-(1,1’-联苯基-4-氧基)]-[((2R,3R,4R,5R)-5-(2,4-二氧代-3,4-二氢嘧啶-1(2H)-基)-4-氟-3-羟基-4-甲基四氢呋喃-2-基)甲氧基]磷酰基]氨基]丙酸异丙酯制剂本实施例主要考察采用喷雾干燥的方法制成的制剂的体外溶出性,以溶出完全的时间为指标。表4.处方式(1a)化合物33.33二氧化硅33.33微晶纤维素4.47乳糖17.87交联羧甲基纤维素钠10.00硬脂酸镁1.00总计100.00单位:重量%(w/w)制备步骤:a)将处方量的式(1a)化合物和二氧化硅加适量乙醇搅拌,使成分散均匀的混合溶液,使用喷雾干燥装置,将混合溶液干燥,得到式(1a)化合物和二氧化硅的混合粉末;b)将式(1a)化合物和二氧化硅的混合粉末和微晶纤维素、乳糖、交联羧甲基纤维素钠、硬脂酸镁混合均匀;c)压片。实验结果表明,采用喷雾干燥的方法,制成的制剂,在在体外溶出实验中10钟就可以完全溶出。实施例8固体口服形式的(S)-2-[[[(S)-(1,1’-联苯基-4-氧基)]-[((2R,3R,4R,5R)-5-(2,4-二氧代-3,4-二氢嘧啶-1(2H)-基)-4-氟-3-羟基-4-甲基四氢呋喃-2-基)甲氧基]磷酰基]氨基]丙酸异丙酯制剂本实施例主要考察吸附剂为无机酸盐时,能否溶出完全。表5.处方式(1a)化合物33.33磷酸钠33.33微晶纤维素11.67乳糖10.67交联羧甲基纤维素钠10.00硬脂酸镁1.00总计100.00单位:重量%(w/w)制备步骤:a)将处方量的式(1a)化合物和磷酸钠、微晶纤维素、乳糖、交联羧甲基纤维素钠、硬脂酸镁混合均匀;b)压片。结果表明,本实施例制备的制剂,在体外溶出实验中,能够迅速崩解,溶出完全。实施例9固体口服形式的(S)-2-[[[(S)-(1,1’-联苯基-4-氧基)]-[((2R,3R,4R,5R)-5-(2,4-二氧代-3,4-二氢嘧啶-1(2H)-基)-4-氟-3-羟基-4-甲基四氢呋喃-2-基)甲氧基]磷酰基]氨基]丙酸异丙酯制剂表6.处方单位:重量%(w/w)制备步骤:a)将吸附剂交联聚维酮及微晶纤维素混合均匀;b)式(1a)化合物搅拌溶解于适量乙醇后缓慢加至吸附剂中,制得湿颗粒;c)将b)步骤中的湿颗粒采用流化床干燥,进风温度控制为约60℃±5℃,物料温度控制在约50℃左右;d)将c)步骤干燥后的颗粒与交联羧甲基纤维素钠、乳糖、硬脂酸镁混合均匀;e)将混合好的粉末在压片机中压片;f)将素片置于包衣机中,喷入薄膜包衣预混剂进行包衣。比较例1固体口服形式的(S)-2-[[[(S)-(1,1’-联苯基-4-氧基)]-[((2R,3R,4R,5R)-5-(2,4-二氧代-3,4-二氢嘧啶-1(2H)-基)-4-氟-3-羟基-4-甲基四氢呋喃-2-基)甲氧基]磷酰基]氨基]丙酸异丙酯制剂本实施例考察采用常规辅料制得的制剂,在体外溶出实验中的溶出性。表7.处方式(1a)化合物85.00交联羧甲基纤维素钠14.00硬脂酸镁1.00总计100.00单位:重量%(w/w)。制备步骤:a)将处方量的式(1a)化合物和交联羧甲基纤维素钠、硬脂酸镁混合均匀;b)压片。实验结果显示,本实施例制得的制剂,在体外溶出实验中崩解后,在溶出杯底凝聚成团,药物不能释放。实验例1本发明的制剂的溶出性将根据实施例9制得的制剂按照溶出度测定法(《中国药典》2015年版四部通则0931第二法)测定溶出性,以1000ml含0.05%十二烷基硫酸钠的pH1.2缓冲液、pH3.0缓冲液、pH4.5缓冲液、pH6.8缓冲液为溶出介质,转速为每分钟50转。分别在5、10、15、20、30、45、60分钟取样检测。按照高效液相色谱法(《中国药典》2015年版四部通则0512)进行检测。采用十八烷基硅烷键合硅胶柱,柱温:30℃,检测器:UV/DAD检测器,检测波长为254nm,流动相:水-甲醇(35:65),流速:1.0ml/min。依据实验所得数据绘制溶出曲线,如图2所示。实验表明,本发明的制剂在以上各种溶出介质中均能溶出完全,符合规定。实验例2本发明的制剂稳定性将根据实施例9制得的制剂在温度40℃±2℃,相对湿度75%±5%加速条件下以及温度25℃±2℃,相对湿度60%±10%的长期条件下放置6个月,按照溶出度测定法(《中国药典》2015年版四部通则0931第二法)测定溶出度,以1000ml含0.05%十二烷基硫酸钠的pH1.2缓冲液为溶出介质,转速为每分钟50转。按照高效液相色谱法(《中国药典》2015年版四部通则0512)进行有关物质、含量测定,采用十八烷基硅烷键合硅胶柱,柱温:30℃,检测器:UV/DAD检测器,检测波长为254nm,流动相:水-甲醇(35:65)。实验结果见表8。表8.本发明的制剂稳定性数据样品存放时间及存放条件含量溶出度总杂质0天101.7%96.8%0.13%加速试验1月(40℃±2℃,RH75%±5%)101.9%99.1%0.14%加速试验2月(40℃±2℃,RH75%±5%)100.5%100.8%0.11%加速试验3月(40℃±2℃,RH75%±5%)100.7%100.8%0.11%加速试验6月(40℃±2℃,RH75%±5%)101.0%97.3%0.14%长期试验3月(25℃±2℃,RH60%±10%)100.5%98.1%0.13%长期试验6月(25℃±2℃,RH60%±10%)100.6%97.3%0.18%从以上的实验结果,可以看出,本发明的(S)-2-[[[(S)-(1,1’-联苯基-4-氧基)]-[((2R,3R,4R,5R)-5-(2,4-二氧代-3,4-二氢嘧啶-1(2H)-基)-4-氟-3-羟基-4-甲基四氢呋喃-2-基)甲氧基]磷酰基]氨基]丙酸异丙酯制剂,在含0.05%十二烷基硫酸钠的pH1.2缓冲液、pH3.0缓冲液、pH4.5缓冲液、pH6.8缓冲液四种溶出介质,均能充分溶出,并且在经加速6个月和长期6个月后,制剂性质稳定,杂质少,各项指标未见明显变化,符合规定。尽管以上已经对本发明作了详细描述,但是本领域技术人员理解,在不偏离本发明的精神和范围的前提下可以对本发明进行各种修改和改变,本发明的权利范围并不限于上文所作的详细描述,而应归属于权利要求书。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1