一种可注射型含人脐带间充质干细胞外泌体骨修复水凝胶及其制备方法与流程
本发明涉及生物医学工程技术领域,尤其是涉及一种可注射型含人脐带间充质干细胞外泌体骨修复水凝胶及其制备方法。
背景技术:
骨缺损修复是骨科领域研究的热点问题。临床上即使是常见的骨折,由于骨再生不良,大约有2%-10%的骨折可能进展为骨不连。而骨科临床医生也常常遇到诸如骨折、骨感染、骨肿瘤切除等原因造成的骨缺损的问题。此外,肥胖、糖尿病等导致骨骼肌肉疾病的增多和骨再生的减少,老龄骨质疏松患者骨折风险较高而骨再生能力不足。因此,如何促进骨骼再生,仍然是临床医生面临的主要挑战。
以间充质干细胞为基础的骨组织工程技术为临床骨缺损再生修复带来了新希望。近期研究表明,干细胞衍生外泌体与干细胞具有相似的生物学效应,可以作为干细胞的替代物应用于骨组织修复,从而避免因直接使用干细胞而导致的突变致瘤、免疫排斥等诸多风险。
目前利用外泌体来修复骨缺损的研究中,主要是将外泌体通过注射的方式来发挥作用,但是这种方法会导致外泌体在体内很快被清除,而骨修复又是一个长周期过程。因此,如何调控外泌体在骨缺损处的释放速率和释放周期,使其与新骨生长周期良好匹配,提高外泌体的生物利用度,从而达到最优的疗效是利用外泌体进行骨修复需要解决的关键问题。
技术实现要素:
针对以上问题,本申请人提供了一种可注射型含人脐带间充质干细胞外泌体骨修复水凝胶。本发明选用海藻酸钠-透明质酸水凝胶作为载体,包裹外泌体注射到骨缺损部位,实现外泌体的控释与缓释,同时加入了纳米羟基磷灰石,从而进一步加强材料的机械性能和骨传导性。
本发明的技术方案如下:
一种可注射型含人脐带间充质干细胞外泌体骨修复水凝胶,其特征在于,所述复合水凝胶材料包含人脐带间充质干细胞外泌体,纳米羟基磷灰石(nhap),透明质酸-己二酸二酰肼衍生物(ha-adh)和主链具有醛基的海藻酸衍生物(alg-cho)。
进一步地,水凝胶中nhap终浓度为5%(w/v),ha-adh终浓度为5%(w/v),alg-cho终浓度为5%(w/v),所含外泌体浓度为150ug/ml。
进一步地,其制备方法有以下步骤:
(1)脐带间充质干细胞的分离培养;
(2)脐带间充质干细胞的成骨诱导:取培养至第三代步骤(1)中的细胞继续培养,当细胞密度达70%时换用成骨诱导培养基继续培养。
(3)外泌体提取:取步骤(2)中成骨诱导2天后的细胞培养上清,在4℃条件下300g离心10min,2000g离心10min,10000g离心30min去除死细胞和细胞碎片,随后用0.22um滤膜过滤培养基,进一步在4℃,100000g条件下离心2小时。所得白色沉淀即为外泌体,将其溶解至pbs中于-80℃冰箱中保存。
(4)nhap制备:将硝酸钙溶解在去离子水中,加入柠檬酸钠,搅拌至完全溶解后用氨水调节溶液ph值,得到溶液a;将磷酸氢二铵溶解在去离子水中得到溶液b;随后启动超重力旋转填充床(rpb),调节转速,将a、b两种溶液分别输送到rpb中反应生成的浆料产物经过离心、洗涤、真空干燥后得到nhap。
(5)ha-adh制备:将透明质酸溶于去离子水中,溶解后加入己二酸二酰肼(adh)并搅拌均匀,后向溶液中加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)催化反应,随后用hcl调节溶液ph,室温反应12h后,用去离子水透析,冷冻干燥得ha-adh。
(6)alg-cho制备:将海藻酸钠溶解到去离子水中,将高碘酸钠溶解于去离子水中,室温下反应24h,随后添加乙二醇终止反应,经过透析、冷冻干燥得到alg-cho。
(7)复合水凝胶制备:称取nhap分散于pbs溶液中,并加入ha-adh至完全溶解,得到溶液1;称取alg-cho溶解于含有外泌体的pbs溶液中得到溶液2;随后将两种溶液装入注射枪内,注射到缺损部位使用。
进一步地,所述步骤(1)为:
取近胎儿段脐带15cm,浸泡在含有10%青链霉素的pbs中,在超净台内取出放置培养皿内,pbs反复冲洗脐带,剥离外膜和脐血管,组织剪剪碎至1mm3大小组织块,移至离心管内,pbs离心洗涤,2500rpm离心5min。用a-mem完全培养基重悬组织块,接种于细胞皿内,置于37℃、5%co2培养箱内培养,第二日补加a-mem完全培养基,以后每3天完全换液一次。当细胞生长达到70-80%融合时,0.25%胰酶消化5min,镜下观察细胞皱缩变圆即刻弃消化液,滴加完全培养基终止消化,按1∶3比例进行传代培养。
进一步地,所述步骤(2)中成骨诱导培养基包含dmem、胎牛血清、地塞米松、抗坏血酸、β-磷酸甘油、l-谷氨酰胺和双抗。
进一步地,所述步骤(4)中硝酸钙质量为5g,溶解硝酸钙的去离子水体积为100ml,柠檬酸钠质量为0.4g,氨水为5mol/l,调节ph值为11,磷酸氢二铵质量为1.675g,溶解磷酸氢二铵的去离子水体积为60ml。
进一步地,所述步骤(5)中透明质酸质量为1g,去离子水体积为200ml,adh为12.5g,ph为4.75,透析时间为5天。
进一步地,所述步骤(6)中海藻酸钠质量为2g,溶解海藻酸钠的去离子水体积为90ml,高碘酸钠质量为1g,溶解高碘酸钠的去离子水体积为10ml,乙二醇体积为2ml。
进一步地,所述步骤(7)中nhap、ha-adh、alg-cho质量为150mg,溶解nhap的pbs体积为1.5ml,溶解alg-cho的pbs含有外泌体的浓度为300ug/ml,体积为1.5ml。
进一步地,所述一种可注射型含人脐带间充质干细胞外泌体骨修复水凝胶用于治疗颅颌面及其他部位的骨缺损。
本发明的有益之处在于:
1、操作方便,能够适应于体内复杂多变的骨缺损环境;
2、可以为细胞提供三维支架,有利于细胞定殖及骨基质沉积;
3、能够在骨缺损部位缓慢降解,且具有良好的外泌体缓释功能;
4、其成功研制将为骨缺损患者带来更加高效的治疗方法,同时为组织工及再生医学等领域提供一种具有较好前景的修复方式。
附图说明
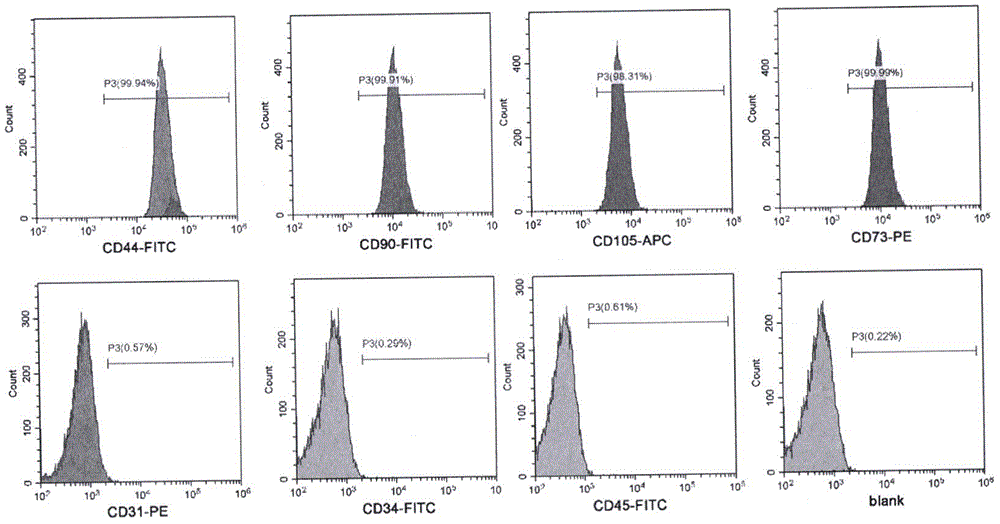
图1为人脐带间充质干细胞流式细胞仪鉴定结果。
图2为外泌体鉴定结果,其中a为透射电镜图,b为nanosight纳米粒径分析结果,c为westernblot结果。
图3为本发明制得的水凝胶扫描电镜图。
图4为外泌体体外缓释曲线。
图5为水凝胶体内骨缺损修复实验he染色结果,其中a为对照组,b为水凝胶组,nb代表新生骨。
具体实施方式
下面结合实施例和检测例,对本发明进行具体描述。
实施例1人脐带间充质干细胞外泌体提取
(1)脐带间充质干细胞的分离培养
取近胎儿段脐带15cm,浸泡在含有10%青链霉素的pbs中,在超净台内取出放置培养皿内,pbs反复冲洗脐带,剥离外膜和脐血管,组织剪剪碎至1mm3大小组织块,移至离心管内,pbs离心洗涤,2500rpm离心5min。用a-mem完全培养基重悬组织块,接种于细胞皿内,置于37℃、5%co2培养箱内培养,第二日补加a-mem完全培养基,以后每3天完全换液一次。当细胞生长达到70-80%融合时,0.25%胰酶消化5min,镜下观察细胞皱缩变圆即刻弃消化液,滴加完全培养基终止消化,按1∶3比例进行传代培养。
(2)外泌体提取
当细胞生长密度达70%时,弃除基础培养基,pbs冲洗两次后换用成骨诱导培养基,继续培养2天,随后收集细胞培养上清,在4℃条件下300g离心10min,2000g离心10min,10000g离心30min去除死细胞和细胞碎片,随后用0.22um滤膜过滤培养基,进一步在4℃,100000g条件下离心2小时。所得白色沉淀即为外泌体,将其溶解至pbs中于-80℃冰箱中保存。
实施例2水凝胶的制备方法
(1)纳米羟基磷灰石的制备
将5g硝酸钙溶解在100ml去离子水中,加入0.4g柠檬酸钠,搅拌至完全溶解后用5mol/l氨水调节溶液ph值为11,得到溶液a;将1.675g磷酸氢二铵溶解在60ml去离子水中得到溶液b;随后启动超重力旋转填充床(rpb),调节转速为2500rpm,将a、b两种溶液分别输送到rpb中反应生成的浆料产物经过离心水洗两次后,加水超声分散10min,所得即为纳米hap分散体。真空干燥得到nhap粉末。
(2)透明质酸衍生物制备
将1g透明质酸溶于200ml去离子水中,溶解后加入12.5g己二酸二酰肼(adh)并搅拌均匀,后向溶液中加入2g1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)催化反应,随后用hcl调节溶液ph至4.75,室温反应12h后,用去离子水连续透析5天,冷冻干燥得ha-adh。
(3)海藻酸钠衍生物制备
将2.0g海藻酸钠溶解到90ml去离子水中,将1.0g高碘酸钠溶解于10ml去离子水中,室温下反应24h,随后添加2ml乙二醇终止反应,经过透析、冷冻干燥得到alg-cho。
(4)可注射型含人脐带间充质干细胞外泌体骨修复水凝胶制备
称取150mg纳米羟基磷灰石分散于1.5mlpbs溶液中,并加入150mgha-adh至完全溶解,得到溶液1;称取150mgalg-cho溶解于1.5ml含有300ug/ml外泌体的pbs溶液中,得到溶液2;随后将两种溶液装入注射枪内,注射到缺损部位使用。
测试例1
将上述实例1得到的脐带间充质干细胞进行鉴定。
测试方法和条件为:
胰蛋白酶消化p3代脐带间充质干细胞后制成单细胞悬液。pbs清洗细胞2次1000rpm离心5min,弃上清液,pbs重悬细胞调整细胞密度至2×105个/管。分别加入5μlpe-cd73,pe-cd31,fitc-cd34,fitc-cd44,fitc-cd45,fitc-cd90及apc-cd105。同型对照管中分别加入等量pbs,每管加入200μl流式细胞仪固定液,用bd流式细胞仪检测,观察并记录阳性细胞表达率。
测试结果如图1所示。可以看到细胞阳性表达干细胞表面标志性抗原cd44,cd90,cd105,cd73,阴性表达造血干细胞表面标志性抗原cd31,cd34及cd45。表明成功提取了脐带间充质干细胞。
测试例2
将上述实例1得到的外泌体进行鉴定。
测试方法和条件为:
(1)透射电镜鉴定干细胞外泌体形态
取10μl外泌体提纯原液,重悬后滴加于载体铜网上,静置1min,随后往铜网上滴加30μl浓度为20ml/l的磷钨酸溶液,室温负染5min。随后将铜网放置于白炽灯下烤干,通过透射电镜观察并采集图像。
(2)外泌体粒径分析
将外泌体稀释后,加入izonqnano纳米分析系统中,测定外泌体的数量以及粒径大小的分布。
(3)western-blot鉴定干细胞外泌体表面标志物:
a.bca测定外泌体浓度
b.按照比例配制分离胶和浓缩胶电泳缓冲液。
c.蛋白变性:取5×loadingbuffer与测定好浓度的蛋白样品混匀,煮沸5分钟使之变性,冰上冷却后-20℃保存备用。
d.电泳:小心移出梳子,将凝胶在电泳装置上固定好。内外槽分别加入1×tris-甘氨酸将样品25μl加入到点样孔内进行电泳,电泳条件:浓缩胶60v,分离胶120v。将已经电泳后的凝胶取出,做好标记。
e.转膜:将膜转移至正极,胶转移至负极。分别用滤纸3张/面压住胶和膜。转移时电压调至100伏,转移时间为1小时。
f.封闭:卸下电泳装置,转移膜至10%脱脂奶粉封闭液中封闭2小时。
g.用pbst洗膜5次,加入相对应的一抗(稀释比例为1∶1000)。反应1.5h。
h.加入hrp标记二抗(浓度为1∶4000),反应1小时。之后每5分钟洗膜一次,共25分钟。
i.取ecl荧光底物将ecl发光液滴加到pvdf膜上,反应3-5分钟,在暗室中取x光底片覆盖,曝光显色、显影、定影。
测试结果如图2所示。从图中可以看到:通过透射电镜观察可以发现外泌体完整的膜性结构,nanosight纳米颗粒跟踪分析显示提取到的外泌体粒径分布峰值在120nm左右,westernblot鉴定结果显示提取到的外泌体阳性表达cd9,cd81,tsg101。以上结果充分证明了我们成功获取了外泌体。
测试例3
将上述实例2得到的产品进行扫描电镜观察及外泌体缓释观察。
测试方法和条件为:水凝胶的内部形貌由sem观察,首先将所制备的水凝胶进行冷冻干燥,通过在其表面喷金增加导电性,然后在加速电压为15kv的条件下观察内部形貌。
测试结果如图3所示。从图3中可以看到:水凝胶呈多孔样结构,孔径大小在50um左右,同时在孔径侧壁上可以看到附着的羟基磷灰石。
测试例4
将上述实例2得到的水凝胶进行体外外泌体缓释测试。
测试方法和条件为:通过bca试剂盒检测外泌体蛋白释放情况。1μg/μl,250μl外泌体滴加于材料中,37℃生理盐水中孵育,收集孵育后1-14天的液体检测外泌体蛋白释放情况,绘制释放曲线。
测试结果如图4所示,可以看到经过连续检测,14天后外泌体从材料释放了大约71.1%。
测试例5
将上述实例2得到的产品进行体内成骨效果测试。
测试方法和条件为:取16只sd雄性大鼠(250-300g),随机分为2组,即空白对照组,水凝胶修复组(含300μl水凝胶)每组8只大鼠。0.1ml50%速眠新注射液麻醉大鼠,备皮,75%酒精消毒,在头顶部做一矢状切口,翻开全层粘骨膜瓣,用种植科取骨钻做一直径为8mm的圆形缺损,钻磨过程中不断用生理盐水冲洗,防止摩擦生热导致局部组织坏死。在植入材料8w后,于麻醉下对大鼠实施心脏灌流术(10%中性福尔马林),取下颅盖骨,10%中性福尔马林固定标本,将标本进行edta脱钙,乙醇逐级脱水,石蜡包埋,切取厚度为4μm的组织学切片,通过he染色分析微观缺损处组织形态改变
测试结果如图5所示,可以看到对照组中缺损部位只在边缘处有部分新骨生成,大部分缺损部位为纤维结缔组织覆盖,而水凝胶组除了在缺损边缘部位有新骨生成之外,在缺损中间部位同样有大量新骨生成。
- 还没有人留言评论。精彩留言会获得点赞!