基于超支化纳米结构的表面增强拉曼生物分子检测方法与流程
本发明属于生物分子检测技术领域,具体涉及一种基于超支化纳米结构的定量表面增强拉曼生物分子检测方法。
背景技术:
要对低浓度的生物分子,诸如蛋白质、肽、寡核苷酸、核酸、酯类、多糖、激素、神经递质、代谢物等进行灵敏且准确的检测,鉴定和/或定量是一项困难的任务,但是它们在医疗诊断、病理学、毒理学、流行病学、生物战、环境取样、法医学和其它大量领域具有广泛而潜在的应用。这就要求我们的检测器件必须逐步微型化,同时也要保证检测的高效和灵敏度,这是目前许多传统的生物分析方法所面临的极大挑战。
表面增强拉曼散射(SERS:Surface Enhanced Raman Scattering)技术由于其具有极高检测灵敏度、可猝灭荧光、非破坏性指纹式的分辨能力等许多优点,被广泛应用于表面研究、生物大分子的界面取向及构型、构象分析、痕量与微量检测,甚至可以进行单分子检测。而现有的纳米技术很难得到均匀SERS增强的耦合的纳米溶胶或者纳米基底,使得分子信号的放大倍数难以达到一致,因此无法用所检测到的分子信号来得到分子浓度,即无法实现特异性定量检测。
技术实现要素:
本发明的目的是运用表面拉曼光谱方法,利用待测物与探针分子的特异性结合作用牵引超支化纳米金属颗粒聚集,然后直接检测两种拉曼小分子的拉曼信号。利用内标作为参比,外标标记待测物,利用两者的比值真实有效的反应待测物所处的物理化学环境,从而实现对生物分子进行特异性和定量化检测。本发明应用表面拉曼光谱方法实现对生物分子进行超灵敏特异性和定量化检测,在食品安全检测、医学诊断、法医检验等领域,具有重要的应用前景和开发价值。
本发明通过以下技术方案实现:
一种基于超支化纳米结构的定量表面增强拉曼生物分子检测方法,包括以下步骤:
(1)超支化纳米结构SERS探针的制备:
①制备粒径均匀的纳米金属球作为内核;
②在内核表面组装上第一单分子层,所述第一单分子层由DNA分子和拉曼小分子(I)组成;
③在第一单分子层表面生长一层带有枝杈的金属球壳;
④将探针分子和拉曼小分子(II)修饰到金属球壳表面;
具体地为,首先制备粒径均匀的小粒径纳米金属球作为内核,然后在内核表面组装上第一单分子层(由DNA支架分子和内标拉曼小分子(I)组成),接着在第一单分子层表面生长一层带有枝杈的金属球壳,最后将相应的探针分子和外标拉曼小分子(II)修饰到带有枝杈的金属球壳表面,形成超支化纳米结构SERS探针,所述超支化纳米结构SERS探针为核壳结构金属纳米颗粒SERS探针。
其中,金属球包括金纳米粒子、银纳米粒子、铜纳米粒子,所述小粒径纳米金属球是指10~30nm的金属球;其中,所述DNA支架分子的一端具有一段重复的腺嘌呤(Adeninephosphate:A),其他含有巯基末端、氨基末端或者羧基末端的强吸附分子可以替换。
其中,所述纳米金属球包括金纳米粒子、银纳米粒子、铜纳米粒子,粒径为10~30nm。
其中,所述DNA分子的序列为
5’-AAAAAAAAAAAAAAAAAAAACAAGAGTTACTAGTCTCGTCGGAGTCGTATCGCTACAAGTCC-3’。
其中,所述“带有枝杈的金属球壳”是指由金纳米粒子或银纳米粒子或者铜纳米粒子,其表面有凸起,其形状类似花瓣。其中,所述金属球壳的粒径为20~300nm。
其中,所述拉曼小分子(I)/(II)选用含有巯基末端、氨基末端或者羧基末端的强吸附且有强拉曼散射截面的分子;如4-巯基苯甲酸(4-MBA)、4-巯基吡啶(4-MPY)、5,5'--二硫二硝基苯甲酸(DTNB)、4,4'-联吡啶(4,4'--DP)、1,2-二(4-吡啶基)乙烯(1,2-BE)、酞嗪(PHTH)等;金属球壳的内外表面各修饰了一种拉曼小分子,且两种拉曼小分子的特征峰不重合。
其中,所述探针分子可以选自以下:
组1:
探针1:5’-AAAAAAAAAA TTTTT ATgATgTTCg TTgTg-3’
探针2:5’-gTgTT TAggATTTgC TTTTT AAAAAAAAAA-3’;或,
组2:
探针1:5’-AAAAAAAAAAAACTATGCAA-3’
探针2:5’-CCTACTACCTCTAAAAAAAAAA-3’;或,
组3:
探针1:5’-AAA AAAAAAAAA ACC TGG GGG AGT-3’
探针2:5’-ATT GCG GAG GAA GGT AAA AAAAAA AAA-3’;或,
组4:
探针1:5’-AAA AAAAAAAAA AGC AAC CTC AAA-3’
探针2:5’-CAG ACA CCA TGG AAA AAAAAA AAA-3’。
(2)待测物与超支化纳米结构的SERS探针的组装:在室温下将上述表面修饰有不同探针分子的核壳结构金属纳米颗粒SERS探针混合,用pH=7.4、浓度为10mM的PB缓冲液调节体系的酸碱度,使得整个反应体系在中性环境中进行,加入设计好的等体积的不同浓度的待测物,摇匀使核壳结构金属纳米颗粒SERS探针与待测物充分结合,形成待测物与核壳结构金属纳米颗粒SERS探针结合的水溶液(或溶胶)。
(3)SERS检测:准备激光检测,测量待测物与超支化纳米结构的SERS探针结合的水溶液(或溶胶),统计加入不同浓度梯度的待测物后,两种拉曼小分子的特征峰强度,并求出拉曼小分子(Ⅱ)与拉曼小分子(Ⅰ)的特征峰比值,找出所求出的特征峰比值与待测物浓度的关系。通过内标法与比值法联用实现对待测物的特异性定量检测。
其中,所述激光检测的条件为激光选用780nm,曝光时间2秒,拉曼位移200-3500cm-1。
将上述实验得到的信号与标准曲线比较,得到待测物的含量。
在一个具体的实施方式中,检测DNA:5’-gCAAA TCCTA AACAC CACAA CgAACATCAT-3’时,标准曲线方程为IR=0.0293C+2.1216(线性相关系数R=0.9848)。
在一个具体的实施方式中,检测let 7家族的RNA,特异性识别let 7家族的RNA效果显著,p<0.05。
let 7家族的RNA为:
let 7a:5’-UGAGGUAGUAGGUUGUAUAGUU-3’
let 7b:5’-UGAGGUAGUAGGUUGUGUGGUU-3’
let 7c:5’-UGAGGUAGUAGGUUGUAUGGUU-3’
let 7d:5’-AGAGGUAGUAGGUUGCAUAGUU-3’
let 7e:5’-UGAGGUAGGAGGUUGUAUAGUU-3’
let 7f:5’-UGAGGUAGUAGAUUGUAUAGUU-3’
let 7g:5’-UGAGGUAGUAGUUUGUACAGUU-3’
let 7i:5’-UGAGGUAGUAGUUUGUGCUGUU-3’
miR 98:5’-UGAGGUAGUAAGUUGUAUUGUU-3’
mirR 21:5’-UAGCUUAUCAGACUGAUGUUGA-3’。
在一个具体的实施方式中,检测ATP时的标准曲线方程为IR=0.0352C+1.83067(线性相关系数R=0.95717)。
在一个具体的实施方式中,检测可卡因时的标准曲线方程为IR=0.02746C+3.17406(线性相关系数R=0.99417)。
本发明提供了一种基于超支化纳米结构的材料,其结构的特殊性具有克服现有SERS特异性定量瓶颈问题的能力,其原理是:
在具有高SERS活性的金属(如金、银、铜等)纳米粒子表面混合修饰上单分子层(DNA支架分子和内标分子),并通过该单分子层的分子与金属的强相互作用,使得金属(金、银、铜等)壳层能够在该单分子层上生长,使得内标分子完全被包埋在金属纳米结构内部。内标分子层不会因外界分子的吸附而发生变化,可以作为非常稳定的SERS内标物,并且能产生很强的SERS信号。加入待测物后,由于探针分子与待测物特异性结合,牵引超支化纳米结构的纳米粒子聚集,随着所处的物理化学环境发生改变,外标SERS信号的变化与加入的待测物浓度有关。在直接检测待测物时,内标信号能有效的反馈溶胶的团聚状态、粒子浓度、待测物分子的表面覆盖度、仪器状态等参数,使得采用内标校正后的信号与待测物浓度之间符合Langmuir吸附等温式,从而达到特异性定量检测的目的。
本发明提出了一种超支化纳米结构SERS探针,所述SERS探针从内到外依次包括内核、第一单分子层、带有枝杈的金属球壳和第二单分子层;其中,所述内核为粒径均匀的小粒径纳米金属球,在内核表面组装上第一单分子层,所述第一单分子层由DNA支架分子和内标分子拉曼小分子(I)组成,所述带有枝杈的金属球壳生长在第一单分子层上,所述第二单分子层由不同的探针分子(探针1、探针2)和拉曼小分子(II)组成,所述第二单分子层修饰到带有枝杈的金属球壳表面,最后形成所述超支化纳米结构SERS探针。
本发明还提出了所述超支化纳米结构SERS探针在用于表面增强拉曼生物分子检测中的应用。
与现有的技术相比,本发明具有以下优点:
(1)本发明使用的超支化纳米核壳结构基底制备方法和原材料简单易得,其中内核和外壳的大小以及分子层的厚度都是可以精确调控的。
(2)本发明与传统内标法相比,消除了待测物和内标物吸附过程中对同一表面位点的竞争,使得内标物能真实、有效的反馈待测物所处的物理化学环境,有着极好的重现性。
(3)本发明对待测物的检测具有特异性。
(4)本发明的检测灵敏度高,可达到fM级别。
(5)本发明成本低,操作简单快捷适用于生物分子的检测。
(6)本发明可以为医疗诊断、病理学、毒理学、流行病学、生物战、环境取样、法医学等广泛领域开辟新路径。
附图说明
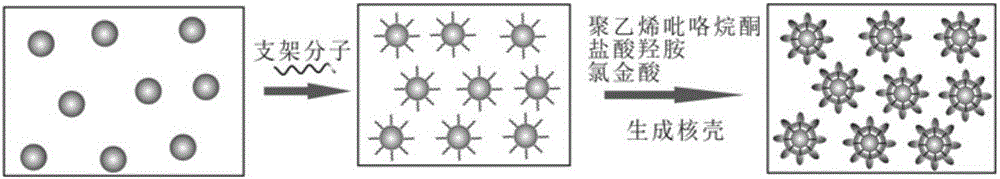
图1.超支化纳米粒子制备的流程图。
图2.不同厚度,不同枝杈形状的核壳纳米粒子示意图。
图3.拉曼光谱特异性定量检测生物分子的示意图。
图4.本发明方法特异性定量检测DNA的工作曲线。
图5.本发明方法特异性识别let 7家族的RNA。
图6.本发明方法特异性定量检测ATP的工作曲线。
图7.本发明方法特异性定量检测可卡因(Cocaine)的工作曲线。
具体实施方式
结合以下具体实施例和附图,对本发明作进一步的详细说明。实施本发明的过程、条件、实验方法等,除以下专门提及的内容之外,均为本领域的普遍知识和公共常识,本发明没有特别限制内容。
实施例1:
超支化纳米粒子的制备:
图1给出了超支化纳米粒子制备的实验流程示意图。
以金核金壳为例,其具体制备方法是:
支架DNA:
5’-AAAAAAAAAAAAAAAAAAAACAAGAGTTACTAGTCTCGTCGGAGTCGTATCGCTACAAGTCC-3’
(1)首先取100ul 10nM 13nm金球,加入4ul 100uM支架DNA,混合后加入2ul 500mm
柠檬酸钠溶液老化,反应15~30min后,12000rpm,15min离心清洗三次,除去未组装上
的DNA,用100ul 10mM PB(0.1M NaCl,pH=7.4)的缓冲溶液分散;
(2)混合物用900ul 0.1M PBS(pH=7.4)的缓冲溶液稀释,备用;
(3)取100ul(2)中溶液,再依次加入50ul 1%PVP,20ul 10mM NH2OH-HCl,重复以上操作六次,最后在振荡的条件下分别加入4ul、8ul、12ul、16ul、20ul、25ul 5mM HAuCl4,并继续剧烈振荡1min后静置反应15~30min,11000rpm,15min离心清洗三次,用200ul去离子水分散;如图2所示即可得到不同厚度,不同枝杈形状的核壳纳米粒子。
实施例2:
特异性超灵敏定量检测DNA
图3给出了特异性定量检测DNA的流程图。
以图2中4号(样品4)超支化纳米粒子作为SERS探针,4-MBA作内标,DTNB作外
标为例:
支架DNA:
5’-AAAAAAAAAAAAAAAAAAAACAAGAGTTACTAGTCTCGTCGGAGTCGTATCGCTACAAGTCC-3’
探针1:5’-AAAAAAAAAA TTTTT ATgATgTTCg TTgTg-3’
探针2:5’-gTgTT TAggATTTgC TTTTT AAAAAAAAAA-3’
待测DNA:5’-gCAAA TCCTAAACAC CACAA CgAAC ATCAT-3’
1.超支化纳米结构SERS探针的制备
(1)首先取100ul 10nM 13nm金球,加入4ul 100uM支架DNA,混合后加入2ul 500mm柠檬酸钠溶液老化,反应15~30min后,12000rpm,15min离心清洗三次,除去未组装上的DNA,用100ul 10mM PB(0.1M NaCl,pH=7.4)的缓冲溶液分散;
(2)首先混合物用900ul 0.1M PBS(pH=7.4)的缓冲溶液稀释,再将30ul 3mM 4-MBA拉曼小分子(Ⅰ)加入混合溶液中,样品放在恒温(25℃)摇床上,轻轻的摇晃,反应30~60min后用12000rpm,15min离心清洗三次,除去未组装上的4-MBA,用1000ul 10mM PB(0.1M NaCl,pH=7.4)的溶液分散;
(3)混合物中依次加入500ul 1%PVP,200ul 10mM NH2OH-HCl,在振荡的条件下加入120ul 5mM HAuCl4,并继续剧烈振荡1min后静置反应15~30min,11000rpm,15min离心清洗三次,用2ml去离子水分散;
(4)取两只1.5ml离心管,各加入上述混合液1mL,然后分别加入20ul 100uM探针1、探针2,混和后加入20ul 500mm柠檬酸钠溶液老化,反应15~30min后,11000rpm,15min离心清洗三次,除去未组装上的探针,用1mL 10mM PB(0.3M NaCl,pH=7.4)的缓冲溶液分散;
(5)再将30ul 3mM DTNB拉曼小分子(Ⅱ)分别加入上述混合溶液中,样品放在恒温(25℃)摇床上,轻轻的摇晃,反应30~60min后用11000rpm,15min离心清洗三次,除去未组装上的DTNB,用1mL 10mM PB(0.3M NaCl,pH=7.4)的溶液分散。
2.待测DNA与超支化纳米结构SERS探针的组装
取步骤1制备的超支化纳米结构SERS探针各50ul等量混合,重复此操作13次,然后分别加入不同浓度的待测DNA(0,3,5,10,20,30,40,50,60,70,80,90,100fM),混合后反应15~30min,即可进行下一步操作。
3.SERS检测
将溶液装入液相槽中,准备用780nm,24mW激光检测,统计加入不同浓度梯度的目标DNA后两种拉曼小分子的特征峰强度,并求出DTNB与4-MBA特征峰比值(IR),寻找所求出的特征峰比值与目标DNA浓度的关系。实验结果如图4所示,我们可以实现对10fM目标DNA的精确检测,且在0-50fM浓度范围内,IR与目标DNA浓度呈良好的线性关系,当目标DNA浓度继续增加时,对IR的影响不大,说明此时聚集状态已经达到了饱和。
其中,标准曲线方程为IR=0.0293C+2.1216(线性相关系数R=0.9848)。
实施例3:
特异性识别let 7家族的RNA
图3给出了特异性识别let 7家族的RNA的流程图。
以图2中4号超支化纳米粒子作SERS为探针,4-MBA作内标,DTNB作外标为例:
支架DNA:
5’-AAAAAAAAAAAAAAAAAAAACAAGAGTTACTAGTCTCGTCGGAGTCGTATCGCTACAAGTCC-3’
探针1:5’-AAAAAAAAAAAACTATGCAA-3’
探针2:5’-CCTACTACCTCTAAAAAAAAAA-3’
let 7a:5’-UGAGGUAGUAGGUUGUAUAGUU-3’
let 7b:5’-UGAGGUAGUAGGUUGUGUGGUU-3’
let 7c:5’-UGAGGUAGUAGGUUGUAUGGUU-3’
let 7d:5’-AGAGGUAGUAGGUUGCAUAGUU-3’
let 7e:5’-UGAGGUAGGAGGUUGUAUAGUU-3’
let 7f:5’-UGAGGUAGUAGAUUGUAUAGUU-3’
let 7g:5’-UGAGGUAGUAGUUUGUACAGUU-3’
let 7i:5’-UGAGGUAGUAGUUUGUGCUGUU-3’
miR 98:5’-UGAGGUAGUAAGUUGUAUUGUU-3’
mirR 21:5’-UAGCUUAUCAGACUGAUGUUGA-3’
1.超支化纳米结构SERS探针的制备
(1)首先取100ul 10nM 13nm金球,加入4ul 100uM支架DNA,混后加入2ul 500mm柠檬酸钠溶液老化,反应15~30min后,12000rpm,15min离心清洗三次,除去未组装上的DNA,用100ul 10mM PB(0.1M NaCl,pH=7.4)的缓冲溶液分散;
(2)首先混合物用900ul 0.1M PBS(pH=7.4)的缓冲溶液稀释,再将30ul 3mM 4-MBA拉曼小分子(Ⅰ)加入混合溶液中,样品放在恒温(25℃)摇床上,轻轻的摇晃,反应30~60min后用12000rpm,15min离心清洗三次,除去未组装上的4-MBA,用1000ul 10mM PB(0.1M NaCl,pH=7.4)的溶液分散;
(3)混合物中依次加入500ul 1%PVP,200ul 10mM NH2OH-HCl,在振荡的情况下加入120ul 5mM HAuCl4,并继续剧烈振荡1min后静置反应15~30min,11000rpm,15min离心清洗三次,用2ml去离子水分散;
(4)取两只1.5ml离心管,各加入上述混合液1mL,然后分别加入20ul 100uM探针1、探针2,混和后加入20ul 500mm柠檬酸钠溶液老化,反应15~30min后,11000rpm,15min离心清洗三次,除去未组装上的探针,用1mL 10mM PB(0.3M NaCl,pH=7.4)的缓冲溶液分散;
(5)再将30ul 3mM DTNB拉曼小分子(Ⅱ)分别加入上述混合溶液中,样品放在恒温(25℃)摇床上,轻轻的摇晃,反应30~60min后用11000rpm,15min离心清洗三次,除去未组装上的DTNB,用1mL 10mM PB(0.3M NaCl,pH=7.4)的溶液分散。
2.待测RNA与超支化纳米结构SERS探针的组装
取步骤1制备的超支化纳米结构SERS探针各50ul等量混合,重复此操作12次,然后分别加入10ul 1pM mirR 21、mirR 31、mirR 98、let 7a、let 7b、let 7c、let 7d、let 7e、let 7f、let7g、let 7i和去离子水,混合后反应15~30min,即可进行下一步操作。
3.SERS检测
将溶液装入液相槽中,准备用780nm,24mW激光检测,统计加入不同待测物后两种拉曼小分子的特征峰强度,并求出DTNB与4-MBA特征峰比值(IR),寻找所求出的特征峰比值与待测mirRNA种类的关系。实验结果如图5所示,let 7d与所选用的探针链碱基是完全互补的,其信号很强,IR值明显较大,其中水和mirR21为空白对照。其他都是let家族的mirRNA,与let 7d有二到四个碱基不同,因此与探针链也会有二到四个碱基错配,可以明显看到信号减弱,即IR值变小,且错配越多,信号越差。
其中,特异性识别let 7家族的RNA效果显著,p<0.05。
实施例4
特异性定量检测ATP
图3给出了特异性定量检测ATP的流程图。
以图2中样品4超支化纳米粒子作为SERS探针,4-MBA作内标,DTNB作外标为例:
支架DNA:
5’-AAAAAAAAAAAAAAAAAAAACAAGAGTTACTAGTCTCGTCGGAGTCGTATCGCTACAAGTCC-3’
探针1:5’-AAA AAAAAAAAA ACC TGG GGG AGT-3’
探针2:5’-ATT GCG GAG GAA GGT AAA AAAAAA AAA-3’
1.超支化纳米结构SERS探针的制备
(1)首先取100ul 10nM 13nm金球,加入4ul 100uM支架DNA,混后加入2ul 500mm柠檬酸钠溶液老化,反应15~30min后,12000rpm,15min离心清洗三次,除去未组装上的DNA,用100ul 10mM PB(0.1M NaCl,pH=7.4)的缓冲溶液分散;
(2)首先混合物用900ul 0.1M PBS(pH=7.4)的缓冲溶液稀释,再将30ul 3mM 4-MBA拉曼小分子(Ⅰ)加入混合溶液中,样品放在恒温(25℃)摇床上,轻轻的摇晃,反应30~60min后用12000rpm,15min离心清洗三次,除去未组装上的4-MBA,用1000ul 10mM PB(0.1MNaCl,pH=7.4)的溶液分散;
(3)混合物中依次加入500ul 1%PVP,200ul 10mM NH2OH-HCl,在振荡的情况下加入120ul 5mM HAuCl4,并继续剧烈振荡1min后静置反应15~30min,11000rpm,15min离心清洗三次,用2ml去离子水分散;
(4)取两只1.5ml离心管,各加入上述混合液1mL,然后分别加入20ul 100uM探针1、探针2,混和后加入20ul 500mm柠檬酸钠溶液老化,反应15~30min后,11000rpm,15min离心清洗三次,除去未组装上的探针,用1mL 10mM PB(0.3M NaCl,pH=7.4)的缓冲溶液分散;
(5)再将30ul 3mM DTNB拉曼小分子(Ⅱ)分别加入上述混合溶液中,样品放在恒温(25℃)摇床上,轻轻的摇晃,反应30~60min后用11000rpm,15min离心清洗三次,除去未组装上的DTNB,用1mL 10mM PB(0.3M NaCl,pH=7.4)的溶液分散。
2.待测ATP与超支化纳米结构SERS探针的组装
取步骤1制备的超支化纳米结构SERS探针各50ul等量混合,重复此操作13次,然后分别加入不同浓度的待测ATP(0,3,5,10,20,30,40,50,60,70,80,90,100nM),混合后反应15~30min,即可进行下一步操作。
3.SERS检测
将溶液装入液相槽中,准备用780nm,24mW激光检测,统计加入不同待测物后两种拉曼小分子的特征峰强度,并求出DTNB与4-MBA特征峰比值(IR),寻找所求出的特征峰比值与待测ATP浓度的关系。实验结果如图6所示,我们可以实现对10nM ATP的精确检测,且在0-60nM浓度范围内,IR与ATP浓度呈良好的线性关系,当ATP浓度继续增加时,对IR的影响不大,说明此时聚集状态已经达到了饱和。
其中,标准曲线方程为IR=0.0352C+1.83067(线性相关系数R=0.95717)。
实施例5:
特异性定量检测可卡因
图3给出了特异性定量检测可卡因的流程图。
以图2中样品4超支化纳米粒子作为SERS探针,4-MBA作内标,DTNB作外标为例:
支架DNA:
5’-AAAAAAAAAAAAAAAAAAAACAAGAGTTACTAGTCTCGTCGGAGTCGTATCGCTACAAGTCC-3’
探针1:5’-AAA AAAAAAAAA AGC AAC CTC AAA-3’
探针2:5’-CAG ACA CCA TGG AAA AAAAAA AAA-3’
1.超支化纳米结构SERS探针的制备
(1)首先取100ul 10nM 13nm金球,加入4ul 100uM支架DNA,混后加入2ul 500mm柠檬酸钠溶液老化,反应15~30min后,12000rpm,15min离心清洗三次,除去未组装上的DNA,用100ul 10mM PB(0.1M NaCl,pH=7.4)的缓冲溶液分散;
(2)首先混合物用900ul 0.1M PBS(pH=7.4)的缓冲溶液稀释,再将30ul 3mM 4-MBA拉曼小分子(Ⅰ)加入混合溶液中,样品放在恒温(25℃)摇床上,轻轻的摇晃,反应30~60min后用12000rpm,15min离心清洗三次,除去未组装上的4-MBA,用1000ul 10mM PB(0.1M NaCl,pH=7.4)的溶液分散;
(3)混合物中依次加入500ul 1%PVP,200ul 10mM NH2OH-HCl,在振荡的情况下加入120ul 5mM HAuCl4,并继续剧烈振荡1min后静置反应15~30min,11000rpm,15min离心清洗三次,用2ml去离子水分散;
(4)取两只1.5ml离心管,各加入上述混合液1mL,然后分别加入20ul 100uM探针1、探针2,混和后加入20ul 500mm柠檬酸钠溶液老化,反应15~30min后,11000rpm,15min离心清洗三次,除去未组装上的探针,用1mL 10mM PB(0.3M NaCl,pH=7.4)的缓冲溶液分散;
(5)再将30ul 3mM DTNB拉曼小分子(Ⅱ)分别加入上述混合溶液中,样品放在恒温(25℃)摇床上,轻轻的摇晃,反应30~60min后用11000rpm,15min离心清洗三次,除去未组装上的DTNB,用1mL 10mM PB(0.3M NaCl,pH=7.4)的溶液分散。
2.待测可卡因与超支化纳米结构SERS探针的组装
取步骤1制备的超支化纳米结构SERS探针各50ul等量混合,重复此操作13次,然后分别加入不同浓度的待测可卡因(0,30,50,100,200,300,400,500,600,700,800,900,1000pM),混合后反应15~30min,即可进行下一步操作。
3.SERS检测
将溶液装入液相槽中,准备用780nm,24mW激光检测,统计加入不同待测物后两种拉曼小分子的特征峰强度,并求出DTNB与4-MBA特征峰比值(IR),寻找所求出的特征峰比值与待测可卡因浓度的关系。实验结果如图7所示,我们可以实现对100pM可卡因的精确检测,且在0-600pM浓度范围内,IR与可卡因浓度呈良好的线性关系,当可卡因浓度继续增加时,对IR的影响不大,说明此时聚集状态已经达到了饱和。
其中,标准曲线方程为IR=0.02746C+3.17406(线性相关系数R=0.99417)。
本发明的保护内容不局限于以上实施例。在不背离发明构思的精神和范围下,本领域技术人员能够想到的变化和优点都被包括在本发明中,并且以所附的权利要求书为保护范围。
SEQUENCE LISTING
<110> 华东师范大学
<120> 基于超支化纳米结构的表面增强拉曼生物分子检测方法
<160> 20
<210> 1
<211> 30
<212> DNA
<213> 人工序列
<400> 1
aaaaaaaaaa tttttatgat gttcgttgtg 30
<210> 2
<211> 30
<212> DNA
<213> 人工序列
<400> 2
gtgtttagga tttgcttttt aaaaaaaaaa 30
<210> 3
<211> 20
<212> DNA
<213> 人工序列
<400> 3
aaaaaaaaaa aactatgcaa 20
<210> 4
<211> 22
<212> DNA
<213> 人工序列
<400> 4
cctactacct ctaaaaaaaa aa 22
<210> 5
<211> 24
<212> DNA
<213> 人工序列
<400> 5
aaaaaaaaaa aaacctgggg gagt 24
<210> 6
<211> 27
<212> DNA
<213> 人工序列
<400> 6
attgcggagg aaggtaaaaa aaaaaaa 27
<210> 7
<211> 24
<212> DNA
<213> 人工序列
<400> 7
aaaaaaaaaa aaagcaacct caaa 24
<210> 8
<211> 24
<212> DNA
<213> 人工序列
<400> 8
cagacaccat ggaaaaaaaa aaaa 24
<210> 9
<211> 62
<212> DNA
<213> 人工序列
<400> 9
aaaaaaaaaa aaaaaaaaaa caagagttac tagtctcgtc ggagtcgtat cgctacaagt 60
cc 62
<210> 10
<211> 30
<212> DNA
<213> 人工序列
<400> 10
gcaaatccta aacaccacaa cgaacatcat 30
<210> 11
<211> 22
<212> RNA
<213> 人工序列
<400> 11
ugagguagua gguuguauag uu 22
<210> 12
<211> 22
<212> RNA
<213> 人工序列
<400> 12
ugagguagua gguugugugg uu 22
<210> 13
<211> 22
<212> RNA
<213> 人工序列
<400> 13
ugagguagua gguuguaugg uu 22
<210> 14
<211> 22
<212> RNA
<213> 人工序列
<400> 14
agagguagua gguugcauag uu 22
<210> 15
<211> 22
<212> RNA
<213> 人工序列
<400> 15
ugagguagga gguuguauag uu 22
<210> 16
<211> 22
<212> RNA
<213> 人工序列
<400> 16
ugagguagua gauuguauag uu 22
<210> 17
<211> 22
<212> RNA
<213> 人工序列
<400> 17
ugagguagua guuuguacag uu 22
<210> 18
<211> 22
<212> RNA
<213> 人工序列
<400> 18
ugagguagua guuugugcug uu 22
<210> 19
<211> 22
<212> RNA
<213> 人工序列
<400> 19
ugagguagua aguuguauug uu 22
<210> 20
<211> 22
<212> RNA
<213> 人工序列
<400> 20
uagcuuauca gacugauguu ga 22
- 还没有人留言评论。精彩留言会获得点赞!
- 一种便携式智能拉曼光谱采集设备的制造方法与工艺
- 用于改善基底表面硬度及耐磨性的Ni‑WC复合涂层及其制备的制造方法与工艺
- 一种具有SERS活性的金/银/聚合物/银核壳纳米蘑菇材料及其制备方法和应用与制造工艺
- 用于增强使用无执照射频谱带进行的传输的帧结构和先听后讲规程(LBT)的技术的制造方法与工艺
- 一种基于近邻协同增强的高光谱混合像元分类方法与制造工艺
- 一种单分散银壳磁性微球的制备方法及其SERS应用与制造工艺
- 一种大口径材料表面散射的高速测量装置和方法与制造工艺
- 纳米金比色探针的制备方法及其检测碘离子的方法与制造工艺
- 一种复合型纳米结构拉曼增强基底、制备方法及应用与制造工艺
- 一种CaF2光学基底表面和亚表面损伤探测方法与制造工艺