合成巨大戟醇及其中间体的方法与流程
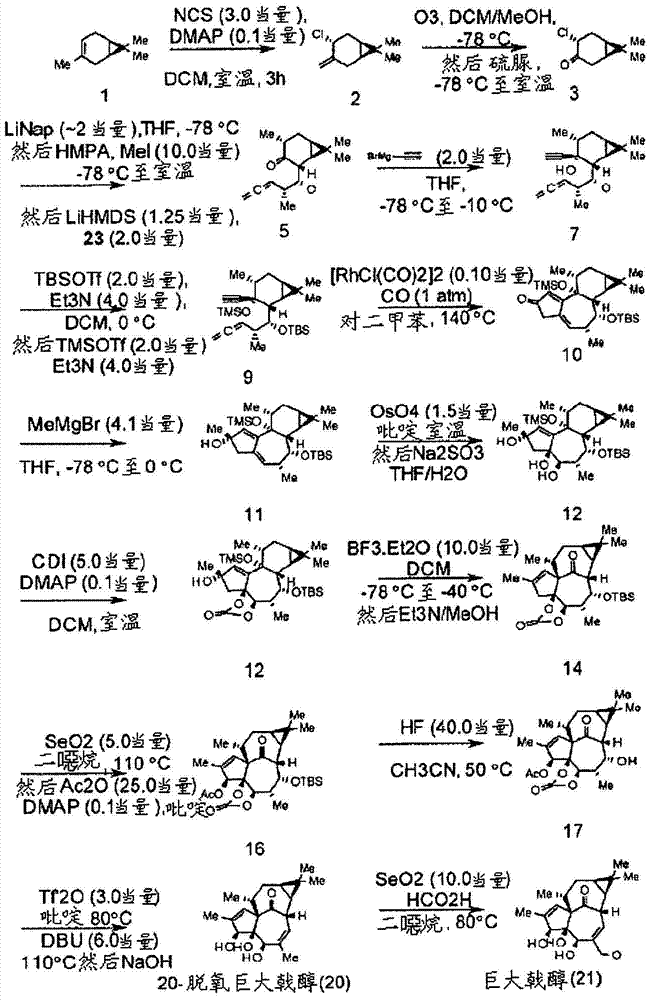
合成巨大戟醇及其中间体的方法发明领域本领域通常涉及合成二萜杂环化合物的方法。更具体地,本领域涉及从化合物1,(+)-3-蒈烯合成巨大戟醇(CAS30220-46-3,21)的有效方法。巨大戟醇是高度氧化的四环二萜。还提供沿巨大戟醇的合成路线的各种有利中间体。巨大戟醇的合成用于化合物诸如巨大戟醇-3-当归酸酯(29)的有效合成,(29)是一种发现于南欧大戟(Euphorbiapeplus)中的化合物,其为FDA批准的用于光化性角化病的局部治疗的活性成分。巨大戟醇具有如下所示的结构,(具有编号的碳原子):发明背景巨大戟醇是由大戟科(Euphorbiacea)植物产生的四环二萜天然产物,属于称作巨大戟烷(ingenane)的分子家族。巨大戟烷分子家族具有包括“内-外”桥接的BC环系统的共同核心结构,但装饰核心结构的环的各种官能团的外观不同。巨大戟醇是最广泛分布的大戟属(Euphorbia)的二萜核。(参见,Abo等人,Phytochemistry,1982,21:725)。Hecker在1968年进行了巨大戟醇的分离的首次报道,Hecker当时正在研究来自巴豆(Crotontiglium)和其它大戟科的种子油的共致癌特性(Hecker,E.,CancerRes.,1968,28:2338-2348)。巨大戟醇最初从大戟(Euphorbiaingens)分离,但也容易从续随子(Euphorbialathyris)的种子分离。(参见,Appendino,G.等人,J.NatProd.,1999,62:76-79)。另外,巨大戟醇可商购获得,例如从LCLaboratories,165NewBostonStreet,Woburn,MA01801,USA。已知此类种子油对两栖类和鱼类具有毒性并且是“剧烈导泻剂”(同上)。如今,巨大戟醇已知具有有前景的生物活性,包括肿瘤促进、抗白血病和抗人类免疫缺陷病毒(HIV)活性。巨大戟醇是巨大戟醇甲基丁烯酸酯(也称为巨大戟醇-3-当归酸酯,商品名,化合物29)基于其上的核心结构。巨大戟醇-3-当归酸酯也可由大戟属植物(例如南欧大戟)产生并且已知是细胞死亡的诱导物。已由美国食品与药物管理局(U.S.FoodandDrugAdministration)批准用于光化性角化病的局部治疗。由于佛波醇和巨大戟醇的结构与佛波醇(一种在巴豆油中发现的巴豆烷(tigliane)家族的二萜)的已知生化特性之间的密切关系,所以其酯具有通过蛋白激酶C(PKC)的活化进行的肿瘤促进活性,Hasler等人研究了巨大戟醇特异性结合PKC的能力并报道Ki为30μM。(参见,“SpecificbindingtoproteinkinaseCbyingenolanditsinductionofbiologicalresponses,”Hasler等人,CancerRes.,1992,52:202-208)。巨大戟醇是一种合成最具挑战性的四环萜类化合物。(还参见,Chen等人,“Totalsynthesisofeudesmaneterpenesbysite-selectiveC-Hoxidations,”Nature,459:824-828,2009;和Shi等人,“ScalableSynthesisofCortistatinAandRelatedStructures,”J.Am.Chem.Soc.,133:8014-8027,2011)。先前报道巨大戟醇的全合成需要37个或更多个独立步骤(化学反应)以获得四环二萜(D.F.Taber,“TotalSynthesisofIngenol,”Org.Chem.Highlights,2004年3月1日;Winkler等人,“TheFirstTotalSynthesisof(±)-Ingenol,”J.Am.Chem.Soc.,2002,124:9726-9728;Nickel等人,“TotalSynthesisofIngenol,”J.Am.Chem.Soc.,2004,126:16300-16301;Tanino等人,J.Am.Chem.Soc.,2003,125:1498-1500;Watanabe等人,J.Org.Chem.,2004,69:7802-7808)。Nickel等人继续研究使用钌催化剂通过闭环的巨大戟醇核心结构。其它研究者已报道各种尝试以合成受称赞的“内外”反式[4.4.1]二环十二烷核心结构。(参见,Funk等人,J.Org.Chem.,“Stereoselectiveconstructionofthecompleteingenaneringsystem,”1993,58(22):5873-5875;Tang等人,Org.Lett.,2001,3:1563-1566;Rigby等人,Org.Lett.,2002,4:799-801)。巨大戟醇(21)由不常见的、高度应变的并且难以合成的反式[4.4.1]二环十二烷环系统组成,其具有内外立体化学,如下所示:(参见,Winkler等人,“Inside-outsidestereoisomerism.VII.MethodologyfortheSynthesisof3-OxygenatedIngenanes.TheFirstIngenolAnalogswithHighAffinityforProteinKinaseC,”J.Org.Chem.,60:1381,1995;和Paquette等人J.Am.Chem.Soc.,1984,106:1446)。在2004年,Oleg等人报道了使用TBS-保护的环氧醇的频哪醇型重排合成巨大戟醇21的“内外”四环核心的能力。(参见,Oleg等人,“RapidAccesstothe‘in,out’-TetracyclicCoreofIngenol,”Angew.Chem.Int.编,2004,44(1):121-123)。Rigby在1993年报道了在尝试合成各种促进肿瘤的二萜中的最新进展概况。(参见,Rigby,J.H.,“RecentAdvancesintheSynthesisofTumor-PromotingDiterpenes,”Atta-ur-Rahman(编)StudiesinNaturalProductsChemistry,第12卷,第233-274页,1993,Elsevier)。Kim等人在“Approachestothesynthesisofingenol,”Chem.Soc.Rev.,1997,26:387中描述了使用分子内二氧杂环己酮(dioxenone)光致环化加成合成巨大戟醇的方法。在一定程度上与以3-蒈烯(1)开始的本发明的方法类似,Funk等人通过“crucialtransrelationshipofC-8andC-10(ingenolnumbering)wassetearlyinthesequencebystereoselectivealkylationofachiralhomocareneenone-esterobtainedfrom(+)-3-carene.”(同上,和Funk等人,J.Am.Chem.Soc.,1988,110(10):3298-3300)报道了使用此分子作为起点的方法。已经报道较新的方法,但仍需要大量的步骤并克服各种困难障碍。(Tanino等人,J.Am.Chem.Soc.,2003,125:1498-1500;和Kuwajima等人,“TotalSynthesisofIngenol,”Chem.Rev.,2005,105:4661-4670)。后来,在2006年,Cha等人在Tetrahedron上刊登综述,概括了已经尝试的各种方法,并表示更新且更有前景的方法仍在研究中。(Cha等人,“Syntheticapproachestoingenol,”Tetrahedron,2006,62:1329-1343)。Cha等人还公开从(+)-3-蒈烯开始的合成方法。(同上,在第1335页)。最近,在2012年,Munro等人提出巨大戟醇的合成方法,涉及立体定向和化学选择的1,5-亚烷基碳烯C-H插入反应。(K.R.Munro等人,“Selectivealkylidenecarbeneinsertionreactions:Studiestowardsthesynthesisofingenol,”在2012年8月20日第244届Am.Chem.Soc.NationalMeeting&Exposition,Philadelphia,PA给出呈现)。巨大戟醇是蛋白激酶C(PKC)活化剂。Winkler等人在1993年报道具有生物活性(即可测量的对蛋白激酶C的亲和力)的巨大戟醇衍生物的合成。(参见,Winkler等人,“SynthesisofingenolanalogswithaffinityforproteinkinaseC,”Bioorg.Med.Chem.Lett.,1993,3(4):577-580)。已知巨大戟醇诱导细胞凋亡并具有抗癌活性。巨大戟醇衍生物由于其已报道的生物活性的多效模式,诸如蛋白激酶C(PKC)的活化、促进肿瘤、抗癌活性、抗-HIV特性,一直以来受到持续的和多学科的关注。例如,某些巨大戟醇酯示出强效抗癌活性,并且已开发出结构-活性关系模型来区分其细胞凋亡和非凋亡特性。(参见,Hasler等人,CancerRes.,1992,52:202-208;Armstrong等人,Cardiovasc.Res.,1994,28:1700-1706;Kuwajima等人,Chem.Rev.,2005,105:4661-4670)。报道了巨大戟醇的各种衍生物及其生物活性。例如,巨大戟醇3,20-二苯甲酸酯(CAS59086-90-7,C34H36O7)是诱导细胞凋亡并具有抗癌活性和抗白血病活性的PKC活化剂。(参见,“Antileukemicprinciplesisolatedfromeuphorbiaceaeplants,”Kupchan等人,Science,1976,191:571;“ZurChemiedesIngenols,II.EsterdesIngenols,unddesA’-’-Isoingenols,”Sorg等人,Z.Naturforsch.,1982,37b:748;“InductionofthymocyteapoptosisbyCa2+-independentproteinkinaseC(nPKC)activationanditsregulationbycalcineurinactivation,”Asada等人,J.Biol.Chem.,1998,273:28392;“IngenolestersinduceapoptosisinJurkatcellsthroughanAP-1andNF-kappaBindependentpathway,”Blanco-Molina等人,Chem.Biol.Interact.,8:767,2001)。Vigone等人还报道关于各种巨大戟醇衍生物的生物活性的研究,所述巨大戟醇衍生物包括氟代-巨大戟醇、巨大戟醇-20-脱氧-20-苯二甲酰亚氨基(phtalimido)、巨大戟醇-3-苯甲酸酯-20-脱氧-20-苯甲酰胺、巨大戟醇-3-苯甲酸酯、巨大戟醇-3,5-二苯甲酸酯、巨大戟醇-3,20-二苯甲酸酯、20-脱氧-20-苄基脲基巨大戟醇-3-苯甲酸酯、巨大戟醇-20-脱氧-20-氟代-3-苯甲酸酯、巨大戟醇-20-脱氧-20-氟代-3,5-二苯甲酸酯、巨大戟醇-20-苯基氨基甲酸酯、巨大戟醇-20-苯甲酸酯、巨大戟醇-3-苯甲酸酯-20-苯基氨基甲酸酯。(参见,Vigone等人,Eur.J.Gynaecol.Oncol.,2005,26(5):526-530)。Vigone等人对巨大戟醇衍生物对乳腺癌细胞系T47D和MDA-MB-231的试验揭示巨大戟醇-20-苯甲酸酯展示以抑制细胞生长和涉及p53-介导的途径的凋亡细胞死亡为特征的抗肿瘤活性。(同上)。此外,已知巨大戟醇的3-十六酰基天然产物衍生物是淋巴母细胞中最强劲的EB病毒(爱泼斯坦-巴尔病毒(Epstein-Barrvirus))诱导物。(参见,Keller等人,Exp.Cell.Biol.,1982,50:121)。当然,巨大戟醇不是唯一具有已知生物活性的萜类化合物。事实上很多(如果不是全部)萜类化合物具有有趣的和特异性的生物活性。(参见,例如,Dixon等人,“Scalable,DivergentSynthesisofMeroterenoidsvia‘Borono-sclareolide’,”J.Am.Chem.Soc.,134:8432-8435,2012;Foo等人,“Scalable,EnantioselectiveSynthesisofGermacrenesandRelatedSesquiterpenesInspiredbyTerpeneCyclasePhaseLogic,”Angew.Chem.Int.Ed.,51:11491-11495,2012;和Renata等人,“StrategicRedoxRelayEnablesAScalableSynthesisofOuabagenin,ABioactiveCardenolide,”Science,339:59-63,2013)。巨大戟醇-3-当归酸酯(29)可从各种大戟属物种分离,并且特别是从南欧大戟和Euphorbiadrummondii通过提取然后色谱来分离,如美国专利号7,449,492所述。(还参见,Sayed等人,Experienta,1980,36:1206-1207;和Hohmann等人,PlantaMed.,2000,66:291-294)。如之前在WO2012/010172中报道,提取17kg新鲜南欧大戟得到7g粗油,其随后必须通过HPLC纯化以生成纯的巨大戟醇-3-当归酸酯。由于难以去除共迁移的叶绿素,基本上限制了通过植物提取巨大戟醇-3-当归酸酯的产率,因此该纯化方法对大规模生产构成困难。(参见,“Theskincancerchemotherapeuticagentingenol-3-angelate(PEP005)isasubstratefortheepidermalmultidrugtransporter(ABCB1)andtargetstumorvasculature,”Li等人,CancerRes.,2010,70(11):4509-4519)。巨大戟醇-3-当归酸酯还可通过使用酶促方法的半合成程序来合成,如PCT/EP2013/051431中所公开。针对该化合物的许多用途,困难仍然是在合成足够量的巨大戟醇。另外,已知巨大戟醇衍生物在酸存在下降解(Appendino等人,“SynthesisofModifiedIngenolEsters,”Eur.J.Org.Chem.,1999,12:3413-3420)。本申请的目标是提供新的和非常有效的方法来合成高度挑战性的巨大戟醇结构,以及沿所公开的合成途径的各种有趣的且有利的中间体。发明概述现要公开用于从化合物(1)开始合成巨大戟醇(21)的可按比例缩放的方法:公开的方法提供巨大戟醇的独特合成路线和沿巨大戟醇的合成途径的中间体。这些合成路线也可用于进一步将巨大戟醇转化为巨大戟醇-3-当归酸酯(贯穿本申请替代地被称作巨大戟醇甲基丁烯酸酯,PEP005,29)。这些合成路线还可用于进一步将巨大戟醇转化为巨大戟醇3-(N-甲基-N-苯基-氨基甲酸酯)、巨大戟醇3-(N-(3-氟代苯基)-N-甲基-氨基甲酸酯)、巨大戟醇3-(3-乙基-5-甲基-异噁唑-4-甲酸酯)、巨大戟醇3-(2,4-二甲基呋喃-3-甲酸酯)、巨大戟醇3-(3,5-二乙基异噁唑-4-甲酸酯)、巨大戟醇3-(2,4,5-三甲基呋喃-3-甲酸酯)、巨大戟醇3-(2-甲基-4-苯基-吡唑-3-甲酸酯)、巨大戟醇3-(3-甲基噻吩-2-甲酸酯)、巨大戟醇3-(二氢吲哚-1-甲酸酯)、巨大戟醇3-(5-甲基-3-苯基-异噁唑-4-甲酸酯)或巨大戟醇3-(吡咯烷-1-甲酸酯),如WO2012/083953所述。本公开方法的一个方面是能够从起始材料23合成巨大戟醇(21)。式23的起始材料可以呈如下所描绘的2R差向异构体或2S差向异构体(30)存在:本文所述的合成程序可从步骤4中这两种差向异构体23或30任一者开始,如下文进一步详述。在本发明的方法中,合成巨大戟醇中的中间体可以是任何一个或多个选自以下的中间体:式4化合物、式33化合物、式34化合物、式35化合物、式37化合物和式38化合物,其中P1和P2各自独立地为羟基保护基团,并且R是二醇保护基团:在本发明方法的一个实施方案中,使化合物33转化为化合物34由铑(I)催化剂催化,所述催化剂可以为例如二羰基氯化铑(I)二聚体([RhCl(CO)2]2)、[RhCl(COD)]2、[RhCl(dppp)]2或[Rh(dppp)2]Cl。在该实施方案中,使式33化合物与铑(I)催化剂在140℃或高于140℃的温度下在高沸点溶剂中一起孵育。高沸点溶剂可任选地为芳族溶剂,诸如例如二甲苯、甲苯、均三甲苯、二氯苯或其它溶剂诸如二丁醚(参见图1)。在本发明方法的另一个实施方案中,在-78℃或更低的温度下通过频哪醇重排使式37化合物转化为式38化合物。在该实施方案中,可以在-78℃加入碳酸氢盐或其它类似中和剂以使反应淬灭。可使式37化合物溶解于诸如二氯甲烷的溶剂中。使式38化合物(化合物37的频哪醇重排产物)在中性溶液中升温至室温以避免暴露于酸。在该实施方案中,试剂三氟化硼乙醚可加至化合物37以形成产物化合物38。可将试剂三氟化硼乙醚以10.0当量或近似当量的量加至化合物37中。在另一个实施方案中,合成巨大戟醇的方法可如方案1所描绘进行(图1)。在此方法中,使化合物1转化为化合物4:在该实施方案中,使化合物1转化为化合物4可通过任何一个或多个中间体2和/或3进行:在该实施方案中,通过化合物1的氯化使化合物1转化为化合物2,然后通过化合物2的臭氧分解或用于氧化裂解的其它方法(像雷米厄-约翰逊反应(Lemieux-Johnsonreaction))使化合物2转化为化合物3。最后,通过化合物3的还原烷基化使化合物3转化为化合物4。在一个实施方案中,通过使用对映异构纯1开始1至4的转化可任选地产生对映异构纯4。对映异构纯1可商购获得。化合物3可在-78℃或更低的温度下被还原,然后在-45℃或更低的温度下进行烷基化,以产生化合物4。还原步骤可涉及例如使化合物3在萘锂或二叔丁基二苯基锂溶液中孵育以形成还原的化合物,然后用碘甲烷进行烷基化,但可用技术人员已知的其它还原剂和烷基化剂取代。通常,合成巨大戟醇可通过方案1和/或2(分别地图1和2),或诸如在方案4和5(分别地图4和5)中提供的其变化形式来进行。例如,在方案2中,方案1的若干步骤已使用套叠试剂(telescopingreagent)缩简成单锅反应,即首先加入一组试剂并使反应继续完成,然后向同一锅中加入第二组试剂,不经进一步纯化或另外地操作在加入第一和第二组试剂之间的反应。可采用方案2的所有合并步骤、一些合并步骤或不采用合并步骤,这取决于所需的实施方案。在一个实施方案中,由本文公开的方法合成的巨大戟醇可进一步修饰以产生巨大戟醇-3-当归酸酯(参见,例如,WO2012/010172)。其它实施方案包括对应于沿本发明合成路线的有利中间体的具体化合物,如方案1和2所述。例如,中间体4、34、35和38。还预期作为本发明合成方法的实施方案和中间体的是可为技术人员所知的等效物。例如,在许多反应中,指示或提出特定组试剂和条件,但技术人员将了解其它等效试剂可取代以实现类似结果,或许具有不同产率。附图简述附图(其并入并形成本说明书的一部分)说明本发明的实施方案并且与说明书一起用于解释本发明:图1描绘方案1,全合成巨大戟醇的实施方案。该方案在下面实验部分的实施例1-21中进一步详细公开。图2描绘方案2,比方案1描绘的更短的全合成巨大戟醇的实施方案。该路线在实验部分的实施例22-28中进一步表征。图3描绘方案3,从起始材料1合成4。该路线在实验部分的实施例1-3中进一步表征。图4描绘方案4,从10合成26的替代路线。该路线在实验部分的实施例29-30中进一步表征。图5描绘方案5,从14合成21的替代路线。该路线在实验部分的实施例31-32中进一步表征发明详述尽管文献中提供了全合成巨大戟醇的报道,但本发明提供迄今为止未利用的有效合成路线,该路线节省时间和资源,是可按比例缩放的,并提供其它优点,如下面进一步详细提供。合成策略开始于环状单萜1(常称为蒈烯、δ-3-蒈烯、蒈烯(isodiprene)、δ-蒈烯,(+)-3-蒈烯、蒈-3-烯(car-3-ene)、3-香芹烯、3,7,7-三甲基二环[4.1.0]庚-3-烯,CAS13466-78-9)的简单起始材料,其相对便宜且可呈对映异构纯形式商购获得(SIGMAALDRICH,St.Louis,MO,US)。目前公开的巨大戟醇合成路线包括多至二十个步骤,如方案1所描绘(图1)。然而,此合成路线可替代地减少至少至20、19、18、17、16、15、14、13、12、11或甚至10个步骤或更少。更短的合成路线的实施方案描绘于方案2(图2),其中合成路线缩短到14个步骤,或化学反应。即,方案2公开通过合并某些步骤以在合成过程实现效率而比方案1更短的巨大戟醇合成路线。然而,方案2不旨在描绘可能合成21的最短路线。本领域技术人员可以能够通过使用替代试剂和/或保护基团等进一步缩简方案2中描绘的一些反应。当采用或预期更大规模生产时这些效率可以是有利的。大规模合成可需要进一步的修改、独特的条件和其它无法预料和无法预知的改变以通过本发明公开的方法和通过本发明公开的中间体成功实现巨大戟醇的更大规模生产。方案2提供通过在单锅中步骤的各种组合的性能从起始材料1和23合成巨大戟醇的较短路线。即,可向中间体中首先加入一组试剂并使得反应进行至完成至下一个中间体,然后向同一锅中加入第二组试剂,不经进一步纯化或另外地操作在加入第一和第二组试剂之间的反应或中间体。可采用方案2、方案4和/或方案5的所有合并步骤、一些合并步骤或不采用合并步骤,这取决于所需的结果。此外,合成路线的另外的缩短是可能的,如下所示。如可为本领域技术人员所知在合成路线中可实现其它效率。在整个描述中,提供各种试剂用于合成途径中的每一步骤。然而,如为合成有机化学领域技术人员所知,替代的可商购获得的试剂常已知并且通常在整个方案中并且更具体地说是在清楚描述的步骤中是可取代的。目前公开的方案成功公开某些过程步骤和条件。然而,在整个途径的各步骤中使用已知等效试剂和/或方法学的进一步优化旨在由本描述所涵盖并且通常为技术人员所知。合成步骤1至4涉及使1转化为结构4(参见图3,方案3)。通过从对映异构纯1开始可获得对映异构纯4。化合物1对应于蒈烯,一种二环单萜。蒈烯也称为δ3-蒈烯或3,7,7-三甲基二环[4.1.0]庚-3-烯,并且可作为可从天然来源分离的99%纯(1S,6R)对映异构体,(+)-3-蒈烯(CAS498-15-7)而获得。此外,90%化学纯(+)-3-蒈烯-其仍为对映异构纯-可用于代替更昂贵的99%化学纯材料。本申请另外公开呈同分异构纯形式的4的方便和有效合成。该化合物为本领域非常需要的并且可用于其它目的,即作为用于获得合成其它大分子的其它合成程序的起始材料。定义所有术语皆旨在被理解为它们将被本领域技术人员所理解的那样。术语“羟基保护基团”或“保护基团(protectivegroup)”或“保护基团(protectinggroup)”(本文在一些情况下表示为“P1”、“P2”和/或“P3”)旨在包括形成对预计的反应稳定的羟基衍生物的任何基团,其中所述羟基保护基团随后任选地可被选择性地去除。所述羟基衍生物可通过羟基保护剂与羟基的选择性反应获得。术语“羟基保护基团(hydroxylprotectinggroup)”旨在具有与术语“羟基保护基团(hydroxylprotectivegroup)”相同的含义。同样,术语“保护基团(protectinggroup)”旨在具有与术语“保护基团(protectivegroup)”相同的含义。醚衍生物,诸如烯丙基醚、异戊二烯基醚、对甲氧基苄基醚、三苯基甲基醚、2-三甲基甲硅烷基乙基醚、叔丁基醚、肉桂基醚、炔丙基醚、对甲氧基苯基醚、苄基醚、3,4-二甲氧基苄基醚、2,6-二甲氧基苄基醚、邻硝基苄基醚、对硝基苄基醚、4-(三甲基甲硅烷基甲基)-苄基醚、2-萘基甲基醚、二苯基甲基醚、(4-甲氧基苯基)-苯基甲基醚、(4-苯基-苯基)-苯基甲基醚、对,对′-二硝基二苯甲基醚、5-二苯并环庚基醚、三(4-叔丁基苯基)甲基醚、(α-萘基)-二苯基甲基醚、对甲氧基苯基二苯基甲基醚、二(对甲氧基苯基)苯基甲基醚、三(对甲氧基苯基)甲基醚或9-(9-苯基)呫吨基醚是羟基保护基团的非限制性实例。醚衍生的羟基保护基团还包括但不限于,烷氧基烷基醚(缩醛和缩酮)诸如1-乙氧基乙基醚、1-甲基-1-甲氧基乙基醚、[(3,4-二甲氧基苄基)氧基]甲基醚、邻甲氧基苯酚甲基醚、2-甲氧基乙氧基甲基醚、2-(三甲基甲硅烷基)乙氧基甲基醚、四氢吡喃基醚、四氢呋喃基醚、甲氧基甲基醚苄基氧基甲基醚、对甲氧基苄基氧基甲基醚、对硝基苄基氧基甲基醚、邻硝基苄基氧基甲基醚、(4-甲氧基苯氧基)甲基醚、叔丁氧基甲基醚、4-戊烯基氧基甲基醚、甲硅烷氧基甲基醚、1-甲氧基环己基醚、4-甲氧基四氢吡喃基醚、1-[(2-氯-4-甲基)苯基]-4-甲氧基哌啶-4基醚、1-(2-氟苯基)-4-甲氧基哌啶-4基醚、1-(4-氯苯基)-4-甲氧基哌啶-4基醚或1-甲基-1-苄基氧基乙基醚。醚衍生的羟基保护基团还包括但不限于,硫缩醛和硫缩酮,诸如四氢噻喃基醚、4-甲氧基四氢噻喃基醚、四氢噻吩基醚或1,3-苯并二硫戊环-2基醚。羟基保护基团还包括但不限于,甲硅烷基醚衍生物,诸如三甲基甲硅烷基醚、三乙基甲硅烷基醚、三异丙基甲硅烷基醚、叔丁基二甲基甲硅烷基醚、二甲基异丙基甲硅烷基醚、二乙基异丙基甲硅烷基醚、二苯基甲基甲硅烷基醚、三苯基甲硅烷基醚、二甲基叔己基甲硅烷基醚、2-降冰片基二甲基甲硅烷基醚、叔丁基二苯基甲硅烷基醚、(2-羟基苯乙烯基)二甲基甲硅烷基醚、(2-羟基苯乙烯基)二异丙基甲硅烷基醚、叔丁基甲氧基苯基甲硅烷基醚或叔丁氧基二苯基甲硅烷基醚。羟基保护基团还包括但不限于,羟基酯,诸如乙酸酯、氯乙酸酯、三氟乙酸酯、苯氧基乙酸酯、甲酸酯、苯甲酰基甲酸酯、二氯乙酸酯、三氯乙酸酯、甲氧基乙酸酯、对氯苯氧基乙酸酯、苯基乙酸酯、3-苯基丙酸酯、4-戊烯酸酯、4-氧代戊酸酯、特戊酸酯、巴豆酸酯、4-甲氧基巴豆酸酯、当归酸酯、苯甲酸酯或对苯基苯甲酸酯。羟基保护基团还包括但不限于,羟基碳酸酯,诸如碳酸甲氧基甲酯、碳酸9-芴基甲酯、碳酸甲酯、碳酸乙酯、碳酸2,2,2-三氯乙酯、碳酸2-(三甲基甲硅烷基)乙酯、碳酸乙烯基酯、碳酸烯丙基酯或碳酸对硝基苯基酯。羟基保护基团还包括羟基的次磺酸酯(sulfenate)诸如2,4-二硝基苯基次磺酸酯。二羟基保护基团,本文有时指示为可变基团“R”,是形成对预计的反应稳定的二醇衍生物的任何基团,其中所述二羟基保护基团随后任选地可被选择性去除。所述二羟基衍生物可通过二羟基保护剂与二醇的选择性反应获得。缩酮衍生物,诸如亚异丙基缩酮(缩丙酮)、亚环戊基缩酮、亚环己基缩酮、亚环庚基缩酮、二苯甲酮缩酮、1-叔丁基亚乙基缩酮或1-苯基亚乙基缩酮、3-亚戊基缩酮、2,4-二甲基-3-亚戊基缩酮、2,6-二甲基-4-亚庚基缩酮、3,3-二甲基-2-亚丁基缩酮;和缩醛衍生物诸如苄亚甲基缩醛、2,4-二甲氧基苄亚甲基缩醛、4-硝基苄亚甲基缩醛、2,4,6-三甲基苄亚甲基缩醛、2,2-二甲基-1-亚丙基缩醛、亚甲基缩醛、亚乙基缩醛、对甲氧基苄亚甲基缩醛、叔丁基亚甲基缩醛、3-(苄基氧基)亚丙基缩醛、丙烯醛缩醛、2-硝基苄亚甲基缩醛、均三甲苯缩醛或2-萘甲醛缩醛是二羟基保护基团的非限制性实例。其它二羟基保护基团包括但不限于,环状原酸酯或原酸酯,诸如甲氧基亚甲基缩醛、乙氧基亚甲基缩醛、2-氧杂环亚戊基原酸酯或异丙氧基亚甲基缩醛。其它二羟基保护基团包括但不限于,双缩醛衍生物诸如丁烷2,3-双缩醛或环己烷-1,2-二缩醛,或二螺缩酮诸如八氢-[2,2′]-联吡喃基缩酮。其它二羟基保护基团包括但不限于,甲硅烷基衍生物诸如二-叔丁基甲硅亚烷基、二烷基甲硅亚烷基、1,3-(1,1,3,3-四异丙基二亚硅氧烷基)、1,1,3,3-四-叔丁氧基二亚硅氧烷基、亚甲基-双-(二异丙基亚硅氧烷基,或1,1,4,4-四苯基-1,4-二亚甲硅烷基衍生物。二羟基保护基团还包括但不限于,环状碳酸酯。其它二羟基保护基团包括但不限于,环状硼酸酯诸如硼酸苯基酯、硼酸甲酯或硼酸乙酯。羟基保护基团和二羟基保护基团还包括但不限于,固相负载的保护基团。用于引入固相负载的保护基团的固相负载试剂可包括(例如)用于引入固相负载的三苯甲基保护基团的聚合物结合的2-氯三苯甲基氯化物、或用于制备固相负载的缩酮-保护基团的乙酰基聚苯乙烯树脂或基于4-(4-羟基苯基)丁-2-酮的树脂。术语“炔烃保护基团(alkyneprotectinggroup)”或“炔烃保护基团(alkyneprotectivegroup)”(本文在一些情况下表示为“Q”)旨在包括形成对预计的反应稳定的炔烃基团衍生物的任何基团,其中所述炔烃保护基团随后任选地可被选择性去除。所述炔烃衍生物可通过炔烃保护剂与炔烃基团的选择性反应获得。此类炔烃保护基团的实例包括但不限于,三烷基甲硅烷基诸如三甲基甲硅烷基(TMS)、三乙基甲硅烷基(TES)、三异丙基甲硅烷基(TIPS)和叔丁基二甲基甲硅烷基(TBDMS)。本发明范围包括的羟基保护基团、二羟基保护基团和炔烃保护基团的非限制性实例可见于,例如,“ProtectiveGroupsinOrganicSynthesis,”第4版.P.G.M.Wuts;T.W.Greene,JohnWiley,2007,第16-366页,和P.J.Kocienski,“ProtectingGroups,”第3版.G.Thieme,2003,所述文章出于所有目的在此通过引用整体并入。用于引入保护基团的试剂通常可从精细化学品的标准供应商,诸如FLUKA、SIGMA-ALDRICH和例如BOEHRINGER-INGELHEIM、MERCK和BASF处商购获得。“羟基活化基团”(有时本文指示为可变基团“L”)意指本领域已知增加羟基部分的反应性的不稳定的化学部分,并且其活化羟基以致它在合成程序期间诸如在取代或消除反应中去除。许多羟基保护基团也是羟基活化基团。羟基活化基团的实例包括但不限于,例如,甲磺酸酯基(甲磺酰基)、甲苯磺酸酯基(对甲苯磺酰基)、三氟甲磺酸酯基(三氟甲磺酰基,Tf)、九氟丁磺酰基(nonflyl)(九氟丁烷磺酰基)、对硝基苯甲酸酯基(诸如3-硝基苯磺酰基)、膦酸酯基等。羟基活化基团还可包括但不限于,三苯基膦和磺酸烷基酯或磺酸芳基酯。用于引入羟基活化基团的试剂包括但不限于,甲磺酸酐、甲磺酰氯、甲苯磺酰氯和三氟乙酰氯。如本文所用术语“活化羟基”是指用羟基活化基团活化的羟基,如上所定义,包括例如甲磺酸酯基、甲苯磺酸酯基、三氟甲磺酸酯基、对硝基苯甲酸酯基和膦酸酯基。如本文所用术语“单锅”方法表示在一系列合成反应中不需要分离和纯化(甚至部分纯化)通过发生在反应容器中的每一化学反应步骤获得的中间体,直到在顺序结束时合成产物。即,“单锅”意指反应在单个反应容器中进行而不需要将中间体转移至第二反应容器中或另外地纯化或分离反应物和/或产物。“一锅”反应提高化学合成的效率,因为在单锅中(或反应容器中)通过加入套叠试剂使反应物经受连续的化学反应。尽管如此,应理解如果需要,在顺序合成反应中的每种中间体产物可任选地被分离和纯化,并因此用于其它目的。术语“单锅,,指示它可在容器中通过多个步骤进行,但并不指示优选的方法是在单个容器中作为半间歇方法。术语“套叠反应”当本文使用时指示别处经常替代地称作套叠合成的方法学或过程,由此向反应容器中首先加入一组试剂并使反应继续完成或几乎完成,然后向同一反应容器(或“锅”)中加入第二组试剂,而不进一步纯化中间体产物或另外地操作加入第一和第二组试剂之间的反应。例如,可将步骤1试剂加至一个反应容器中并使反应进行至完成或几乎完成。代替处理该中间体产物,然后加入步骤2的下一组试剂并再次使反应进行至完成。此类套叠合成或套叠反应,还可更普遍地称作“单锅”或“一锅”反应。此类反应传统上最受化学家的青睐因为它们有效地避免可能漫长的纯化过程的需要,其可需要用于分离在每一反应步骤之间的中间体。化合物巨大戟醇-3-当归酸酯在整个本申请中,并且可在本领域中在各种文献出版物中,可替代地被称作巨大戟醇甲基丁烯酸酯、PEP005、29和CAS75567-37-2。化合物巨大戟醇在整个本申请中,并且可在本领域中在各种文献出版物中,可替代地被称作CAS30220-46-3、C20H28O5、21、(1aR,2S,5R,5aR,6S,8aS,9R,10aR)-1a,2,5,5a,6,9,10,10a-八氢-5,5a,6-三羟基-4-(羟基甲基)-1,1,7,9-四甲基-1H-2,8a-桥亚甲基环戊[a]环丙-[e]环癸-11-酮。用于本申请的术语“芳族”意指具有共轭的π电子系统的至少一个环的芳族基团,即,具有4n+2个离域电子的芳族碳分子,根据Hückel法则,并且包括碳环芳基(例如,苯基)和杂环芳基(例如,吡啶)二者。该术语包括单环或稠环多环,即,共享邻近碳原子对、基团的环。术语“芳族”当用于如本公开所用“芳族溶剂”的上下文时意指任何已知的和/或可商购获得的芳族溶剂,诸如但不限于,甲苯、苯、二甲苯、任何Kesols、和/或GaroSOL、和其衍生物和混合物。术语“烷基”自身或作为另一个取代基的部分意指(除非另外指出)直链或支链、或环状烃基团、或其组合,其可完全饱和、单-或多不饱和,并且可包括二价和多价基团,其具有指定的碳原子数,即C1-C10意指链中一至十个碳原子。饱和烃基团的非限制性实例包括诸如甲基、乙基、正丙基、异丙基、正丁基、叔丁基、异丁基、仲丁基、环己基、(环己基)甲基、环丙基甲基、例如正戊基、正己基、正庚基、正辛基的同系物和同分异构体等的基团。不饱和烷基是具有一个或多个双键或三键的烷基。不饱和烷基的实例包括但不限于,乙烯基、2-丙烯基、巴豆基、2-异戊烯基、2-(丁二烯基)、2,4-戊二烯基、3-(1,4-戊二烯基)、乙炔基、1-和3-丙炔基、3-丁炔基、和更高级的同系物和同分异构体。术语“烷基”(除非另外提到)还意在包括以下更详细定义的那些烷基衍生物,诸如“杂烷基”。术语“亚烷基”自身或作为另一个取代基的部分意指衍生自烷烃的二价基团,如所例示但不限于,--CH2CH2CH2CH2--,并且还包括如下描述为“杂亚烷基”的那些基团。通常,烷基(或亚烷基)将具有1至24个碳原子,其中具有10个或更少碳原子的那些基团在本发明中是优选的。“低级烷基”或“低级亚烷基”是较短的链烷基或亚烷基,通常具有八个或更少碳原子。术语“炔基”意图指示包含1-3个C-C三键和2-10个碳原子,通常包含2-6个碳原子,特别是2-4个碳原子,诸如2-3个碳原子的烃基团,例如乙炔基、丙炔基、丁炔基、戊炔基或己炔基。术语“烷氧基”、“烷基氨基”和“烷基硫基”(或硫基烷氧基)以其常规含义使用,并且是指分别通过氧原子、氨基、或硫原子连接到分子其余部分的那些烷基。术语“杂烷基”自身或与另一个术语组合,意指(除非另外指出)稳定的直链或支链、或环状烃基团、或其组合,由所述数目的碳原子和至少一个选自O、N、Si和S的杂原子组成,并且其中氮和硫原子可任选地被氧化并且氮杂原子可任选地被季铵化。杂原子O、N和S和Si可置于杂烷基的任何内部位置或在烷基连接到分子其余部分的位置处。实例包括但不限于,-CH2-CH2-O-CH3、-CH2-CH2-NH-CH3、-CH2-CH2-N(CH3)-CH3、-CH2-S-CH2-CH3、-CH2-CH2、-S(O)-CH2、-CH2-CH2-S(O)2-CH3、-CHCH-O-CH3、-Si(CH3)3、-CH2-CHN-OCH3,和-CHCH-N(CH3)-CH3。多达两个杂原子可以是连续的,诸如例如,-CH2-NH-OCH3和-CH2-O-Si(CH3)3。类似地,术语“杂亚烷基”自身或作为另一个取代基的部分意指衍生自杂烷基的二价基团,如所例示但不限于,-CH2-CH2-S-CH2-CH2-和-CH2-S-CH2-CH2-NH-CH2-。对于杂亚烷基,杂原子也可占据一个或两个链末端,例如,亚烷基氧基、亚烷基二氧基、亚烷基氨基、亚烷基二氨基等。另外,对于亚烷基和杂亚烷基连接基团,未通过连接基团化学式的手写方向来暗示连接基团的定向。例如,式-C(O)2R′-表示-C(O)2R′-和-R′C(O)2-二者。术语“环烷基”和“杂环烷基”自身或与其它术语组合,分别表示(除非另外指出)“烷基”和“杂烷基”的环状形式。此外,对于杂环烷基,杂原子可占据杂环连接到分子其余部分的位置处。环烷基的实例包括但不限于,环戊基、环己基、1-环己烯基、3-环己烯基、环庚基等。杂环烷基的实例包括但不限于,1-(1,2,5,6-四氢吡啶基)、1-哌啶基、2-哌啶基、3-哌啶基、4-吗啉基、3-吗啉基、四氢呋喃-2-基、四氢呋喃-3-基、四氢噻吩-2-基、四氢噻吩-3-基、1-哌嗪基、2-哌嗪基等。术语“卤代”或“卤素”自身或作为另一个取代基的部分,意指(除非另外指出)氟、氯、溴或碘原子。此外,术语诸如“卤代烷基”意在包括单卤代烷基和多卤代烷基。例如,术语“卤代(C1-C4)烷基”意在包括但不限于,三氟甲基、2,2,2-三氟乙基、4-氯丁基、3-溴丙基等。术语“芳基”意指(除非另外指出)可以是单环或多环(优选1至5个环)的多不饱和、芳族取代基,其稠合一起或共价连接。术语“杂芳基”是指含有一至四个选自N、O和S的杂原子的芳基(或环),其中氮和硫原子任选地被氧化,并且氮原子任选地被季铵化。杂芳基可通过杂原子连接到分子的其余部分。芳基和杂芳基的非限制性实例包括苯基、1-萘基、2-萘基、4-联苯基、1-吡咯基、2-吡咯基、3-吡咯基、3-吡唑基、2-咪唑基、4-咪唑基、吡嗪基、2-噁唑基、4-噁唑基、2-苯基-4-噁唑基、5-噁唑基、3-异噁唑基、4-异噁唑基、5-异噁唑基、2-噻唑基、4-噻唑基、5-噻唑基、2-呋喃基、3-呋喃基、2-噻吩基、3-噻吩基、2-吡啶基、3-吡啶基、4-吡啶基、2-嘧啶基、4-嘧啶基、5-苯并噻唑基、嘌呤基、2-苯并咪唑基、5-吲哚基、1-异喹啉基、5-异喹啉基、2-喹喔啉基、5-喹喔啉基、3-喹啉基、四唑基、苯并[b]呋喃基、苯并[b]噻吩基、2,3-二氢苯并[1,4]二氧杂环己烯-6-基、苯并[1,3]间二氧杂环戊烯-5-基和6-喹啉基。用于每个上述芳基和杂芳基环系统的取代基选自如下所述可接受的取代基。为简洁起见,术语“芳基”当与其它术语组合使用时(例如,芳基氧基、芳基硫氧基、芳基烷基),包括如上所定义的芳基和杂芳基环二者。因此,术语“芳基烷基”意在包括其中芳基连接到烷基的那些基团,例如,苄基、苯乙基、吡啶基甲基等,包括其中碳原子(例如,亚甲基)已被(例如)氧原子替代的那些烷基,例如,苯氧基甲基、2-吡啶基氧基甲基、3-(1-萘基氧基)丙基等。每个上述术语,例如,“烷基”、“杂烷基”、“芳基”和“杂芳基”意在包括指示的基团的取代和未取代两种形式。用于每种类型基团的优选取代基在下面提供。用于烷基和杂烷基基团的取代基,包括经常称作亚烷基、烯基、杂亚烷基、杂烯基、炔基、环烷基、杂环烷基、环烯基和杂环烯基的那些基团,一般称作“烷基取代基”,并且它们可以是选自但不限于以下的一个或多个各种基团:--OR′、=O、=NR′、=N--OR′、--NR′R″、--SR′、-卤素、--SiR′R″R″′、--OC(O)R′、--C(O)R′、--CO2R′、--CONR′R″、--OC(O)NR′R″、--NR″C(O)R′、--NR′--C(O)NR″R″′、--NR″C(O)2R′、--NR--C(NR′R″R″′)=NR″″、--NR--C(NR′R″)=NR″′、--S(O)R′、--S(O)2R′、--S(O)2NR′R″、--NRSO2R′、--CN和--NO2,其数目自零至(2M′+1)的范围,其中M′是此类基团中的碳原子总数。R′、R″、R″′和R″″各自优选独立地是指氢、取代或未取代的杂烷基、取代或未取代的芳基(例如,被1-3个卤素取代的芳基)、取代或未取代的烷基、烷氧基或硫基烷氧基、或芳基烷基。当本发明的化合物包括一个以上R基团时,例如,每个R基团独立选择,如同当存在一个以上R′、R″、R′″和R″″基团时,每个这些基团独立选择一样。当R′和R″连接到同一氮原子时,它们可与氮原子结合以形成5-、6-或7-元环。例如,--NR′R″意在包括但不限于,1-吡咯烷基和4-吗啉基。从取代基的上述讨论中,本领域技术人员将理解术语“烷基”意在包括包含结合至除了氢基团以外的基团的碳原子的基团,诸如卤代烷基,例如,--CF3和--CH2CF3)和酰基,例如,--C(O)CH3、--C(O)CF3、--C(O)CH2OCH3等)。与针对烷基基团描述的取代基类似,用于芳基和杂芳基的取代基一般称作“芳基取代基”。取代基选自例如:卤素、--OR′、=O、=NR′、=N--OR′、--NR′R″、--SR′、-卤素、--SiR′R″R′″、--OC(O)R′、--C(O)R′、--CO2R′、--CONR′R″、--OC(O)NR′R″、--NR″C(O)R′、--NR′--C(O)NR″R′″、--NR″C(O)2R′、--NR--C(NR′R″R″″)=NR′″、--NR--C(NR′R″)=NR′″、--S(O)R′、--S(O)2R′、--S(O)2NR′R″、--NRSO2R′、--CN和--NO2、--R′、--N3、--CH(Ph)2、氟(C1-C4)烷氧基、和氟(C1-C4)烷基,数目从零至芳族环系统上开放化合价的总数的范围;并且其中R′、R″、R′″和R″″优选地独立选自氢、取代或未取代的烷基、取代或未取代的杂烷基、取代或未取代的芳基和取代或未取代的杂芳基。当本发明的化合物包括一个以上R基团时,例如,每个R基团独立选择,如同当存在一个以上R′、R″、R′″和R″″基团时,每个这些基团独立选择一样。在以下方案中,符号X表示如上所述的″R″。术语‘催化量’旨在指示相对于待转化的反应物的小于化学计量量的催化剂的量。在烯烃的二羟基化中催化量的四氧化锇因此旨在指示以摩尔表示的四氧化锇的量,其小于待二羟基化的以摩尔表示的烯烃的量。催化量的四氧化锇相对于待二羟基化的烯烃-衍生物为例如0.5-20、1-10、2-7、3-5或5摩尔百分比。术语‘有效的缓冲范围’旨在指示pH范围,其中缓冲液有效地中和加入的酸和碱,同时维持相对恒定的pH。申请人意识到有许多惯例和系统,由此有机化合物可被命名和另外地描述,包括常用名称以及系统,诸如IUPAC系统。不希望受此类系统或名称束缚,申请人在下文提供一组用于本文公开的每个中间体的可能的化学名称。这些名称不旨在以任何方式限制,并且在其中下面提供的名称和本文描绘的结构之间发生疑问或矛盾的所有情况下,结构具有优先权并且总是旨在传达申请人的意图。1:(1S,6R)-3,7,7-三甲基二环[4.1.0]庚-3-烯2:(1R,3R,6S)-3-氯-7,7-二甲基-4-亚甲基二环[4.1.0]庚烷3:(1S,4R,6R)-4-氯-7,7-二甲基二环[4.1.0]庚-3-酮4:(1S,4R,6R)-4,7,7-三甲基二环[4.1.0]庚-3-酮5:(1R,2R,4R,6R)-2-((1R,2R)-1-羟基-2-甲基-戊-3,4-二烯-1-基)-4,7,7-三甲基二环[4.1.0]庚-3-酮6:(1R,2R,3R,4R,6R)-2-((1R,2R)-1-羟基-2-甲基-戊-3,4-二烯-1-基)-4,7,7-三甲基-3-((三甲基甲硅烷基)乙炔基)二环[4.1.0]庚-3-醇7:(1R,2R,3R,4R,6R)-3-乙炔基-2-((1R,2R)-1-羟基-2-甲基-戊-3,4-二烯-1-基)-4,7,7-三甲基二环[4.1.0]庚-3-醇8:(1R,2R,3R,4R,6R)-2-((1R,2R)-1-((叔丁基二甲基甲硅烷基)氧基)-2-甲基-戊-3,4-二烯-1-基)-3-乙炔基-4,7,7-三甲基二环[4.1.0]庚-3-醇9:叔丁基(((1R,2R)-1-((1R,2R,3R,4R,6R)-3-乙炔基-4,7,7-三甲基-3-((三甲基甲硅烷基)氧基)二环[4.1.0]庚-2-基)-2-甲基-戊-3,4-二烯-1-基)氧基)二甲基硅烷10:(1aR,1bR,2R,3R,7bR,8R,9aR)-2-((叔丁基二甲基甲硅烷基)氧基)-1,1,3,8-四甲基-7b-((三甲基甲硅烷基)氧基)-1,1a,1b,2,3,5,7b,8,9,9a-十氢-6H-环丙[3,4]苯并[1,2-e]薁-6-酮11:(1aR,1bR,2R,3R,6S,7bR,8R,9aR)-2-((叔丁基二甲基甲硅烷基)氧基)-1,1,3,6,8-五甲基-7b-((三甲基甲硅烷基)氧基)-1a,1b,2,3,5,6,7b,8,9,9a-十氢-1H-环丙[3,4]苯并[1,2-e]薁-6-醇12:(1aR,16R,2R,3R,4R,4aS,6S,7bR,8R,9aR)-2-((叔丁基二甲基甲硅烷基)氧基)-1,1,3,6,8-戊-甲基-7b-((三甲基甲硅烷基)氧基)-1,1a,1b,2,3,4,5,6,7b,8,9,9a-十二氢-4aH-环丙[3,4]苯并[1,2-e]薁-4,4a,6-三醇13:(2S,3aS,6aR,7R,8R,8aR,8bR,9aR,11R,11aR)-8-((叔丁基二甲基甲硅烷基)氧基)-2-羟基-2,7,9,9,11-五甲基-11a-((三甲基甲硅烷基)氧基)-2,3,6a,7,8,8a,8b,9,9a,10,11,11a-十二氢-环丙[5′,6′]苯并[1′,2′:7,8]薁并[3a,4-d][1,3]二氧杂环戊烯-5-酮14:(3aS,6aR,7R,8R,9R,9aR,10aR,12R,12aS)-8-((叔丁基二甲基甲硅烷基)氧基)-2,7,10,10,12-五甲基-6a,7,9,9a,10,10a,11,12-八氢-3H,8H-9,12a-桥亚甲基环戊[1,10]环丙[6,7]环癸[1,2-d][1,3]二氧杂环戊烯-5,13-二酮15:(3S,3aR,6aR,7R,8R,9R,9aR,10aR,12R,12aS)-8-((叔丁基二甲基甲硅烷基)氧基)-3-羟基-2,7,10,10,12-五甲基-6a,7,9,9a,10,10a,11,12-八氢-3H,8H-9,12a-桥亚甲基环戊[1,10]环丙[6,7]环癸[1,2-d][1,3]二氧杂环戊烯-5,13-二酮16:(3S,3aS,6aR,7R,8R,9R,9aR,10aR,12R,12aS)-乙酸8-((叔丁基二甲基甲硅烷基)氧基)-2,7,10,10,12-五甲基-5,13-二氧代-6a,7,9,9a,10,10a,11,12-八氢-3H,8H-9,12a-桥亚甲基环戊[1,10]环丙[6,7]环癸[1,2-d][1,3]二氧杂环戊烯-3-基酯17:(3S,3aS,6aR,7S,8R,9R,9aR,10aR,12R,12aS)-乙酸8-羟基-2,7,10,10,12-五甲基-5,13-二氧代-6a,7,9,9a,10,10a,11,12-八氢-3H,8H-9,12a-桥亚甲基环戊[1,10]环丙[6,7]环癸[1,2-d][1,3]二氧杂环戊烯-3-基酯18:(3S,3aS,6aR,7R,8R,9R,9aR,10aR,12R,12aS)-乙酸2,7,10,10,12-五甲基-5,13-二氧代-8-(((三氟甲基)磺酰基)氧基)-6a,7,9,9a,10,10a,11,12-八氢-3H,8H-9,12a-桥亚甲基环戊[1,10]环丙[6,7]环癸[1,2-d][1,3]二氧杂环戊烯-3-基酯19:(3S,3aR,6aR,9S,9aR,10aR,12R,12aS)-乙酸2,7,10,10,12-五甲基-5,13-二氧代-6a,9,9a,10a,11,12-六氢-3H,10H-9,12a-桥亚甲基环戊[1,10]环丙[6,7]环癸[1,2-d][1,3]二氧杂环戊烯-3-基酯20:(1aR,2S,5R,5aS,6S,8aS,9R,10aR)-5,5a,6-三羟基-1,1,4,7,9-五甲基-1a,2,5,5a,6,9,10,10a-八氢-1H-2,8a-桥亚甲基环戊[a]环丙[e][10]轮烯-11-酮21:(1aR,2S,5R,5aR,6S,8aS,9R,10aR)-5,5a,6-三羟基-4-(羟基甲基)-1,1,7,9-四-甲基-1a,2,5,5a,6,9,10,10a-八氢-1H-2,8a-桥亚甲基环戊[a]环丙[e][10]轮烯-11-酮22:(R)-2-甲基戊-3,4-二烯-1-醇23:(R)-2-甲基戊-3,4-二烯-1-醛24:(1aR,1bR,2R,3R,4R,4aS,7bR,8R,9aR)-2-((叔丁基二甲基甲硅烷基)氧基)-4,4a-二羟基-1,1,3,8-四甲基-7b-((三甲基甲硅烷基)氧基)-1,1a,1b,2,3,4,4a,5,7b,8,9,9a-十二氢-6H-环丙[3,4]苯并[1,2-e]薁-6-酮27:(3aS,6aR,7S,8R,9R,9aR,10aR,12R,12aS)-8-羟基-2,7,10,10,12-五甲基-6a,7,9,9a,10,10a,11,12-八氢-3H,8H-9,12a-桥亚甲基环戊[1,10]环丙[6,7]环癸[1,2-d][1,3]二氧杂环戊烯-5,13-二酮28:(3aS,6aR,9S,9aR,10aR,12R,12aS)-2,7,10,10,12-五甲基-6a,9,9a,10a,11,12-六氢-3H,10H-9,12a-桥亚甲基环戊[1,10]环丙[6,7]环癸[1,2-d][1,3]二氧杂环戊烯-5,13-二酮29:(1aR,2S,5R,5aS,6S,8aS,9R,10aR)-(Z)-2-甲基丁-2-烯酸5,5a-二羟基-4-(羟基甲基)-1,1,7,9-四甲基-11-氧代-1a,2,5,5a,6,9,10,10a-八氢-1H-2,8a-桥亚甲基环戊[a]环丙[e][10]轮烯-6-基酯缩写整个本申请使用的缩写具有下面提供的含义。下面提供的含义并非意图具有限制性,而意图还涵盖本领域技术人员了解的任何等效的常见或系统名称。本领域技术人员通常了解的含义应归于未在下面列出的任何其它缩写名称。Ac:酰基Ac2O:醋酸酐、乙酸酐BF3:三氟化硼CDI:羰基二咪唑CeCl3:氯化铈(III)、氯化铈、三氯化铈CH3CN:乙腈CO:一氧化碳DABCO:1,4-二氮杂二环[2.2.2]辛烷DBB:二-叔丁基-联苯DBU:1,8-二氮杂二环[5.4.0]十一碳-7-烯、二氮杂二环十一碳烯DCM:二氯甲烷、CH2Cl2DMAP:二甲基氨基吡啶DMS:二甲基硫醚Et2O:二乙基醚、乙基醚、乙醚Et3N:三乙胺EtOAc:乙酸乙酯HF:氟化氢HMPA:六甲基磷酰胺IBX:2-碘氧基苯甲酸、O-碘代苯甲酸K2CO3:碳酸钾KHMDS:六甲基磷酰胺钾LDA:二异丙基氨基锂、[(CH3)2CH]2NLiLiDBB:二-叔丁基-联苯锂LiHMDS:双(三甲基甲硅烷基)氨基锂LN:萘锂MeI:碘甲烷MeLi:甲基锂MeOH:甲醇NH4Cl:氯化铵NaHCO3:碳酸氢钠NaHMDS:六甲基磷酰胺钠((CH3)3Si)2NNaNa2SO3:亚硫酸钠Na2SO4:硫酸钠n-BuLi:正丁基锂NCS:N-氯琥珀酰亚胺NMO:N-甲基吗啉-N-氧化物O3:臭氧OsO4:四氧化锇PhMe:甲苯、苯基甲基Py:吡啶[RhCl(CO)2]2:二羰基氯化铑(I)二聚体[RhCl(COD)]2:环辛二烯基氯化铑二聚体[RhCl(DPPP)2]Cl:双[1,3-双(二苯基膦)丙烷]氯化铑SeO2:二氧化硒SiO2:二氧化硅TBAF:四-正丁基氟化铵、(CH3CH2CH2CH2)4N+F-TBHP:叔丁基过氧化氢TBS:叔丁基二甲基甲硅烷基醚、TBDMSTBSOTf:三氟甲磺酸叔丁基二甲基甲硅烷基酯、TBDMS三氟甲磺酸酯TES:三乙基甲硅烷基醚Tf:三氟甲磺酸酯(trifluoromethanesulfonate/triflate)Tf2O:三氟甲磺酸酐THF:四氢呋喃TIPS:三异丙基甲硅烷基醚TMANO:三甲胺-N-氧化物TMS:三甲基甲硅烷基乙炔TMSOTf:三氟甲磺酸三甲基甲硅烷基酯、TMS三氟甲磺酸酯此外,编号的化合物通常被称为对应于化合物编号的“式”,即例如编号的化合物1与式1、化合物1、或仅1相同并且可与之互换称呼。合成方法通常,下面提供的方法反映在方案1的较长合成路线(图1)和方案2的较短合成路线(图2)中。然而,也在方案4和方案5中提供了对这两条路线的略微修改,从而呈现其它合成路线选择。方案1呈现本申请程序的具体实施方案,但如本领域技术人员将知道,各种替代组试剂可用于各步骤,如以下所示作为选择。还预期终产物(巨大戟醇)可用于进一步的合成步骤以形成如以上在文献中报道和概括的其它衍生物,包括(例如)巨大戟醇-3-当归酸酯(29)。合成方法的大小和规模将取决于所需终产物的量而变化。终产物的预期量包括但不限于,一个或多个微克、一个或毫克、一个或多个克和/或一个或多个千克的巨大戟醇。在本发明的方法中的重要中间体在下面强调。但应理解其它中间体(除了强调的那些)也将在其它合成化学方案中具有有利用途,因为它们能够缩短至其它终产物的各种合成路线。因此,据信本文公开的所有中间体都是独特的、有利的且适用于不同用途。另外,尽管可以在下面步骤1开始合成巨大戟醇,并进行至巨大戟醇的终产物,但还可需要简单地实现一个或多个关键中间体(诸如例如34、35或38)的合成。在这些情况下,预期过程将继续仅直到获得所需中间体。因此,公开的合成方法包括合成所有本文公开的中间体,似乎每个中间体被认为是所需终产物。即,该方法预期公开本文公开的每个和每一个中间体的有效合成,似乎每一个其自身是所需的、有用的和有利的终产物。因此,本文预期的方法包括涉及所有公开步骤、一些公开步骤、一个或多个公开步骤、或任何其组合的合成方法。公开的方法包括(例如)如下所述仅涉及步骤1-9的34的合成,或仅涉及方案1的步骤1-15的40的合成等。在使用干燥剂的所有情况下,预期的干燥剂包括在文献中报道的和技术人员已知的所有那些干燥剂,诸如但不限于,硫酸镁、硫酸钠、硫酸钙、氯化钙、氯化钾、氢氧化钾、硫酸、生石灰、五氧化磷、碳酸钾、钠、硅胶、氧化铝、氢氧化钙、氢化铝锂(LAH)、氢氧化钾等。(参见,Burfield等人,“DessicantEfficiencyinSolventDrying.AReappraisalbyApplicationofaNovelMethodforSolventWaterAssay,”J.Org.Chem.,42(18):3060-3065,1977)。加至每一处理中的干燥剂的量可由本领域技术人员优化而非特别限制。此外,尽管提供用于处理每一步骤中间体的一般指南,但技术人员通常理解其它任选的溶剂和试剂在处理步骤期间可同样被取代。然而,在一些例外情况下,发现需要极为特定的处理条件来来维持不稳定的中间体。那些情况在下面在其中它们发生的步骤中指示。下面许多步骤指示在反应结束后的各种处理。处理通常涉及使反应淬灭以终止任何剩余的催化活性和起始试剂。在这之后通常加入有机溶剂并分离水层与有机层。产物通常从有机层获得并且未使用的反应物和其它伪副产物以及不希望的化学物质通常在水层中捕获并丢弃。在贯穿文献发现的标准有机合成程序中的处理通常是接着通过暴露于干燥剂以去除仍部分溶解于有机层的任何过量水或水性副产物来干燥产物和浓缩剩余有机层。可通过任何已知方式来实现溶解于溶剂中的产物的浓缩,所述方式诸如在压力下蒸发,在增加的温度和压力下蒸发等。此类浓缩可通过使用标准实验设备(诸如旋转蒸发器蒸馏等)来实现。在这之后任选地是一个或多个纯化步骤,其可包括但不限于,快速柱色谱、通过各种介质和/或本领域已知的其它预备方法过滤和/或结晶/重结晶。(参见,例如,AddisonAult,“TechniquesandExperimentsforOrganicChemistry,”第6版,UniversityScienceBooks,Sausalito,CA,1998,AnnB.McGuire,编,第45-59页)。尽管某些有机共溶剂和淬灭剂可在如下所述步骤中指示,但技术人员已知的其它等效的有机溶剂和淬灭剂也可同样采用并且在本文完全预期。此外,在大多数步骤中的大多数处理可根据偏好和所需终用途或终产物进一步改变。不需要采用干燥和蒸发(在有机合成化学工作台上的常规步骤)并且可认为在所有步骤中是任选的。用有机溶剂萃取的次数可多至一次、二次、三次、四次、五次或十次或更多次,这取决于所需结果和反应规模。除了其中特别指出,处理中所用淬灭剂的体积、量以及有机溶剂的体积可取决于特定反应条件而变化并且使之优化以生成最好结果。此外,在指出惰性气体或稀有气体时,通常用于本领域的任何惰性气体可取代为指示的惰性气体,诸如氩气、氮气、氦气、氖气等。步骤1:使1氯化以产生2将式1化合物(SIGMA-ALDRICH,Inc.,St.Louis,MO)溶解于溶剂中。在一个实施方案中,溶剂是二氯甲烷。向1在二氯甲烷(CH2Cl2,DCM)中的溶液中加入氯化试剂和催化量的二甲基氨基吡啶(DMAP)。已知各种其它氯化/氧化试剂并且可在此步骤中被取代以实现类似结果,诸如N-氯琥珀酰亚胺(NCS)、漂白剂(NaOCl)和CeCl3、tBuOCl、三氯异氰脲酸。可搅拌约3小时或更长的时间段,这取决于反应规模,即,起始材料的量。可监测反应并在室温(r.t.)下继续搅拌直到实现所需量的产物。各种起始材料的量可产生可变产率并需要更高温度用于加速反应和提高产率。因此,反应时间和试剂的调节可以是基于起始材料的量优化所需产率所必需的。针对关于形成任选活性的2-和3-蒈烯系统的更多内容,参见Paquette等人,“RegioselectiveRoutestoNucleophilicOpticallyActive2-and3-CareneSystems”J.Org.Chem.,55:1589-1598,1990,出于所有目的通过引用整体并入本文。终止反应后,加入戊烷并且继续搅拌直到溶液变为悬浮液。所得悬浮液可通过SiO2垫过滤。可选地,可避免戊烷并使反应简单地进行至完成,之后加入水性溶液(诸如水),并分离有机层,用饱和水性盐溶液(优选氯化钠(NaCl))洗涤,并经合适的干燥剂干燥,诸如但不限于,硫酸钠(Na2SO4)、或本文先前公开的任何其它干燥剂。然后可过滤产物并在减压下浓缩。所得残余物可任选地进一步纯化以去除过量琥珀酰亚胺,例如通过快速柱色谱(制备型薄层色谱(TLC)、硅胶、戊烷或己烷)以生成呈无色液体的产物2。步骤2:使2臭氧分解以生成3可将从步骤1获得的中间体2(粗品或进一步纯化的)溶解于溶剂中,诸如二氯甲烷∶甲醇(CH2Cl2∶MeOH)为2∶1的混合物(或其它比率,诸如但不限于3∶1、4∶1、5∶1等)或任何其它合适的溶剂中,诸如氯仿、二乙基醚或乙酸乙酯。然而,应注意,甲醇的用途可用作此步骤中的至少一种溶剂。然后使溶液冷却至至少-78℃或更低。将溶液用臭氧处理直到它变为深蓝色。臭氧可通过引起臭氧分解的任何已知方式产生,包括但不限于,通过电晕放电、紫外线或电解产生臭氧(O3)。推荐暴露于臭氧直到溶液颜色变深蓝。这可需要孵育1小时、2小时、3小时、4小时或之间的任何时间,这取决于起始材料的量、所选溶剂和其它条件变量。也可通过已知方式实时监测产物形成。可用空气或O2直到溶液变无色将过量臭氧从溶液去除。加入硫脲和任选地二甲基硫醚(DMS,(CH3)2S)(或其它还原剂)并将反应混合物升温,优选至室温,并且可继续搅拌一段时间,诸如数小时,或多至例如,1小时、2小时、3小时、或4小时或更久。如在步骤1中,通过加入水性介质(诸如水和盐水)、分离有机层和萃取水层进行处理。萃取可用(例如)二氯甲烷或其它合适的萃取剂(诸如氯仿、二乙基醚或乙酸乙酯)完成。然后可合并萃取的有机层并经合适的干燥剂(诸如Na2SO4)干燥,然后过滤并真空浓缩。任选地,使用各种已知和合适的允许使产物3与起始材料2物理分离的展开溶剂组合,产物3可通过快速柱色谱纯化,诸如例如,填充在二氯甲烷或类似溶剂中的硅胶,然后戊烷/Et2O=20∶1→10∶1,以生成呈无色液体的氯-酮3。注意使1转化为3可在单锅中进行。即,步骤1和2可在一个锅中进行,如方案2所描绘(图2)。这通过通常称作加入“套叠”试剂来实现。例如,可将步骤1试剂加至一个反应容器中并使反应进行至完成。代替处理该中间体产物,然后加入步骤2的下一组试剂并再次使反应进行至完成。然后如指示处理终产物3和/或视需要对步骤3进一步纯化。尽管发现许多中间体的稳定性发生变化,但发现只要将式3化合物维持在约-20℃或以下的低温下,它就相当稳定。步骤3:3的还原烷基化向三颈玻璃烧瓶中加入还原剂,诸如萘或二-叔丁基联苯(DBB)和在无水THF中的锂金属。优选地,锂金属是新鲜切割的。其它还原剂可用于此步骤,诸如例如钠、钾、SmI2。然后将悬浮液进行超声处理。超声处理可进行数小时,优选1、2、3、4或根据需要多至数小时以生成深绿色溶液。可选地,在室温将混合物搅拌3小时或更久,这取决于反应物的规模。如果需要可采用更高温度来加快反应。在单独的烧瓶中,将式3化合物溶解于合适的溶剂中。可用于此步骤的溶剂包括(例如)THF或其它非质子极性溶剂。将3的溶液冷却至-78℃。应将3的溶液温度降低至约-78℃。优选地,在整个反应期间将温度尽可能维持在接近-78℃。在一些条件下更高温度可产生伪副产物。因此,甚至在-50℃,产生不需要的产物或根本不产生产物。因此,温度应不高于或接近-50℃。温度应维持在接近-78℃。在一段时间内例如通过使用套管或允许逐滴加入的其它装置将萘锂或二叔丁基二苯基锂(LiDBB)溶液加至3的溶液中。优选地在足够长的时间内加入还原剂以确保充分冷却并维持-78℃的温度。优选地逐滴加入可持续长至20分钟、30分钟、45分钟、60分钟或数小时,这取决于起始材料的量。使反应在-78℃进行直到溶液中持续绿色。向冷却的溶液中缓慢加入碘甲烷,并至少在低至-45℃(或更低)的温度下继续搅拌。使碘甲烷反应足够量时间,这取决于起始材料的量。优选地反应进行长至2小时,但可从1至6小时,诸如3小时、4小时、5小时或6小时或更久。HMPA的使用可允许较短反应时间并承受更高温度(参见下文)。将此阶段的反应尽可能小心地维持在接近-45℃。加入饱和氯化铵水溶液(NH4Cl)、HCl水溶液、饱和碳酸氢钠或水并使反应混合物逐渐升温至室温。处理涉及分离有机层和水层,并用Et2O或其它合适的萃取试剂多次萃取水层。将合并的有机层干燥,过滤并在减压下浓缩。粗产物可任选地进一步纯化,例如通过快速柱色谱(硅胶,戊烷/Et2O=100∶1→40∶1→20∶1→10∶1)以生成呈浅黄色油状物的甲基酮产物4。步骤4:使4进行羟醛反应以制备中间体5在-78℃在氩气或其它惰性(稀有)气体下向4在合适的非质子极性溶剂(诸如THF)中的溶液中加入也溶解于合适的溶剂(例如THF)中的LiHMDS。优选地,用于此步骤的LiHMDS或任何其它类似的锂碱,是新鲜的以获得最佳产率。其它强胺碱也可用于此步骤,例如LDA、NaHMDS和KHMDS。将混合物在-78℃搅拌足以使4完全去质子化的一段时间,优选1小时或更久,这取决于采用的起始材料的量。然后,在数分钟内缓慢加入23在溶剂(优选THF)中的溶液(但可使用其它溶剂)。然后使混合物在-78℃搅拌足够时间以允许反应完成,例如持续数小时或更久,或多至3小时、或4小时、或甚至5小时,这取决于反应的体积和反应物的量。然后通过加入足够量的合适的淬灭剂,诸如饱和NH4Cl水溶液(更优选NH4Cl和EtOAc)使反应淬灭。可分离反应混合物并例如用EtOAc萃取水层。在处理中,将合并的有机级分干燥,蒸发,并可任选地通过柱色谱,例如通过使用5%EtOAc:己烷系统(例如,可采用任何合适的溶剂系统,诸如己烷/EtOAc=20∶1→15∶1)进一步纯化以提供呈无色油状物的5。从式22化合物制备23通过改变用邻碘氧基苯甲酸对醇进行氧化的已知程序来进行(参见,More等人,“ASimpleandAdvantageousProtocolfortheoxidationofalcoholswitho-IodoxybenzoicAcid(IBX),”Org.Lett.,4(17):3001-3003,2002),如下:对烧瓶装填22在溶剂(诸如THF)中的溶液。可通过已知方法获得化合物22。(参见,例如,Konegawa等人,“Enzyme-mediatedopticalresolutionof2-methyl-3,4-pentadien-1-ol,achiralbuildingblockpossessingterminalallenylgroup,”Synlett,1997(11):1297-1299,1997)。将试剂2-碘氧基苯甲酸(IBX)加至烧瓶中,然后将其紧密密封并加热所得悬浮液。烧瓶应紧密密封以允许使试剂有效转化为产物。加热可继续至高达80℃足够长时间以允许反应完成。然后冷却悬浮液。处理涉及过滤。过滤可通过使用(例如)棉花或类似的过滤介质实现。例如用THF或其它非质子极性溶剂洗涤残余物,并可将含有23的滤液不经进一步纯化用于上述羟醛反应。式23化合物优选在临使用前新鲜制备的,以得到5的最佳产率。使3转化为5可在单锅中进行,从而将步骤3和4合并到单个步骤中。花费许多努力和实验来实现此效率。令人惊讶的是,据发现4-甲基酮难以分离,使得表面看来很简单的反应以提供充足产率的方式完成非常具有挑战性。简言之,可如上所述对装填萘、新鲜蒸馏的THF和新鲜切割的锂的烧瓶进行超声处理。然后可对单独的烧瓶装填3和新鲜蒸馏的THF并冷却至至少-78℃。然后可将萘锂溶液随时间缓慢加至3的溶液中直到持续深绿色。然后,可将六甲基磷酰胺(HMPA)和碘甲烷的溶液随时间加至深绿色溶液中同时维持在-78℃的温度。然后将该反应搅拌一小时或更久以允许完成反应。然后可将反应烧瓶在室温转移到水浴中并通过真空去除过量碘甲烷。冷却回到-78℃后,随时间逐滴加入LiHMDS并使其搅拌直到还原完成,再次维持在-78℃的温度。然后在-78℃在搅拌下可加入新鲜制备的醛23的溶液。在数小时后可使反应淬灭。淬灭(如上)可包括加入饱和NH4Cl。萃取产物和处理将如上生成5。萃取可采用方便和合适的溶剂,诸如EtOAc。可如上将合并的有机层干燥、过滤并浓缩。步骤5:乙炔化物加至5以生成31在-78℃在氩气(或其它惰性气体)下向三甲基甲硅烷基乙炔(TMS)例如在THF中的溶液中加入在己烷或其它合适的溶剂(需要实现无水条件)中的正丁基锂(n-BuLi)。在此步骤中可采用其它炔烃保护基团(Q)(除了TMS)。许多替代的炔烃保护基团是本领域已知的并且在此步骤中可取代TMS,在合适条件下生成类似的或可能相同的结果。将溶液在-78℃搅拌直到完成,然后在-78℃在氩气下加至CeCl3在THF中的悬浮液中。THF可被其它合适的醚溶剂取代,并且CeCl3可用作用于该Friedel-Crafts酰化技术的路易斯酸(Lewisacid)。其它方法可用于获得化合物7,如下面进一步详细解释,其中步骤5和6任选地合并。将所得悬浮液在-78℃剧烈搅拌。将5溶解于THF中的溶液逐滴加入上述溶液。然后将此悬浮液在-78℃搅拌直到反应完成。在处理中,通过加入水和EtOAc使反应淬灭。分离各层并且用合适的萃取溶剂(诸如EtOAc)将水层萃取若干次。将合并的萃取物干燥并蒸发以生成呈非对映体混合物的31,其可拆分或不经进一步纯化而使用。尽管TMS被指示为可用于此步骤的一个保护基团,但应理解也可使用具有类似结果的其它类似的保护基团(诸如TBS、TES和TIPS)。步骤6:使31脱甲硅烷基化以生成7在0℃在惰性气体下向31溶解于THF或其它合适的溶剂中的溶液中加入溶解在THF中的四-正丁基氟化铵(TBAF,可商购获得)。TBAF与31的化学计量在维持充足水平的去除甲硅烷基保护基团(Q)所需的氟化物中是重要的。优选地31与TBAF的比率为1摩尔当量与1摩尔当量。如果在反应中使用太多氟化物,则产率将受损。可用于此步骤的一种试剂是TBAF。其它试剂可能也不会起作用,并且因此在此步骤中使用TBAF是重要的。然而,在前一步骤中可使用除了TMS外的其它保护基团。如果替代保护基团用于前一步骤,则将采用本领域已知的合适的脱保护剂以去除在前一步骤中使用的保护基团。孵育后,标准处理生成产物。例如,可加入EtOAc和H2O的溶液并将有机层用水洗涤若干次以从脱保护的产物中萃取反应物。可将有机层干燥并蒸发以提供呈白色固体的7。去除或尽可能多地去除大多数胺盐在一些条件下可能是有帮助的。注意使5转化为7可在单锅中进行。即,步骤5-7可在一个锅中进行,如方案2所描绘(图2)。如上,这可通过在单个反应容器中加入套叠试剂而不需要进一步纯化中间体31来实现。可向冷却至-78℃的酮5在THF中的溶液中逐滴加入在THF中的格氏试剂(Grignardreagent),诸如乙炔基溴化镁。在一些条件下其它有机锂试剂也可用于此步骤。然而,尽管乙炔锂不太理想,因为它不可商购获得,但可使用乙炔锂和类似试剂。然后将反应混合物升温至-10℃并继续搅拌直到完成。将饱和NH4Cl水溶液(10mL)或其它碱水溶液作为淬灭剂加入并用有机溶剂(诸如EtOAc、Et2O或DCM)将混合物萃取若干次。将合并的有机层干燥并任选地进一步纯化,例如通过快速柱色谱(硅胶,己烷/EtOAc=10∶1→5∶1)以提供呈无色油状物的醇7。步骤7:7的保护此步骤的要点是保护7-羟基,在其上将最终形成巨大戟醇的七元环。尽管TBS是可用于此步骤的一个羟基保护基团,但应理解也可使用具有类似结果的其它类似的保护基团(P2)(诸如TMS、TES、TBDPS和TIPS)。在0℃在惰性气体下向7和三乙胺(Et3N)在二氯甲烷(DCM)中的溶液中加入三氟甲磺酸叔丁基二甲基甲硅烷基酯(TBSOTf)或其它保护基团试剂。如果采用不同的保护基团,则将需要其它已知条件来利用所选的保护基团。在此反应中任何其它非亲核性的碱也可取代。在使反应进行至完成后,可通过加入饱和NaHCO3水溶液或其它合适的淬灭剂使反应淬灭。加入DCM以萃取杂质并分离各层。可根据需要用有机溶剂将水层萃取多次。将合并的有机级分干燥并蒸发以生成呈无色油状物的32。步骤8:对32进一步保护以生成33此步骤的要点是保护10-羟基,在其上将最终形成巨大戟醇的七元环。尽管TMS是可用于此步骤的一个羟基保护基团,但应理解也可使用具有类似结果的其它类似的保护基团(P1)诸如TBS、TES或Ac。例如,P1可以是TMS并且P2可以是TBS。在0℃在惰性气体下使含有溶解于有效量的Et3N和DCM中的32的溶液与羟基保护剂(诸如TMSOTf)一起孵育。具有相同或类似结果的其它胺碱(诸如(iPr)2Net(Hünig碱)、2,6-二甲基吡啶、或吡啶等)可在此步骤中取代。在允许反应进行至完成后,用水性溶液(诸如饱和NaHCO3水溶液)使反应淬灭并以典型的方式处理产物9。例如,可加入有机溶剂(诸如DCM)并分离各层。可用DCM将水层萃取多次并合并。将合并的有机级分干燥,蒸发,并且9产物可任选地进一步纯化,例如通过在溶剂(诸如己烷)中的柱色谱,以得到呈无色油状物的33。注意使7转化为33可在单锅中进行。即,步骤7和8可在一个锅中进行,如方案2中所描绘(图2)。再次,如上,可以套叠方式加入试剂,以使步骤7和8在单个反应容器中进行而不需要在步骤之间分离中间体32。例如,在0℃可向7在CH2Cl2中的溶液中逐滴加入三乙胺然后加入TBSOTf。在反应终点后,逐滴加入三乙胺,然后加入TMSOTf。可通过将反应取样并且通过TLC或其它分析分离方式使反应物和产物可视化来监测终点。然后在0℃将反应混合物搅拌一段时间,然后用饱和碱(诸如NaHCO3)水溶液淬灭。然后用标准有机溶剂(诸如EtOAc)将混合物萃取若干次并将合并的有机层任选地干燥,过滤并在减压下浓缩。也可采用通过快速柱色谱(硅胶,戊烷)对粗产物任选的纯化。步骤9:Pauson-Khand反应以生成34在此步骤中,巨大戟醇的核心四环环结构以惊人的方式获得。保护基团可如上所定义。例如,P1可以是TMS并且P2可以是TBS。此转化的许多方面(从反应实现34的重大产率的基本事实到在稀释基本上提高34的产率的条件的许多重复和尝试后取得的发现)是惊人的。令人惊讶地发现在反应中越稀释反应物,在测试规模下越观察到更好的产率,并且如下面实施例中所呈现。事实上,一旦反应稀释至约0.005M,产率即可提高~30%。进一步发现产率对所用溶剂的质量高度敏感。仅仅将溶剂从常规的二甲苯或蒸馏的二甲苯改变为无水对二甲苯,一种通常将预测基本上不会影响反应的小的改变,事实上却在测试规模上大幅增加10的产率。对反应容器装填在无水对二甲苯中的33并脱气(例如使用一氧化碳)并超声处理处理。尽管可使用其它基于二甲苯的溶剂,但观察到使用无水对二甲苯的产率最佳。将催化量的铑(I)复合物诸如[RhCl(CO)2]2加至反应中。用于此步骤的铑(I)催化剂是铑(I)复合物,诸如例如,[RhCl(CO)2]2、[RhCl(COD)]2、[RhCl(CO)(dppp)]2和[Rh(dppp)2]Cl。(参见,例如,Jeong等人,“Pauson-Khand-typereactionmediatedbyRh(I)catalysts,”PureAppl.Chem.,74(1):85-91,2002;和Brummond,KayM.,“Rh(I)-catalyzedintramolecular[2+2+1]cycloadditionofallenenes:Constructionofbicyclo[4.3.0]nonenoneswithanangularmethylgroupandtricyclo[6.4.0.01,5]dodecenone,”BeilsteinJ.Org.Chem.,7:404-409,2011,二者皆出于所有目的通过引用整体并入,特别是本文公开的所有Rh(I)复合物)。其它催化剂也可用于此反应包括金属诸如但不限于,铑、钼、锆、铁、钴和铱。这些金属催化剂可与配体或者不与配体一起使用。本领域已知的可用于本公开的反应的一些通常采用的金属配体包括,例如,1,3-双(二苯基膦)丙烷(dppp)、双齿膦配体和其它(诸如三苯基膦)等。例如,具体的金属催化剂可包括但不限于,Mo(CO)6、Fe(CO)4(NMe3)、[Cp2ZrCl]2、IrCl(CO)(PPh3)2、[Ir(COD))Cl]2、[Co2(CO)8]、[Co2(CO)8(P(OPh)3)],以及如上还提到的铑催化剂等。(参见,例如,Alcaide等人,“TheAllenicPauson-KhandReactioninSynthesis,”Euro.J.Org.Chem.,2004(16):3377-3383,2004,和其中公开的各种催化剂)。这些催化剂可商购获得或从可商购获得的来源容易制备。在1atmCO下将容器优选地通过转移至浴中(诸如预先加热的油浴)升温至140℃数小时或直到反应基本完成。其它合适的溶剂可包括但不限于,具有高沸点的那些,诸如芳族和非芳族溶剂,和二丁醚、甲苯、均三甲苯、萘、和二氯苯。溶剂的沸点优选至少140℃。应该将反应加热至此温度以在一些条件下维持充足产率。例如可在约1atmCO下将反应加热至140℃直到完成。可使反应冷却并且如果需要加入另外的铑(I)催化剂。如果需要另外的催化剂在CO气氛下将反应再次加热至140℃。完成后,将反应混合物直接加样至柱上并通过柱色谱迅速纯化以提供呈白色泡沫状物的34。推荐(尽管非必须)该中间体用于下一步骤(如下所述步骤10),并且随后的步骤基本不纯化,直到获得20,以避免介入的化合物的不稳定性。步骤10:34的甲基加入以生成35在惰性气体下使用溶剂以使34悬浮并冷却至-78℃。溶剂可以是(例如)THF。然而,在此步骤中其它溶剂也可同等起作用,诸如但不限于,其它醚类(etherial)溶剂。向此溶液中加入甲基溴化镁(MeMgBr)。还可使用具有类似结果的其它有机金属试剂或格氏试剂。例如,甲基锂和CeCl3也可用于获得相同产物11。然而,有人可优选使用MeMgBr,因为它更方便,并且CeCl3可需要其它方案以维持试剂以无水状态。如果不适当地干燥,CeCl3可分解并负面影响反应。完成后,将混合物升温至0℃短时间,约15分钟;然而,此孵育时间将取决于用于该步骤的反应物规模而变化。然后将反应冷却至-78℃并通过加入水小心地淬灭。然后将混合物缓慢升温至室温。加入萃取溶剂(诸如EtOAc和水),分离各层,并将水层用其它溶剂(诸如EtOAc)萃取。将合并的有机级分干燥并蒸发以生成呈无色油状物的35,其可不经进一步纯化用于下一步骤。由于其内在的不稳定性,通常不推荐此中间体进一步纯化。步骤11:使35二羟基化以生成36在惰性气体(诸如氩气)下溶剂吡啶可用于溶解36,向其中加入新鲜制备的OsO4,OsO4也可溶解于吡啶中。(参见,雷米厄-约翰逊氧化,如在例如Pappo等人,“OsmiumTetroxide-CatalyzedPeriodateOxidationofOlefenicBonds,”J.Org.Chem.,21(4):478-479,1956中所公开)。其它共溶剂诸如DCM、THF、EtOH、EtOAc、Et2O和THF可与吡啶一起使用并实现类似结果。然后在室温下将此混合物搅拌约12小时至24小时或更长的时间段。可选地,可使反应孵育少于16小时,只要监测到产物形成。然后通过加入(例如)饱和Na2SO3水溶液和EtOAc使反应淬灭,但可使用其它水性和有机中和淬灭溶剂系统。然后分离各层并将水层用有机溶剂(诸如EtOAc)进一步萃取。将合并的有机级分蒸发并加入THF。然后加入饱和水性还原剂(诸如Na2SO3)并将所得双相混合物剧烈搅拌约24小时以使得充分混合并萃取以及层拆分。分离各层并用EtOAc将水层进一步萃取若干次。在此步骤中,如在其中采用EtOAc或THF的先前步骤中,具有相等产率和拆分度的其它有机溶剂可取代,如技术人员已知。将合并的有机级分干燥并蒸发以生成呈黄色固体的二醇36,其可不经进一步纯化用于下一步骤。也可用催化量的OsO4(诸如相对于烯烃为1-10,诸如2-8、诸如3-5、诸如5摩尔百分比)和共氧化剂(诸如例如TMANO、NMO或TBHP)实现二醇36的形成。反应可在缓冲液存在下优先进行,所述缓冲液诸如包含酸(诸如柠檬酸、磷酸和乙酸)及其盐和其混合物的水性缓冲液组合物。有效的缓冲液的范围可以是pH1至pH6,诸如pH2-5.5,诸如pH3-5。在标准条件下将化合物35溶解于丙酮、乙腈和约pH3的水性缓冲液的混合物中,向其中加入相对于化合物35的催化量的OsO4和化学计量量的DABCO以及相对于化合物35的过量TMANO共氧化剂。在50℃将反应搅拌20至50小时或更久。在反应中可采用具有类似结果的其它溶剂诸如THF、EtOH、t-BuOH和H2O。还可在范围为20℃至80℃的更高或更低温度下进行该反应,其中更低温度需要增加反应次数。水性缓冲液组合物可包括但不限于酸诸如柠檬酸、磷酸和乙酸及其盐、和其混合物。有效的缓冲液的范围可以是pH1至pH6。也可采用DABCO的替代性叔胺试剂,诸如三乙胺、二异丙基乙基胺、或奎宁环。不加入叔胺还可进行具有类似结果的反应。也可采用具有类似结果的其它共氧化剂诸如NMO和TBHP。通过加入饱和水性还原剂(诸如Na2SO3)使反应淬灭。分离各层并用EtOAc将水层进一步萃取若干次。在此步骤中,如在其中采用EtOAc或丙酮的先前步骤中,具有相等产率和拆分度的其它有机溶剂可取代,如技术人员已知。将合并的有机级分干燥并蒸发以产生呈黄色固体的二醇36,其不经进一步纯化用于下一步骤。注意式36化合物是酸不稳定的并且应该储存在中性条件下以维持稳定性。优选地36可储存但对通过二氧化硅的纯化和其它类似方式不稳定。不推荐进一步纯化并且可以是非必需的,因为粗产物可直接用于下一步骤。步骤12:对36保护以形成37在惰性气体下溶剂DCM可用于溶解36。加入试剂N,N-羰基二咪唑(CDI)和任选地DMAP并将溶液在室温下搅拌直到完成。可使用DMAP以使反应进行更快,如果需要,但非必须。尽管CDI指示此步骤,但可同等采用其它类似的试剂诸如光气(COCl2)或三光气(碳酸双(三氯甲基)酯,C3Cl6O3)以生成类似结果。反应进程可通过标准已知程序来监测。还要注意尽管在此步骤的上述描述中指示具体保护基团(R),但其它二醇保护基团是本领域已知的并且出于相同目的可互换地用于本发明的步骤,即如下所述在前述步骤期间保护所指示的二醇36。然后通过加入饱和CuSO4水溶液或其它合适的中和剂使反应淬灭,并分离各层,其中用溶剂(诸如DCM)使水层萃取若干次。将合并的有机级分干燥并蒸发以产生呈白色固体的37,其可在此步骤纯化作为终产物,或直接用于下一步骤。注意式37化合物是酸不稳定的并且应该储存在中性条件下以维持稳定性。任选地,13可从36与OsO4、NMO、在t-BuOH中的柠檬酸和水反应以形成24而形成,如在方案4所描绘(图4)。保护8-元环上的两个羟基以形成25可通过采用任何标准的和合适的保护基团(诸如但不限于,TBS、TMS、TMSOTf、Ac等)而实现。如上在甲基加入(步骤10)中,与格氏试剂MeMgBr反应,然后得到中间体26。然后此中间体可用于在方案1或方案2中概述的步骤的其余部分,开始于下面步骤13的频哪醇重排,其中使37与三氟化硼乙醚复合物一起孵育,如在下一步骤进一步详细解释。然后用26取代37将生成相应的受保护的中间体38,这取决于在此替代途径中采用哪个保护基团。步骤13:使37频哪醇重排以提供38在惰性气体下将式37化合物溶解于DCM或类似的溶剂中,并冷却至约-50℃至-78℃之间或更低。反应可以是温度敏感性的并且在一些条件下偏离指示的低温可大幅降低产率。在搅拌下可将路易斯酸(诸如但不限于,三氟化硼、二乙基醚复合物(BF3·Et2O))逐滴加至溶解的37。(参见,Lockner等人,“PracticalRadicalCyclizationswithArylboronicAcidsandTrifluoroborates,”Org.Lett.,13(20):5628-5631,2011)。然后可将反应在此温度下搅拌几分钟,然后升温至-50℃。在升高的温度下数分钟后,例如约30min或更久(取决于起始材料的量),在-40℃加入Et3N/MeOH(3mL)的混合物并将溶液搅拌几分钟。然后加入饱和NaHCO3水溶液。然后将反应混合物升温至室温并用DCM萃取若干次。将合并的有机级分干燥并蒸发。粗产物可任选地使用包含最优选的5%EtOAc:己烷的溶剂系统进行色谱以提供呈清澈油状物的38。在此步骤中尤其重要的是然后进行本文描述的处理。根据经验确定的是采用的大部分其它处理程序生成由二烯消除产生的一种或多种伪副产物(很可能是热力学产物)。注意产物38与本文公开的其它中间体相比是相对不稳定的。在酸性环境的背景下并且尤其当暴露于强酸时,化合物38是尤其不稳定的。此中间体必须维持在中性环境下,否则反应在酸性条件下将自身逆转。中间体38可任选地通过快速柱色谱纯化,如果需要,色谱使用合适的溶剂系统诸如但不限于,硅胶,填充在DCM中的柱,然后己烷/EtOAc=20∶1→10∶1→5∶1。14的纯化将生成白色泡沫状物。另外,从34制备38所需的步骤通常需要步骤依次进行连续不断而不中止或中断以避免介入的中间体的分解。沿本公开从34至38的合成途径的中间体是相对不稳定的并且不应该储存任何长时间。因此,纯化步骤之间的这些中间体是可能的,但为了维持可接受的产率通常不鼓励这样做。步骤14:使38烯丙基氧化以生成39在惰性气体诸如氩气下将所需量的化合物38溶解于二噁烷(1,4-二氧杂环己烷、1,4-二噁烷、[6]-冠-2)或类似的非质子溶剂中。向此溶液中加入SeO2并将混合物加热至80℃数小时,例如,长达10至14小时。加热的持续时间可取决于采用的起始材料的量而变化。然而,必不可少的是将混合物加热至至少约80℃。将所得混合物用固体NaHCO3处理、干燥并过滤。过滤介质可以是任何标准介质,诸如但不限于,硅藻土。如果使用硅藻土,则然后用溶剂(诸如EtOAc)洗涤并将合并的有机级分浓缩以生成呈无色油状物的39。用于过滤目的的替代性介质是本领域已知的。无论任何时候提到通过机械装置过滤,应理解在合适的条件下可用其它过滤介质诸如但不限于,硅藻土、棉花、玻璃丝、氧化铝、硅藻土(Kieselguhr)、二氧化硅等进行取代。(参见,例如,“HandbookofFilterMedia,”D.B.Purchase和K.Sutherland编,ElsevierScience&TechnologyBooks,2002;和“FiltersandFiltrationHandbook,”K.Sutherland,第5版,Elsevier,Butterworth-Heinemann,2008,Burlington,MA,所述二者出于所有目的通过引用整体并入本文)。步骤15:使39酰化以产生40在此下一步骤中式39化合物可用作粗产物不经进一步纯化。简言之,在惰性气体下将39溶解于合适的有机溶剂(诸如DCM)中,尽管可采用其它类似溶剂。然后加入试剂Ac2O和催化(或化学计量)量的DMAP并将混合物搅拌直到反应完成,但可采用其它类似的碱,诸如但不限于,吡啶、二甲基吡啶和/或三乙胺。此外,可采用其它乙酰化试剂(诸如但不限于乙酰氯)以生成保护基团P3。注意通常使用比通常用于此类反应的Ac2O更多的Ac2O可提高产率。因此,在此步骤中可采用多至2当量、或2.5当量、3当量、或甚至3.5或4当量的Ac2O以提高产率。反应的处理涉及通过加入合适的中和试剂(诸如饱和CuSO4水溶液)淬灭,然后分离所得物层,并用合适的有机溶剂(诸如DCM)将水层洗涤若干次。然后将合并的有机级分干燥并蒸发以生成呈无色油状物的40。注意使38转化为40(涵盖步骤14和15)通过以套叠方式连续加入用于这些步骤的单独指示的试剂可在单锅反应中进行,如上述在其它可合并的步骤的情况下所述。如上在惰性气体下将式38化合物溶解于二噁烷中,并加入SeO2。将混合物小心地密封并加热至约80℃,保持数小时,例如长达约10至14小时之间或更久。然后将此反应冷却至室温并加入Ac2O和DMAP。将反应搅拌同时孵育直到完成,通常数分钟至一小时或更久。根据如上所述的相同程序进行处理,通过诸如硅藻土的介质或类似的介质过滤,用中和试剂(诸如CuSO4)洗涤。然后将合并的有机层干燥并浓缩。产物40可任选地(如果需要如此)通过快速柱色谱或其它类似的方式进一步纯化,例如包括但不限于:硅胶,填充在DCM中的柱,然后己烷/EtOAc=20:1→10:1→5:1,。此得到呈橙色油状物的16。步骤16:40的脱保护以提供41对反应容器(诸如例如,塑料小瓶)装填40(其可以是粗产物)和乙腈(CH3CN)。然后加入氟化物源(诸如47%HF水溶液)并在环境气氛下将混合物加热至50℃。尽管在此步骤中可采用其它氟化物试剂,但如果选择HF,由于HF的危害性,推荐使用塑料反应容器。在一些条件下由于本发明中间体在水性碱性条件下的内在不稳定性,在此步骤中可使用酸性氟化物来源替代碱性氟化物来源。完成后,通常数小时,或甚至多至约10小时或更久,将反应冷却至室温并通过缓慢加入中和溶液(诸如饱和NaHCO3水溶液)或其它合适的淬灭剂来淬灭。加入有机溶剂EtOAc,尽管在处理中可采用其它已知有机溶剂。然后可分离各层并将水层用有机溶剂(诸如EtOAc)洗涤若干次。然后将合并的有机级分干燥并蒸发以得到呈无色油状物的41。步骤17:使41活化以产生42将溶解于吡啶和/或其它类似的和相容的共溶剂中的化合物41置于惰性气体(诸如氩气)下,向其中逐滴加入试剂用于引入羟基活化基团“L”,诸如优选Tf2O,尽管在此步骤中可使用其它合适的羟基活化基团。可将混合物任选地加热至高达80℃,但这并非必须。通常,较高的热使得反应进行更快,而在室温下反应将以较低速率进行。完成后,将反应冷却并通过缓慢加入淬灭剂(诸如饱和NaHCO3水溶液)来淬灭。加入有机溶剂(诸如但不限于,EtOAc)以萃取产物。例如用饱和CuSO4水溶液将有机层洗涤若干次。然后将有机层干燥并蒸发以生成42,由于其内在不稳定性尤其在碱存在下,其应该不经进一步纯化便立即用于下一步骤。步骤18:消除活化的42以生成43在惰性气体下将粗化合物42溶解于有机溶剂(诸如甲苯)中。向此混合物中加入二氮杂二环十一碳烯(DBU),尽管其它类似的非亲核性碱也可取代用于该反应,并将混合物加热至110℃。如果加热至110℃反应可进行一定程度加快,但该温度不是必需的。反应还将在环境温度、以及在环境温度至110℃之间的温度下进行。完成后,使反应任选地冷却并通过加入合适的淬灭剂(诸如饱和CuSO4水溶液)进行淬灭,但(如上所示)本领域已知的其它淬灭剂可类似地用于此类处理。分离各层并将水层用合适的有机溶剂(诸如DCM)萃取若干次。将合并的有机级分干燥以产生呈无色油状物的43,其可不经进一步纯化便立即用于下一步骤。还要注意可通过其它合成方法学来实现醇消除并将第二双键引入至化合物43。例如,还可使用MartinSulfurane(双[α,α-双(三氟甲基)苯甲醇-合]二苯基硫)反应作为用于醇消除的有效试剂。此试剂将化合物41直接转化为化合物43。(参见,Martin等人,J.Am.Chem.Soc.,93(17):4327-4329,1971)。MartinSulfurane作为用于醇消除的常用试剂是本领域已知的,其以相同方式(活化,然后消除)起作用除了进行活化和消除二者而不分离任何中间体。此外,可使用Mitsunobu条件来获得相同结果。(参见,OrganicReactions,第42卷,第335-656页,LeoAPaquette等人编,1992,JohnWiley&Sons,Inc.)。Mistunobu条件通常采用偶氮二羧酸酯,诸如偶氮二羧酸二乙酯(DEAD)或偶氮二羧酸二异丙酯(DIAD)和三苯基膦,其还在一个步骤中完成活化和消除醇基。步骤19:使43脱保护以提供20在环境气氛下向包含溶解于有机溶剂(诸如MeOH)中的化合物43的溶液中加入碱(诸如但不限于K2CO3)。可选地,可使用其它碱(诸如KOH、NaOH或DBU)水溶液。在反应完成后加入饱和碱(诸如NaHCO3)水溶液和有机溶剂(诸如DCM),其通常仅需要几分钟,尽管如果需要可通过已知方法监测反应。分离各层并将水层用有机溶剂(诸如DCM)萃取若干次。将合并的有机级分干燥并通过色谱(诸如制备型TLC)使粗混合物任选地纯化以得到呈白色固体的20-脱氧巨大戟醇,20。使化合物41转化为20(涵盖步骤17至20)通过以套叠方式连续加入用于这些步骤的单独指示的试剂可在单锅反应中进行,如上述在其它可合并的步骤的情况下所述。步骤20:使20烯丙基氧化以获得巨大戟醇(21)尽管此转化已在文献中报道,但可通过如下修改此程序获得显著更好的产率。(参见,Nickel等人,J.Am.Chem.Soc.,126:16300-16301,2004,在方案5中的反应“l”)。向溶解于溶剂混合物(诸如二噁烷和甲酸)的20的溶液中加入SeO2。可将悬浮液加热至80℃数小时,或直到反应完成,如通过监测产物的出现而判断。然后可将反应冷却并通过加入合适的中和溶液(诸如但不限于,饱和NaHCO3水溶液和Et2O)淬灭。去除水层并加入氢氧化钠。将双相混合物剧烈摇晃并去除有机层。将水层用合适的溶剂(诸如Et2O)萃取,并将合并的有机层干燥并浓缩。可任选地将粗产物进一步纯化,例如通过柱色谱在合适的溶剂系统中诸如例如,1:1DCM:EtOAc,以生成呈白色膜状物的巨大戟醇(21)。最后,通过已知方式可使巨大戟醇(21)进一步转化为巨大戟醇-3-当归酸酯(29)。(参见,例如,WO2012/010172,其出于所有目的通过引用整体并入本文)。可如上所述采用各种羟基保护基团和相应试剂。简言之,使巨大戟醇(21)转化为巨大戟醇-3-当归酸酯(29)的此过程可包括以下步骤:(a)使巨大戟醇的位置5和20的一个或两个羟基与相同或不同的合适的羟基保护剂反应,即用保护基团保护巨大戟醇的位置5和20的一个或两个羟基,(b)使对应于21的化合物酯化,其中碳5和20是受保护的,即使位置3处的羟基酯化,以获得下面描述的化合物中的任一种:其中R1表示氢或羟基保护基团并且R2表示氢或羟基保护基团,或者R1表示羟基保护基团并且R2表示氢或羟基保护基团,或者其中D表示二羟基保护基团,并且(c)从上述化合物去除羟基保护基团R1、或R1和R2、或D以获得巨大戟醇-3-当归酸酯(29)。可选地,巨大戟醇(21)可被酯化以获得:其中R3表示氢或当归酰基,即使巨大戟醇(21)的3-和20-羟基酯化并任选地使5-羟基酯化以获得如上描绘的化合物。在酯化后裂解在位置20或在位置5和20的当归酸酯以获得巨大戟醇-3-当归酸酯。可选地,巨大戟醇的3-羟基可被酯化以获得巨大戟醇-3-当归酸酯。涵盖其它替代合成程序。例如,使34转化为21可通过方案4描绘的路线(图4)进行替代,如以上简单所述。该替代方案可提供在反应按比例放大或其它因素诸如花费、时间和/或试剂的毒性等中的各种效率。实施例概述应理解,本文所述的实施例和实施方案出于说明目的并且对其的各种修改或变化是本领域技术人员所能预见的且包括在本申请的精神和范围以及权利要求书的范围之内。因此,提供以下实施例以说明而非限制所要求保护的发明。在下文公开两种一般合成方法以实现巨大戟醇的有效全合成。第一实验程序包括若干任选的中间步骤,而第二实验程序是缩短并进一步优化的程序,其利用在单锅中进行各组步骤以使不稳定的中间体由于降解的可能损失最小化。程序1:较长的方案-方案1实施例1:1的氯化向(+)-3-蒈烯(1)(22.5g,165.2mmol,1.0当量)在CH2Cl2(600mL)中的溶液中加入N-氯琥珀酰亚胺(66.2g,495.5mmol,3.0当量)和DMAP(2.02g,16.5mmol,0.1当量)并将溶液在室温搅拌3h。加入戊烷(600mL)并将所得悬浮液搅拌5min,然后通过SiO2垫过滤。使溶液在减压下浓缩以得到氯-蒈烯2,其不经进一步纯化用于下一步骤。粗品2的少量样品可通过柱色谱(戊烷)进一步纯化以得到分析纯2。2:1HNMR(500MHz,CDCl3):δ4.93-4.88(m,1H),4.81-4.76(m,1H),4.54(t,J=3.0Hz,1H),2.87(ddt,J=16.5,8.1,2.8Hz,1H),2.48(ddd,J=15.7,9.3,2.7Hz,1H),2.30(d,J=16.6Hz,1H),1.76(dt,J=15.7,3.7Hz,1H),1.02(s,3H),0.90-0.86(m,1H),0.85(s,3H),0.80(td,J=9.2,3.9Hz,1H)。实施例2:2的臭氧分解在氩气下向粗品氯-蒈烯2在CH2Cl2(400mL)中的溶液中加入MeOH(125mL),并将溶液冷却至-78℃。在-78℃将溶液用O3鼓泡直到溶液变蓝。通过将O2鼓泡通过溶液直到再次变为无色来排出过量O3。加入硫脲(21g,276mmol)并使反应混合物升温至室温并继续搅拌2h。将反应混合物用水(2×400mL)和盐水(400mL)洗涤并将合并的有机层经Na2SO4干燥,过滤并小心地真空浓缩。通过快速柱色谱(硅胶,填充在CH2Cl2中的柱,然后戊烷/Et2O=20∶1→10∶1)纯化残余物生成呈无色液体的氯-酮3(13.8g,48%,经2个步骤)。3:1HNMR(500MHz,CDCl3):δ3.93(t,J=3.0Hz,1H),3.02(dd,J=18.6,9.0Hz,1H),2.62(dddd,J=16.5,9.2,2.9,1.1Hz,1H),2.24(dt,J=18.6,1.4Hz,1H),2.03(ddd,J=16.4,5.0,3.1Hz,1H),1.26(td,J=9.1,1.9Hz,1H),1.07(s,3H),0.95(td,J=9.2,5.0Hz,1H),0.85(s,3H)。实施例3:3的还原烷基化对三颈烧瓶装填无水THF(90mL)、二-叔丁基-联苯(DBB)(9.2g,34.7mmol,6.0当量)和新鲜切割的锂金属(200mg,28.9mmol,5.0当量)。将悬浮液在室温搅拌3h以得到深绿色溶液。在单独的烧瓶中,将氯-酮3(1.0g,5.79mmol,1.0当量)溶解于THF(29mL)中并冷却至-78℃。在30min内将LiDBB溶液通过套管加至3的溶液中直到持续绿色。缓慢加入碘甲烷(3.6mL,57.9mmol,10当量)并在-45℃继续搅拌5h。加入饱和NH4Cl水溶液(100mL)并将反应混合物升温至室温。分离有机层并将水层用Et2O(3×100mL)萃取。将合并的有机层经Na2SO4干燥,过滤并小心地在减压下浓缩。使粗产物通过快速柱色谱(硅胶,戊烷,然后戊烷/Et2O=80∶1→40∶1→20∶1→10∶1)纯化以得到呈浅黄色油状物的甲基酮4(353mg,40%)。4:1HNMR(600MHz,CDCl3):δ2.58(dd,J=18.3,8.6Hz,1H),2.23(qdd,J=7.3,5.0,2.7Hz,1H),2.09(dd,J=18.3,3.4Hz,1H),2.02(dddd,J=15.0,9.0,2.6,1.0Hz,1H),1.72(ddd,J=15.1,6.1,4.8Hz,1H),1.23(d,J=7.2Hz,3H),1.07(s,3H),0.93(s,3H),0.88-0.78(m,2H)。实施例4:4的羟醛反应在-78℃向4(62mg,0.41mmol,1.0当量)在0.8mLTHF中的溶液中加入LiHMDS(1M在THF中的溶液,101μL,0.49mmol,1.2当量)。在-78℃使混合物搅拌1小时,然后在15min内加入23(78mg,0.811mmol,2.0当量)在7mLTHF中的溶液。在-78℃使混合物搅拌3h,然后通过加入饱和NH4Cl水溶液(15mL)和EtOAc(20mL)淬灭。分离反应混合物并将水层用EtOAc(3×20mL)萃取。将合并的有机级分用硫酸钠干燥,过滤,蒸发,并通过柱色谱(己烷/EtOAc=20∶1→15∶1)纯化以提供呈无色油状物的5(76mg,75%)。5:1HNMR(400MHz,CDCl3):δ5.28-5.21(m,1H),4.73-4.62(m,2H),4.08(dd,J=2.7,1.4Hz,1H),3.76(dt,J=8.9,2.4Hz,1H),2.56-2.45(m,1H),2.26(qdd,J=7.3,5.8,2.8Hz,1H),2.07(dd,J=8.9,7.4Hz,1H),1.84(ddd,J=14.9,7.8,2.9Hz,1H),1.69(ddd,J=14.7,8.5,5.9Hz,1H),1.19-1.16(m,6H),1.15(s,3H),1.09(s,3H),0.86(q,J=8.5Hz,1H),0.40(dd,J=9.1,7.4Hz,1H)。实施例5:乙炔化物加至5在-78℃在氩气下向三甲基甲硅烷基乙炔(1.06g,10.8mmol,4.0当量)在20mLTHF中的溶液中加入2.1M在己烷中的n-BuLi溶液(5.1mL,10.8mmol,4.0当量)。在-78℃将溶液搅拌1小时,然后在-78℃在氩气下加至CeCl3(2.66g,10.8mmol,4.0当量)在50mLTHF中的悬浮液中。在-78℃将所得悬浮液剧烈搅拌1小时,然后逐滴加入5(670mg,2.7mmol,1.0当量)在10mLTHF中的溶液。在-78℃使悬浮液搅拌3h,然后通过加入水(200mL)和EtOAc(200mL)淬灭。分离各层并将水层用EtOAc(3×150mL)萃取。将合并的有机层经硫酸钠干燥,过滤并浓缩以得到呈非对映体的6∶1混合物的6(680mg)。6:1HNMR(600MHz,CDCl3):δ5.20(dt,J=8.2,6.7Hz,1H),4.75-4.70(m,2H),3.79(dt,J=7.2,4.6Hz,1H),3.44(d,J=4.8Hz,1H),2.91(ddq,J=10.6,6.6,2.0Hz,1H),2.79(s,1H),1.68(ddd,J=14.8,7.0,1.0Hz,1H),1.61-1.49(m,2H),1.18(d,J=7.0Hz,3H),1.06(d,J=6.5Hz,3H),1.04(s,3H),0.96(s,3H),0.79-0.64(m,1H),0.31(dd,J=9.5,4.9Hz,1H),0.17(s,9H)。实施例6:6的脱甲硅烷基化在0℃在氩气下向6(450mg,1.30mmol,1.0当量)在13mLTHF中的溶液中加入1.0M在THF中的TBAF(1.3mL,1.30mmol,1.0当量)。在10min后加入EtOAc(20mL)和H2O(20mL)并将有机层用H2O(5×20mL)洗涤。将有机层用硫酸钠干燥,过滤并浓缩以得到呈无色油状物的7(326mg,90%)。7:1HNMR(400MHz,CDCl3):δ5.19(dt,J=8.0,6.7Hz,1H),4.73(d,J=5.9Hz,2H),3.79(dt,J=7.0,4.9Hz,1H),3.14(d,J=5.4Hz,1H),2.94(s,1H),2.92-2.84(m,1H),2.66(s,1H),1.73-1.64(m,1H),1.60-1.51(m,2H),1.31(dq,J=12.2,6.6Hz,1H),1.17(d,J=6.9Hz,3H),1.08(d,J=6.6Hz,3H),1.04(s,3H),0.95(s,3H),0.72(t,J=8.7Hz,1H),0.30(dd,J=9.5,4.8Hz,1H)。实施例7:7的TBS保护在0℃向7(358mg,1.3mmol,1.0当量)和Et3N(2.7mL,19.5mmol,15当量)在8mLDCM中的溶液中加入TBSOTf(687mg,2.6mmol,2.0当量)。在30min后通过加入饱和NaHCO3水溶液(8mL)使反应淬灭。加入DCM(15mL),分离各层,并将水层用DCM(2×15mL)萃取。将合并的有机级分用硫酸钠干燥,过滤并浓缩以得到呈无色油状物的8(384mg,76%)。8:1HNMR(600MHz,CDCl3):δ5.35(dt,J=8.2,6.7Hz,1H),4.66(ddd,J=6.6,1.9,0.8Hz,2H),4.12(dd,J=5.2,3.4Hz,1H),3.31(dddt,J=8.8,7.0,5.2,1.9Hz,1H),3.08(s,1H),2.52(s,1H),1.70-1.57(m,2H),1.54(s,1H),1.11(d,J=6.9Hz,3H),1.05(d,J=6.6Hz,3H),1.04(s,3H),0.94(s,9H),0.92(s,3H),0.83(dd,J=9.3,5.2Hz,1H),0.67(dd,J=9.2,7.7Hz,1H),0.13(s,3H),0.10(s,3H)。实施例8:8的TMS保护在0℃在氩气下向8(120mg,0.25mmol,1.0当量)和Et3N(500μL)在2mLDCM中的溶液中加入TMSOTf(111.13mg,0.5mmol,2.0当量)。在30min后通过加入饱和NaHCO3水溶液(3mL)使反应淬灭。加入DCM(3mL),分离各层,并将水层用DCM(3×3mL)萃取。将合并的有机级分用硫酸钠干燥,过滤,浓缩,并将粗产物通过柱色谱(己烷)纯化以得到呈无色油状物的9(120mg,85%)。9:1HNMR(400MHz,CDCl3):δ5.52(dt,J=7.9,6.8Hz,1H),4.59(dd,J=6.8,2.0Hz,2H),4.44(d,J=2.9Hz,1H),3.01-2.85(m,1H),2.58(s,1H),1.58-1.50(m,1H),1.50-1.39(m,1H),1.36(dd,J=5.9,3.0Hz,1H),1.24-1.14(m,2H),1.13(d,J=7.1Hz,3H),1.01(d,J=6.8Hz,3H),1.00(s,3H),0.92(s,9H),0.87(s,3H),0.56(ddd,J=9.3,7.8,1.3Hz,1H),0.19(s,9H),0.08(s,3H),0.04(s,3H)。实施例9:9的Pauson-Khand反应对1L三颈烧瓶装填9(1.5g,3.25mmol,1.0当量)在无水对二甲苯(650mL)中的溶液并在超声处理下使用一氧化碳使溶液脱气。加入[RhCl(CO)2]2(126.3mg,0.325mmol,0.1当量)并将反应混合物转移至预热的油浴中并在140℃在1atm.CO下搅拌12h。将反应混合物冷却至室温并在减压下浓缩。将残余物通过快速柱色谱(硅胶,己烷然后己烷/Et2O=40∶1→30∶1→20∶1→10∶1)纯化生成呈浅棕色泡沫状物的10(1.15g,72%)。10:1HNMR(400MHz,CDCl3):δ6.06(s,1H),5.85(d,J=8.4Hz,1H),4.01(dd,J=7.8,3.1Hz,1H),3.19(d,J=19.3Hz,1H),2.96(d,J=19.3Hz,1H),2.58-2.48(m,1H),1.76-1.66(m,1H),1.63-1.51(m,3H),1.38(d,J=7.4Hz,3H),1.05(s,3H),1.04-1.03(m,1H),1.02(d,J=6.2Hz,3H),0.90(s,9H),0.86(s,3H),0.66(t,J=8.4Hz,1H),0.07(s,9H),-0.01(s,3H),-0.02(s,3H)。实施例10:甲基加至10在-78℃在5min内向10(1.32g,2.70mmol,1.0当量)在THF(52mL)中的溶液中加入甲基溴化镁(3.0M在Et2O中,2.7mL,8.10mmol,3.0当量)。将反应混合物在该温度下搅拌15min,然后升温至0℃。在15min后,将反应混合物冷却回-78℃并加入另一份MeMgBr(1.0mL,3mmol,1.11当量)。将反应混合物升温至-30℃并在15min后小心地用水(100mL)淬灭。将混合物用EtOAc(3×100mL)萃取并将合并的有机层经Na2SO4干燥,过滤并在减压下浓缩。粗产物通过快速柱色谱(硅胶,填充在DCM中的柱,然后己烷/EtOAc=10∶1→5∶1)纯化得到呈白色泡沫状物的11(1.08g,80%)和回收的10(240mg,18%)。11:1HNMR(400MHz,CDCl3):δ5.66(s,1H),5.52(d,J=8.3Hz,1H),4.00(dd,J=7.9,3.0Hz,1H),2.68(d,J=12.8Hz,1H),2.55(d,J=12.9Hz,1H),2.47-2.36(m,1H),1.66(dd,J=14.2,7.1Hz,1H),1.57-1.44(m,2H),1.38(t,J=7.8Hz,1H),1.31-1.27(m,6H),1.05-1.01(m,6H),1.00-0.95(m,1H),0.89(s,10H),0.84(s,3H),0.63-0.56(m,1H),0.11(s,9H),-0.02(s,6H)。实施例11:11的二羟基化向11(100mg,0.198mmol,1.0当量)在吡啶(4mL)中的溶液中加入呈新鲜制备的吡啶溶液(760μL的100mg/1mL溶液)的OsO4(76mg,0.297mmol,1.5当量)。使反应混合物在室温搅拌12h,然后通过加入饱和Na2SO3水溶液(20mL)淬灭。将反应混合物用EtOAc(3×10mL)萃取并将合并的有机层经Na2SO4干燥,过滤并真空浓缩。将粗锇酸酯溶解于THF(20mL)中并加入饱和Na2SO3水溶液(20mL)。将所得反应混合物剧烈搅拌24h,然后加入水(20mL)。将混合物用EtOAc(3×40mL)萃取并将合并的有机层经Na2SO4干燥、过滤并在减压下浓缩以得到粗二醇12,其不经进一步纯化立即使用。12:1HNMR(400MHz,CDCl3):δ5.79(s,1H),4.80(d,J=4.8Hz,1H),4.29(dd,J=8.0,5.3Hz,1H),2.82(pd,J=7.8,4.8Hz,1H),2.55(d,J=14.5Hz,1H),2.40(d,J=14.5Hz,1H),1.68(dd,J=14.8,6.8Hz,1H),1.52-1.46(m,4H),1.40(t,J=5.9Hz,1H),1.20-1.11(m,6H),1.05(s,3H),0.97-0.93(m,12H),0.64(d,J=6.7Hz,3H),0.20(s,9H),0.11(s,3H),0.10(s,3H)。实施例12:12的碳酸酯保护将粗品12溶解于DCM(6mL)中并加入N,N-羰基二咪唑(172mg,1.06mmol,5.0当量)和DMAP(2.6mg,21.2μmol,0.1当量)。将溶液在室温搅拌8h,然后通过加入饱和CuSO4水溶液(6mL)淬灭。分离各层并将水层用DCM(3×10mL)萃取。经合并的有机层经硫酸钠干燥、过滤并真空浓缩。将粗产物通过快速柱色谱(硅胶,填充在DCM中的柱,然后己烷/EtOAc=10∶1→5∶1)纯化得到呈白色固体的13(72mg,64%)。13:1HNMR(400MHz,CDCl3):δ5.79(s,1H),4.80(d,J=4.8Hz,1H),4.29(dd,J=8.0,5.3Hz,1H),2.82(pd,J=7.8,4.8Hz,1H),2.55(d,J=14.5Hz,1H),2.40(d,J=14.5Hz,1H),1.68(dd,J=14.8,6.8Hz,1H),1.52-1.46(m,4H),1.40(t,J=5.9Hz,1H),1.20-1.11(m,6H),1.05(s,3H),0.97-0.93(m,12H),0.64(d,J=6.7Hz,3H),0.20(s,9H),0.11(s,3H),0.10(s,3H)。实施例33:11的二羟基化-催化量的OsO4对25mL圆底烧瓶装填在丙酮/CH3CN/0.5M缓冲溶液(7mL,0.05M,5∶3∶2)中的化合物11(174mg,0.345mmol,1.0当量)、Me3NO.2H2O(383mg,3.45mmol,10当量)和DABCO(39mg,0.345mmol,1.0当量)。该缓冲溶液是通过以下方式制备:将柠檬酸(840mg)和NaHPO4(280mg)加入10mL蒸馏H2O的溶液中并在室温搅拌1分钟,由此通过pH试纸测试溶液的pH值是3。然后,将OsO4溶液(2.5重量%在叔丁醇中,0.17mL,0.017mmol,0.05当量)加至烧瓶中并在50℃剧烈搅拌22h,然后通过加入饱和Na2SO3水溶液(10mL)淬灭(在15h后,通过TLC每3h监测反应。如果起始材料停止转化,则使反应淬灭)。用乙醚(3×10mL)萃取反应混合物,并将合并的有机层经Na2SO4干燥,过滤并真空浓缩以得到粗品12(Rf=0.33(己烷/EtOAc=7∶3;茴香醛)。实施例34:12的碳酸酯保护将粗品11溶解于己烷(7mL,0.05M)中并加入N,N-羰基二咪唑(280mg,1.73mmol,5.0当量)。在室温将溶液搅拌20小时。通过将粗品溶液上样至快速柱色谱(硅胶,填充在己烷中的柱,然后己烷/EtOAc=20∶1→5∶1)来纯化粗产物得到呈白色泡沫状物的13(100mg,51%)和11(19mg,20%纯)。实施例13:13的频哪醇重排在-78℃向13(191mg,0.338mmol,1.0当量)在DCM(7mL)中的溶液中逐滴加入BF3Et2O(420μL,3.38mmol,10当量)。在此温度将反应混合物搅拌2min,然后升温至-50℃。在30min后,在-40℃加入Et3N/MeOH的1∶1混合物(3mL),将溶液搅拌2min并加入饱和NaHCO3水溶液(5mL)。将反应混合物升温至室温并用DCM(3×25mL)萃取。将合并的有机层经Na2SO4干燥,过滤并在减压下浓缩。通过快速柱色谱(硅胶,填充在DCM中的柱,然后己烷/EtOAc=20∶1→10∶1→5∶1)纯化粗产物得到呈白色泡沫状物的14(128mg,80%)。14:1HNMR(400MHz,CDCl3):δ5.65(s,1H),4.80(d,J=4.8Hz,1H),4.19(dd,J=7.6,4.1Hz,1H),3.20(d,J=17.8Hz,1H),2.81(pd,J=7.9,4.7Hz,1H),2.52(d,J=17.7Hz,1H),2.44-2.32(m,2H),1.88-1.80(m,2H),1.72(s,3H),1.09(s,3H),1.03(s,3H),1.01-0.95(m,1H),0.95(d,J=7.1Hz,3H),0.93(s,9H),0.83(d,J=8.0Hz,3H),0.68(q,J=8.1Hz,1H),0.10(s,3H),0.04(s,3H)。实施例14:14的烯丙基氧化将14(9.2mg,0.019mmol,1.0当量)溶解于0.6mL二噁烷中。加入SeO2(10mg,0.095mmol,5.0当量)并在环境气氛下将混合物加热至80℃,保持12h。冷却后,将固体NaHCO3加至反应混合物中并将粗混合物通过硅藻土塞过滤以获得粗品15。该物质通常不经进一步纯化便使用。15:1HNMR(400MHz,CDCl3):δ5.90(s,1H),4.80(d,J=4.6Hz,1H),4.21(dd,J=7.4,4.3Hz,1H),4.18(s,1H),2.83(ddq,J=11.9,7.6,3.7Hz,1H),2.53(d,J=17.4Hz,1H),2.40(dq,J=8.4,3.8,3.3Hz,1H),1.99-1.85(m,2H),1.84(dd,J=1.5,0.8Hz,3H),1.12(s,3H),1.04(s,3H),1.02-0.97(m,1H),0.96(d,J=7.0Hz,3H),0.94(s,9H),0.83(d,J=7.9Hz,3H),0.70(td,J=8.5,6.2Hz,1H),0.11(s,3H),0.06(s,3H)。实施例15:15的酰化将粗品15溶解于DCM(500μL)中。加入Ac2O(20μL,0.38mmol,20.0当量)和DMAP(5mg,0.019mmol,1.0当量)并将混合物搅拌30min。通过加入饱和CuSO4水溶液(500μL)使反应淬灭,分离各层,并将水层用DCM(3×500μL)洗涤。将合并的有机级分用硫酸钠干燥,过滤并浓缩以得到呈无色油状物的16(9mg,87%,粗品)。16:1HNMR(600MHz,CDCl3):δ6.14(d,J=1.9Hz,1H),5.18(s,1H),5.14(d,J=4.5Hz,1H),4.20(dd,J=7.5,4.1Hz,1H),2.84(pd,J=8.0,4.4Hz,1H),2.33(qt,J=7.1,3.5Hz,1H),2.26(dd,J=11.3,4.1Hz,1H),2.18(s,3H),1.85(dd,J=8.3,3.5Hz,2H),1.77(d,J=1.9Hz,3H),1.07(s,3H),1.04(s,3H),0.99(d,J=7.1Hz,3H),0.98-0.95(m,1H),0.93(s,9H),0.79(d,J=8.1Hz,3H),0.69(q,J=8.4Hz,1H),0.10(s,3H),0.05(d,J=3.1Hz,3H)。实施例16:16的甲硅烷基脱保护对塑料falcon管装填16(82mg,0.154mmol,1.0当量)和CH3CN(4.5mL)。加入47%HF水溶液(336μL,9.24mmol,60.0当量)并将混合物加热至50℃。在10h后,将反应冷却至室温,并通过缓慢加入饱和NaHCO3水溶液(10mL)淬灭。加入EtOAc(10mL),分离各层,并将水层用EtOAc(3×10mL)萃取。将合并的有机级分经硫酸钠干燥,过滤并真空浓缩。通过快速柱色谱(硅胶,填充在DCM中的柱,然后己烷/EtOAc=5∶1→2∶1→1∶1)来纯化粗产物,得到呈无色油状物的17(58mg,90%)。17:1HNMR(400MHz,CDCl3):δ6.07(s,1H),5.19-5.16(m,2H),4.17(dd,J=8.1,3.5Hz,1H),3.03(tt,J=8.2,4.1Hz,1H),2.72(d,J=10.9Hz,1H),2.48-2.29(m,2H),2.18(s,3H),1.91-1.84(m,2H),1.81-1.77(m,3H),1.09(s,3H),1.06(s,3H),1.00(d,J=7.1Hz,3H),0.96-0.91(m,1H),0.81(d,J=8.2Hz,3H),0.72(q,J=8.3Hz,1H)。实施例17:17的三氟甲磺酰化将17(2mg,0.0047mmol,1.0当量)溶解于吡啶(400μL)中。逐滴加入Tf2O(5μL,0.0235mmol,5.0当量)并将混合物加热至80℃。在1小时后将反应冷却并通过缓慢加入饱和NaHCO3水溶液(1mL)淬灭。加入EtOAc(1mL),分离各层,并将有机层用饱和CuSO4水溶液(3×1mL)洗涤。将有机层用硫酸钠干燥,过滤并浓缩以得到18,其不经进一步纯化立即使用。18:1HNMR(600MHz,CDCl3):δ6.13(s,1H),5.19-5.17(m,2H),5.15(dd,J=7.8,4.0Hz,1H),3.26(td,J=8.0,4.3Hz,1H),2.53-2.48(m,1H),2.43-2.38(m,1H),2.35(t,J=7.5Hz,1H),2.33-2.27(m,1H),2.19(s,3H),1.82-1.80(m,3H),1.09(s,3H),1.06(d,J=1.3Hz,3H),1.02(d,J=7.1Hz,3H),1.00-0.96(m,1H),0.95(d,J=8.0Hz,3H),0.79(t,J=7.9Hz,1H)。实施例18:三氟甲磺酸酯18的消除将粗品18溶解于甲苯(500μL)中。加入DBU(10μL,0.047mmol,10.0当量)并将混合物加热至110℃。在6h后,将反应冷却并通过加入饱和CuSO4水溶液(1mL)淬灭。分离各层并将水层用DCM(3×1mL)萃取。将合并的有机级分经硫酸钠干燥,过滤并蒸发以得到19,其不经进一步纯化而使用。19:1HNMR(600MHz,CDCl3):δ6.19(d,J=1.9Hz,1H),5.97-5.93(m,1H),5.44(s,1H),4.55(s,1H),3.53(d,J=9.2Hz,1H),3.50(t,J=6.0Hz,1H),2.78(s,1H),2.18(d,J=2.1Hz,3H),2.07(p,J=5.9Hz,1H),1.81(d,J=1.6Hz,3H),1.80(s,3H),1.06(s,6H),1.03(d,J=7.2Hz,3H),0.98-0.93(m,1H),0.71(dd,J=9.6,6.6Hz,1H)。实施例19:19的脱保护在环境气氛下将粗品19溶解于MeOH(500μL)中并加入K2CO3(1mg,0.0047mmol,10当量)。在15min后加入饱和NaHCO3水溶液(1mL)和DCM(1mL)。分离各层并将水层用DCM(3×1mL)萃取。将合并的有机级分用硫酸钠干燥并蒸发。将粗混合物通过制备型TLC(3∶1Et2O∶Hex)纯化以得到呈白色固体的20-脱氧巨大戟醇(20)(0.5mg,33%,经3个步骤)(对于NMR数据,参见Uemura等人,“Isolationandstructuresof20-deoxyingenolnewditerpene,derivativesandingenolderivativeobtainedfrom‘kansui’,”Tet.Lett.29:2527-2528,1974,出于所有目的通过引用整体并入本文)。实施例20:20的烯丙基氧化向20(4.9mg,0.015mmol,1.0当量)在二噁烷(500μL)和甲酸(250μL)中的溶液中加入SeO2(17mg,0.15mmol,10.0当量)。将悬浮液加热至80℃,保持2h,然后冷却并通过加入饱和NaHCO3水溶液(4mL)和Et2O(4mL)淬灭。去除水层并加入10%氢氧化钠(4mL)。将双相混合物剧烈摇晃并去除有机层。将水层用Et2O(2×4mL)萃取并将合并的有机层干燥并蒸发。通过柱色谱(1∶1DCM∶EtOAc)纯化粗产物以得到呈白色膜状物的巨大戟醇(21,3.6mg,70%)(对于描述巨大戟醇(21)的NMR数据,参见Appendio等人,“AnExpeditiousProcedurefortheIsolationofIngenolfromtheSeedsofEuphorbialathyris,”J.Nat.Prod.,62:76-79,1999,出于所有目的通过引用整体并入本文)。实施例21:22的IBX氧化对圆底烧瓶装填22(100mg,1.02mmol,1.0当量)在THF(4mL)中的溶液。加入IBX(571mg,2.04mmol,2.0当量),将烧瓶用黄色帽紧密密封并将所得悬浮液加热至80℃,保持1h。使悬浮液冷却下来并随后通过棉花塞过滤。将残余物用THF(2mL)洗涤且含有醛23(85mg,86%)的滤液不经进一步纯化便用于下一步骤(注意:反应的产率由使用三甲氧基苯作为内标的NMR确定)。23:1HNMR(400MHz,CDCl3):δ9.58(dd,J=1.7,0.5Hz,1H),5.23(q,J=6.7Hz,1H),4.85(ddd,J=6.7,3.1,0.5Hz,2H),3.06-2.96(m,1H),1.22(dd,J=7.0,0.5Hz,3H)。程序2:较短的方案-方案2用于获得化合物3的程序如上文在实施例1和2中所述。使化合物22转化为反应物化合物23基本上如上文在实施例21中所述进行。实施例22:对1L三颈烧瓶装填萘和新鲜蒸馏的THF(550mL)。向此溶液中加入新鲜切割的锂(1.54g,222mmol,6.0当量)。将混合物超声处理2.5h。对单独的1L三颈烧瓶装填3(6.39g,37mmol,1.0当量)在新鲜蒸馏的THF(160mL)中的溶液并冷却至-78℃。在40min内缓慢加入新鲜制备的Li-萘溶液直到反应混合物的深绿色持续约1min。在15min内加入HMPA(38mL)和碘甲烷(23mL,370mmol,10当量)在THF(50mL)中的溶液,并在-78℃将所得反应混合物搅拌1h。将含有反应混合物的烧瓶转移至水浴中(室温)并继续搅拌20min。然后,通过施加真空(约200托,保持15min)去除过量碘甲烷。将反应混合物冷却回-78℃,在15min内逐滴加入LiHMDS(46.3mL,46.3mmol,1.25当量)并继续搅拌1h。在30min内接着加入新鲜制备的醛23(2.0当量,参见下面23的制备)的溶液并在-78℃继续搅拌。在4h后,通过加入饱和NH4Cl水溶液(100mL)使反应淬灭。用EtOAc(3×500mL)萃取反应混合物并将合并的有机层经硫酸钠干燥,过滤并在减压下浓缩。通过快速柱色谱(硅胶,梯度:己烷,然后己烷/EtOAc=40∶1→30∶1→20∶1→10∶1)纯化残余物生成呈无色液体的5(4.08g,44%)。实施例23将酮5(3.0g,12.1mmol,1.0当量)在THF(120mL)中的溶液冷却至-78℃并逐滴加入乙炔基溴化镁(0.5M在THF中的溶液,121mL,60.4mmol,5.0当量)。将反应混合物升温至-10℃并继续搅拌2h。加入饱和NH4Cl水溶液(40mL)并将混合物用EtOAc(3×15mL)萃取。将合并的有机层经Na2SO4干燥,过滤并在减压下浓缩。通过快速柱色谱(硅胶,己烷/EtOAc=10∶1→5∶1)纯化粗产物得到呈不可分离的非对映体的10∶1混合物和无色油状物的醇7(2.69g,81%)。实施例24在0℃向7(2.69g,9.80mmol,1.0当量)在DCM(49mL)中的溶液中加入三乙胺(5.46mL,39.2mmol,4.0当量),然后逐滴加入TBSOTf(4.49mL,19.6mmol,2.0当量)。在30min后,通过TLC判断起始材料消耗,并且依次逐滴加入三乙胺(5.46mL,39.2mmol,4.0当量)和TMSOTf(3.5mL,19.6mmol,2.0当量)。在0℃将反应混合物搅拌1.5h,然后用饱和NaHCO3水溶液(50mL)淬灭。将混合物用DCM(3×50mL)萃取并将合并的有机层经Na2SO4干燥,过滤并在减压下浓缩。通过快速柱色谱(硅胶,己烷)纯化粗产物得到在冷却后固化呈无色粘性油状物的9(3.22g,71%)。使化合物9转化为化合物10且然后转化为化合物11、12、13和14基本如上文分别在实施例9至实施例13中所述进行。使化合物14转化为化合物16在下面的实施例中描述。实施例25向14(128mg,0.26mmol,1.0当量)在二噁烷(7.5mL)中的溶液中加入SeO2(144mg,1.3mmol,5.0当量)。将烧瓶用黄色帽密封并将悬浮液加热至80℃,保持14h。将悬浮液冷却至室温并加入吡啶(1.05mL,13mmol,50当量)、Ac2O(614μL,6.5mmol,25当量)和DMAP(3.2mg,0.026mmol,0.1当量)。将混合物搅拌45min,用EtOAc(20mL)稀释并通过硅藻土过滤。用饱和CuSO4水溶液(20mL)洗涤滤液并将合并的有机层经硫酸钠干燥,过滤和蒸发。通过快速柱色谱(硅胶,填充在DCM中的柱,然后己烷/EtOAc=20∶1→10∶1→5∶1)纯化粗产物得到呈橙色油状物的16(82mg,59%)。实施例26对塑料falcon管装填16(82mg,0.154mmol,1.0当量)和CH3CN(4.5mL)。加入47%HF水溶液(336μL,9.24mmol,60.0当量)并将混合物加热至50℃。在10h后使反应冷却至室温并通过缓慢加入饱和NaHCO3水溶液(10mL)淬灭。加入EtOAc(10mL),分离各层,并将水层用EtOAc(3×10mL)萃取。将合并的有机级分经硫酸钠干燥,过滤并真空浓缩。通过快速柱色谱(硅胶,填充在DCM中的柱,然后己烷/EtOAc=5∶1→2∶1→1∶1)纯化粗产物得到呈无色油状物的17(58mg,90%)。实施例27向17(9.0mg,0.0215mmol,1.0当量)和DMAP(0.26mg,0.00215mmol,0.1当量)在吡啶(1mL)中的溶液中加入Tf2O(11μL,0.0645mmol,3.0当量)。使溶液升温至80℃,保持30min。向溶液中加入DBU(19μL,0.129mmol,6.0当量)。将溶液加热至110℃,保持30min。使混合物冷却并加入10%氢氧化钠水溶液(200μL)。将混合物搅拌30min,然后通过加入3mL饱和NaHCO3水溶液和3mLEtOAc淬灭。去除水层并将有机层用饱和CuSO4水溶液(2×3mL)洗涤。将有机层干燥并蒸发以得到粗品20。通过柱色谱(50∶1DCM/MeOH)纯化粗材料以得到20-脱氧巨大戟醇(20,2.0mg,28%)。实施例28向20(4.9mg,0.015mmol,1.0当量)在二噁烷(500μL)和甲酸(250μL)中的溶液中加入SeO2(17mg,0.15mmol,10.0当量)。使悬浮液加热至80℃,保持2h,然后冷却并通过加入饱和NaHCO3水溶液(4mL)和Et2O(4mL)淬灭。去除水层并加入10%氢氧化钠(4mL)。使双相混合物剧烈摇晃并去除有机层。将水层用Et2O(2×4mL)萃取并将合并的有机层干燥并蒸发。通过柱色谱(1∶1DCM∶EtOAc)纯化粗产物以得到呈白色膜状物的巨大戟醇(21,3.6mg,70%)。替代程序:使10转化为26-方案4实施例29使10(30mg,0.061mmol)溶解于水(1.0ml)和叔丁醇(1.0ml)的混合物中。加入OsO4在叔丁醇中的溶液(200μl,0.058M,0.006mmol,0.1当量)。加入N-甲基吗啉-N-氧化物(NMO)(14mg,0.123mmol,2.0当量)和柠檬酸(24mg,0.123mmol,2.0当量)。在室温下使混合物搅拌16h。加入饱和Na2SO3水溶液(5ml)并将混合物用乙酸乙酯(3×5ml)萃取。将合并的有机物干燥(Na2SO4),过滤并将溶剂蒸发。使残余物经受快速色谱(戊烷至3∶1戊烷/EtOAc)生成白色晶体24(25mg,78%)。24:1HNMR(500MHz,CDCl3):δ6.19(s,1H),3.82(d,J=1.7Hz,1H),3.34(d,J=10.0Hz,1H),3.14(d,J=17.1Hz,1H),2.71(s,1H),2.55(d,J=17.1Hz,1H),2.18(s,1H),1.99-1.89(m,1H),1.86(m,1H),1.72-1.65(m,1H),1.60(m,1H),1.15(d,J=6.9Hz,3H),1.10(s,3H),0.97(s,3H),0.85(s,9H),0.75-0.72(m,2H),0.71(d,J=6.9Hz,3H),0.27(s,9H),0.16(s,3H),0.10(s,3H)。实施例30向24(80mg,0.15mmol,1.0当量)在CH2Cl2(3mL)中的溶液中加入CDI(50mg,0.30mmol,2.0当量)和DMAP(2mg,0.015mmol,0.1当量)。使溶液在室温搅拌3小时。此外加入CDI(50mg,0.30mmol,2.0当量)和DMAP(2mg,0.015mmol,0.1当量)并继续搅拌3小时。通过加入饱和CuSO4水溶液(4mL)使反应淬灭。去除有机层并将水层用CH2Cl2(3×4mL)萃取。将合并的有机级分用Na2SO4干燥,过滤并浓缩。通过柱色谱(10∶1己烷/EtOAc)纯化粗产物以得到呈白色泡沫状物的45(67mg,80%)。45:1H-NMR(600MHz,CDCl3)δ6.31(s,1H),4.81(d,J=5.1Hz,1H),4.35(dd,J=8.1,5.1Hz,1H),3.16(d,J=18.2Hz,1H),2.90(pd,J=7.9,5.1Hz,1H),2.79(d,J=18.2Hz,1H),1.79-1.72(m,1H),1.58-1.50(m,1H),1.46(dd,J=6.4,5.1Hz,1H),1.42-1.33(m,1H),1.17(dd,J=9.7,6.4Hz,1H),1.08(s,3H),0.98(s,3H),0.97-0.93(m,12H),0.70(t,J=8.9Hz,1H),0.65(d,J=6.5Hz,3H),0.22(s,9H),0.13(s,3H),0.11(s,3H);有机金属甲基化试剂(诸如例如MeMgBr、MeMgCl或MeMgI)可与化合物45或化合物25的酮反应以获得叔醇26。替代程序:使14转化为21-方案5实施例31在0℃向塑料falcon管中的在THF(0.66mL,0.1M)中的化合物14(31mg,0.065mmol,1.0当量)中逐滴加入48%HF水溶液(0.33mL,9.10mmol,140当量)。将反应转移至室温并搅拌12h,然后在室温缓慢加入饱和NaHCO3水溶液(10mL)以使反应淬灭。加入EtOAc(5mL),分离各层,并将水层用EtOAc(3×5mL)萃取。将合并的有机级分经Na2SO4干燥,过滤并真空浓缩。通过快速柱色谱(硅胶,填充在己烷中的柱,然后己烷/EtOAc=9∶1→8∶2→1∶1)纯化粗产物得到呈棕色油状物的27(20mg,85%)(Rf=0.44(己烷/EtOAc=5∶5;茴香醛))。1HNMR(600MHz,CDCl3):δ5.53(s,1H),4.77(d,J=4.8Hz,1H),4.13-4.12(m,1H),3.13(d,J=17.8Hz,1H),2.95-2.88(m,1H),2.64(s,1H),2.57(d,J=17.9Hz,1H),2.49-2.43(m,1H),1.87(t,J=6.0Hz,1H),1.75(s,3H),1.12(s,3H),1.05(s,3H),0.95(d,J=6.9Hz,3H),0.71(q,J=7.1Hz,1H)。13CNMR(151MHz,CDCl3):δ211.0,152.9,135.7,123.5,93.5,92.8,76.4,67.9,53.6,47.1,38.6,37.4,30.9,29.7,28.7,22.9,22.1,17.1,16.6,14.9,10.5。实施例32在0℃将在CH2Cl2(0.10mL)中的Tf2O(7.4μL,0.0439mmol,1.5当量)逐滴加至在CH2Cl2(0.70mL)中的化合物27(10.5mg,0.0292mmol,1.0当量)和DMAP(17.8mg,0.146mmol,5.0当量)中。将反应转移至室温并搅拌20分钟以得到紫色溶液,然后通过加入冰水(1mL)淬灭并分离各层。用二乙基醚(3×3mL)萃取水层。将合并的有机级分经Na2SO4干燥,过滤并真空浓缩。通过短硅胶垫(己烷/EtOAc=8∶2作为洗脱液)纯化所得残余物以得到呈黄色油状物的所需三氟甲磺酸酯(Rf=0.44(己烷/EtOAc=7∶3;茴香醛))。向三氟甲磺酸酯在甲苯(0.7mL)中的溶液中加入DMAP(17.8mg,0.146mmol,5.0当量)。在110℃将反应混合物搅拌3h,然后在室温加入冰水(1mL)并分离各层。将水层用二乙基醚(3×3mL)萃取。将合并的有机级分经Na2SO4干燥,过滤并真空浓缩。通过快速柱色谱(硅胶,填充在己烷中的柱,然后己烷/EtOAc=9∶1)纯化粗产物得到呈黄色油状物的化合物28(5.2mg,52%)(Rf=0.49(己烷/EtOAc=7∶3;茴香醛))。1HNMR(600MHz,CDCl3):δ5.95(dd,J=5.8,1.6Hz,1H),5.69(s,1H),4.57(s,1H),3.71-3.68(m,1H),2.99(d,J=16.4Hz,1H),2.59(d,J=16.4Hz,1H),2.50-2.48(m,1H),2.10(qd,J=8.8,3.1Hz,1H),1.85-1.81(m,1H),1.79(t,J=1.7Hz,3H),1.77(s,3H),1.07(s,3H),1.05(s,3H),0.98(d,J=7.0Hz,3H),0.72-0.68(m,1H)。13CNMR(151MHz,CDCl3):δ203.9,153.7,135.3,133.4,128.1,124.8,93.7,90.3,72.2,49.0,43.5,36.7,30.7,29.7,28.5,24.2,23.0,22.1,17.0,16.8,15.3。应理解上述描述旨在为说明性的而非限制性的。本领域技术人员在阅读上述描述后将易知本发明的许多变化。本发明的范围应参考以下随附权利要求连同所述权利要求所赋予权利的等效物的全部范围来确定。本文引用许多专利和出版物以更充分描述和公开本发明的方法和化合物,以及它们所属领域的状况。为了描述背景、已知方法,并且具体来说,为了提供关于本发明方法和组合物的实践的另外的细节,本文引用的参考文献、出版物、专利、书籍、手册和其它材料出于所有目的通过引用整体全部并入本文,其程度如同每个单独的参考物特定地且单独地表示为通过引用并入一样。条款鉴于本发明,本发明人已特别提供:1.一种从式5化合物合成巨大戟醇(21)的方法,其包括:使所述式5化合物与炔基化试剂接触以形成式31化合物其中Q是炔烃保护基团,并且在一个或多个步骤中使化合物31转化为巨大戟醇。2.根据条款1所述的方法,其还包括使巨大戟醇21转化为巨大戟醇甲基丁烯酸酯293.根据条款1所述的方法,其中所述炔基化试剂是三甲基甲硅烷基乙炔化物。4.根据条款1所述的方法,其包括制备至少一种选自以下的中间体:式4化合物、式34化合物、式35化合物、式37化合物和式38化合物其中P1和P2各自独立地为羟基保护基团,并且其中R是任何二醇保护基团。5.根据条款1所述的方法,其还包括使式33化合物转化为式34化合物其中P1和P2各自独立地为羟基保护基团。6.根据条款5所述的方法,其中使所述式33化合物转化为所述式34化合物包括使所述式33化合物与铑(I)催化剂一起孵育。7.根据条款6所述的方法,其中所述铑(I)催化剂是选自以下的二羰基氯化铑(I)二聚体:([RhCl(CO)2]2)、[RhCl(COD)]2、[RhCl(CO)(dppp)]2和[Rh(dppp)2]Cl。8.根据条款6所述的方法,其中使所述式33化合物孵育包括使所述式33化合物加热至高于140℃的温度。9.根据条款8所述的方法,其还包括使所述式33化合物溶解于高沸点溶剂。10.根据条款9所述的方法,其中所述高沸点溶剂是芳族的。11.根据条款10所述的方法,其中所述高沸点芳族溶剂选自:二甲苯、甲苯、均三甲苯和对二氯苯。12.根据条款4所述的方法,其还包括使式式37化合物转化为式38化合物。13.根据条款12所述的方法,其中使所述式37化合物转化为所述式38化合物通过频哪醇重排发生并且包括使所述式37化合物在至少约-50℃至-78℃或更低的温度下孵育。14.根据条款12所述的方法,其还包括至少在约-78℃或更低温度通过加入碳酸氢盐使反应淬灭。15.根据条款12所述的方法,其还包括使所述式37化合物溶解于选自以下的一种或多种溶剂:二氯甲烷、二氯乙烷、乙腈、和其混合物。16.根据条款12所述的方法,其还包括使所述式38化合物在中性溶液中加热至室温以避免暴露于酸。17.根据条款12所述的方法,其还包括使所述式37化合物与BF3·Et2O复合物接触。18.根据条款17所述的方法,其中BF3·Et2O以约10.0摩尔当量的量存在。19.根据条款1所述的方法,其还包括使(+)-3-蒈烯(1)转化为式4化合物20.根据条款19所述的方法,其中使所述式1化合物转化为所述式4化合物通过一个或多个式2和/或3中间体进行:21.根据条款20所述的方法,其还包括使所述式1化合物氯化。22.根据条款20所述的方法,其还包括使所述式2化合物暴露于臭氧以生成所述式3化合物。23.根据条款20所述的方法,其还包括使所述式3化合物还原烷基化以生成所述式4化合物。24.根据条款23所述的方法,其还包括使所述式3化合物在-78℃或更低的温度下还原,然后在-40℃或更低的温度下烷基化。25.根据条款24所述的方法,其中还原包括使所述式3化合物在萘锂溶液中孵育以形成还原的化合物,并且烷基化包括使所述还原的化合物与碘甲烷一起孵育。26.一种合成巨大戟醇(21)的方法,其包括:(a)使式1化合物氯化以形成式2化合物:(b)使所述式2化合物进行臭氧分解以形成式3化合物:(c)使3还原烷基化以形成式4化合物:(d)从所述式4化合物形成式5的醇:(e)通过将乙炔化物加至所述式5化合物形成式31化合物:(f)使所述式31化合物脱保护以形成式7化合物:(g)保护所述式7化合物以形成式32化合物:(h)保护所述式32化合物以形成式33化合物:(i)使所述式33化合物环化以形成式34化合物:(j)使所述式34化合物甲基化以形成式35化合物:(k)使所述式35化合物二羟基化以形成式36化合物:(l)保护所述式36化合物以形成式37化合物:(m)进行所述式37化合物的频哪醇重排以形成式38化合物:(n)使所述式38化合物氧化以形成式39化合物:(o)保护所述式39化合物以形成式40化合物:(p)使所述式40化合物脱保护以形成式41化合物:(q)用羟基活化基团使所述式41化合物活化以形成式42化合物:(r)消除所述式42化合物的活化羟基以形成式43化合物:(s)使所述式43化合物脱保护以形成式20化合物:以及(t)使所述式20化合物氧化以形成所述式21化合物,其中步骤(d)包括使式23的试剂与所述式4化合物一起孵育:其中P1、P2和P3各自独立地为羟基保护基团,Q是炔烃保护基团,L是羟基活化基团衍生物,并且R是二醇保护基团。27.根据条款26所述的方法,其中步骤(e)和(f)在单个反应容器中通过使用套叠反应进行。28.根据条款26所述的方法,其中步骤(g)和(h)在单个反应容器中通过使用套叠反应进行。29.根据条款26所述的方法,其中步骤(n)和(o)在单个反应容器中通过使用套叠反应进行。30.根据条款26所述的方法,其中步骤(q)、(r)和/或(s)中的一个或多个在单个反应容器中通过使用套叠反应进行。31.根据条款26所述的方法,其中步骤(k)和(l)在单个反应容器中通过使用套叠反应进行。32.根据条款26所述的方法,其中步骤(a)和(b)在单个反应容器中通过使用套叠反应进行。33.根据条款26所述的方法,其中在步骤(a)、(b)、(e)、(f)、(g)、(h)、(k)、(l)、(n)、(o)、(q)、(r)和/或(s)中的一个或多个在单个反应容器中通过使用套叠反应进行。34.根据条款26所述的方法,其还包括:(u)使所述式21化合物转化为式29化合物以形成巨大戟醇-3-当归酸酯:35.根据条款26所述的方法,其中所述二醇保护基团选自以下衍生物:缩酮、缩醛、原酸酯、双缩醛、甲硅烷基、环状碳酸酯和环状硼酸酯。36.一种合成巨大戟醇(21)的方法,其包括:从化合物43去除保护基团以生成20-脱氧巨大戟醇(20):并且使20-脱氧巨大戟醇(20)氧化以得到巨大戟醇(21):其中R是二醇保护基团,并且P3是羟基保护基团。37.根据条款36所述的方法,其还包括通过消除-OL使化合物42转化以形成化合物43:其中L是羟基活化基团,并且R是二醇保护基团。38.一种从化合物7合成化合物34的方法,其包括:保护化合物7羟基部分以生成化合物33并且通过使化合物33与选自([RhCl(CO)2]2)、[RhCl(COD)]2、[RhCl(CO)(dppp)]2和[Rh(dppp)2]Cl的二羰基氯化铑(I)二聚体一起孵育使化合物33环化,以生成化合物34:其中P1和P2各自独立地为羟基保护基团。39.一种从化合物34合成化合物44的方法,其包括:使化合物34与格氏试剂XMgBr一起孵育以产生化合物44其中P1和P2各自独立地为羟基保护基团并且X是烷基。40.一种从化合物37合成化合物38的方法,其包括:在还原条件下使化合物37与路易斯酸一起孵育,以生成化合物38其中P1和P2各自独立地为羟基保护基团并且R是二醇保护基团。41.根据条款40所述的方法,其中所述路易斯酸是BF3·Et2O。42.一种合成巨大戟醇的方法,其包括根据条款37、38和40所述的方法,并且其还包括:使化合物35氧化并保护以生成化合物37,其中P1和P2各自独立地为羟基保护基团,并且R是二醇保护基团。43.一种化合物,其选自:其中P1、P2和P3各自独立地为羟基保护基团,Q是炔烃保护基团,L是羟基活化基团,并且R是二醇保护基团。44.根据条款43所述的化合物,其为化合物5。45.根据条款43所述的化合物,其为化合物7。46.根据条款43所述的化合物,其为化合物31。47.根据条款43所述的化合物,其为化合物32。48.根据条款43所述的化合物,其为化合物33。49.根据条款43所述的化合物,其为化合物34。50.根据条款43所述的化合物,其为化合物35。51.根据条款43所述的化合物,其为化合物36。52.根据条款43所述的化合物,其为化合物37。53.根据条款43所述的化合物,其为化合物38。54.根据条款43所述的化合物,其为化合物39。55.根据条款43所述的化合物,其为化合物40。56.根据条款43所述的化合物,其为化合物41。57.根据条款43所述的化合物,其为化合物42。58.根据条款43所述的化合物,其为化合物43。59.一种化合物,其选自:60.根据条款59所述的化合物,其为化合物8。61.根据条款59所述的化合物,其为化合物9。62.根据条款59所述的化合物,其为化合物10。63.根据条款59所述的化合物,其为化合物11。64.根据条款59所述的化合物,其为化合物12。65.根据条款59所述的化合物,其为化合物13。66.根据条款59所述的化合物,其为化合物14。67.根据条款59所述的化合物,其为化合物15。68.根据条款59所述的化合物,其为化合物16。69.根据条款59所述的化合物,其为化合物17。70.根据条款59所述的化合物,其为化合物18。71.一种从式5化合物合成巨大戟醇(21)的方法,其包括:使所述式5化合物与炔基化试剂接触以形成式31化合物其中Q是炔烃保护基团或氢,并且在一个或多个步骤中使化合物31转化为巨大戟醇。72.根据条款71所述的方法,其还包括使巨大戟醇21转化为巨大戟醇甲基丁烯酸酯2973.根据条款71-72中任一项所述的方法,其中所述炔基化试剂是三甲基甲硅烷基乙炔化物。74.根据条款71-22中任一项所述的方法,其中Q是氢。75.根据条款71-72或74中任一项所述的方法,其中所述炔基化试剂是乙炔基溴化镁。76.根据条款71-75中任一项所述的方法,其包括制备至少一种选自以下的中间体:式4化合物、式33化合物、式34化合物、式37化合物和式38化合物其中P1和P2各自独立地为羟基保护基团,并且其中R是任何二醇保护基团。77.根据条款76所述的方法,其还包括使式33化合物转化为式34化合物其中P1和P2各自独立地为羟基保护基团。78.根据条款77所述的方法,其中使所述式33化合物转化为所述式34化合物包括使所述式33化合物与铑(I)催化剂一起孵育。79.根据条款78所述的方法,其中所述铑(I)催化剂是选自以下的二羰基氯化铑(I)二聚体:([RhCl(CO)2]2)、[RhCl(COD)]2、[RhCl(CO)(dppp)]2和[Rh(dppp)2]Cl。80.根据条款78-79中任一项所述的方法,其中孵育所述式33化合物包括使所述式33化合物加热至高于140℃的温度。81.根据条款76所述的方法,其还包括使式式37化合物转化为式38化合物。82.根据权利要求81所述的方法,其中使所述式37化合物转化为所述式38化合物通过频哪醇重排发生并且包括使所述式37化合物在至少约-50℃至-78℃或更低的温度下孵育。83.根据条款81-82中任一项所述的方法,其还包括使所述式37化合物与BF3·Et2O复合物接触。84.根据权利要求71-83中任一项所述的方法,其还包括使(+)-3-蒈烯(1)转化为式4化合物85.根据权利要求84所述的方法,其中使所述式1化合物转化为所述式4化合物通过一个或多个式2和/或3中间体进行:86.一种合成巨大戟醇(21)的方法,其包括:(a)使式1化合物氯化以形成式2化合物:(b)使所述式2化合物进行臭氧分解以形成式3化合物:(c)使3还原烷基化以形成式4化合物:(d)从所述式4化合物形成式5的醇:(e)通过将乙炔化物加至所述式5化合物形成式31化合物:(f)当Q不是氢时使所述式31化合物脱保护,以形成式7化合物:(g)保护所述式7化合物以形成式32化合物:(h)保护所述式32化合物以形成式33化合物:(i)使所述式33化合物环化以形成式34化合物:(j)使所述式34化合物甲基化以形成式35化合物:(k)使所述式35化合物二羟基化以形成式36化合物:(1)保护所述式36化合物以形成式37化合物:(m)进行所述式37化合物的频哪醇重排以形成式38化合物:(n)使所述式38化合物氧化以形成式39化合物:(o)保护所述式39化合物以形成式40化合物:(p)使所述式40化合物脱保护以形成式41化合物:(q)用羟基活化基团使所述式41化合物活化以形成式42化合物:(r)消除所述式42化合物的活化羟基以形成式43化合物:(s)使所述式43化合物脱保护以形成式20化合物:并且(t)使所述式20化合物氧化以形成所述式21化合物,其中步骤(d)包括使式23的试剂与所述式4化合物一起孵育:其中P1、P2和P3各自独立地为羟基保护基团,Q是炔烃保护基团或氢,L是羟基活化基团衍生物,并且R是二醇保护基团。87.根据条款86所述的方法,其中在步骤(a)、(b)、(e)、(f)、(g)、(h)、(k)、(l)、(n)、(o)、(q)、(r)和/或(s)中的一个或多个在单个反应容器中通过使用套叠反应进行。88.根据条款86-87中任一项所述的方法,其还包括:(u)使所述式21化合物转化为式29化合物以形成巨大戟醇-3-当归酸酯:89.一种从化合物35合成化合物36的方法,其包括:使化合物35与催化量的OsO4一起孵育以产生化合物36。其中P1和P2各自独立地为羟基保护基团。90.根据条款89所述的方法,其包括:在氧化剂存在下并在缓冲液存在下使化合物35与催化量的OsO4一起孵育以产生化合物36。91.据权利要求89-90中任一项所述的方法,其中所述氧化剂选自三甲胺-N-氧化物、N-甲基吗啉-N-氧化物和叔丁基过氧化氢。92.根据权利要求90-91中任一项所述的方法,其中所述缓冲液的pH在pH1-pH6内。93.根据条款90-92中任一项所述的方法,其中所述缓冲液包含酸或酸的盐、或其混合物,所述酸选自柠檬酸、磷酸和乙酸。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种丙辛吲哚盐酸盐药物中间体丙辛吲哚的合成方法与制造工艺
- 一种吲哚洛尔药物中间体(一)‑4‑(2‑羟基‑3‑异丙氨基丙氧)吲哚的合成方法与制造工艺
- 依替米贝的中间体及其合成方法与依替米贝的合成方法与制造工艺
- 一种白消安药物中间体1,4‑双甲基磺酸丁二酯的合成方法与制造工艺
- 一种塞利洛尔药物中间体3‑(4‑乙氧基苯基)‑1,1‑二乙基脲的合成方法与制造工艺
- 一种羟基保泰松药物中间体4‑羟基偶氮苯的合成方法与制造工艺
- 一种甲氧卡那霉素药物中间体γ‑氨基‑α‑羟基丁酸的合成方法与制造工艺
- 一种非那西丁药物中间体对硝基苯乙醚的合成方法与制造工艺
- 一种间尼索地平药物中间体乙酰乙酸异丁酯的合成方法与制造工艺
- 一种甲氧苄啶药物中间体3,4,5—三甲氧基苯甲酸甲酯的合成方法与制造工艺