罗汉果醇合成途径中萜类化合物及其糖基化产物的合成方法与流程
本发明涉及生物
技术领域:
,具体涉及罗汉果醇合成路径中三种萜类化合物及其糖基化产物的合成方法。即运用含有葫芦烷二烯醇合成酶和细胞色素P450的重组酿酒酵母菌株,以葡萄糖为底物合成三种萜类化合物,这三种萜类化合物经质谱和核磁鉴定分别为11-羟基-葫芦烷二烯醇,11-氧-葫芦烷二烯醇,11-氧-24,25-环氧-葫芦烷二烯醇;这三种萜类化合物进一步经糖基化合成多种糖基化产物。
背景技术:
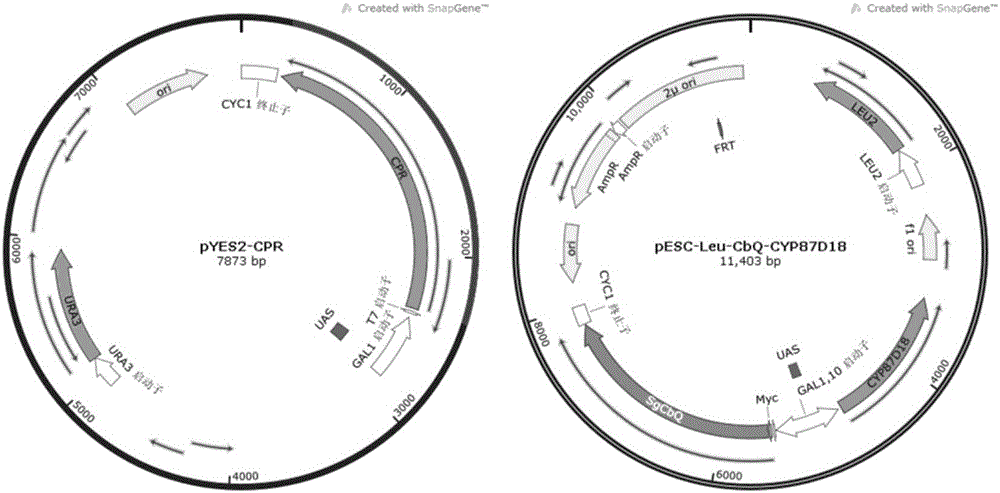
:罗汉果(Siraitiagrosvenorii)是我国所特有的珍贵药用植物,主要分布于我国广西地区,具有止咳润肺、化痰补血、润肠通便、祛瘀等功能(IndraPrakashandVenkataSaiPrakashChaturvedula.AdditionalnewminorcucurbitaneglycosidesfromSiraitiagrosvenorii.Molecules.2014.19:3669-3680),已被卫生部和中医药管理局列入第一批“药食同源品种名单”。罗汉果提取物主要成分为罗汉果甜甙,是一种高甜度、低能量的天然甜味剂,同时具有降血糖、抗氧化、抗癌、抗病毒等作用可广泛应用于营养保健品、食品、药品等行业中(Chun-HuiChiu,ReubenWang,Cho-ChingLee,Yi-ChenLo,Ting-JangLu.BiotransformationofmogrosidesfromSiraitiagrosvenoriiSwinglebySaccharomycescerevisiae.Journalofagriculturalandfoodchemistry.2013.61:7127-7134)。在罗汉果甜甙中,四种三萜类化合物含量较多,分别为罗汉果甙V,罗汉果甙Ⅵ,赛门甙I,11-氧-罗汉果甙;此外,还有一些三萜类化合物具有很重要的功能。目前罗汉果甜甙主要从罗汉果中提取,受种植条件和低提取率的影响,罗汉果甜甙远未达到市场需求。随着代谢工程和合成生物学技术的发展,微生物发酵法合成萜类化合物已被广泛研究,一些化合物如青蒿素,紫杉醇已经可以通过微生物发酵方式规模化合成。针对罗汉果甜甙的生物合成路径,已有文献报道葫芦烷二烯醇合成酶催化三萜骨架2,3氧化角鲨烯合成葫芦烷二烯醇,后者经三步P450氧化获得罗汉果醇,进一步经C-3和C-24糖基化得到罗汉果甜甙(QiTang,XiaojunMa,ChangmingMo,IainWWilson,CaiSong,HuanZhao,YanfangYang,WeiFu,DeyouQiu.AnefficientapproachtofindingSiraitiagrosvenoriitriterpenebiosyntheticgenesbyRNA-seqanddigitalgeneexpressionanalysis.BMCGenomics2011.12:343)。目前经2,3-氧化角鲨烯合成葫芦烷二烯醇和经罗汉果醇糖基化合成罗汉果甜甙这两部分合成路径已比较清晰,相关酶已有报道,例如采用来源于拟南芥的糖基转移酶催化罗汉果醇合成罗汉果甜甙I(DaiL,LiuC,ZhuY,etal.FunctionalcharacterizationofcucurbitadienolsynthaseandtriterpeneglycosyltransferaseinvolvedinbiosynthesisofmogrosidesfromSiraitiagrosvenorii.PlantandCellPhysiology.2015.YaoquanLiu,JungYeopLee,MonikaKhare.Methodsandmaterialsforenzymaticsynthesisofmogrosidecompounds.US20140308698A1.);但是催化葫芦烷二烯醇合成罗汉果醇的细胞色素P450报道很少,比较结构发现,葫芦烷二烯醇需要经C-11羟基化或者氧化,C-24和C-25羟基化才能得到罗汉果醇,有报道提出了葫芦烷二烯醇合成罗汉果醇可能的合成路线,但并未进行准确验证(YaoquanLiu,JorgenHansen,JensHoughton-larsen,MuthuswamyPanchapagesaMurali,SathishKumar,NinaNicolineRasmussen.Methodsandmaterialsforbiosynthesisofmogrosidecompounds.US20150064743A1)。葫芦烷二烯醇经P450单氧化酶催化C-11羟基化后生成C-11-羟基-葫芦烷二烯醇,如此该化合物可经糖基化酶修饰获得C-3或者C-11糖基化产物。以此类推,葫芦烷二烯醇催化获得罗汉果醇过程中,理论上所产生的羟基均可能经糖基化合成新的产物。因此探究和确定葫芦烷二烯醇合成罗汉果醇路径中的中间代谢产物,并对其糖基化获得新的产物是本发明的一个中心思路。技术实现要素:本发明的目的之一是提供由葫芦烷二烯醇合成罗汉果醇路径中三种三萜类化合物的合成方法。具体是将来源于Siraitiagrosvenorii的细胞色素P450基因CYP87D18、葫芦烷二烯醇合成酶CbQ和来源于Arabidopsisthaliana的细胞色素还原酶(CPR)酶基因引入酿酒酵母BY4741中,获得重组酿酒酵母菌株SY2;所得重组菌株SY2以葡萄糖为底物合成三种三萜类化合物,这三种化合物经质谱和核磁验证确定为11-氧-葫芦烷二烯醇、11-羟基-葫芦烷二烯醇、11-氧-24,25-环氧-葫芦烷二烯醇。本发明的目的之二是提出了由葫芦烷二烯醇合成罗汉果醇的代谢途径。具体是葫芦烷二烯醇经细胞色素P450CYP87D18催化首先合成11-氧-葫芦烷二烯醇,后者经P450酶CYP87D18进一步催化合成11-羟基-葫芦烷二烯醇和11-氧-24,25-环氧-葫芦烷二烯醇,11-羟基-葫芦烷二烯醇可经Siraitiagrosvenorii中其他种类的P450氧化酶催化在C-24和C-25分别羟化合成罗汉果醇;11-氧-24,25-环氧-葫芦烷二烯醇可经Siraitiagrosvenorii中其他种类的环氧化物酶(Epoxidehydrolase)合成罗汉果醇。该合成路径的提出对于准确确定葫芦烷二烯醇合成罗汉果醇合成路径以及微生物发酵方法合成相关中间产物具有重要意义。本发明的目的之三是提出三萜类化合物11-氧-葫芦烷二烯醇、11-羟基-葫芦烷二烯醇、11-氧-24,25-环氧-葫芦烷二烯醇经糖基转移酶催化合成新产物的思路。具体包括下面几个方面:首先,经重组酿酒酵母菌株SY2发酵得到的三萜类产物11-羟基-葫芦烷二烯醇可以经糖基转移酶催化获得C-3糖基化,C-11糖基化,或C-3和C-11同时糖基化的产物,糖基化的葡萄糖可以是一个或者多个,如图1所示。其次,经重组酿酒酵母菌株SY2发酵得到的三萜类产物11-氧-葫芦烷二烯醇可以经糖基转移酶催化获得C-3糖基化产物,糖基化的葡萄糖可以是一个或者多个,如图1所示。再次,经重组酿酒酵母菌株SY2发酵得到的三萜类产物11-氧-24,25-环氧-葫芦烷二烯醇可以经糖基转移酶催化获得C-3糖基化产物,糖基化的葡萄糖可以是一个或者多个,如图1所示。该思路的提出有助于开发更多葫芦烷类糖基化产物,这些产物具有重要的生物活性和生理功能;同时,通过糖基化修饰可增加其可溶性改善功能。附图说明图1葫芦烷类糖基化产物的合成策略图2显示重组酵母表达载体pESC-Leu-CbQ-CYP87D18和pYES2-CPR的物理图谱图3三种萜类化合物气相色谱图(A为酿酒酵母重组菌株SY1的发酵气相色谱图;B为酿酒酵母重组菌株SY2的发酵气相色谱图)。图4三种萜类化合物的质谱图(A为产物11-氧-葫芦烷二烯醇,对应于气相色谱图中1号产物峰,出峰时间为20.27min;B为产物11-羟基-葫芦烷二烯醇,对应气相色谱图中2号产物峰,出峰时间为21.31min;C为11-氧-24,25-环氧-葫芦烷二烯醇,对应气相色谱图中3号产物峰,出峰时间为23.72min)。图5体外酶反应气相色谱图(A为酿酒酵母重组菌株SY1所得微粒体体外酶反应;B为酿酒酵母重组菌株SY2所得微粒体体外酶反应;C为11-羟基-葫芦烷二烯醇标品;D为11-氧-葫芦烷二烯醇标品)。具体实施方式下面结合附图和具体实施案例对本发明的具体实施方式做详细叙述。以下实施方式仅用于说明本发明,但不限制本发明的使用范围。下述实施例中所用方法如无特别说明均为常规方法,具体步骤可参见:《MolecularCloning:ALaboratoryManual》(Sambrook,J.,Russell,DavidW.,MolecularCloning:ALaboratoryManual,3rdedition,2001,NY,ColdSpringHarbor)。各实施例中所用相同名称的材料或试剂如无特别说明即为相同的。实施例中描述到的各种生物材料的取得途径仅是提供一种实验获取的途径以达到具体公开的目的,不应成为实施本发明时对生物材料来源的限制。事实上,所用到的生物材料的来源是广泛的,任何不违反法律和道德伦理能够获取的生物材料都可以按照实施例中的提示替换使用。本发明中所用引物由江苏金唯智生物技术有限公司合成,基因合成由无锡青兰生物科技有限公司合成。实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,实施例将有助于理解本发明,但是本发明的保护范围不限于下述的实施例。实施例1、酿酒酵母重组菌株SY2的构建酿酒酵母重组菌株SY2的构建,包括以下步骤:1、构建酿酒酵母重组质粒pESC-Leu-CbQ前期基因SgCbQ(GeneBankIDNO:HQ128567)已被证实为葫芦烷二烯醇合成酶。通过分析酿酒酵母对密码子的使用偏好性,对SgCbQ基因进行密码子优化后交由无锡青兰生物科技有限公司合成,合成的SgCbQ基因片段序列如SEQIDNO.1所示;然后将合成的SgCbQ基因经XhoI和NheI双酶切,与同样经XhoI和NheI双酶切的pESC-Leu质粒进行连接,获得重组表达质粒pESC-Leu-CbQ,重组质粒物理图谱见附图2。将构建得到的载体pESC-Leu-CbQ进行测序验证,相关测序工作由江苏金唯智生物技术有限公司完成,验证正确后,将载体pESC-Leu-CbQ置于-20保存。2、构建酿酒酵母重组质粒pESC-Leu-CbQ-CYP87D18根据转录组和表达谱数据分析,从罗汉果转录组数据库中挖掘得到注释为细胞色素P450的基因(GenBankIDNO.HQ128571.1),命名为CYP87D18。针对该酶基因进行密码子优化并交由无锡青兰生物科技有限公司合成,合成的CYP87D18基因片段序列如SEQIDNO.2所示;所获得的CYP87D18基因片段经酶切位点NotI和SacI,连接到重组质粒pESC-Leu-CbQ中,得到重组质粒pESC-Leu-CbQ-CYP87D18,其物理图谱见附图2。将构建得到的载体pESC-Leu-CbQ-CYP87D18进行测序验证,相关测序工作由江苏金唯智生物技术有限公司完成,验证正确后,将载体pESC-Leu-CbQ-CYP87D18置于-20保存。3、构建酿酒酵母重组质粒pYES2-CPR此外,将来自于Arabidopsisthaliana的细胞色素还原酶(CPR)基因(NCBI:NM_118585.3)经密码子优化后交由无锡青兰生物科技有限公司合成,合成的CPR基因片段序列如SEQIDNO.3,所得到的CPR基因片段经酶切位点KpnI和NotI连接到载体pYES2中,获得重组质粒pYES2-CPR,其物理图谱见附图2.将构建得到的载体pYES2-CPR进行测序验证,相关测序工作由江苏金唯智生物技术有限公司完成,验证正确后,将载体pYES2-CPR置于-20保存。4、构建酿酒酵母重组菌株SY2将上述构建成功的重组质粒pYES2-CPR和pESC-Leu-CbQ-CYP87D18通过醋酸锂转化法转入到酿酒酵母BY4741中,将转化后的酿酒酵母BY4741涂布于缺少尿嘧啶和亮氨酸的营养缺陷型筛选平板上,放置于30℃培养箱中培养2-3天。挑选筛选平板上的阳性克隆,接种于20mlSD培养基中,培养24小时,提取酵母质粒并PCR验证,从而确认重组质粒pYES2-CPR和pESC-Leu-CbQ-CYP87D18已转入酿酒酵母BY4741中,得到酿酒酵母重组菌株SY2。为获得对照酿酒酵母重组菌株SY1,将构建成功的重组质粒pYES2-CPR和pESC-Leu-CbQ通过醋酸锂转化法转入酿酒酵母BY4741中,筛选方法与重组菌株SY2类似,经PCR验证确认重组质粒pYES2-CPR和pESC-Leu-CbQ转入酿酒酵母BY4741中,得到酿酒酵母重组菌株SY1。实施例2、酿酒酵母重组菌株SY2以葡萄糖为底物合成三种葫芦烷型三萜类化合物重组酿酒酵母SY2以自身体内含有的2,3-氧化角鲨烯为底物,经葫芦烷二烯醇合成酶获得葫芦烷二烯醇,后者进一步经细胞色素P450CYP87D18催化合成新的产物,对于新产物的确定包括以下过程:1、发酵酿酒酵母重组菌株SY2和SY1从含有酿酒酵母重组菌株SY2的平板上挑去单菌落接种于20mL缺少尿嘧啶和亮氨酸的酵母合成培养基(补充添加了20g/L葡萄糖和13mg/L氯化血红素)中,于30℃,200rpm条件下培养48h,使酵母细胞大量增殖;收集细胞并用灭菌的去离子水洗涤三次;随后转移至缺少尿嘧啶和亮氨酸的酵母合成培养基(补充添加了20g/L半乳糖和13mg/L氯化血红素)中,于30℃,200rpm条件下培养24h,诱导SgCbQ、CYP87D18和CPR酶基因的表达;再次收集细胞,用灭菌的去离子水洗涤细胞三次;将收集的酵母菌体重悬至20mL含有3%葡萄糖和13mg/L氯化血红素的酵母合成培养基中,于30℃,200rpm条件下继续培养48h。为验证酿酒酵母重组菌株SY2可以生成新的产物,酿酒酵母重组菌株SY1也将采用类似重组菌株SY2的发酵方法,2、萃取发酵产物发酵终止时,离心收集酵母细胞,用5mL40%KOH/50%乙醇(V/V:1:1)85℃水浴条件下皂化10min,然后用5mL的正己烷对皂化产物萃取3次,合并正己烷萃取产物,并通过减压旋蒸对产物进行浓缩干燥;最后将干燥的产物溶解于500μL正己烷中,经0.22μm滤膜过滤处理后利用GC-MS进行分析。气相色谱仪为安捷伦7890,质谱仪为安捷伦Q-TOF-MS,分析柱为HP-5ms(30m×0.25mm×0.5μm),流动相为氦气,分流比为100:1,进样量为1μL,柱温箱升温程序为:80℃,1min;20℃/min升至300℃;300℃维持15min。质谱为ESI源,采用正离子模式。如气相色谱结果显示(图3),与酿酒酵母重组菌株SY1相比,酿酒酵母重组菌株SY2提取物分别在20.27min、21.31min和23.72min处生成了新的产物峰,根据质谱结果显示三个新产物的分子量分别为440(m/z)、442(m/z)、456(m/z)。通过分析新产物的分子离子峰与主要裂解规律,确定其中三个产物有可能为产物11-氧-葫芦烷二烯醇,对应于气相色谱图中1号产物峰,出峰时间为20.27min;产物11-羟基-葫芦烷二烯醇,对应气相色谱图中2号产物峰,出峰时间为21.31min;产物11-氧-24,25-环氧-葫芦烷二烯醇,对应气相色谱图中3号产物峰,出峰时间为23.72min。3、新产物的分离及鉴定为进一步确认这三种产物分别为11-氧-葫芦烷二烯醇、11-羟基-葫芦烷二烯醇、11-氧-24,25-环氧-葫芦烷二烯醇,需对上述三种产物进行分离鉴定,具体方法为:萃取产物经薄层层析(TLC)进行分离,其中展开剂为正己烷-乙酸乙酯(1:3),显色剂为含有0.5%香草醛的浓硫酸-乙醇溶液(10%浓硫酸),经在吹风机加热显色后,从硅胶板上刮下新产物所在区域,利用正己烷-乙酸乙酯(1:1)萃取。采用液相质谱核磁连用技术LC-MS-NMR分析新产物:LC-MS分析采用Agilent1260HPLC系统和Bruker-micrOTOF-II电喷雾质谱仪。高效液相中使用反相C18柱(4.6×250mm,5μm,Welch,上海),条件为流速0.5mL/min,紫外检测波长为210nm。流动相A为水(0.1%甲酸),流动相B为乙腈(0.1%甲酸),采用梯度洗脱法:0-20min,50-100%B;20-50min,100%B。电喷雾离子源(ESI)参数为:扫描范围:负离子模式,100-1000m/z;喷雾电压:4500V,毛细管温度:400°C,干气流量:6mL/min,干燥温度:180°C,雾化气压:1bar。通过质谱信号收集产物,分别收集m/z为441.3727,443,3884和457.3676的产物(图4);经干燥后溶解在氘代乙腈中,经BrukerDMX-600核磁共振谱仪在600MHz下做核磁分析。这三种产物核磁数据分别为:表111-氧-葫芦烷二烯醇的C谱和H谱数据C数目δ13Cδ1H121.3CH2,1.19(m),1.47(m)229.4CH2,1.53(m),1.80(m)376.3CH,3.37(br,s)442.05141.56120.0CH,5.59(d,J=5.82Hz)724.5CH2,1.92(m),2.33(m)844.7CH,1.93(m)949.11036.0CH,2.39(m)11207.01249.3CH2,2.30(d,J=14.2Hz),3.03(d,J=14.2Hz)1350.31449.51530.2CH2,1.28(m)1628.3CH2,1.34(m),2.01(m)1750.2CH,1.74(m)1817.1CH3,0.71(s)1918.6CH3,1.03(s)2036.6CH,1.06(m),1.41(m)2118.7CH3,0.90(d,J=6.45Hz)2235.0CH2,1.27(m),1.35(m)2325.2CH2,1.88(m),2.04(m)24125.9CH,5.10(br,s)25126.02625.8CH3,1.66(s)2717.7CH3,1.59(s)2827.9CH3,0.99(s)2926.0CH3,1.09(s)3020.1CH3,1.04(s)表211-羟基-葫芦烷二烯醇的C谱和H谱数据Cδ13Cδ1H121.3CH2,0.99(m),1.49(m)225.9CH2,1.40(m),2.21(m)376.8CH,3.36(br,s)441.75142.96120.3CH,5.47(d,J=6.10Hz)724.8CH2,1.77(m),2.39(m)843.1CH,1.35(m)956.11041.0CH,1.74(m)1178.7CH,3.78(m)1237.2CH2,1.03(m),1.40(m)1349.51449.91528.6CH2,1.26(m),1.89(m)1630.3CH2,1.47(m),1.92(m)1751.0CH,1.57(m)1819.6CH3,0.81(s)1917.0CH3,0.87(s)2036.6CH,1.44(m),2.45(m)2118.8CH3,0.94(d,J=6.40Hz)2234.8CH2,1.09(m),1.15(m)2325.4CH2,1.88(m),2.03(m)24126.1CH,5.10(br,s)25124.92625.7CH3,1.66(s)2717.6CH3,1.59(s)2827.0CH3,1.02(s)2926.0CH3,1.09(s)3025.9CH3,1.05(s)表311-氧-24,25-环氧-葫芦烷二烯醇的C谱和H谱数据Cδ13Cδ1H121.3CH2,1.20(m),1.49(m)229.4CH2,1.53(dd),1.94(m)376.3CH,3.37(br,s)441.25140.26120.1CH,5.59(d,J=5.89Hz)723.9CH2,1.94(m),2.36(m)844.1CH,1.94(m)948.81035.9CH,2.36(m)11207.01249.6CH2,2.37(d,J=14.5Hz),3.04(d,J=14.4Hz)1348.91450.21531.6CH2,1.31(m)1622.4CH2,1.77(m),1.84(m)1751.3CH,2.05(m)1819.3CH3,0.85(s)1918.8CH3,1.04(s)2045.0CH,1.29(m),1.43(m)2126.3CH3,1.20(s)2234.6CH2,1.31(m),1.36(m)2323.9CH2,1.94(m)24125.6CH,5.10(br,s)25131.22625.7CH3,1.66(s)2717.7CH3,1.60(s)2827.8CH3,0.99(s)2925.9CH3,1.09(s)3020.2CH3,1.03(s)经核磁验证确认这三种产物分别为11-氧-葫芦烷二烯醇、11-羟基-葫芦烷二烯醇、11-氧-24,25-环氧-葫芦烷二烯醇。三种产物的确立对于探索和研究葫芦烷二烯醇合成罗汉果醇合成路径具有重要意义,同时该三种产物还可经糖基转移酶糖基化修饰得到多种三萜类化合物。实施例3、体外P450酶CYP87D18反应确定罗汉果醇合成路径中相关产物合成顺序采用微粒体制备方式测定细胞色素P450CYP87D18催化葫芦烷二烯醇得到三种产物的合成顺序。具体操作过程如下:1、诱导酿酒酵母重组菌株SY2中细胞色素P450CYP87D18与实施例2中SY2菌株的培养方法及相关酶的诱导方法类似。为了对比细胞色素P450CYP87D18体外酶催化反应,酿酒酵母重组菌株SY1也同时采用如实施例2中的菌体培养和酶诱导方法。2、微粒体的制备将50ml诱导后的菌液,经5000rpm离心5min收集菌体,并用蒸馏水洗涤两次;用2ml0.25M蔗糖溶液重悬菌液,加入苯甲基磺酰氟(PMSF)至终浓度0.67M,加入微珠至覆盖液面,振荡涡旋3min;1000rpm离心3min,出去未破碎细胞及碎片;取上清,5000rpm,离心10min,除去线粒体;提高转速至9000rpm,离心10min,除去破碎的线粒体碎片。取上清转移至新EP管中,10000rpm离心90min;移除上清,用2ml冰冷的0.154MKCl重悬沉淀,10000rpm离心30min,去掉上清;将含有微粒体的沉淀悬浮于2mLPDEbuffer(50mM磷酸钾缓冲液,pH7.5;0.5%脱氧胆酸;1mMDTTand1mMEDTA)中;制备得到的微粒体直接用于体外酶反应。3、体外酶反应为确定细胞色素P450CYP87D18催化葫芦烷二烯醇合成三种产物的生成顺序,依次在体外酶反应体系中加入11-氧-葫芦烷二烯醇和11-羟基-葫芦烷二烯醇,具体体外酶反应体系(800μL)如下:磷酸钾缓冲液(100mM,pH7.5),含有P450酶CYP87D18的微粒体酶液(200μL),11-氧-葫芦烷二烯醇或11-羟基-葫芦烷二烯醇(1mg),NADPH(1mM),30℃反应2h,反应结束后用正己烷萃取两次,并将获得样品进行GC-MS分析。以11-氧-葫芦烷二烯醇为底物进行体外反应时,液相结果发现生成11-羟基-葫芦烷二烯醇(图5);相反以11-羟基-葫芦烷二烯醇为底物进行体外反应时,液相结果未检测到11-氧-葫芦烷二烯醇,说明细胞色素P450CYP87D18很有可能首先催化葫芦烷二烯醇生成11-氧-葫芦烷二烯醇,后者进一步经P450酶CYP87D18催化合成11-羟基-葫芦烷二烯醇,由于11-氧-24,25-环氧-葫芦烷二烯醇与11-氧-葫芦烷二烯醇结构类似,推测该产物也极有可能由细胞色素P450CYP87D18催化11-氧-葫芦烷二烯醇合成,但因11-氧-24,25-环氧-葫芦烷二烯醇含量很低,体外酶反应未检测到。所得到的11-羟基-葫芦烷二烯醇可进一步经Siraitiagrosvenorii中其他P450酶催化C-24和C-25羟基化或者环氧化合成罗汉果醇;所得到的11-氧-24,25-环氧-葫芦烷二烯醇可进一步经Siraitiagrosvenorii中其他环氧化物酶催化生成罗汉果醇。序列表<110>中国科学院天津工业生物技术研究所<120>罗汉果醇合成路径中三种萜类化合物及其糖基化产物的合成方法<130>3<160>3<170>PatentInversion3.3<210>1<211>2280<212>DNA<213>葫芦烷二烯醇合成酶SgCbQ基因序列<400>1atgtggagattgaaggttggtgctgaatctgttggtgaaaacgacgaaaagtggttgaag60tctatctctaaccacttgggtagacaagtttgggaattctgtccagacgctggtactcaa120caacaattgttgcaagttcacaaggctagaaaggctttccacgacgacagattccacaga180aagcaatcttctgacttgttcatcactatccaatacggtaaggaagttgaaaacggtggt240aagactgctggtgttaagttgaaggaaggtgaagaagttagaaaggaagctgttgaatct300tctttggaaagagctttgtctttctactcttctatccaaacttctgacggtaactgggct360tctgacttgggtggtccaatgttcttgttgccaggtttggttatcgctttgtacgttact420ggtgttttgaactctgttttgtctaagcaccacagacaagaaatgtgtagatacgtttac480aaccaccaaaacgaagacggtggttggggtttgcacatcgaaggtccatctactatgttc540ggttctgctttgaactacgttgctttgagattgttgggtgaagacgctaacgctggtgct600atgccaaaggctagagcttggatcttggaccacggtggtgctactggtatcacttcttgg660ggtaagttgtggttgtctgttttgggtgtttacgaatggtctggtaacaacccattgcca720ccagaattctggttgttcccatacttcttgccattccacccaggtagaatgtggtgtcac780tgtagaatggtttacttgccaatgtcttacttgtacggtaagagattcgttggtccaatc840actccaatcgttttgtctttgagaaaggaattgtacgctgttccataccacgaaatcgac900tggaacaagtctagaaacacttgtgctaaggaagacttgtactacccacacccaaagatg960caagacatcttgtggggttctttgcaccacgtttacgaaccattgttcactagatggcca1020gctaagagattgagagaaaaggctttgcaaactgctatgcaacacatccactacgaagac1080gaaaacactagatacatctgtttgggtccagttaacaaggttttgaacttgttgtgttgt1140tgggttgaagacccatactctgacgctttcaagttgcacttgcaaagagttcacgactac1200ttgtgggttgctgaagacggtatgaagatgcaaggttacaacggttctcaattgtgggac1260actgctttctctatccaagctatcgtttctactaagttggttgacaactacggtccaact1320ttgagaaaggctcacgacttcgttaagtcttctcaaatccaacaagactgtccaggtgac1380ccaaacgtttggtacagacacatccacaagggtgcttggccattctctactagagaccac1440ggttggttgatctctgactgtactgctgaaggtttgaaggctgctttgatgttgtctaag1500ttgccatctgaaactgttggtgaatctttggaaagaaacagattgtgtgacgctgttaac1560gttttgttgtctttgcaaaacgacaacggtggtttcgcttcttacgaattgactagatct1620tacccatggttggaattgatcaacccagctgaaactttcggtgacatcgttatcgactac1680ccatacgttgaatgtacttctgctactatggaagctttgactttgttcaagaagttgcac1740ccaggtcacagaactaaggaaatcgacactgctatcgttagagctgctaacttcttggaa1800aacatgcaaagaactgacggttcttggtacggttgttggggtgtttgtttcacttacgct1860ggttggttcggtatcaagggtttggttgctgctggtagaacttacaacaactgtttggct1920atcagaaaggcttgtgacttcttgttgtctaaggaattgccaggtggtggttggggtgaa1980tcttacttgtcttgtcaaaacaaggtttacactaacttggaaggtaacagaccacacttg2040gttaacactgcttgggttttgatggctttgatcgaagctggtcaagctgaaagagaccca2100actccattgcacagagctgctagattgttgatcaactctcaattggaaaacggtgacttc2160ccacaacaagaaatcatgggtgttttcaacaagaactgtatgatcacttacgctgcttac2220agaaacatcttcccaatctgggctttgggtgaatactgtcacagagttttgactgaataa2280<210>2<211>1422<212>DNA<213>细胞色素P450CYP87D18基因序列<400>2atgtggactgttgttttgggtttggctactttgttcgttgcttactacatccactggatc60aacaagtggagagactctaagttcaacggtgttttgccaccaggtactatgggtttgcca120ttgatcggtgaaactatccaattgtctagaccatctgactctttggacgttcacccattc180atccaaaagaaggttgaaagatacggtccaatcttcaagacttgtttggctggtagacca240gttgttgtttctgctgacgctgaattcaacaactacatcatgttgcaagaaggtagagct300gttgaaatgtggtacttggacactttgtctaagttcttcggtttggacactgaatggttg360aaggctttgggtttgatccacaagtacatcagatctatcactttgaaccacttcggtgct420gaagctttgagagaaagattcttgccattcatcgaagcttcttctatggaagctttgcac480tcttggtctactcaaccatctgttgaagttaagaacgcttctgctttgatggttttcaga540acttctgttaacaagatgttcggtgaagacgctaagaagttgtctggtaacatcccaggt600aagttcactaagttgttgggtggtttcttgtctttgccattgaacttcccaggtactact660taccacaagtgtttgaaggacatgaaggaaatccaaaagaagttgagagaagttgttgac720gacagattggctaacgttggtccagacgttgaagacttcttgggtcaagctttgaaggac780aaggaatctgaaaagttcatctctgaagaattcatcatccaattgttgttctctatctct840ttcgcttctttcgaatctatctctactactttgactttgatcttgaagttgttggacgaa900cacccagaagttgttaaggaattggaagctgaacacgaagctatcagaaaggctagagct960gacccagacggtccaatcacttgggaagaatacaagtctatgactttcactttgcaagtt1020atcaacgaaactttgagattgggttctgttactccagctttgttgagaaagactgttaag1080gacttgcaagttaagggttacatcatcccagaaggttggactatcatgttggttactgct1140tctagacacagagacccaaaggtttacaaggacccacacatcttcaacccatggagatgg1200aaggacttggactctatcactatccaaaagaacttcatgccattcggtggtggtttgaga1260cactgtgctggtgctgaatactctaaggtttacttgtgtactttcttgcacatcttgtgt1320actaagtacagatggactaagttgggtggtggtactatcgctagagcgcacatcttgtct1380ttcgaagacggtttgcacgttaagttcactccaaaggaataa1422<210>3<211>2079<212>DNA<213>细胞色素还原酶CPR基因序列<400>3atgacttctgctttgtatgcttccgatttgtttaagcagctcaagtcaattatggggaca60gattcgttatccgacgatgttgtacttgtgattgcaacgacgtctttggcactagtagct120ggatttgtggtgttgttatggaagaaaacgacggcggatcggagcggggagctgaagcct180ttgatgatccctaagtctcttatggctaaggacgaggatgatgatttggatttgggatcc240gggaagactagagtctctatcttcttcggtacgcagactggaacagctgagggatttgct300aaggcattatccgaagaaatcaaagcgagatatgaaaaagcagcagtcaaagtcattgac360ttggatgactatgctgccgatgatgaccagtatgaagagaaattgaagaaggaaactttg420gcatttttctgtgttgctacttatggagatggagagcctactgacaatgctgccagattt480tacaaatggtttacggaggaaaatgaacgggatataaagcttcaacaactagcatatggt540gtgtttgctcttggtaatcgccaatatgaacattttaataagatcgggatagttcttgat600gaagagttatgtaagaaaggtgcaaagcgtcttattgaagtcggtctaggagatgatgat660cagagcattgaggatgattttaatgcctggaaagaatcactatggtctgagctagacaag720ctcctcaaagacgaggatgataaaagtgtggcaactccttatacagctgttattcctgaa780taccgggtggtgactcatgatcctcggtttacaactcaaaaatcaatggaatcaaatgtg840gccaatggaaatactactattgacattcatcatccctgcagagttgatgttgctgtgcag900aaggagcttcacacacatgaatctgatcggtcttgcattcatctcgagttcgacatatcc960aggacgggtattacatatgaaacaggtgaccatgtaggtgtatatgctgaaaatcatgtt1020gaaatagttgaagaagctggaaaattgcttggccactctttagatttagtattttccata1080catgctgacaaggaagatggctccccattggaaagcgcagtgccgcctcctttccctggt1140ccatgcacacttgggactggtttggcaagatacgcagaccttttgaaccctcctcgaaag1200tctgcgttagttgccttggcggcctatgccactgaaccaagtgaagccgagaaacttaag1260cacctgacatcacctgatggaaaggatgagtactcacaatggattgttgcaagtcagaga1320agtcttttagaggtgatggctgcttttccatctgcaaaacccccactaggtgtatttttt1380gctgcaatagctcctcgtctacaacctcgttactactccatctcatcctcgccaagattg1440gcgccaagtagagttcatgttacatccgcactagtatatggtccaactcctactggtaga1500atccacaagggtgtgtgttctacgtggatgaagaatgcagttcctgcggagaaaagtcat1560gaatgtagtggagccccaatctttattcgagcatctaatttcaagttaccatccaaccct1620tcaactccaatcgttatggtgggacctgggactgggctggcaccttttagaggttttctg1680caggaaaggatggcactaaaagaagatggagaagaactaggttcatctttgctcttcttt1740gggtgtagaaatcgacagatggactttatatacgaggatgagctcaataattttgttgat1800caaggcgtaatatctgagctcatcatggcattctcccgtgaaggagctcagaaggagtat1860gttcaacataagatgatggagaaggcagcacaagtttgggatctaataaaggaagaagga1920tatctctatgtatgcggtgatgctaagggcatggcgagggacgtccaccgaactctacac1980accattgttcaggagcaggaaggtgtgagttcgtcagaggcagaggctatagttaagaaa2040cttcaaaccgaaggaagatacctcagagatgtctggtga2079当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1