烟曲霉酸型化合物及其应用及产品的制作方法
本发明涉及制药领域,特别是一种烟曲霉酸型化合物。
背景技术:
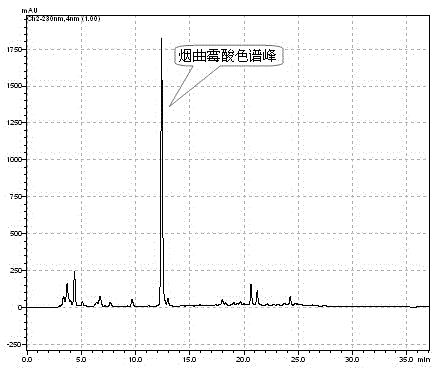
:烟曲霉酸(helvolicacid或fumigacin)是一种真菌来源降三萜抗菌素。早在上世纪40年代,从烟曲霉Aspergillusfumigatus中发现的一种抗微生物活性化合物(ChainE,etalBritshJournalofExperimentalPathology1943;24(3):108-119;WaksmanSA&GeigerWB,JournalofBacteriology1944;47(4):391-7),对病原细菌、真菌均有明显抑制活性(ZhaoJ,etal.Molecules2010;15(11):7961-70;KangD,etal.FungalBiology2013;117(3):211-9)。随后也在炭角菌(RatnaweeraPB,etal.Mycology:AnInternationalJournalonFungalBiology2014;5(1):23-28)、稻帚枝霉(TschenJSM,etal.BotanicalBulletinofAcademiaSinica1997;38(4):251-256)、毕赤酵母(ZhaoJ,etal.Molecules.2010;15(11):7961-70)等多种真菌中发现该化合物。有意思的是该化合物与其它抗菌素联用,有显著的协同抗多药耐药菌效应(QinL,etal.NaturalProductResearch2009;23(4):309-18;秦岭,官家发,李伯刚,等.ZL200510021822.9)。因此,烟曲霉酸型化合物作为抗菌素受到生物医药领域的关注。但是,烟曲霉酸型化合物是否具有抗肿瘤或其它功效尚未见报道。技术实现要素:本发明所要解决的技术问题在于提供一种烟曲霉酸型化合物。本发明还要解决的另一个技术问题是,提供一种烟曲霉酸型化合物在制备抗癌复合药物中的应用。本发明还提供了一种烟曲霉酸型化合物的抗癌复合药物。本发明是这样实现的:烟曲霉酸型化合物,该化合物具有如通式(Ⅰ)所示的结构:(1)式中,R1、R2、R3、R4及R5为氢原子、羟基、羰基氧原子、乙酰氧基、氨基、羧基、芳基、酰基、烷氧基或卤素,且R1、R2、R3、R4及R5不全为氢原子。本发明还要解决的另一个技术问题是,提供一种烟曲霉酸型化合物在制备抗癌复合药物中的应用。本发明还提供了一种烟曲霉酸型化合物的抗癌复合药物,按重量份数计算,包括烟曲霉酸型化合物及复配药物;所述的复配药物为不与烟曲霉酸型化合物发生化学反应的抗癌药物。所述的复配药物为环磷酰胺、顺铂、紫杉醇、5-氟尿嘧啶。烟曲霉酸型化合物与复配药物的质量比为1:100~20:1。本发明将分离获得的烟曲霉酸型化合物进行单独或与其它抗癌药物组合后的抗癌效果进行研究,类似烟曲霉酸型骨架化合物抗多药耐药菌的协同作用,提供了烟曲霉酸型化合物抗癌协同增效作用的新用途。本发明发现了烟曲霉酸型化合物在抗癌复合药物中有显著的协同增效作用。通过烟曲霉酸型化合物与其它抗癌药物组合而成的抗癌复合药物可减少抗癌药物用量,降低抗癌药物的产生的副作用及治疗费用。本发明具有成本低廉,使用效果好等优点。附图说明附图1为戴氏虫草柱层析馏分D的HPLC色谱图;附图2为戴氏虫草柱层析馏分D5的HPLC色谱图;附图3为分离获得的烟曲霉酸HPLC色谱图;附图4为小鼠平均瘤体积变化趋势(±s.d.,n=16);附图5为不同给药组对S180荷瘤小鼠免疫器官指数的影响(±s.d.,n=8);附图5中:Model表示模型组;CTX表示环磷酰胺组;HA-H表示烟曲霉酸高剂量组;HA-L表示烟曲霉酸低剂量组;CTX+HA-L表示复合药物组;Thymusindex表示胸腺指数;Spleenindex表示脾脏指数。具体实施方式本发明的实施例1:戴氏虫草发酵品的生产1、烟曲霉酸是从虫草真菌戴氏虫草(戴氏绿僵菌)GYYA0601菌株发酵品中分离得到。戴氏虫草菌种保藏编号为CGMCCNO.2880,申请人在先申请的已授权专利(ZL200910301440)已经公开。2、戴氏虫草斜面种子培养基配方包括蔗糖25g、黄豆3g、酵母膏5g、蛋白胨2g、麦麸3g、KH2PO41g、MgSO4·7H2O0.5g、琼脂18g、蒸馏水1L、初始pH7.0;戴氏虫草液体种子或/发酵培养基配方包括蔗糖30g,蛋白胨5g,酵母膏3g,KH2PO41g,MgSO4•7H2O0.5g,蒸馏水1L,初始pH7.0。3、戴氏虫草斜面种子23-28℃培养7-15天,置于4℃保藏备用。移植斜面菌种到盛有120mL液体种子培养基的500mL规格的摇瓶中,然后置于旋转摇床,120-180r/min,25-30℃培养4d,制备发酵液体种子。50L发酵罐装33L发酵培养基,按体积系数4%(v/v)的比例接种发酵液体种子,150-250r/min,28℃条件下发酵60-80h。发酵终止后,减压抽滤发酵产物,用蒸馏水清洗3次,将其置于烘箱,45-60℃干燥至恒重,称量发酵品干重。干燥后的发酵品捣成粉末,过60-100目分子筛,密封-20℃冷藏备用。本发明的实施例2:戴氏虫草中烟曲霉酸的分离制备与结构鉴定1、戴氏虫草发酵品粉末,90%的甲醇水冷浸提取6次(每次3d),合并提取液,减压浓缩回收甲醇后获得棕褐色浸膏。温水重悬后,利用液液两相萃取方法用三氯甲烷浸提(每次至少2h,共3次),合并提取液,减压浓缩,得到三氯甲烷萃取部位。采用湿法装柱(100-200目硅胶)和干法上样(40-80目硅胶)进行正相硅胶柱层析,用不同比例(10:1、5:1、1:1、1:5、1:10、0:10)的石油醚-乙酸乙酯作为淋溶系统进行梯度洗脱,将50mL作为一个馏分,利用薄层层析(TLC)指导合并相同的馏分,得到A-F六个馏分。其中馏分D富含烟曲霉酸。D馏分的HPLC色谱图如图1。再次采用湿法装柱(100-200目硅胶)和湿法上样(溶解在1:1的石油醚-乙酸乙酯溶液中)进行硅胶柱层析,淋溶系统用石油醚-乙酸乙酯(1:1)进行洗脱,采用TLC检测,获得D1-D5等5个馏分,其中D5富含烟曲霉酸馏分。D5馏分的HPLC色谱图如图2。利用高效制备液相色谱仪对D5部位进一步纯化。色谱柱及色谱条件为:HypersilODS2-C18柱(规格为:粒径5μm,250×10mm,依利特);流动相:体积比例为75%-100%的甲醇进行梯度洗脱;流速:2mL/min;柱温:25℃;洗脱时间:20min;检测器:紫外全光谱扫描。自动收集烟曲霉酸色谱峰,最后将收集到的目标产物馏分进行重结晶,得到无色针状结晶单体化合物烟曲霉酸,其HPLC色谱图如图3。2、采用紫外光谱仪上检测单体化合物的紫外光谱。甲醇在检测时作为空白背景;样品则溶解在甲醇中(浓度为200μg/mL);将单体化合物与KBr混合均匀,之后用压片机制片后,在红外拉曼光谱仪上进行红外分析;将单体化合物溶解在乙腈中,配成浓度10μg/mL,利用高分辨质谱仪分析检测单体化合物的分子量;运用核磁共振波谱仪,将样品溶解在CDCl3中进行检测,分析单体化合物的碳谱、氢谱、二维核磁谱等(1HNMR,13CNMR,DEPT,HMBC,HMQC和COSY)。其中在氢谱的测量中,化学位移的标准品使用的是甲基硅酯。相关解析的数据如下:无色针状结晶(甲醇),M.p.206-208℃,IR:v(cm-1)3501.4,3171.9,2960.3,1724.4,1651.5,1454.1,1379.7,1269.4,1197.6,1156.4,1052.3,1022.8,982.8,902.6,864.2,775.8.ESI-MSm/z:591[M+Na]+,1159[2M+Na]+;1H-NMR(CDCl3,500MHz)δ:7.31(1H,d,J=10.0Hz,H-1),5.87(1H,d,J=9.8Hz,H-2),2.78(1H,m,H-4),2.27(1H,d,J=12.6Hz,H-5),5.24(1H,s,H-6),2.11(3H,s,6-OCOCH3),2.63(1H,dd,J=10.4Hz,12.7Hz,H-9),1.57(1H,m,H-11),1.81(1H,m,H-12),2.59(1H,brd,J=6.6HZ,H-13),2.27(2H,d,J=12.6Hz,H-15),5.89(1H,s,H-16),1.94(3H,s,16-OCOCH3),0.93(3H,s,H-18),1.45(3H,s,H-19),2.46(2H,m,H-22),2.14(1H,m,H-23),5.11(1H,m,H-24),1.69(3H,s,H-25),1.61(3H,s,H-27),1.28(3H,d,J=6.9Hz,H-28),1.18(3H,s,H-29);13C-NMR(400MHz,CDCl3)δ:157.3(C-1),127.8(C-2),201.4(C-3),40.4(C-4),47.2(C-5),73.8(C-6),168.9(6-OCOCH3),20.7(6-OCOCH3),208.8(C-7),52.7(C-8),41.7(C-9),38.2(C-10),23.9(C-11),25.9(C-12),49.4(C-13),46.6(C-14),40.6(C-15),73.5(C-16),170.3(16-OCOCH3),20.5(16-OCOCH3),147.6(C-17),17.9(C-18),27.5(C-19),130.5(C-20),174.2(C-21),28.6(C-22),28.3(C-23),122.8(C-24),132.9(C-25),17.8(C-26),25.7(C-27),13.1(C-28),18.4(C-29)。查找文献(ZhaoJ,etal.Molecules.2010;15(11):7961-70)对比数据,将该化合物鉴定为烟曲霉酸,结构式如下:本发明的实施例3:烟曲霉酸的体外抑制肿瘤细胞活性1、肿瘤细胞株及培养与传代。人高转移肺癌细胞株95-D,人胰腺癌细胞株sw1990,人宫颈癌细胞株HeLa,人肝癌细胞株HepG2,均购自中国科学研究院上海细胞所。将冻存的95-D、SW1990、HeLa和HepG2肿瘤细胞于37℃水浴中快速融化,移液器吸出细胞悬液至装有5mL含10%血清的新鲜DMEM完全培养基中,1000rpm离心5min,弃上清,重新加入培养基,然后置于含有5%CO2、饱和湿度的孵箱中,37℃培养。当细胞生长融合度达80%以上,弃培养基,加入0.25%胰蛋白酶消化1-2min,再加入含有10%血清的DMEM培养基终止消化,1000rpm离心5min,磷酸盐缓冲液(PBS)小心润洗2次,在离心后的细胞中加入DMEM完全培养基,然后用分装至多个培养瓶。2、MTT法活性测定。将对数生长期的细胞加入培养基,使得细胞悬液的浓度约为1×105cells/mL,然后将细胞接种在96孔板中,每个孔中的培养基为100μL,培养约4h后加入不同浓度的待测药物(烟曲霉酸及阳性对照药物,同时用DMSO作为空白对照),置于孵箱中培养24h,在每个孔中加入10-20μL5mg/mL的MTT溶液后,在孵箱中孵育4h,然后再在每个孔中加入体积为100-150μLDMSO溶液。在摇床上低速振荡10min,充分溶解胞内形成的甲瓒结晶物。最后用酶标仪测定,波长设定为570nm(参比波长为630nm)。计算存活率及半数抑制浓度IC50。计算各肿瘤细胞的IC50值见表1。表1.烟曲霉酸及阳性药物羟基喜树碱对肿瘤细胞的抑制活性(n=6)本发明的实施例4:烟曲霉酸的体内抗肿瘤的协同效应1、实验动物与瘤株。SPF级昆明种雄性小鼠80只,购自第三军医大学实验动物中心,许可证号SCXK-(军)2012-0011,4-6周龄,体质量18~22g。实验期间提供足量的自来水及遵义医学院医学与生物学研究中心提供的普通饲料,动物室保持22℃,通风良好,光照周期8:00~20:00。适应一周后用于实验。小鼠肉瘤S180细胞,购于中国科学院上海生命科学院细胞资源中心,液氮保存,使用时取出直接于昆明小鼠腹腔复苏和传代,实验结束按照常规方法冻存细胞,保存于液氮留种。2、S180肉瘤细胞株的复苏及传代培养。从液氮中取出冻存的S180肉瘤细胞株于37℃水浴中快速解冻,无菌条件下加入新鲜的含10%FBS的RPMI-1640培养液,1000rpm离心5min,弃去培养液加入适量无菌NS,无菌接种于健康昆明种小鼠的腹腔内,于接种后的第8d,在超净工作台内抽取生长良好的乳白色S180腹水,按1:4加入无菌NS稀释,取0.5mL注射于健康昆明小鼠腹腔内传代培养。3、荷瘤小鼠模型的建立。取传代后7至10d腹水瘤生长良好的小鼠,无菌条件下抽取腹水,为乳白色浓稠状液体,立即加入4倍体积无菌NS,台盼蓝染色法计算细胞存活率,大于95%方可使用。调整细胞密度为1×107个/mL,按照0.2mL/只接种于常规皮肤消毒后的昆明种小鼠右腋皮下,造成实体瘤模型,共80只。4、动物分组与给药。接种完毕后第5d待肿瘤直径达到5mm时,动物随机分为5组,每组16只(第0d):模型对照组、环磷酰胺阳性药物组(20mg/kg)、烟曲霉酸高剂量组(20mg/kg)、烟曲霉酸低剂量组(HA10mg/kg)以及复合药物组(烟曲霉酸10mg/kg+环磷酰胺20mg/kg),并开始腹腔注射给药,每天给药一次,连续10d。于第13d摘除眼球取血,剥离瘤组织及其他脏器以备实验需要。5、体内抗肿瘤活性的测定:自接种瘤细胞次日算起,每日观察瘤增长情况,待瘤体肉眼可见时用游标卡尺测量瘤长短径,按照瘤体积V=a×b2/2计算瘤体积(其中a为长径,b为短径,单位mm),至处死荷瘤小鼠当日终止。统计瘤体积数据并制作平均瘤体积-时间曲线,评价各组对肿瘤体积增长影响。图5的结果提示,复合药物组能明显抑制肿瘤的生长;停药后小鼠第3d处死每组中8只荷瘤小鼠,剥离完整瘤组织,电子天平称量瘤体湿重(精确到0.01g)并计算肿瘤生长抑制率。模型组肿瘤平均瘤重小于1g,或20%肿瘤重量小于400mg表示肿瘤生长不良,实验组小鼠死亡率超过20%表示药物所致毒性。肿瘤抑制率%=(模型组平均瘤重-给药组平均瘤重)/模型组平均瘤重×100%。表2的结果提示,与模型组相比,复合药物组的抑瘤率有极显著差异(P<0.01),且是阳性药物组的3.6倍。表2.不同给药组的抑瘤率(±s.d.,n=8)注:与模型组比较**P<0.016、对荷瘤小鼠免疫器官和生存期的影响。荷瘤小鼠处死后取出胸腺、脾脏称量,计算免疫器官指数。免疫器官指数(mg/g)=免疫器官质量(mg)/体重(g)。结果见图5,烟曲霉酸高剂量组和低剂量组均能显著提升胸腺指数功能具增强作用(P<0.05或(P<0.01))。剩余的8只荷瘤小鼠待其自然死亡后,记录生存时间,计算生命延长率。生命延长率%=(给药组平均存活天数-模型组平均生存天数)/模型组平均生存天数×100%。结果见及表3,与模型组比较,高、低剂量烟曲霉酸组均明显延长荷瘤小鼠的生存时间(P<0.05),特别是复合药物组能极显著延长荷瘤小鼠的生存时间(P<0.01)表3不同给药组队荷瘤小鼠生存期的影响(±s.d.,n=8)实验组生存时间(天)生命延长率(%)模型组35.83±15.64—阳性对照组53.13±9.38**48.26±26.11高剂量组46.85±15.09*27.97±42.12低剂量组47.14±8.30*31.56±23.15复合药物组57.00±8.57**59.07±23.91注:与模型组比较*P<0.05,**P<0.01在制备药物的过程中,可加入的辅料包括药学上可接收的盐、盐的水合物、异构体或酯,如与钠、钾、钙、镁等形成的盐。本发明各复合药的给药途径包括注射给药(静脉注射、肌肉注射和皮下注射等)和口服给药。复合药物的给药剂型包括液体剂型和固体剂型。给药途径为注射给药或口服给药。本发明复合药的给药剂量取决于多种因素,包括预防或治疗疾病的性质和严重程度,动物或患者的性别、年龄、体重、个体反应、给药途径、给药次数等。因此,给药剂量有大范围变化。可根据本发明复合物生产的制剂中所含实际药物数量,加以适当调整,以达到其治疗目的。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 烟曲霉Asp f 3的线性抗原表位最小基序肽Asp f 3<sup>67-72</sup>及其扩展短肽的制作方法
- 一种米曲霉菌株ysy035和富硒米曲霉的分离筛选方法及其应用
- 一种烟曲霉菌的pcr检测的引物及方法
- 烟曲霉Asp f 3的线性抗原表位最小基序肽Asp f 3<sup>123-127</sup>及其扩展短肽的制作方法
- 一种曲霉菌半乳甘露聚糖抗原免疫检测试剂盒及其制备方法与应用
- 烟曲霉Asp f 3的线性抗原表位最小基序肽Asp f 3<sup>16-23</sup>及其扩展短肽的制作方法
- 烟曲霉Asp f 3的线性抗原表位最小基序肽Asp f 3<sup>35-41</sup>及其扩展短肽的制作方法
- 烟曲霉Asp f3蛋白的线性抗原表位最小基序肽Asp f3<sup>5-9</sup>及其扩展短肽的制作方法
- 烟曲霉Asp f 3的线性抗原表位最小基序肽Asp f 3<sup>72-78</sup>及其扩展短肽的制作方法
- 烟曲霉Asp f 3的线性抗原表位最小基序肽Asp f 3<sup>141-148</sup>及其扩展短肽的制作方法
- 烟曲霉Asp f 3的线性抗原表位最小基序肽Asp f 3<sup>141-148</sup>及其扩展短肽的制作方法
- 烟曲霉Asp f 4的线性抗原表位最小基序肽Asp f 4<sup>56-61</sup>及其扩展短肽的制作方法
- 烟曲霉Asp f 4的线性抗原表位最小基序肽Asp f 4<sup>104-109</sup>及其扩展短肽的制作方法
- 烟曲霉Asp f 4的线性抗原表位最小基序肽Asp f 4<sup>130-134</sup>及其扩展短肽的制作方法
- 烟曲霉Asp f 4的线性抗原表位最小基序肽Asp f 4<sup>226-232</sup>及其扩展短肽的制作方法
- 一种用于防治灰雁曲霉菌病的中草药剂的制作方法
- 一种山鸡曲霉菌病防治剂的制作方法
- 治疗鸡曲霉菌病的中药煎煮液及其制备方法
- 一种烟曲霉素的提取方法
- 一株紫红曲霉菌株及其在制备食品中的应用