人造双向植物启动子的制作方法
优先权要求
本申请要求2014年11月11日提交的“syntheticbi-directionalplantpromoter”的美国临时专利申请序号62/078,205的申请日的权益。
本公开一般涉及用于促进植物或植物细胞中核苷酸序列的转录的组合物和方法。一些实施方案涉及可在植物中起作用以促进可操作连接的核苷酸序列的转录的人造木薯叶脉花叶病毒(csvmv)双向启动子。具体实施方案涉及包括人造启动子(例如,将核酸分子引入细胞)的方法和包含人造启动子的细胞、细胞培养物、组织、生物体、以及生物体的部分,以及由其产生的产物。
发明背景
许多植物物种可以用来自其他物种的转基因转化以引入农学上期望的性状或特征,例如改善营养价值品质、提高产率、赋予害虫或疾病抗性、提高干旱和应激耐受性、改善园艺质量(如着色和生长)、给予除草剂抗性、使得能够从植物产生工业上有用的化合物和/或材料、和/或使得能产生药物。将转基因导入到植物细胞、随后复原含有稳定整合的转基因拷贝的可育转基因植物的做法,可以导致生成拥有期望性状或特征的转基因植物。
基因表达的控制和调节的运行机制众多。基因的转录启动是基因表达的主要控制机制。转录的启动一般由位于所转录基因的5’侧翼或上游区中的多核苷酸序列控制。这些序列统称为启动子。启动子通常含有用于使rna聚合酶开始转录的信号,使得能够产生信使rna(mrna)。成熟的mrna被核糖体转录,由此合成蛋白质。dna结合蛋白与启动子dna序列特异性相互作用以促进转录复合物的形成并启动基因表达过程。有多种从植物分离并得以表征的真核生物启动子,其对于驱动植物中的转基因表达是有功能的。已分离和表征了应答环境刺激、营养可用性、和包括热休克、厌氧生活或存在重金属在内的不利条件而影响基因表达的启动子。还有在发育期间或以组织或器官特异性方式控制基因表达的启动子。另外,已从细菌和病毒分离和表征了原核生物启动子,这些分离的原核生物启动子对于驱动植物中的转基因表达有功能。
典型的能够在真核生物中表达的启动子由最小启动子和其他顺式元件组成。最小启动子实质上是一个tata框区,rna聚合酶ii(polii)、tata结合蛋白(tbp)和tbp相关因子(taf)可在此结合而启动转录。然而,在大多数情况下,准确的转录需要tata基序以外的序列元件。已发现这类序列元件(例如增强子)提高临近的基因的总体表达水平,且往往是以不依赖位置和/或取向的方式。在一些polii基因的转录起始位点附近的其他序列(例如inr序列)可以为其他促进转录活化的因子提供可变剪接位点,在缺少功能性tata元件的启动子中,其甚至可替代地提供转录的核心启动子结合位点。zenzie-gregory等(1992)j.biol.chem.267:2823-30。
其他基因调控元件包括与特定dna结合因子相互作用的序列。这些序列基序有时称为顺式元件,且通常是位置和取向依赖性的,尽管它们可见于基因编码序列的5’或3’侧或内含子中。这类顺式元件,组织特异性或发育特异性转录因子结合的单独或组合地与它们结合,可以决定启动子在转录水平上的时空表达模式。上游顺式元件后随最小启动子的排列方式通常会产生具体启动子的极性。已克隆并广泛用于基础研究和生物技术应用的植物中的启动子一般是单向的,仅指导融合于其3’端(即下游)的一个基因。参见,xie等(2001)nat.biotechnol.19(7):677-9;美国专利6,388,170。
在植物启动子中已鉴定出许多顺式元件(或“上游调节序列”)。这些顺式元件施加于与其可操作连接的基因的控制有很大不同。一些元件作用于提高可操作连接的基因应答环境响应(例如温度、湿度和创伤)的转录。其他顺式元件可能对发育线索(developmentalcue)(例如萌发、种子成熟和开花)或空间信息(流例如组织特异性)应答。参见例如,langridge等(1989)proc.natl.acad.sci.usa86:3219-23。特定启动子元件的控制类型通常是启动子的内在性质;即,在这类启动子控制下的异源基因很可能依照该启动子元件所来源的天然基因的控制来表达。这些元件通常还可与其他元件交换并维持其对基因表达的特征性内在调控。
为了代谢工程和性状叠加的目的,经常需要将多个基因导入植物中,这些基因经常由相同的或同源的启动子调控。然而,当多个导入的转基因具有同源的启动子来驱动它们时,很可能发生基于同源性的基因沉默(hbgs)。mol等(1989)plantmol.biol.13:287-94。因此,已报告hbgs在转基因植物中大量发生。参见例如,vaucheret和fagard(2001)trendsgenet.17:29-35。提出了几种机制来解释hbgs现象,其均包括以下特征,即启动子中的序列同源性触发导致重复基因沉默的细胞识别机制。matzke和matzke(199547:23-48;fire(1999)trendsgenet.15:358-63;hamilton和baulcombe(1999)science286:950-2;steimer等(2000)plantcell12:1165-78。此外,为了获得不同转基因的相似水平的表达模式而重复使用相同的启动子,可能导致重复启动子中竞争性转录因子(tf)结合位点的过量,可导致内源性tf的耗竭并导致转录下调。
鉴于在转基因事件的单个基因座内强化表达多基因性状的需要越来越强烈,提供减少与创建此类转基因事件相关的技术挑战的解决方案是重要的。更具体地说,避免转基因植物中hbgs的策略经常涉及开发功能等同但具有最小序列同源性的人造启动子是理想的。当将这类人造启动子用于在作物植物中表达转基因时,它们可以有助于避免或减少hbgs。mourrainetal.(2007)planta225(2):365-79;bhullaretal.(2003)plantphysiol.132:988-98。
公开
在本发明的实施方案中,本公开涉及包含来自拟南芥泛素-10启动子和木薯叶脉花叶病毒启动子的多个启动子元件的人造木薯叶脉花叶病毒(csvmv)双向多核苷酸启动子。在另一个实施方案中,本发明公开包括各种启动子元件。相应地,启动子元件包含内含子。在一些情况下,启动子元件包含5'-utr。此外,启动子元件包含上游启动子元件。此外,启动子元件包含最小核心启动子。在本发明的实施方案中,本公开涉及用于产生转基因植物细胞的方法,包括以下步骤:a)用包含人造的csvmv双向多核苷酸启动子的基因表达盒转化植物细胞,所述人造的csvmv双向多核苷酸启动子可操作地连接于至少一个目的多核苷酸序列;b)分离包含基因表达盒的转化的植物细胞;和c)产生包含所述可操作地连接于至少一个目的多核苷酸序列的人造的csvmv双向多核苷酸启动子的转基因植物细胞。在本发明公开的实施方案中,本公开涉及用于在植物细胞中表达目的多核苷酸序列的方法,所述方法包括向植物细胞中引入可操作地连接于人造的csvmv双向多核苷酸启动子的目的多核苷酸序列。在本发明公开的实施方案中,本公开涉及包含人造的csvmv双向多核苷酸启动子的转基因植物细胞。
从以下参考附图进行的几个实施方案的详细描述,上述和其它特征将变得更加明显。
附图说明
图1:该图是长度为517bp的木薯叶脉花叶病毒启动子(“csvmv”)的示意图。最小核心启动子(“csvmv核心启动子”)已被鉴定为一个123bp区域,位于该启动子5'末端下游约320bp处。该csvmv启动子的示意图中包括了长度为74bp的5'utr区(“csvmv5'utr”)。
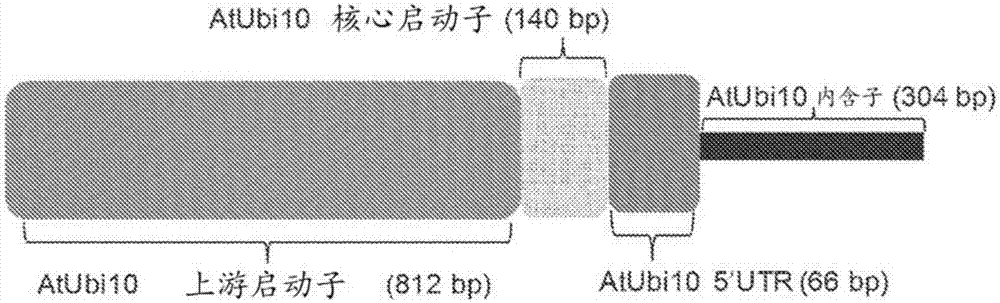
图2:该图是长度为1,332bp的拟南芥泛素10启动子(“atubi10”)的示意图。最小核心启动子(“atubi10核心启动子”)被鉴定为一个140bp区域,位于该启动子的5'端下游836bp处。该atubi10启动子的示意图中包括了长度为74bp的5'utr区(“atubi105'utr”)和长度为304bp的内含子(“atubi10内含子”)。
图3:该图提供了经粒子轰击用于表达gfp和rfp蛋白质的大豆未成熟胚的显微镜图像。大豆植物细胞中gfp和rfp转基因pdab113198(198gfp和198rfp)、pdab13199(199gfp和199rfp)、pdab13132(192gfp和192rfp)及pdab13134(194gfp和194rfp)的瞬时表达导致的绿色荧光蛋白和红色荧光蛋白的表达水平与对照构建体pdab113188(188gfp和188rfp)和pdab113190(190gfp和190rfp)中gfp和rfp转基因的表达水平相当。
图4:该图是从csvmv和atubi10双向启动子获得的rfp/gfp焦点的计数,与单向极性启动子进行比较。
图5:该图提供了经粒子轰击用于gfp和rfp表达的玉米胚的显微镜图像。在玉米植物细胞内的gfp和rfp转基因pdab113198、pdab113199、pdab113192、pdab113194、pdab113193、pdab113196和pdab113197的瞬时表达导致绿色荧光蛋白(图a)和红色荧光蛋白(图b)的表达。
图6:该图表示相对表达量,与通过双向启动子表达的rfp和gfp蛋白的荧光强度相关。
实施发明的模式
i.若干实施方案的概览
转基因植物的开发正变得越来越复杂,且通常需要将多个转基因堆叠到单个基因座中。参见xie等(2001)nat.biotechnol.19(7):677-9。由于每个转基因通常需要唯一的启动子用于表达,因此需要多个启动子来表达一个基因叠加内的不同转基因。除了增加基因叠加的大小外,这还通常导致同一启动子被重复使用,以获得不同转基因的相似水平的表达模式。该办法经常造成问题,因为由同一启动子驱动多个转基因的表达可能导致基因沉默或hbgs。重复启动子中竞争性转录因子(tf)结合位点的过量可能导致内源性tf的消耗并引起转录下调。转基因的沉默对产生的转基因植物表达转基因的性能而言是不期望的。在转基因内的重复序列经常导致基因基因座内同源重组,从而导致多核苷酸重排以及不合需要的表型或者农艺性能。
用于基础研究或生物技术应用的植物启动子一般是单向的,且仅调节在其3’端融合(下游)的一个基因。为了产生具有多种期望性状或特征的转基因植物,减少驱动编码期望性状和特征的转基因表达的配置启动子的数目将是有用的。尤其是在需要将多个转基因导入植物用于代谢工程和性状叠加,由此需要多个启动子来驱动多个转基因的表达的应用中。通过开发能驱动启动子侧翼的两个转基因表达的单一人造csvmv双向启动子,可以减少开发转基因作物所需的启动子的总数,由此减少同一启动子的重复施用,减小转基因构建体的大小,和/或降低hbgs的可能性。这样的启动子可以通过将已知的顺式元件引入新的或人造的dna段中来产生,或者通过“域交换”来产生,在“域交换”中,一个启动子的结构域被替换为来自其他异源启动子的功能等同的结构域。
本文的实施方案利用这样的方法,其中利用来自拟南芥泛素-10基因的单向启动子(例如atubi10)和木薯叶脉花叶病毒启动子(例如,csvmv)设计人造的csvmv双向启动子,使得一个启动子可以驱动两个基因的表达,每个在该启动子的一端。人造的csvmv双向启动子可允许本领域技术人员将转基因叠加到植物细胞和植物中,同时减少相同启动子的重复使用,并减小转基因构建体的大小。此外,用单一的人造csvmv双向启动子来调节两个基因的表达还提供在相同条件下共表达这两个基因的能力,如例如当两个基因各自有助于宿主中的单一性状时可能有用。已报告了在植物中利用启动子的双向功能的一些事例,包括玉米泛素1启动子(国际专利公布号wo2013101343a1)、camv35启动子(barfield和pua(1991)plantcellrep.10(6-7):308-14;xie等(2001)同上)和mas启动子(velten等(1984)emboj.3(12):2723-30;langridge等(1989)proc.natl.acad.sci.usa86:3219-23)。
植物基因中基因表达的转录启动和调控受共同排列在启动子内的多种dna序列元件的指导。真核生物启动子的组成为最小核心启动子元件(minp)和其他上游调控序列(urs)。核心启动子元件是足以指导准确的转录启动的连续dna序列的最小区段。植物中的核心启动子还包含与转录启动有关的规范区,如caat和tata框。tata框元件通常位于转录启动位点上游的约20至35个核苷酸。
minp的活化依赖于urs,多种蛋白质与之结合并随后与转录启动复合物相互作用。urs包含这样的dna序列,它们确定包含urs的启动子的时空表达模式。启动子的极性经常由minp的取向决定,而urs是双极的(即其功能独立于其取向)。
在一些实施方案的具体实例中,利用最初来源于拟南芥的拟南芥ubi10启动子(atubi10)的最小核心启动子元件(minubi10p)来工程构建在植物中起作用的人造csvmv双向启动子,以提供相对于先前描述的双向启动子而言独特的表达控制特征。实施方案包括人造的csvmv双向启动子,该启动子还包含衍生自天然csvmv启动子的最小核心启动子元件核苷酸序列(mincsvmvp)。在其他实施方案中,利用最初来源于木薯叶脉花叶病毒的修饰木薯叶脉花叶病毒启动子(csvmv)的最小核心启动子元件来工程构建可以在植物中起作用的人造双向拟南芥ubi10启动子,以提供相对于先前可用的双向启动子而言独特的表达控制特征。实施方案包括人造双向atubi10启动子,该启动子还包含衍生自天然atubi10启动子的最小核心启动子元件核苷酸序列。
atubi10启动子包含源自拟南芥基因组的序列。在一些实例中使用的修饰的atubi10启动子是约1.3kb的启动子,含有:tata盒;5'utr;和内含子。其他来自拟南芥属物种和拟南芥基因型的拟南芥泛素启动子变体可能在由tata元件组成的minp元件周围表现出高序列保守性。因此,使用atubi10启动子的这一短的、高度保守的区域(例如,seqidno:1)作为用于构建人造双向植物启动子的最小核心启动子元件,用来例示本发明的实施方案。
csvmv启动子包含源自木薯叶脉花叶病毒基因组的序列。在一些实例中使用的修饰的csvmv启动子是约0.5kb启动子,含有tata盒和5'utr。其他衍生自木薯病毒物种和木薯叶脉花叶病毒变体的木薯叶脉花叶病毒启动子变体可能在由tata元件组成的minp元件周围显示高序列保守性。因此,使用csvmv启动子的这一短的、高度保守的区域(例如,seqidno:5)作为用于构建人造双向植物启动子的最小核心启动子元件,用来例示本发明的实施方案
ii.缩写
atubi10拟南芥泛素10
bca二辛可宁酸
camv花椰菜花叶病毒
csvmv木薯叶脉花叶病毒
ctp叶绿体转运肽
hbgs基于同源性的基因沉默
minubi1p最小核心启动子
ola寡聚物连接扩增
pcr聚合酶链式反应
rca滚环扩增
rt-pcr逆转录酶pcr
snupe单核苷酸引物延伸
urs上游调控序列
iii.术语
在本申请全文中使用了许多术语。为了提供对说明书和权利要求的清楚和一致的理解,包括要给予此类术语的范围,提供以下定义。
内含子:如本文中使用的,短语“内含子”指转录但不翻译的基因(或表达的目的多核苷酸序列)中所包含的任意核酸序列。内含子包括在表达的dna序列内的不翻译的核酸序列,以及从其转录的rna分子中的相应序列。
分离的:“分离的”生物学组分(如核酸或蛋白质)已经从该组分所天然存在的生物体细胞中的其它生物学组分(即其它染色体和染色体外的dna和rna、和蛋白质)实质性分开、分开产生、或纯化出来,同时引起该组分中的化学或功能变化(例如可通过断裂将核酸连接到染色体中的剩余dna的化学键从染色体分离核酸)。已经“分离的”核酸分子和蛋白质包含通过标准的纯化方法纯化的核酸分子和蛋白质。该术语还包括通过在宿主细胞中重组表达制备的核酸和蛋白质,以及化学人造的核酸分子、蛋白质和肽。
基因表达:核酸转录单元(包括例如基因组dna)的编码信息被转化成细胞的运作性、非运作性或结构性部分的过程,往往包括蛋白质合成。基因表达可能受到外部信号,例如,细胞、组织或生物体暴露于增加或降低基因表达的作用剂,的影响。基因的表达还可在从dna到rna到蛋白质的途径中的任何一处受到调节。基因表达调节的发生方式有,例如,经由作用于转录、翻译、rna运输和加工、中间分子如mrna的降解的控制,或经由活化、失活、区室化、或生成特定蛋白质分子后的其降解、或其组合。基因表达可在rna水平或蛋白质水平上通过本领域中已知的任意方法来测量,包括但不限于,northern印迹、rt-pcr、western印迹、或体外、原位或体内蛋白质活性测定法。
基于同源性的基因沉默:如本文中使用的,短语“基于同源性的基因沉默”(hbgs)是包括转录性基因沉默和转录后基因沉默两者在内的一般术语。非连锁的致沉默基因座对靶基因座的沉默作用可能缘于转录抑制(转录性基因沉默;tgs)或mrna降解(转录后基因沉默;ptgs),转录抑制或mrna降解分别是由对应于启动子或转录序列的双链rna(dsrna)的产生所导致。在每个过程中牵涉的细胞组分不同,表明dsrna诱导的tgs和ptgs很可能是一种古老的通用机制的多样化的结果。然而,难以实现tgs和ptgs的严格比较,因为这种比较一般依赖于对不同沉默基因座的分析。我们描述既触发tgs又触发ptgs的单个转基因基因座,这是由于对应于不同靶基因的启动子和转录序列的dsrna的产生。mourrain等(2007)planta225:365-79。sirna很可能是触发同源序列上的tgs和ptgs的实际分子:在此模型中,通过转基因序列的甲基化扩散到内源性启动子中,sirna可以顺式地或反式地触发同源序列的沉默和甲基化,见上文。
核酸分子:如本文中使用的,术语“核酸分子”(或“核酸”或“多核苷酸”)可以指核苷酸的聚合形式,其可以包括rna、cdna、基因组dna的有义和反义链以及上述者的人造形式和混合的聚合物。核苷酸可以指核糖核苷酸、脱氧核糖核苷酸、或任一核苷酸类型的修饰形式。如本文中使用的“核酸分子”与“核酸”和“多核苷酸”同义。除非另外指明,核酸分子通常长度为至少10个碱基。该术语可以指具有不确定长度的rna或dna分子。该术语包括dna的单链和双链形式。核酸分子可以包含通过天然和/或非天然核苷酸联接而连接在一起的、天然和/或修饰的核苷酸。
核酸分子可以被化学或生化修饰,或者可以含有非天然或衍生化的核苷酸碱基,如本领域技术人员会容易领会的。这类修饰包括,例如标记物、甲基化、用类似物取代一个或多个天然存在的核苷酸、核苷酸间修饰(例如不带电荷的连接:例如膦酸甲酯、磷酸三酯、氨基磷酸酯、氨基甲酸酯等;带电荷的连接:例如,硫代磷酸酯、二硫代磷酸酯等;悬垂模块:例如肽;嵌入剂:例如吖啶、补骨脂素等;螯合剂;烷化剂;和经修饰的连接:例如alpha异头核酸等)。术语“核酸分子”还包括任何拓扑学构象,包括单链、双链、部分的双链体、三链体、发夹、环状和挂锁式(padlocked)构象。
转录以5’至3’方式沿dna链前进。这意味着rna通过将核糖核苷酸-5’-三磷酸连续添加到延伸的链的3’末端来制备(要求消除焦磷酸)。在线性或环状核酸分子中,如果独立元件(例如特定的核苷酸序列)在同一核酸中或者会在同一核酸中键合于另一元件的5’方向,则可称它们相对于该另一元件为“上游”,类似地,如果独立元件在同一核酸中或者会在同一核酸中键合于另一元件的3’方向,则可称它们相对于该另一元件为“下游”。
如本文中使用的,短语“碱基位置”指给定的碱基或核苷酸残基在指定核酸内的位置。所述指定的核酸可通过与参照核酸比对(见下文)来限定。
杂交:寡核苷酸及其类似物通过互补碱基之间的氢键杂交的过程,所述氢键包括watson-crick、hoogsteen或反hoogsteen氢键。一般而言,核酸分子由含氮碱基组成,所述碱基为嘧啶(胞嘧啶(c)、尿嘧啶(u)和胸腺嘧啶(t))或嘌呤(腺嘌呤(a)和鸟嘌呤(g))。这些含氮碱基在嘧啶和嘌呤之间形成氢键,并且嘧啶对嘌呤的键合称为“碱基互补”。更具体地,a会与t或u氢键键合,而g会与c键合。“互补”指在两条不同的核酸序列或同一核酸序列的两个不同区域之间发生的碱基互补。
“可特异性杂交”和“特异性互补”是表明程度足以从而使得寡核苷酸与dna或rna靶物之间发生稳定且特异性的结合的互补性的术语。可特异性杂交不需要寡核苷酸与其靶序列为100%互补。如果寡核苷酸对靶dna或rna分子的结合可干扰靶dna或rna的正常功能,而且寡核苷酸有足够程度的互补性来避免寡核苷酸在期望特异性结合的条件下(例如在体内测定法或系统的情况中在生理学条件下)对非靶序列发生非特异性结合,则寡核苷酸是可特异性杂交的。这样的结合称为特异性杂交。
产生特定严格度的杂交条件会根据选择的杂交方法的性质和杂交的核酸序列的组成和长度而变化。一般地,杂交温度和杂交缓冲液的离子强度(特别是na+和/或mg2+浓度)会对杂交的严格性起贡献,但洗涤次数也影响严格性。sambrook等(编),molecularcloning:alaboratorymanual,第2版,1-3卷,coldspringharborlaboratorypress,coldspringharbor,ny,1989,第9章和第11章论述了得到特定严格度所需要的杂交条件的有关计算方法。
如本文中使用的,“严格条件”涵盖这样的条件,在该条件下仅当杂交分子与dna靶物之间有低于50%的错配时才会发生杂交。“严格条件”包括其他具体的严格性水平。如此,如本文中使用的,“中等严格性”条件是这样的条件,在该条件下,具有超过50%序列错配的分子不会杂交;“高严格性”条件是这样的条件,在该条件下,具有超过20%错配的序列不会杂交;而“极高严格性”条件是这样的条件,在该条件下,具有超过10%错配的序列不会杂交。
在具体的实施方案中,严格条件可包括在65℃杂交,接着在65℃用0.1xssc/0.1%sds洗涤40分钟。
以下是代表性的非限制性杂交条件:
极高严格性:在5xssc缓冲液中在65℃杂交16小时;在2xssc缓冲液中各在室温洗涤15分钟两次;和在0.5xssc缓冲液中各在65℃洗涤20分钟两次。
高严格性:在5x-6xssc缓冲液中在65℃-70℃杂交16-20小时;在2xssc缓冲液中各在室温洗涤5-20分钟两次;和在1xssc缓冲液中各在55℃-70℃洗涤30分钟两次。
中等严格性:在6xssc缓冲液中在室温至55℃杂交16-20小时;在2x-3xssc缓冲液中各在室温至55℃洗涤20-30分钟至少两次。
在具体的实施方案中,特异性可杂交的核酸分子可在极高严格性的杂交条件下保持结合。在这些和别的实施方案中,特异性可杂交的核酸分子可在高严格性的杂交条件下保持结合。在这些和别的实施方案中,特异性可杂交的核酸分子可在中等严格性的杂交条件下保持结合。
寡核苷酸:寡核苷酸是短的核酸聚合物。寡核苷酸可通过切割更长的核酸区段,或通过聚合各个核苷酸前体而形成。自动化的合成仪允许合成长达数百个碱基对的寡核苷酸。由于寡核苷酸可结合互补核苷酸序列,因此可将它们用作探针来检测dna或rna。由dna构成的寡核苷酸(寡聚脱氧核糖核苷酸)可用于pcr,一种用来扩增小dna序列的技术。在pcr中,寡核苷酸一般称为“引物”,其允许dna聚合酶延伸寡核苷酸并复制互补链。
序列同一性:术语“序列同一性”或“同一性”,如本文中使用的,在两条核酸或多肽序列的语境中,可以指当进行比对以在规定的比较窗口上实现最大对应性时,两条序列中相同的残基。
如本文中使用的,术语“序列同一性百分比”可以指通过在比较窗口内比较两条最佳比对的序列(例如核酸序列和氨基酸序列)所测定的值,其中为了实现两条序列的最佳比对,比较窗口中的序列部分相比于参照序列(不包含添加或缺失)可以包含添加或缺失(即缺口)。百分比如下计算:确定两条序列中出现相同核苷酸或氨基酸残基的位置的数目而得到匹配位置的数目,将匹配位置的数目除以比较窗口中的总位置数目,并将结果乘以100,得到序列同一性百分比。
用于比较的序列比对方法是本领域中公知的。各种程序和比对算法记载于,例如:smith和waterman(1981)adv.appl.math.2:482;needleman和wunsch(1970)j.mol.biol.48:443;pearson和lipman(1988)proc.natl.acad.sci.u.s.a.85:2444;higgins和sharp(1988)gene73:237-44;higgins和sharp(1989)cabios5:151-3;corpet等(1988)nucleicacidsres.16:10881-90;huang等(1992)comp.appl.biosci.8:155-65;pearson等(1994)methodsmol.biol.24:307-31;tatiana等(1999)femsmicrobiol.lett.174:247-50。对序列比对方法和同源性计算的详细讨论可见于例如altschul等(1990)j.mol.biol.215:403-10。
美国国家生物技术信息中心(nationalcenterforbiotechnologyinformation)(ncbi)基础本地比对搜索手段(basiclocalalignmentsearchtool)(
可操作连接:当第一核酸序列与第二核酸序列存在功能关系时,第一核酸序列与第二核酸序列是可操作连接的。例如,若启动子影响编码序列的转录或表达,则该启动子与该编码序列是可操作连接的。当可操作连接的多个核酸序列为重组产生时,它们一般是连续的,且在有必要连接两个蛋白质编码区时,它们位于同一阅读框中。然而,可操作连接的多个元件不一定需要是连续的。
启动子:一般位于上游(靠近基因的5’区)的为转录所必需的dna区域。启动子可以允许其控制的基因的适宜的活化或抑制。启动子可以含有由转录因子识别的特定序列。这些因子可以结合启动子dna序列并导致rna聚合酶(一种从基因的编码区合成rna的酶)的募集。
转化:当被转导到细胞中的核酸分子变得被该细胞稳定复制时(通过将核酸分子掺入细胞基因组或通过附加体复制),该细胞被该核酸分子“转化”。如本文中使用的,术语“转化”涵盖可将核酸分子导入这类细胞的所有技术。例子包括但不限于:用病毒载体转染;用质粒载体转化;电穿孔(fromm等(1986)nature319:791-3);脂质转染(felgner等(1987)proc.natl.acad.sci.usa84:7413-7);显微注射(mueller等(1978)cell15:579-85);土壤杆菌介导的转移(fraley等(1983)proc.natl.acad.sci.usa80:4803-7);直接dna摄取;晶须介导的转化;和微射弹轰击(microprojectilebombardment)(klein等(1987)nature327:70)。
转基因:外源核酸序列。在一个例子中,转基因是基因序列(例如除草剂抗性基因),编码工业或药学可用化合物的基因,或编码期望的农学性状的基因。在又一个例子中,转基因是反义核酸序列,其中反义核酸序列的表达抑制靶核酸序列的表达。转基因可以含有可操作连接于转基因的调控序列(例如启动子)。在一些实施方案中,目的多核苷酸序列是转基因。然而,在其他实施方案中,目的多核苷酸序列是内源核酸序列,其中期望该内源核酸序列的额外的基因组拷贝,或者目的核酸序列是相对于宿主生物体中的靶核酸分子序列而言处于反义取向的核酸序列。
转基因事件:通过用异源dna(即包括目的转基因的核酸构建体)转化植物细胞,再生由于该转基因插入到植物的基因组中而产生的植物的群体,并选择以特定的基因组位置中的插入为特征的特定植物,产生转基因“事件”。术语“事件”是指原始转化体以及该转化体的包含异源dna的后代。术语“事件”还指该转化体与包含所述基因组/转基因dna的另一品种之间的有性远交产生的后代。即使在与轮回亲本反复回交之后,来自转化的亲本的插入的转基因dna和侧翼基因组dna(基因组/转基因dna)仍存在于杂交后代中相同的染色体位置。术语“事件”还指来自起始转化体及其包含插入的dna和直接邻接于插入的dna的侧翼基因组序列的后代的dna,预期该dna会被转移至这样的后代:所述后代作为一个含有插入的dna的亲本系(例如起始转化体和其自交所得的后代)和不一个含有该插入的dna的亲本系有性杂交的结果而接受了含有目的转基因的插入的dna。
载体:被导入到细胞中,由此生成被转化的细胞的核酸分子。载体可以包含允许其在宿主细胞中复制的核酸序列,诸如复制起点。例子包括,但不限于,携带外源dna进入细胞的质粒、粘粒、噬菌体或病毒。载体还可以包含一种或多种基因、反义分子和/或选择标志物基因以及本领域中已知的其它遗传元件。载体可以转导、转化或感染细胞,由此使得细胞表达载体所编码的核酸分子和/或蛋白质。任选地,载体可以包括帮助实现核酸分子进入细胞的材料(例如脂质体、蛋白质外壳,等等)。
除非另外特定地解释,本文中使用的所有技术和科学术语具有与本公开所属领域的普通技术人员通常理解的相同的含义。对分子生物学常见术语的定义可见于例如:lewin,genesv,oxforduniversitypress,1994(isbn0-19-854287-9);kendrew等(编),theencyclopediaofmolecularbiology,blackwellscienceltd.,1994(isbn0-632-02182-9);和meyers(编),molecularbiologyandbiotechnology:acomprehensivedeskreference,vchpublishers,inc.,1995(isbn1-56081-569-8)。
如本文中使用的,冠词“一”(a、an)和“该”(the)包括复数指称,除非上下文清楚明确地另有要求。
iv.人造双向启动子,csvmv或atubi10,以及包含其的核酸
本公开提供了包含可用作双向启动子的人造核苷酸序列的核酸分子。在一些实施方案中,人造csvmv双向启动子可以可操作地连接于一个或两个目的多核苷酸序列。例如,人造csvmv双向启动子可以可操作地连接于一个或两个编码基因的目的多核苷酸序列(例如,两个基因,启动子的每个末端一个),从而调节至少一个(例如,一个或两个)目的核苷酸序列的转录。在一些实施方案中,通过在人造csvmv双向启动子中纳入来自csvmv启动子的urs,可以针对可操作地连接于人造csvmv双向启动子的目的多核苷酸序列实现特定的表达和调节模式(例如,由csvmv启动子控制下的基因表现)。在其它实施方案中,通过在人造csvmv双向启动子中纳入来自atubi10启动子的urs,可以针对可操作地连接到人造csvmv双向启动子的目的多核苷酸序列实现特定的表达和调节模式(例如,由atubi10启动子控制下的基因表现)。
通过将来自单向拟南芥泛素-10基因(atubi10)启动子的最小核心启动子元件并入与天然启动子不同的分子环境中来工程构建人造的csvmv双向启动子,来例示本发明的一些实施方案。该最小核心启动子元件在本文中称为“minubi10p”,长度为约140bp。minubi10p元件的测序和分析可以保留作为转录启动子的功能,如果其共享至少约75%;至少约80%;至少约85%;至少约90%;至少约91%;至少约92%;至少约93%;至少约94%;至少约95%;至少约96%;至少约97%;至少约98%;至少约99%;和/或至少约100%)与seqidno:1的minubi10p元件的序列同一性。在本发明的一些实施方案中可能有用的minubi10p元件的特征可以包括,例如不限于,上述的核苷酸序列的高度保守;至少一个tata盒的存在。具体地,minubi10p元件可能在minubi10p序列内重叠。
在实施方案中,将minubi10p元件纳入与天然启动子不同的分子上下文中以工程化人造csvmv双向启动子的过程可以包括将minubi10p元件掺入csvmv启动子核酸或atubi10启动子核酸,同时相对于csvmv或atubi10启动子的天然序列逆转minubi10p元件的取向。因此,人造csvmv或atubi10双向启动子可以包含位于csvmv或atubi10启动子核苷酸序列的5'、且与之朝向相反的minubi10p最小核心启动子元件,使得其可以可操作地连接位于csvmv或atubi10启动子核苷酸序列5'的多核苷酸序列。例如,minubi10p元件可以以反向取向并入csvmv或atubi10启动子的5'末端。
在本文中,将来自单向木薯叶脉花叶病毒基因(csvmv)启动子的最小核心启动子元件掺入不同于天然启动子的分子背景中以工程化构建人造csvmv双向启动子,来例示本发明的一些实施方案。该最小核心启动子元件在本文中称为“mincsvmvp”,且长度为约123bp。对mincsvmvp元件的测序和分析可能保留其作为转录启动者的功能,如果,例如,其与seqidno:5的mincsvmvp元件有至少约75%;至少约80%;至少约85%;至少约90%;至少约91%;至少约92%;至少约93%;至少约94%;至少约95%;至少约96%;至少约97%;至少约98%;至少约99%;和/或至少约100%序列同一性的话。在本发明的一些实施方案中可用的mincsvmvp元件的特征可包括,例如但不限于,前述的核苷酸序列的高度保守性;至少一个tata框的存在。具体地,mincsvmvp元件可在mincsvmvp序列中有重叠。
在实施方案中,将mincsvmvp元件纳入不同于天然启动子的分子上下文中以工程化构建人造的csmv双向启动子的方法可以包括将mincsvmvp元件掺入csvmv启动子核酸或atubi10启动子核酸中,同时逆转核酸中mincsvmvp元件相对于csvmv或atubi10启动子的其余序列的取向。如此,人造的csvmv或atubi10双向启动子可以包含位于csvmv或atubi10启动子核苷酸序列的5’、且与之呈相反取向的mincsvmvp最小核心启动子元件,使得其可以可操作连接于位于该csvmv或atubi10启动子核苷酸序列5’的目的多核苷酸序列。例如,mincsvmvp元件可以以相反取向纳入在csvmv或atubi10启动子的5’末端。
人造csvmv双向启动子除了minubi10p元件以及天然csvmv启动子的元件(包括mincsvmvp)外,还可以包含一个或多个另外的序列元件。在一些实施方案中,人造csvmv双向启动子可以包含启动子urs;外显子(例如前导或信号肽);内含子;间隔物序列;和/或一个或多个前述任何者的组合。例如而不限于,人造csvmv双向启动子可以包含来自csvmv启动子的urs序列;来自adh基因的内含子;编码来自atubi10基因的前导肽的外显子;来自atubi10基因的内含子;以及这些的组合。
人造的双向atubi10启动子除了mincsvmvp元件和天然atubi10启动子的元件(包括minubi10p)之外还可以包含一个或多个另外的序列元件。在一些实施方案中,人造双向atubi10启动子可以包含启动子urs;外显子(例如,前导或信号肽);内含子;间隔物序列;和/或一个或多个前述任何者的组合。例如且不限于,人造的双向atubi10启动子可以包含来自atubi10启动子的urs序列;adh基因的内含子;编码来自atubi10基因的前导肽的外显子;来自atubi10基因的内含子;以及这些的组合。
在包含启动子urs的启动子的一些实施方案中,可选择urs使之赋予人造启动子特定的调节特性。已知的启动子在其施加于可操作连接的基因上的控制类型中有广泛不同(例如环境应答、发育提示和空间信息),且掺入异源启动子的urs通常可维持urs就其天然启动子和可操作连接的基因而言所展现的控制类型。langridge等(1989),见上。已表征且依照一些实施方案可以含有包含在人造双向玉米泛素1启动子内的urs的真核生物启动子的例子包括,例如而不限于:在美国专利no.6,437,217(玉米rs81启动子);5,641,876(稻肌动蛋白启动子);6,426,446(玉米rs324启动子);6,429,362(玉米pr-1启动子);6,232,526(玉米a3启动子);6,177,611(组成型玉米启动子);6,433,252(玉米l3油质蛋白(oleosin)启动子);6,429,357(稻肌动蛋白2启动子和稻肌动蛋白2内含子);5,837,848(根特异性启动子);6,294,714(可被光诱导的启动子);6,140,078(可被盐诱导的启动子);6,252,138(可被病原体诱导的启动子);6,175,060(可被磷缺乏诱导的启动子);6,388,170(双向启动子);6,635,806(gamma-coixin启动子);和美国专利申请流水号09/757,089(玉米叶绿体醛缩酶启动子)中描述的那些启动子。
另外的例示性原核生物启动子包括胭脂碱(nopaline)合酶(nos)启动子(ebert等(1987)proc.natl.acad.sci.usa84(16):5745-9);章鱼碱(octopine)合酶(ocs)启动子(其携带在根癌土壤杆菌(agrobacteriumtumefaciens)的肿瘤诱导性质粒上);花椰菜花叶病毒启动子如花椰菜镶嵌病毒(camv)19s启动子(lawton等(1987)plantmol.biol.9:315-24);camv35s启动子(odell等(1985)nature313:810-2;玄参镶嵌病毒35s启动子(walker等(1987)proc.natl.acad.sci.usa84(19):6624-8);蔗糖合酶启动子(yang和russell(1990)proc.natl.acad.sci.usa87:4144-8);r基因复合物启动子(chandler等(1989)plantcell1:1175-83);camv35s(美国专利no.5,322,938,5,352,605,5,359,142和5,530,196);fmv35s(美国专利no.6,051,753和5,378,619);pc1sv启动子(美国专利no.5,850,019);scp1启动子(美国专利no.6,677,503);和根癌土壤杆菌nos启动子(genbank登录号v00087;depicker等(1982)j.mol.appl.genet.1:561-73;bevan等(1983)nature304:184-7)等。
在一些实施方案中,人造csmv双向启动子还可以包含外显子。例如,可能期望将可操作地连接于启动子的目的多核苷酸序列所编码的多肽靶向或运输到特定的亚细胞位置和/或区室。在这些和其他实施方案中,编码序列(外显子)可以纳入剩余的人造csvmv双向启动子序列与编码多肽的核苷酸序列之间的核酸分子中。可以依照熟练从业人员的判断来安排这些元件从而使得人造csvmv双向启动子促进多肽(或可操作地连接于启动子的两个多肽编码序列之一或两个)的表达,所述多肽包含由纳入编码序列编码的多肽与其余多肽处于功能关系中。在具体的例子中,可以纳入编码前导、转运或信号肽(例如拟南芥ubi10前导肽)的外显子。
可以由掺入人造csvmv双向启动子的外显子编码的肽包括,例如而不限于:泛素(例如拟南芥ubi10)前导序列;叶绿体转运肽(ctp)(例如拟南芥epspsctp(klee等(1987)mol.gen.genet.210:437-42),和矮牵牛(petuniahybrida)epspsctp(della-cioppa等(1986)proc.natl.acad.sci.usa83:6873-7)),如对于麦草畏单加氧酶(dmo)的叶绿体靶向在国际pct公开文本no.wo2008/105890中所例示的。
在本发明的一些实施方案中还可以将内含子纳入人造csvmv双向启动子,例如在剩余的人造csvmv双向启动子序列与可操作地连接于启动子的目的多核苷酸序列之间。在一些例子中,纳入人造csvmv双向启动子的内含子可以为(不构成限制)充当翻译前导序列的5′utr,其存在于翻译起始序列上游的完全加工过的mrna中(此类翻译前导序列可以影响初始转录本到mrna的加工、mrna稳定性和/或翻译效率)。翻译前导序列的例子包括玉米和矮牵牛花热休克蛋白前导序列(美国专利no.5,362,865)、植物病毒外壳蛋白前导序列、植物rubisco前导序列等。参见例如,turner和foster(1995)molecularbiotech.3(3):225-36。5′utr的非限制性例子包括gmhsp(美国专利no.5,659,122);phdnak(美国专利no.5,362,865);atant1;tev(carrington和freed(1990)j.virol.64:1590-7);和agrtunos(genbank登录号v00087;和bevan等(1983)nature304:184-7)。在特定的实例中,可以将拟南芥泛素10内含子掺入人造csvmv双向启动子。
可任选地纳入人造csvmv双向启动子中的另外的序列包括,例如而不限于:3’非翻译序列;3’转录终止区;和多腺苷酸化区。这些是位于目的多核苷酸序列(例如可操作地连接于人造csvmv双向启动子的目的基因序列)下游的遗传元件,且包括提供多腺苷酸化信号的多核苷酸,和/或能影响转录、mrna加工或基因表达的其他调节信号。多腺苷酸信号在植物中可作用于引起多腺苷酸核苷酸到mrna前体3’端的添加。所述多腺苷酸化序列可源自天然基因、多种植物基因或t-dna基因。3’转录终止区的非限制性例子是胭脂碱合酶3’区(nos3’;fraley等(1983)proc.natl.acad.sci.usa80:4803-7)。ingelbrecht等(1989),plantcell1:671-80中提供了使用不同的3’非翻译区的例子。多腺苷酸化信号的非限制性例子包括来自豌豆(pisumsativum)rbcs2基因(ps.rbcs2-e9;coruzzi等(1984)emboj.3:1671-9)和根癌土壤杆菌nos基因(genbank登录号e01312)的多腺苷酸化信号。
在一些实施方案中,人造csvmv双向启动子包含一个或多个促进包含该启动子的核酸靶定到靶生物体基因组中的特定基因座处的核苷酸序列。例如,可以纳入与宿主中的基因组dna序列(例如稀有或唯一的基因组dna序列)区段同源的一个或多个序列。在一些例子中,这些同源序列可以指导包含人造csvmv双向启动子的核酸在宿主基因组中同源dna位点处的重组和整合。在具体的例子中,人造的csvmv双向启动子包含一个或多个促进包含该启动子的核酸靶定到宿主基因组中的稀有或唯一位置处的核苷酸序列,其利用了识别在该稀有或唯一位置处的序列并促进在该稀有或唯一位置处的整合的工程化的核酸酶。采用锌指内切核酸酶作为核酸酶的这类靶向性整合系统记载于美国专利申请no.13/011,735中,将其全部内容通过该提述并入本文。
在其他实施方案中,本公开还包括包含性状的目的多核苷酸序列作为一个实施方案。所述性状可以是杀虫剂抗性性状,除草剂耐性性状,氮利用效率性状,水分利用效率性状,营养品质性状,dna结合性状,选择标记物性状,及其任意组合。
在进一步的实施方案中,性状作为转基因事件整合在转基因植物细胞内。在另外的实施方案中,转基因事件产生商业产品。因此,自本公开的转基因植物细胞衍生组合物,其中所述组合物是选自粕(meal),面粉(flour),蛋白质浓缩物或油的商业产品。在进一步的实施方案中,包括由转化的植物细胞衍生的转基因植物产生的商业产品,其中商业产品包含可检测量的本发明的核酸序列。在一些实施方案中,这样的商业产品可以通过,例如,获得转基因植物并从中制备食物或饲料来加以生产。包含一个或多个本发明的核酸序列的商业产品包括,例如但不限于:植物的粕、油、粉碎的或完全的谷粒或种子,以及任何如下所述的食物产品:其包含重组植物或种子的任何包含本发明的一个或多个核酸序列的粕、油、粉碎的或完全的谷粒。在一种或多种商品或商业产品中检测本发明的一个或多个序列是事实上的证据,证明该商品或商业产品是从旨在表达一种或多种农艺性状的转基因植物产生的。
可以使用任何本领域中已知的技术来产生包含人造csvmv双向启动子的核酸,包括例如而不限于:rca;pcr扩增;rt-pcr扩增;ola;和snupe。这些和其他等同技术是本领域技术人员公知的,且进一步详细记载于,例如而不限于:sambrook等,molecularcloning:alaboratorymanual,3rded.,coldspringharborlaboratory,2001;和ausubel等,currentprotocolsinmolecularbiology,johnwiley&sons,1998。通过提述整体并入上文引用的所有参考文献,包括前述两者的手册,包括其中提供的任意附图、图、和/或表。
v.向细胞投递包含人造双向启动子csvmv的核酸分子
本公开还提供用于用包含人造csvmv双向启动子的核酸分子来转化细胞的方法。依照一些实施方案,可以使用本领域已知用于将核酸分子导入植物中的大量技术中的任一种来将植物用包含人造csvmv双向启动子的核酸分子转化,例如,以将一个或多个人造csvmv双向启动子导入宿主植物基因组,和/或进一步导入可操作地连接于启动子的一个或多个目的核苷酸。
用于植物转化的合适方法包括可将dna导入细胞的任意方法,例如而不限于:电穿孔(参见例如,美国专利5,384,253);微射弹轰击(参见例如,美国专利5,015,580,5,550,318,5,538,880,6,160,208,6,399,861和6,403,865);土壤杆菌介导的转化(参见例如,美国专利5,635,055,5,824,877,5,591,616;5,981,840和6,384,301);和原生质体转化(参见例如,美国专利5,508,184)。通过应用如前所述的技术,可以稳定地转化基本上任意植物物种的细胞,并且通过本领域技术人员已知的技术使这些细胞发育成转基因植物。例如,在棉花转化的背景中可能特别有用的技术记载于美国专利5,846,797,5,159,135,5,004,863和6,624,344;具体用于转化芸苔属植物的技术记载于例如美国专利5,750,871;用于转化大豆的技术记载于例如美国专利6,384,301;而用于转化玉米的技术记载于例如美国专利7,060,876和5,591,616和国际pct公开文本wo95/06722。
在实现外源核酸到受体细胞的投递后,一般鉴定出经转化的细胞用于进一步培养和植物再生。为了改进鉴定转化体的能力,可能期望采用可选择或可筛选的标志基因和用于生成转化体的转化载体。在此情况中,可通过将细胞暴露于一种或多种选择剂来测定潜在转化的细胞群体,或可对细胞筛选期望的标志基因性状。
可在支持植物再生的培养基中培养从暴露于选择剂存活的细胞,或在筛选测定法中得分为阳性的细胞。在一些实施方案中,可通过纳入别的物质如生长调节剂来改良任何适宜的植物组织培养基(例如ms和n6培养基)。可在具有生长调节剂的基础培养基上维持,直至可获得足够的组织来开始植物再生工作,或者直至在重复若干轮手动选择后组织的形态适合于再生(例如至少2周),然后转移至有助于芽形成的培养基。周期性地转移培养物直至已发生充分的芽形成。一旦形成芽,就将其转移到有助于根形成的培养基。一旦形成充足的根,就将植物转移到土壤进行进一步生长和成熟。
为了确认包含人造csvmv双向启动子的期望的核酸分子在再生植物中的存在,可以实施多种测定法。这类测定法包括例如:分子生物学测定法,如southern和northern印迹和pcr;生化测定法,如检测蛋白质产物的存在,例如通过免疫学手段(elisa和/或western印迹)或通过酶功能;植物部分测定法,如叶或根测定法;以及对全再生植物的表型的分析。
可例如通过pcr扩增来筛选靶向性整合事件,使用例如特异于目的核酸分子的寡核苷酸引物。理解pcr基因分型包括但不限于,对源自预测含有整合入基因组的目的核酸分子的分离宿主植物愈伤组织的基因组dna的聚合酶链式反应(pcr)扩增,继之以对pcr扩增产物的标准克隆和序列分析。关于pcr基因分型的方法已有丰富的描述(参见例如,rios等(2002),plantj.32:243-53),且可应用于源自任何植物物种或组织类型(包括细胞培养物)的基因组dna。结合靶序列和导入序列两者的寡核苷酸引物的多个组合可在pcr扩增反应中顺序使用或复用。可以产生设计为与靶位点、导入的核酸序列和/或这两者的组合退火的寡核苷酸引物。如此,pcr基因分型策略可包括,例如而不限于:植物基因组中特定序列的扩增;植物基因组中多个特定序列的扩增;植物基因组中非特定序列的扩增;和前述任一项的组合。本领域技术人员可设计出引物和扩增反应的其他组合来查询基因组。例如,一组正向和反向寡核苷酸引物可设计为与特异于所导入核酸序列边界外的靶物的核酸序列退火。
正向和反向寡核苷酸引物可设计为与导入的核酸分子特异性退火,例如对应于其中包含的目的多核苷酸序列内的编码区的序列,或核酸分子的其他部分。这些引物可连同上文所述的引物一起使用。寡核苷酸引物可依照期望的序列合成,并且是可商购的(例如可购自integrateddnatechnologies,inc.,coralville,ia)。扩增之后可以是克隆和测序,或扩增产物的直接序列分析。本领域技术人员可想到用于分析在pcr基因分型期间生成的扩增产物的备选方法。在一个实施方案中,在pcr扩增中采用特异于基因靶物的寡核苷酸引物。
vi.包含人造双向启动子csvmv的细胞、细胞培养物、组织和生物
本发明的一些实施方案还提供包含人造csvmv双向启动子(例如可以存在于核酸构建体中的)的细胞。在具体的例子中,依照一些实施方案的人造csvmv双向启动子可用作调控序列来调控转基因在植物细胞和植物中的表达。在这些例子的一些中,使用可操作地连接于目的核苷酸序列(例如转基因)的人造csvmv双向启动子可以减少调控给定数目的目的核苷酸序列的表达所需的异源启动子的数目,和/或减小导入给定数目的目的核苷酸序列所需的核酸构建体的大小。此外,使用人造csvmv双向启动子可以允许两个可操作连接的目的核苷酸序列在相同条件下(即该csvmv启动子有活性的条件)的共表达。此等实例在例如在下述情况下可能特别有用:两个可操作连接的目的核苷酸序列各自作用于包含该目的核苷酸序列的转基因宿主中的单个性状,且目的核苷酸序列的共表达有利地影响该性状在转基因宿主中的表达。
在一些实施方案中,包含一个或多个人造csvmv双向启动子和/或目的核苷酸序列的转基因植物可以具有由目的核苷酸序列在该植物中的表达所赋予(例如引入、增强或贡献)的一种或多种期望的性状。这类性状可以包括,例如而不限于:对昆虫、其他害虫和致病剂的抗性;对除草剂的耐受性;提高的稳定性、产率或货架期;环境耐受性;药物产生;工业产物产生;和营养增强。在一些例子中,可赋予期望的性状,其通过用包含可操作地连接于目的多核苷酸序列的人造csvmv双向启动子的核酸分子来转化植物。在一些例子中,可对经由育种产生作为后代植物的植物赋予期望的性状,该性状可以是由可操作地连接于人造csvmv双向启动子的一个或多个目的多核苷酸序列赋予的,所述目的核苷酸序列是从包含可操作地连接于人造csvmv双向启动子的目的核苷酸序列的亲本植物传递给该植物的。
依照一些实施方案中的转基因植物可以是能用本发明的核酸分子转化,或能用经本发明的核酸分子转化的植物育种产生的任何植物。相应地,所述植物可以是双子叶或单子叶植物。用于一些例子的双子叶植物的非限制性例子包括:苜蓿;豆类;椰菜;甘蓝;卡诺拉油菜,胡萝卜;花椰菜;芹菜;大白菜;棉花;黄瓜;茄子;莴苣;甜瓜(melon);豌豆;胡椒;花生;马铃薯;南瓜;萝卜;油菜籽;菠菜;大豆;倭瓜;甜菜;向日葵;烟草;番茄;和西瓜。用于一些例子的单子叶植物的非限制性例子包括:短柄草属;玉米;洋葱;稻;高粱;小麦;黑麦;粟/黍;甘蔗;燕麦;黑小麦;柳枝稷;和草坪草。
在一些实施方案中,可以任意方式来使用或培养转基因植物,其中期望存在人造的csvmv双向启动子和/或可操作连接的目的多核苷酸序列。因此,这类转基因植物可通过用依照本发明的核酸分子转化而工程改造化,以便例如拥有一种或多种期望的性状或者转基因事件,而且这类转基因植物可通过本领域技术人员已知的任意方法来收获(crop)和/或栽培。
提供下列实施例来例示某些特定特征和/或实施方案。所述实施例不应理解为将公开内容限制为所例示的具体特征或实施方案。
实施例
实施例1:木薯叶脉花叶病毒(csvmv)启动子元件的注释
csvmv启动子(seqidno:9;图1)是517bp的多核苷酸序列(美国专利号7,053,205)。该多核苷酸序列可以分为三部分。第一部分是一个320bp的5'上游启动子多核苷酸片段。第二部分位于前述5'上游启动子部分(urs)的近端下游。第二部分包含一个123bp的核心启动子(mincsvmvp)。这两个多核苷酸片段的鉴定最初描述于美国专利申请2005/0118432a1中。这两个部分进一步连接到第三部分。第三部分是位于前述5'上游启动子和123bp核心启动子下游的一个74bp的5'非翻译区(utr)。
该517bpcsvmv启动子片段的多核苷酸序列如seqidno:9所示。320bp的5'上游启动子多核苷酸片段以斜体字显示,如seqidno:7所示。123bp核心启动子以加下划线的字体显示,如seqidno:5所示。74bp5'utr以粗体字显示,如seqidno:6所示。因此,seqidno:9如下所示:
实施例2:拟南芥泛素10(atubi10)启动子元件的注释
atubi10启动子(seqidno:8;图2)是一条1,322bp的多核苷酸序列(callis,j.etal.,(1995)structureandevolutionofgenesencodingpolyubiquitinandubiquitin-likeproteinsinarabidopsisthalianaecotypecolumbia,genetics,139(2),921-39)。该多核苷酸序列可以分为三部分。第一部分是812bp的5'上游启动子多核苷酸片段(urs)。第二部分位于该5'上游部分的近端下游。该第二部分含有140bp的最小核心启动子(minubi10p)。这两个部分进一步连接到由内含子和5'utr组成的第三部分。该5'utr是一个66bp的5'非翻译区(utr),位于前述5'上游启动子和140bp核心启动子的直接下游。该304bp内含子位于该多核苷酸序列的最下游的末端。
1,332bpatubi10启动子片段的多核苷酸序列如seqidno:8所示。812bp,5'上游启动子多核苷酸片段以斜体显示,如seqidno:4所示。140bp的最小核心启动子以加下划线的字体显示,如seqidno:1所示。66bp5'utr以粗体字显示,如seqidno:3所示。304bp内含子以小写字体显示,如seqidno:2所示。因此,seqidno:8如下所示:
实施例3:双向启动子的设计
设计了第一个含有来自csvmv和atubi10启动子的基因调节元件的双向启动子,如seqidno:10所示。该双向启动子包含部分csvmv启动子的序列(碱基对1-197),其以相反互补取向融合到全长atubi10启动子(碱基对198-1,519)的5'末端。该部分csvmv启动子的组成部分含有一个csvmv最小核心启动子的123bp区(碱基对75-197处,下划线字体;seqidno:5)以及csvmv5'非翻译区(碱基对1-74处,粗体字体;seqidno:7)。该全长atubi10启动子的组成部分含有一个上游启动子区域(碱基对198-1009处,斜体字体;seqidno:4)、atubi10最小核心启动子(碱基对1,010-1,149处,双下划线字体;seqidno:1)、atubi105'非翻译区(碱基对1,150-1,215处,加粗且加下划线字体;seqidno:3)和atubi10内含子(碱基对1,216-1519处,小写字体;seqidno:2)。因此,seqidno:10如下所示:
设计了第二个含有来自atubi10启动子的基因调节元件的双向启动子,如seqidno:11所示。该双向启动子含有atubi10启动子的部分序列(碱基对1-510),以反向互补取向融合到与全长atubi10启动子(碱基对511-1,832;seqidno:4)的5'末端。所述部分atubi10启动子的组成部分含有:140bp的atubi10最小核心启动子的区域(下划线字体,碱基对371-510;seqidno:1)、atubi105'非翻译区(粗体字体,碱基对305-370;seqidno:3)、和atubi10内含子(小写字体,碱基对1-304;seqidno:2)。全长atubi10启动子的组成部分含有上游启动子区域(斜体字体,碱基对511-1,322;seqidno:4),atubi10最小核心启动子(双下划线字体,碱基对1,323-1,462;seqidno:1)、atubi105'非翻译区(粗体和下划线字体,碱基对1,463-1,528;seqidno:3)、和atubi10内含子(小写和下划线字体,碱基对1,529-1,832;seqidno:2)。相应地,seqidno:11如下所示:
设计了第三个含有来自csvmv和atubi10启动子的基因调节元件的双向启动子,并以seqidno:12表示。该双向启动子包含部分atubi10启动子的序列(碱基对1-510),以相反互补取向融合到全长csvmv启动子(碱基对511-1,027)的5'末端。该部分atubi10启动子的组成部分含有:140bp的atubi10最小核心启动子区域(下划线字体,碱基对371-510;seqidno:1)、atubi105'非翻译区(粗体字体,碱基对305-370;seqidno:3)、和atubi10内含子(小写字体,碱基对1-304;seqidno:2)。该csvmv启动子的组成部分含有上游启动子区域(斜体字体,碱基对511-830;seqidno:7)、csvmv最小核心启动子(双下划线字体,碱基对831-953;seqidno:5)、和csvmv5'非翻译区(粗体和下划线字体,碱基对954-1,027;seqidno:6)。因此,seqidno:12如下所示:
设计了第四个包含来自csvmv启动子的基因调控元件的双向启动子,并以seqidno:13表示。该双向启动子含有csvmv启动子的部分序列(碱基对1-197),以反向互补取向融合到全长csvmv启动子(碱基对198-714)的5'末端。所述部分csvmv启动子的组成部分含有123bp的csvmv最小核心启动子的区域(下划线字体,碱基对75-197;seqidno:5)和csvmv5'非翻译区(粗体字体,碱基对1-74;seqidno:6)。所述全长csvmv启动子的组成部分含有上游启动子区域(斜体字体,碱基对198-518;seqidno:7)、csvmv核心启动子(双下划线字体,碱基对519-640;seqidno:5)、和csvmv5'非翻译区(粗体和下划线字体,碱基对641-714;seqidno:6)。因此,seqidno:13如下所示:
实施例4:植物转化构建体
设计植物转化构建体以在植物体内测试双向启动子的表达。最终的双向启动子构建体的产生如下所述:将驱动一个报道基因的最小启动子以反向互补的取向插入到驱动第二报道基因的主启动子的上游。构建了8个质粒:pdab113192,pdab113193,pdab113194,pdab113195,pdab113196,pdab113197,pdab113198和pdab113199,它们包含来自csvmv和atubi10启动子的元件,这些元件驱动绿色荧光蛋白(gfp;evrogen,moscow,russia)和红色荧光蛋白(rfp;clontech,mountainview,ca)转基因,并以根癌土壤杆菌orf23/243'utr(barker等人,plantmolecularbiology1983,2(6),335-50)或根癌土壤杆菌胭脂蛋白合成酶3'utr(表1)终止。所得到的构建体含有驱动两个不同转基因的单个双向启动子,该两个转基因可操作地连接到双向启动子的5'和3'末端。使用
表1.含有双向启动子的构建体的描述,这些双向启动子被构建为驱动rfp和gfp转基因的表达(例如pdab113192-113199)
实施例5:大豆植物转化
将上述构建体用于转化大豆植物。将大豆植物(glycinemaxc.v.maverick)种植在温室中,在12/12昼/夜光周期条件下培养,温度为26.7-30℃。种植后5周(开花后约7~14天)收获宽度大于0.9厘米的大豆豆荚。
通过用70%乙醇洗涤豆荚30秒钟,然后在温和搅拌下用含有2滴tween-20的10%漂白剂洗涤10分钟,对收获的豆荚进行表面灭菌。倾去漂白剂,将外植体用无菌水冲洗3次,每次5分钟,轻轻搅拌。无菌的豆荚在4℃下储存7-8天。
通过在透照式立体显微镜上背光照射豆荚来确定豆荚内未成熟胚的位置。取3mm至5mm长的胚用于进行转化,弃去超大或过小的胚。在豆荚的两端切出两个切口,并沿着豆荚的纵向弯曲部分切出一个切口。在进行纵向切割时,切掉足够的植物组织以暴露豆荚腔的内部。然后打开荚,取出未成熟的胚。将分离的胚置于质壁分离培养基(4.4g/lms基础加维生素(m519),73g/l甘露醇,73g/l山梨糖醇,2.3g/lgelzan
在硅化的2ml管中制备金微载体。加入约50mg的0.6μm金微载体(bio-rad,hercules,ca)和1ml100%乙醇)并涡旋2分钟。该步骤之后,以1,000×g离心4分钟,弃去上清液。接下来,加入1ml70%的乙醇,涡旋2分钟,然后将管在室温下温育15分钟,不时涡旋。温育后,将制备物以1000×g离心1分钟,弃去上清液。通过加入1ml无菌水涡旋1分钟、使颗粒沉降1分钟、然后以1800xg离心1分钟来清洗颗粒。洗涤步骤重复两次。将所得的离心沉淀的植物材料重新悬浮于50%无菌甘油中。
制备好的金微载体如下所述用dna包被用于轰击:首先通过涡旋2分钟重悬,将50μl溶液转移到硅化管中。在涡旋管的同时,按照以下顺序加入试剂:5μl的dna,50μl的2.5mcacl,20μl的1m精氨酸。将管盖上盖,在4℃涡旋20分钟。涡旋后,加入200μl的100%乙醇,涡旋1分钟,并以1000×g离心1分钟。去除上清液,重复乙醇洗涤两次。将最终的离心沉淀重新悬浮于50μl的100%乙醇中。
在轰击时,将9μl的经涡旋的dna/金微载体混合物在位于大载体保持器中的大载体的中心上方涂抹成均匀的涂层,重复该步骤直到所有轰击大载体被涂覆。确定质壁分离介质上的未成熟的胚的取向,使得它们背轴侧朝上并集中在板中心。样品用bioradpds-1000/hetm基因枪轰击,基因枪使用63.3kg/cm的破裂盘,距靶9cm。将胚转移到se40培养基(4.3g/lms基础盐(m524),1ml/lgamborgb5维生素(g249),30g/l蔗糖,4ml/l2,4-d10mg/ml,2g/
轰击之后,将经轰击的大豆植物材料在使用rfp和gfp滤镜组的leicam165fctm立体显微镜上用dfc310fx相机(leica,wetzlar,germany)成像24至48小时。使用imagejtmtm(wsrasband,imagej,u.s.nationalinstitutesofhealth,bethesda,maryland,usa,http://imagej.nih.gov/ij/,1997-2014)将图像分成红色、绿色和蓝色通道,通过选择呈现转化灶(focus)的最佳频道来选择用于分析的频道。使用魔棒工具(wandtracingtool)优化阈值以确定总面积。使用imagejtm中的findmaxima函数定量转化灶。利用没有dna对照板的未轰击和轰击的植物材料从实验总数中扣除背景转化灶。
实施例6:大豆中的瞬时基因表达
如上所述使用粒子轰击转化大豆未成熟胚。轰击后,将植物材料温育24-48小时,样品使用配备dfc310fx相机的leicam165fctm立体显微镜可视化(图3),并使用imagejtm分析样品以计数转化灶(图4和表2)。
表2大豆中的相对荧光强度。
图3中提供的显微镜图像、以及图4和表2中提供的蛋白质表达定量水平表明:pdab113198的含有csvmv和atubi10基因调控元件的双向启动子(seqidno:13的双向启动子)、pdab113199的含有csvmv和atubi10基因调控元件的双向启动子(seqidno:13的双向启动子)、pdab113192的含有csvmv和atubi10基因调控元件的双向启动子(seqidno:11的双向启动子)、以及pdab113194的含有csvmv和atubi10基因调控元件的双向启动子(seqidno:10的双向启动子)驱动了gfp和rfp蛋白二者的表达。双向启动子的表达水平与驱动gfp的表达的单启动子对照(pdab113188)或驱动rfp的表达的单启动子对照(pdab113190)的表达相当。此外,pdab113198、pdab113192和pdab113194的双向启动子驱动gfp的表达水平与对照构建体pdab13188相比可比较。
实施例7:玉米转化
将上述构建体用于转化玉米细胞。从温室中生长的玉米(cv.b104)获得未成熟的玉米胚。令玉米植物自交或同胞授粉,授粉后9-12天收获玉米棒。在实验前一天,将玉米棒浸入家用漂白剂的20%溶液(含有5%次氯酸钠)中震摇动20-30分钟进行表面灭菌,然后在无菌水中冲洗3次。灭菌后,从每只玉米棒上无菌地切下未成熟的合子胚(大小2.0-2.4mm),并收集在含有渗透介质的2ml管中。分离完成后,移除渗透介质,将胚胎随机地转移到半固体渗透介质上。将各个胚排列成用于生物射弹的适当的靶格式。将板在27.5℃的连续50μm低光室中温育过夜。
在实验当天,如下所述制备灭菌的金微载体以便转化:在冰上解冻金微载体,涡旋,并将50μl等份的悬浮的金加到灭菌的2ml管中。在涡旋的同时按顺序加入下列组分:金微载体、1.0μg/μl储液5μl、2.5mcacl250μl、0.1m亚精胺20μl。将所得悬浮液在4℃涡旋20分钟,用乙醇洗涤3次,并重悬于30μl100%乙醇中。将制备好的悬浮液储存在冰上直到轰击。
在轰击时,如下所述制备大载体:5μl经涡旋dna/金微载体混合物均匀地涂抹在大载体的中心,对每个样品重复该步骤,并让复合物干燥约10分钟。bioradbiolisticpds-1000/heparticledeliverysystemtm进行轰击,使用灭菌的63.3kg/cm的破裂盘,距离6cm。
轰击后,用3mtapetm包裹板,并在27.5℃连续50μm低光条件下将其储存在托盘上过夜。24小时后,使用
实施例8:玉米中的瞬时基因表达
使用如上所述的颗粒轰击转化玉米未成熟胚。温育24小时后,使用
表3.玉米中的相对荧光强度。
总之,atubi10和csvmv启动子已经被转化成新颖的人造csvmv双向启动子,其包括来自拟南芥泛素-10启动子的多个启动子元件以及木薯叶脉花叶病毒启动子,在大豆和玉米中都有功能。从双向启动子获得的目标第一和第二核苷酸的表达水平似乎与单向启动子基因构建体相当。所述双向启动子稳健地驱动融合于该双向启动子的任一端的多个转基因序列的表达。
尽管在上文已论述了许多例示性的方面和实施方案,但本领域技术人员能具体修改、置换、添加和子组合。因此,意图将所附权利要求和以后加入的权利要求解释为包括所有这类修改、置换、添加和子组合,如在其真实精神和范围内的。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种基于转录组测序构建的棒状杆菌组成型表达载体启动子的制造方法与工艺
- 一种棒状杆菌组成型表达载体启动子、含有该启动子及gnd基因的表达载体的制造方法与工艺
- 一种棒状杆菌组成型表达载体启动子、含有该启动子及lrp基因的表达载体的制造方法与工艺
- 一株呕吐毒素降解菌及其应用的制造方法与工艺
- 一种具有家蚕血细胞特异性活性的启动子的鉴定方法与流程
- 一种改造的质粒复制子及其应用的制造方法与工艺
- 一种水稻种子特异性启动子Posseed及其应用的制造方法与工艺
- 一种在水稻幼穗特异表达的启动子及其应用的制造方法与工艺
- 一种表达外源基因的启动子及其应用的制造方法与工艺
- 可诱导的CRISPRon或CRISPRi小鼠胚胎干细胞及其应用的制造方法与工艺