新型取代的吲唑、其制备方法、包含其的药物制剂及其用于制备药物的用途与流程
本发明涉及新的取代的吲唑、其制备方法、用于制备该新的化合物的中间体、新的取代的吲唑用于治疗和/或预防疾病的用途及其用于制备用于治疗和/或预防疾病的药物的用途,所述疾病特别是增殖性疾病、自身免疫性疾病、代谢和炎性疾病,例如类风湿性关节炎、脊椎关节炎(特别是牛皮癣性脊椎关节炎和别赫捷列夫氏病(bekhterev'sdisease))、慢性阻塞性肺疾病(缩写:copd)、多发性硬化、系统性红斑狼疮、痛风、代谢综合征、脂肪肝肝炎、胰岛素抵抗、子宫内膜异位症和炎症诱发性疼痛或慢性疼痛,以及淋巴瘤。
本发明涉及抑制白细胞介素-1-受体相关激酶4(irak4)的通式(i)的新的取代的吲唑。
人irak4(白细胞介素-1-受体相关激酶4)在激活免疫系统中起重要作用。因此,该激酶是用于开发炎症抑制物质的重要的治疗靶分子。irak4由许多细胞表达并介导以下受体的信号转导:toll样受体(tlr)(tlr3除外),以及由il-1r(受体)、il-18r、il-33r和il-36r组成的白细胞介素(il)-1β家族受体(janeway和medzhitov,annu.rev.immunol.,2002;dinarello,annu.rev.immunol.,2009;flannery和bowie,biochemicalpharmacology,2010)。
irak4缺失的小鼠和irak4缺失的患者人细胞均对tlr(tlr3除外)和il-1β家族的刺激不起反应(suzuki,suzuki等人,nature,2002;davidson,currie等人,thejournalofimmunology,2006;ku,vonbernuth等人,jem,2007;kim,staschke等人,jem,2007)。
tlr配体或il-1β家族配体与各自受体的结合导致myd88[髓细胞分化初次应答基因(88)]募集并结合至受体。从而,myd88与irak4相互作用,导致形成活性复合物,所述活性复合物与激酶irak1或irak2相互作用并将其激活(kollewe,mackensen等人,journalofbiologicalchemistry,2004;precious等人,j.biol.chem.,2009)。由此,将nf(核因子)-κb信号途径和mapk(促分裂原活化蛋白激酶)信号途径激活(wang,deng等人,nature,2001)。nf-κb信号途径和mapk信号途径两者的激活产生与不同的免疫过程相关的过程。例如,存在增多的多种炎症信号分子和酶(如细胞因子、趋化因子和cox-2(环加氧酶-2))的表达,以及增强的炎症相关基因(例如cox-2、il-6(白细胞介素-6)、il-8)的mrna稳定性(holtmann,enninga等人,journalofbiologicalchemistry,2001;datta,novotny等人,thejournalofimmunology,2004)。此外,这些过程可伴随有某些细胞类型(例如单核细胞、巨噬细胞、树突细胞、t细胞和b细胞)的增殖和分化(wan,chi等人,natimmunol,2006;mcgettrickandj.o'neill,britishjournalofhaematology,2007)。
irak4在各种炎症性疾病的病理学中的核心作用已通过直接比较野生型(wt)小鼠与具有激酶失活形式irak4(irak4kdki)的遗传修饰动物而示出。在多发性硬化、动脉粥样硬化、心肌梗死和阿尔茨海默氏病动物模型中,irak4kdki动物具有改善的临床表现(rekhter,staschke等人,biochemicalandbiophysicalresearchcommunication,2008;maekawa,mizue等人,circulation,2009;staschke,dong等人,thejournalofimmunology,2009;kim,febbraio等人,thejournalofimmunology,2011;cameron,tse等人,thejournalofneuroscience,2012)。此外,已发现,在动物模型中irak4的缺失通过改善抗病毒反应并同时降低全身炎症而防止病毒诱导的心肌炎(valaperti,nishii等人,circulation,2013)。还已表明irak4的表达与伏格特-小柳-原田综合征(vogt-koyanagi-haradasyndrome)的疾病活性相关(sun,yang等人,plosone,2014)。此外,已显示irak4与通过浆细胞样树突细胞的免疫复合物介导的ifnα(干扰素α)产生(系统性红斑狼疮(sle)发病中的关键过程)高度相关(chiang等人,thejournalofimmunology,2010)。此外,信号途径与肥胖相关(ahmad,r.,p.shihab等人,diabetology&metabolicsyndrome,2015)。
除了irak4在先天免疫性中的关键作用,也存在这样的暗示:irak4影响th17t细胞(适应性免疫的成员)的分化。在irak4激酶活性缺失情况下,与wt小鼠相比,有较少的il-17-生成t细胞(th17t细胞)产生。抑制irak4使得能够预防和/或治疗动脉粥样硬化、1型糖尿病、类风湿性关节炎、脊椎关节炎(特别是牛皮癣性脊椎关节炎和别克捷列夫氏病(bekhterev'sdisease))、红斑狼疮、银屑病、白癜风、巨细胞动脉炎、慢性炎性肠道疾病和病毒性疾病,例如hiv(人免疫缺陷病毒)、肝炎病毒(staschke等人,thejournalofimmunology,2009;marquez等人,annrheumdis,2014;zambrano-zaragoza等人,internationaljournalofinflammation,2014;wang等人,experimentalandtherapeuticmedicine,2015;ciccia等人,rheumatology,2015)。
由于irak4在tlr(tlr3除外)的和il-1受体家族的myd88-介导信号级联中的核心作用,抑制irak4可以用于预防和/或治疗由所述受体介导的疾病。tlr和il-1受体家族的成员与以下疾病的发病机理相关:类风湿性关节炎、银屑病、关节炎、重症肌无力、脉管炎(例如贝切特氏病(behcet’sdisease)、多血管炎肉芽肿病和巨细胞动脉炎肉芽肿病)、胰腺炎、系统性红斑狼疮、皮肌炎和多肌盐、代谢综合征包括例如胰岛素抵抗、高血压、异常脂蛋白血症和肥胖、糖尿病(1型和2型)、糖尿病肾病、骨关节炎、斯耶格伦氏综合征(
肺部疾病如肺纤维化、阻塞性肺病(copd)、急性呼吸窘迫综合征(ards)、急性肺损伤(ali)、间质性肺病(ild)、结节病和肺动脉高压,它们也显示与各种tlr介导的信号途径相关。肺部疾病的发病机理可能受传染或非传染过程影响(ramirezcruz,maldonadobernal等人,revalergmex,2004;jeyaseelan,chu等人,infectionandimmunity,2005;seki,tasaka等人,inflammationresearch,2010;xiang,fan等人,mediatorsofinflammation,2010;margaritopoulos,antoniou等人,fibrogenesis&tissuerepair,2010;hilberath,carlo等人,thefasebjournal,2011;nadigel,prefontaine等人,respiratoryresearch,2011;kovach和standiford,internationalimmunopharmacology,2011;bauer,shapiro等人,molmed,2012;deng,yang等人,plosone,2013;freeman,martinez等人,respiratoryresearch,2013;dubaniewicz,a.,humanimmunology,2013)。tlr和il-1r家族成员还参与其他炎症性疾病如过敏症、贝切特氏病、痛风、红斑狼疮、成人斯蒂尔氏病(adult-onsetstill'sdisease)、心包炎和慢性炎性肠道疾病例如溃疡性结肠炎和克罗恩氏病(crohn'sdisease)、移植排斥反应和移植物抗宿主反应的发病机理,因此,此处,抑制irak4是合适的预防和/或治疗方法(liu-bryan,scott等人,arthritis&rheumatism,2005;piggott,eisenbarth等人,jclininves,2005;christensen,shupe等人,immunity,2006;cario,inflammatoryboweldiseases,2010;nickerson,christensen等人,thejournalofimmunology,2010;rakoff-nahoum,hao等人,immunity,2006;heimesaat,fischer等人,plosone,2007;heimesaat,nogai等人,gut,2010;kobori,yagi等人,jgastroenterol,2010;schmidt,raghavan等人,natimmunol,2010;shi,mucsi等人,immunologicalreviews,2010;leventhal和schroppel,kidneyint,2012;chen,lin等人,arthritisresther,2013;hao,liu等人,curropingastroenterol,2013;kreisel和goldstein,transplantinternational,2013;li,wang等人,pharmacology&therapeutics,2013;walsh,carthy等人,cytokine&growthfactorreviews,2013;zhu,jiang等人,autoimmunity,2013;yap和lai,nephrology,2013;vennegaard,dyring-andersen等人,contactdermatitis,2014;d'elia,brucato等人,clinexprheumatol,2015;jain,thongprayoon等人,amjcardiol.,2015;li,zhang等人,oncolrep.,2015)。
由tlr和il-1r家族介导的妇科疾病例如子宫内膜异位症(adenomyosis)、痛经、交媾困难和子宫内膜组织异位症(endometriosis),特别是与子宫内膜异位症相关的疼痛和其他与子宫内膜异位症相关的症状例如痛经、交媾困难、排尿困难和大便困难,它们可受到irak4抑制剂的预防和/或治疗使用的积极影响(akoum,lawson等人,humanreproduction,2007;allhorn,boing等人,reproductivebiologyandendocrinology,2008;lawson,bourcier等人,journalofreproductiveimmunology,2008;sikora,mielczarek-palacz等人,americanjournalofreproductiveimmunology,2012;khan,kitajima等人,journalofobstetricsandgynaecologyresearch,2013;santulli,borghese等人,humanreproduction,2013)。irak4抑制剂的预防和/或治疗使用还对动脉粥样硬化具有积极影响(seneviratne,sivagurunathan等人,clinicachimicaacta,2012;falck-hansen,kassiteridi等人,internationaljournalofmolecularsciences,2013;sedimbi,hagglof等人,cellmollifesci,2013)。
除了已经提及的疾病外,在眼部疾病的发病机理中也描述了irak4介导的tlr过程,所述眼部疾病如视网膜缺血、角膜炎、过敏性结膜炎、干燥性角结膜炎、黄斑变性和眼色素层炎(kaarniranta和salminen,jmolmed(berl),2009;sun和pearlman,investigativeophthalmology&visualscience,2009;redfern和mcdermott,experimentaleyeresearch,2010;kezic,taylor等人,jleukocbiol,2011;chang,mccluskey等人,clinical&experimentalophthalmology,2012;guo,gao等人,immunolcellbiol,2012;lee,hattori等人,investigativeophthalmology&visualscience,2012;qi,zhao等人,investigativeophthalmology&visualscience,2014)。
抑制irak4也是纤维化疾病的合适治疗方法,所述纤维化疾病如肝纤维化、心肌炎、原发性胆汁性肝硬化、囊性纤维化(zhao,zhao等人,scandjgastroenterol,2011;benias,gopal等人,clinreshepatolgastroenterol,2012;yang,l.和e.seki,frontphysiol,2012;liu,hu等人,biochimbiophysacta.,2015)。
由于irak4在由tlr-和il-1r家族介导的疾病中具有关键地位,可以用irak4抑制剂以预防和/或治疗方式来治疗慢性肝脏疾病,例如脂肪肝肝炎,特别是非酒精性脂肪性肝病(nafld)和/或非酒精性脂肪性肝炎(nash)、酒精性脂肪性肝炎(ash)(nozaki,saibara等人,alcoholclinexpres,2004;csak,t.,a.velayudham等人,amjphysiolgastrointestliverphysiol,2011;miura,kodama等人,gastroenterology,2010;kamari,shaish等人,jhepatol,2011;ye,li等人,gut,2012;roh,seki,jgastroenterolhepatol,2013;ceccarelli,s.,v.nobili等人,worldjgastroenterol,2014;miura,ohnishi,worldjgastroenterol,2014;stojsavljevic,palcic等人,worldjgastroenterol,2014)。
由于irak4在tlr介导过程中的核心作用,抑制irak4还能够治疗和/或预防心血管疾病和神经障碍,例如心肌再灌注损伤、心肌梗死、高血压(oyama,blais等人,circulation,2004;timmers,sluijter等人,circulationresearch,2008;fang和hu,medscimonit,2011;bijani,internationalreviewsofimmunology,2012;bomfim,dossantos等人,clinsci(lond),2012;christia和frangogiannis,europeanjournalofclinicalinvestigation,2013;thompson和webb,clinsci(lond),2013;hernanz,martínez-revelles等人,britishjournalofpharmacology,2015;frangogiannis,curropincardiol,2015;bomfim,echem等人,lifesciences,2015),以及阿尔茨海默氏病、中风、颅脑创伤、肌萎缩性侧索硬化(als)和帕金森氏症(brough,tyrrell等人,trendsinpharmacologicalsciences,2011;carty和bowie,biochemicalpharmacology,2011;denes,kitazawa,cheng等人,thejournalofimmunology,2011;lim,kou等人,theamericanjournalofpathology,2011;béraud和maguire-zeiss,parkinsonism&relateddisorders,2012;denes,wilkinson等人,diseasemodels&mechanisms,2013;noelker,morel等人,sci.rep.,2013;wang,wang等人,stroke,2013;xiang,chao等人,revneurosci,2015;lee,lee等人,jneuroinflammation,2015)。
由于通过irak4的tlr介导的信号和il-1受体家族介导的信号参与瘙痒和疼痛(包括急性、慢性、炎性和神经性疼痛),可以设想通过抑制irak4对所述适应症具有治疗作用。疼痛的实例包括痛觉过敏、异常性疼痛、经前痛、与子宫内膜异位症相关的疼痛、手术后疼痛、间质性膀胱炎、crps(复杂性局部疼痛综合征)、三叉神经痛、前列腺炎、脊髓损伤引起的疼痛、炎症引发的疼痛、下腰痛、癌痛、化疗相关的疼痛、hiv治疗诱发的神经病、烧伤引起的疼痛和慢性疼痛(wolf,livshits等人,brain,behavior,andimmunity,2008;kim,lee等人,toll-likereceptors:rolesininfectionandneuropathology,2009;delrey,apkarian等人,annalsofthenewyorkacademyofsciences,2012;guerrero,cunha等人,europeanjournalofpharmacology,2012;kwok,hutchinson等人,plosone,2012;nicotra,loram等人,experimentalneurology,2012;chopra和cooper,jneuroimmunepharmacol,2013;david,ratnayake等人,neurobiologyofdisease,2013;han,zhao等人,neuroscience,2013;liu和ji,pflugersarch.,2013;stokes,cheung等人,journalofneuroinflammation,2013;zhao,zhang等人,neuroscience,2013;liu,zhang等人,cellresearch,2014;park,stokes等人,cancerchemotherpharmacol,2014;vanderwatt,wilkinson等人,bmcinfectdis,2014;won,k.a.,m.j.kim等人,jpain,2014;min,ahmad等人,photochemphotobiol.,2015;schrepf,bradley等人,brainbehavimmun,2015;wong,l.,j.d.done等人,prostate,2015)。
这也适用于一些肿瘤疾病。某些淋巴瘤如abc-dlbcl(活化b细胞弥漫性大细胞b细胞淋巴瘤)、套细胞淋巴瘤和沃尔丹斯特伦疾病(
炎症性疾病如caps(冷吡啉相关周期性综合征(cryopyrin-associatedperiodicsyndromes)),包括fcas(家族性寒冷型自身炎症综合征(familialcoldautoinflammatorysyndrome))、mws(muckle-wells综合征)、nomid(新生儿多系统炎症性疾病(neonatal-onsetmultisysteminflammatorydisease))和conca(慢性婴儿神经皮肤关节综合征(chronicinfantile,neurological,cutaneous,andarticular)));fmf(家族性地中海热)、hids(高-igd综合征)、traps(肿瘤坏死因子受体1相关周期性综合征)、幼年特发性关节炎(juvenileidiopathicarthritis)、成人斯蒂尔氏病、亚-贝二氏综合征(adamantiades-
现有技术公开了许多irak4抑制剂(参见,例如,annualreportsinmedicinalchemistry(2014),49,117–133)。
us8293923和us20130274241公开了具有3-取代吲唑结构的irak4抑制剂。没有2-取代吲唑的描述。
wo2013106254和wo2011153588公开了2,3-二取代吲唑衍生物。
wo2007091107描述了2-取代吲唑衍生物用于治疗杜兴肌营养不良(duchennemusculardystrophy)。所公开的化合物不具有6-羟烷基取代基。
wo2015091426描述了在2位被羧酰胺侧链取代的吲唑,例如实施例64。
wo2015104662公开了以下通式的2-取代吲唑:
其中r2为烷基或环烷基基团。在wo2015104662中明确描述了在2位具有甲基、2-甲氧基乙基和环戊基基团的2-取代吲唑(实施例1、4和76)。还由实施例117描述了在1位具有羟乙基取代基的吲唑衍生物。但是没有描述在1位或2位具有3-羟基-3-甲基丁基取代基的吲唑衍生物。
在wo2015104662中,通过通式上位性地包括了在2位具有羟基取代的烷基基团的吲唑,但是没有明确地公开。
在wo2015104662中,通式和r2取代基的定义没有包括在2位具有烷基基团且其中该烷基基团额外被甲基磺酰基基团取代的吲唑。
除了吲唑上在1和2位的上述取代形式,wo2015104662还描述了在6位具有取代基、r1定义如下的吲唑:烷基、氰基、-nrarb或选自环烷基、芳基或杂环基的任选的取代基团,其中取代基独立地为烷基、烷氧基、卤素、羟基、羟烷基、氨基、氨基烷基、硝基、氰基、卤代烷基、卤代烷氧基、-ococh2-o-烷基、-op(o)(o-烷基)2或-ch2-op(o)(o-烷基)2。对于其中r1为烷基基团的咪唑化合物,有效申请日为2015年1月7日(wo2015104662的国际申请日)。要求优先权的印度申请146/che/2014和3018/che/2014并没有公开任何r1为烷基基团的吲唑化合物。
因此,r1为任选取代的烷基基团的以下通式的吲唑化合物在2015年1月7日首次被描述,因此是在本申请的优先权日之后。
在wo2015104662中描述的6位取代基r1的实例为环丙基、环己基、氰基、3-氟苯基和饱和的杂环取代基。在wo2015104662中没有明确描述在6位具有羟基取代的烷基基团的吲唑。
本发明解决的问题是,提供具有白细胞介素-1受体相关激酶-4(irak4)的抑制剂的作用的新的化合物。
新的irak4抑制剂特别适用于治疗和预防以反应过度的免疫系统为特征的增殖性、代谢性和炎症性疾病。在本文中应特别提及炎症性皮肤病、心血管疾病、肺部疾病、眼部疾病、神经障碍、疼痛病和癌症。
此外,新的irak4抑制剂适于治疗和预防
●自身免疫性和炎症性疾病,特别是类风湿性关节炎、多发性硬化、系统性红斑狼疮、脊椎关节炎和痛风,
●代谢病,特别是肝脏疾病,例如脂肪肝,以及
●妇科疾病,特别是子宫内膜异位症和与子宫内膜异位症相关的疼痛,以及其他与子宫内膜异位症相关的症状如痛经、交媾交媾困难、排尿困难和大便困难。
本发明提供通式(i)的化合物,及其非对映异构体、对映异构体、代谢物、盐、溶剂合物或盐的溶剂合物
其中:
r1为c1-c6-烷基,其中c1-c6-烷基基团未被取代,或者被以下基团单取代或相同或不同地多取代:
卤素、羟基、未取代的或单或多-卤素-取代的c3-c6-环烷基,
或r6、r7so2、r7so或r8o基团,
或选自以下的基团:
其中*代表基团至分子其余部分的键合位点;
r2和r3总是具有相同的定义,均为氢或c1-c6-烷基;
r4为卤素、氰基、未取代的c1-c6-烷基或者单或相同或不同地多取代的c1-c6-烷基、或未取代的c3-c6-环烷基或者单或相同或不同地多取代的c3-c6-环烷基,取代基选自卤素和羟基;
r5为氢、卤素或未取代的或单或多-卤素-取代的c1-c6-烷基;
r6为具有4至6个环原子的未取代或者单-或二-甲基-取代的单环饱和杂环,其含有选自o、s、so和so2的杂原子或杂基;
r7为c1-c6-烷基,其中,c1-c6-烷基基团未被取代,或者被卤素、羟基或c3-c6-环烷基单取代或相同或不同地多取代,
或r7为c3-c6-环烷基;
r8为c1-c6-烷基,其中,c1-c6-烷基基团未被取代,或者被卤素单取代或相同或不同地多取代。
在下文描述的本发明的合成中间体和工作实施例的情况下,以相应的碱或酸的盐的形式给出的任何化合物,通常是按照各自制备和/或纯化方法得到的精确化学计量组成未知的盐。因此,除非更详细地说明,否则在这样的盐的情况下,增补的名称和结构式(如“盐酸盐”、“三氟乙酸盐”、“钠盐”或“xhcl”、“xcf3cooh”、“xna+”)不应当化学计量意义地理解,而仅是对其中所包含的盐-形成组分的说明性符号。
这同样适用于通过所述制备/或纯化方法获得的未知化学计量组成(如果其为定义类型)的溶剂合物形式的合成中间体或工作实施例或其盐的情况。
本发明的化合物为式(i)的化合物及其盐、溶剂合物和盐的溶剂合物,由式(i)涵盖且为下述结构式的化合物及其盐、溶剂合物和盐的溶剂合物,以及由式(i)涵盖并在下文中作为实施方案提及的化合物及其盐、溶剂合物和盐的溶剂合物,条件是由式(i)涵盖并在下文中提及的化合物并不是盐、溶剂合物和盐的溶剂合物。
在本发明的上下文中,优选的盐为本发明化合物的生理上可接受的盐。然而,本发明还涵盖本身不适于制药应用但可用于例如分离或纯化本发明的化合物的盐。
本发明化合物的生理上可接受的盐包括无机酸、羧酸和磺酸的酸加成盐,例如如下酸的盐:盐酸、氢溴酸、硫酸、磷酸、甲磺酸、乙磺酸、甲苯磺酸、苯磺酸、萘二磺酸、乙酸、三氟乙酸、丙酸、乳酸、酒石酸、苹果酸、柠檬酸、富马酸、马来酸和苯甲酸。
本发明化合物的生理上可接受的盐还包括常规碱的盐,例如并优选碱金属盐(例如钠盐和钾盐)、碱土金属盐(例如钙盐和镁盐)以及衍生自氨或具有1至16个碳原子的有机胺的铵盐,所述有机胺例如并优选乙胺、二乙胺、三乙胺、乙基二异丙基胺、单乙醇胺、二乙醇胺、三乙醇胺、二环己基胺、二甲氨基乙醇、普鲁卡因、二苄基胺、n-甲基吗啉、精氨酸、赖氨酸、乙二胺和n-甲基哌啶。
在本发明的上下文中,溶剂合物描述为通过与溶剂分子配位形成固态或液态络合物的本发明化合物的那些形式。水合物是与水配位的特殊形式的溶剂合物。
本发明的化合物可——根据其结构——以不同的立体异构形式存在,即以构型异构体或(如果合适)构象异构体(对映异构体和/或非对映异构体,包括阻转异构体)的形式存在。因此,本发明包含对映异构体和非对映异构体及其各自的混合物。可以以已知方式从对映异构体和/或非对映异构体的这些混合物中分离出立体异构均一的成分;为此目的优选使用色谱法,特别是在非手性相或手性相上的hplc色谱法。
如果本发明的化合物可以互变异构的形式存在,则本发明涵盖所有的互变异构形式。
本发明还包含本发明化合物的所有适合的同位素变体。在本文中,本发明化合物的同位素变体应理解为意指这样的化合物:其中本发明化合物中至少一个原子已被替换为原子序数相同但原子质量与在自然界中通常或主要存在的原子质量不同的另一原子。可纳入本发明化合物的同位素的实例为氢、碳、氮、氧、磷、硫、氟、氯、溴和碘的同位素,如2h(氘)、3h(氚)、13c、14c、15n、17o、18o、32p、33p、33s、34s、35s、36s、18f、36cl、82br、123i、124i、129i和131i。本发明化合物的特别的同位素变体,特别例如其中已纳入一种或多种放射性同位素的变体,可以有利于例如考察在体内的作用机理或活性化合物分布;由于相对容易的可制备性和可检测性,用3h或14c标记的特定化合物适于此目的。此外,纳入同位素(例如氘)由于化合物的更高的代谢稳定性可能产生特别的治疗益处,例如延长在体内的半衰期或减小所需的活性剂量;因此,在一些情况下,本发明化合物的此类修饰也可构成本发明的优选实施方案。本发明化合物的同位素变体可通过本领域技术人员已知的方法,例如通过在下文进一步描述的方法以及在工作实施例中描述的方法,通过使用各自试剂和/或起始化合物的相应同位素修饰来制备。
本发明还提供本发明化合物的所有可能的晶型和多晶型形式,其中多晶型物可作为单一多晶型物或所有浓度范围内的诸多多晶型物的混合物存在。
此外,本发明还涵盖本发明化合物的前药。在该上下文中,术语“前药”表示这样的化合物:其本身可以有生物活性或无生物活性,但在体内停留期间被(例如代谢或水解地)转化为本发明的化合物。
在本发明的上下文中,除非另有说明,否则取代基具有以下的含义:
烷基在本发明的上下文中代表具有指定的特定数目碳原子的直链或支链烷基基团。实例包括甲基、乙基、正丙基、异丙基、正丁基、异丁基、1-甲基丙基、2-甲基丙基、叔丁基、正戊基、1-乙基丙基、1-甲基丁基、2-甲基丁基、3-甲基丁基、2,2-二甲基丙基、正己基、1-甲基戊基、2-甲基戊基、3-甲基戊基、4-甲基戊基、1-乙基丁基和2-乙基丁基。优选甲基、乙基、正丙基、正丁基、2-甲基丁基、3-甲基丁基和2,2-二甲基丙基。
环烷基在本发明的上下文中为在每种情况下具有指定数目碳原子的单环饱和烷基基团。优选的实例包括环丙基、环丁基、环戊基和环己基。
烷氧基在本发明的上下文中代表具有指定的特定数目碳原子的直链或支链烷氧基基团。优选1至6个碳原子。实例包括甲氧基、乙氧基、正丙氧基、异丙氧基、1-甲基丙氧基、正丁氧基、异丁氧基、叔丁氧基、正戊氧基、异戊氧基、1-乙基丙氧基、1-甲基丁氧基、2-甲基丁氧基、3-甲基丁氧基和正己氧基。特别优选具有1至4个碳原子的直链或支链烷氧基基团。作为优选的提及的实例为甲氧基、乙氧基、正丙氧基、1-甲基丙氧基、正丁氧基和异丁氧基。
卤素在本发明的上下文中为氟、氯和溴。优选氟。
羟基在本发明的上下文中为oh。
单环饱和杂环是具有4至6个环原子并含有选自o、s、so和so2的杂原子或杂基的单环饱和杂环。优选具有选自o、so和so2的杂原子或杂基的杂环。实例包括:氧杂环丁烷、四氢呋喃、四氢-2h-吡喃-4-基、1,1-二氧四氢-2h-噻喃-3-基、1,1-二氧四氢-2h-噻喃-2-基、1,1-二氧四氢-2h-噻喃-4-基、1,1-二氧四氢噻吩-3-基、1,1-二氧四氢噻吩-2-基、1,1-二氧硫杂环丁-2-基(1,1-dioxidothietan-2-yl)或1,1-二氧硫杂环丁-3-基。在本文中特别优选氧杂环丁烷和四氢呋喃。非常特别优选氧杂环丁烷-3-基。
键上的符号*表示分子中的键合点。
当本发明化合物中的基团被取代时,所述基团可被单取代或多取代,除非另有说明。在本发明的上下文中,所有出现多于一次的基团彼此独立定义。优选被一个、两个或三个相同或不同的取代基取代。
r1的一个优选实施方案是被1、2或3个氟原子取代的c2-c6-烷基基团。特别优选2,2,2-三氟乙基、3,3,3-三氟丙基和4,4,4-三氟丁基。非常特别优选的是4,4,4-三氟丁基基团。
r1的另一优选实施方案是被一个或两个羟基基团或者一个c1-c3-烷氧基或三氟取代c1-c3-烷氧基取代的c2-c6-烷基基团。特别优选被羟基或者c1-c3-烷氧基或三氟甲氧基或2,2,2-三氟乙氧基取代的c2-c5-烷基基团。非常特别优选3-羟基-3-甲基丁基、3-甲氧基丙基、3-羟基丙基、3-三氟甲氧基丙基、2-甲氧基乙基或2-羟乙基。特别优选3-羟基-3-甲基丁基基团。
另外优选地,r1为被c1-c6-烷基-so2基团取代的c2-c6-烷基基团。甲基-so2-取代的c2-c4-烷基基团是特别优选的。特别优选r1为2-(甲基磺酰基)乙基或3-(甲基磺酰基)丙基。在后一组中,2-(甲基磺酰基)乙基是特别优选的。
另外优选地,r1是被以下基团取代的c1-c3-烷基基团:氧杂环丁烷基、四氢呋喃基、四氢-2h-吡喃-4-基、1,1-二氧四氢-2h-噻喃-3-基、1,1-二氧四氢-2h-噻喃-2-基、1,1-二氧四氢-2h-噻喃-4-基、1,1-二氧四氢噻吩-3-基、1,1-二氧四氢噻吩-2-基、1,1-二氧硫杂环丁-2-基或1,1-二氧硫杂环丁-3-基。特别优选的是被氧杂环丁烷基团取代的c1-c3-烷基基团。特别优选r1为氧杂环丁烷-3-基甲基基团。
对于r2和r3(它们总是具有相同的定义),氢或甲基是优选的。特别优选甲基。
就r4来说,优选未取代或者单或多-卤素-取代的c1-c3-烷基基团,或被一个羟基基团取代的c1-c3-烷基基团,或被一个羟基基团和三个氟原子取代的c1-c3-烷基基团。
对于r4,特别优选以下基团:甲基、乙基、三氟-c1-c3-烷基、二氟-c1-c3-烷基、羟甲基、1-羟乙基、2-羟基丙-2-基和2,2,2-三氟-1-羟乙基。对于r4,特别优选甲基、三氟甲基和二氟甲基基团。在本文中特别优选三氟甲基基团。
r5的优选实施方案是氢、氟、氯或c1-c3-烷基。更优选地,r5是氢、氟或甲基。最优选地,r5为氢或氟。
还特别优选r4为甲基或三氟甲基且r5为氟的化合物。非常特别优选r4为甲基且r5为氟的化合物,其中r5是在r4的邻位。
对于r6,优选实施方案包括氧杂环丁烷基、四氢呋喃基、四氢-2h-吡喃-4-基、1,1-二氧四氢-2h-噻喃-3-基、1,1-二氧四氢-2h-噻喃-2-基、1,1-二氧四氢-2h-噻喃-4-基、1,1-二氧四氢噻吩-3-基、1,1-二氧四氢噻吩-2-基、1,1-二氧硫杂环丁-2-基或1,1-二氧硫杂环丁-3-基。在本文中特别优选氧杂环丁烷基。非常特别优选氧杂环丁烷-3-基。
r7仅连接至官能团–so2-和–so-上,即,为r7-取代的-so2-或so基团。就此而论,r7优选为c1-c4-烷基,其中c1-c4-烷基基团未被取代,或被羟基或环丙基单取代,或被三个氟原子取代。另外优选r7为环丙基基团。特别优选的r7为甲基、乙基或羟乙基。非常特别优选r7为甲基。
这意味着,在被r7so2-或r7so-取代的c1-c6-烷基基团的情况下,就r1而言,优选被c1-c6-烷基-so2或c1-c6-烷基-so取代的c1-c6-烷基。对于r1,在本文中特别优选甲基磺酰基乙基和甲基磺酰基丙基。在本文中非常特别优选甲基磺酰基乙基。
对于r8,优选未取代的c1-c4-烷基基团或三氟取代的c1-c4-烷基基团。特别优选甲基、乙基、三氟甲基或2,2,2-三氟乙基。非常特别优选甲基、三氟甲基或2,2,2-三氟乙基。
优选下述式(i)的化合物,及其非对映异构体、对映异构体、代谢物、盐、溶剂合物或盐的溶剂合物,在式(i)的化合物中
r1为c1-c6-烷基,其中c1-c6-烷基基团未被取代,或者被氟、羟基或r6、r7so2、r7so或r8o基团单取代或相同或不同地多取代;
r2和r3总是具有相同的定义,均为氢或c1-c3-烷基;
r4为卤素、氰基或c1-c3-烷基,其中,c1-c3-烷基基团未被取代,
或者被卤素或羟基单取代或相同或不同地多取代;
r5为氢、氟、氯或c1-c3-烷基;
r6为氧杂环丁烷基或四氢呋喃基;
r7为c1-c4-烷基,其中,c1-c4-烷基基团未被取代,或者被羟基或环丙基单取代,或被三个氟原子取代;
r8为未取代的c1-c4-烷基或三氟取代的c1-c4-烷基。
另外优选下述式(i)的化合物,及其非对映异构体、对映异构体、代谢物、盐、溶剂合物或盐的溶剂合物,在式(i)的化合物中
r1为c2-c6-烷基,其中c2-c6-烷基是未取代的,或
c2-c6-烷基是单-、二-或三氟取代的,或
c2-c6-烷基被羟基、r6、r7so2或r8o单取代,
或其中r1为氧杂环丁烷基取代的c1-c3-烷基;
r2和r3总是具有相同的定义,均为氢或甲基;
r4为未取代的c1-c3-烷基基团或单-或多-卤素取代的c1-c3-烷基基团,或被一个羟基取代的c1-c3-烷基基团,或被一个羟基和三个氟原子取代的c1-c3-烷基基团;
r5为氢、氟或c1-c3-烷基;
r7为c1-c3-烷基;
r8为c1-c4-烷基,其中c1-c4-烷基基团是未取代的或单-、二-或三氟取代的;
还特别优选下述通式(i)的化合物,及其非对映异构体、对映异构体、代谢物、盐、溶剂合物或盐的溶剂合物,在通式(i)的化合物中
r1为被羟基或c1-c3-烷氧基或三氟甲氧基或2,2,2-三氟乙氧基或三氟甲基取代的c2-c5-烷基基团,或
为甲基-so2-取代的c2-c4-烷基基团,或
为氧杂环丁烷-3-基-取代的c1-c2-烷基基团;
r2和r3总是具有相同的定义,均为氢或甲基;
r4为甲基、乙基、三氟-c1-c3-烷基、二氟-c1-c3-烷基、羟甲基、1-羟乙基、2-羟基丙-2-基和2,2,2-三氟-1-羟乙基,且
r5为氢、氟或甲基。
非常特别优选下述化合物,及其非对映异构体、对映异构体、代谢物、盐、溶剂合物或盐的溶剂合物,在所述化合物中
r1为4,4,4-三氟丁基、3-羟基-3-甲基丁基、3-羟基丁基、3-甲氧基丙基、3-羟基丙基、3-羟基-2-甲基丙基、3-羟基-2,2-二甲基丙基、3-三氟甲氧基丙基、2-甲氧基乙基、2-羟乙基、2-(甲基磺酰基)乙基或3-(甲基磺酰基)丙基;
r2和r3均为甲基或氢,且
r4为二氟甲基、三氟甲基或甲基且
r5为氢或氟。
还非常特别优选下述化合物,及其非对映异构体、对映异构体、代谢物、盐、溶剂合物或盐的溶剂合物,在所述化合物中
r1为3-羟基-3-甲基丁基、3-羟基丁基、3-羟基-2-甲基丙基、3-羟基-2,2-二甲基丙基、3-(甲基磺酰基)丙基或2-(甲基磺酰基)乙基;
r2和r3均为甲基;
r4为二氟甲基或三氟甲基;且
r5为氢。
还特别优选下述化合物,及其非对映异构体、对映异构体、代谢物、盐、溶剂合物或盐的溶剂合物,在所述化合物中
r1为3-羟基-3-甲基丁基、3-羟基丁基、3-羟基-2-甲基丙基、3-羟基-2,2-二甲基丙基、3-(甲基磺酰基)丙基或2-(甲基磺酰基)乙基;
r2和r3均为甲基;
r4为甲基且
r5为氟,其中r5在r4的邻位。
本发明特别提供以下化合物:
1)n-[6-(2-羟基丙-2-基)-2-(2-甲氧基乙基)-2h-吲唑-5-基]-6-(三氟甲基)吡啶-2-羧酰胺
2)n-[6-(羟甲基)-2-(2-甲氧基乙基)-2h-吲唑-5-基]-6-(三氟甲基)吡啶-2-羧酰胺
3)n-[6-(2-羟基丙-2-基)-2-(3-甲氧基丙基)-2h-吲唑-5-基]-6-(三氟甲基)吡啶-2-羧酰胺
4)n-[6-(羟甲基)-2-(3-甲氧基丙基)-2h-吲唑-5-基]-6-(三氟甲基)吡啶-2-羧酰胺
5)n-[2-(2-羟乙基)-6-(2-羟基丙-2-基)-2h-吲唑-5-基]-6-(三氟甲基)吡啶-2-羧酰胺
6)n-[6-(2-羟基丙-2-基)-2-(3-羟丙基)-2h-吲唑-5-基]-6-(三氟甲基)吡啶-2-羧酰胺
7)n-[2-(2-羟乙基)-6-(羟甲基)-2h-吲唑-5-基]-6-(三氟甲基)吡啶-2-羧酰胺
8)n-[6-(2-羟基丙-2-基)-2-(氧杂环丁烷-3-基甲基)-2h-吲唑-5-基]-6-(三氟甲基)吡啶-2-羧酰胺
9)n-[6-(羟甲基)-2-(氧杂环丁烷-3-基甲基)-2h-吲唑-5-基]-6-(三氟甲基)吡啶-2-羧酰胺
10)n-{6-(2-羟基丙-2-基)-2-[3-(甲基磺酰基)丙基]-2h-吲唑-5-基}-6-(三氟甲基)吡啶-2-羧酰胺
11)n-[2-(3-羟基-3-甲基丁基)-6-(2-羟基丙-2-基)-2h-吲唑-5-基]-6-(三氟甲基)吡啶-2-羧酰胺
12)n-{6-(2-羟基丙-2-基)-2-[2-(甲基磺酰基)乙基]-2h-吲唑-5-基}-6-(三氟甲基)吡啶-2-羧酰胺
13)6-(二氟甲基)-n-[2-(3-羟基-3-甲基丁基)-6-(2-羟基丙-2-基)-2h-吲唑-5-基]吡啶-2-羧酰胺
14)6-(二氟甲基)-n-{6-(2-羟基丙-2-基)-2-[2-(甲基磺酰基)乙基]-2h-吲唑-5-基}吡啶-2-羧酰胺
15)6-(二氟甲基)-n-[6-(2-羟基丙-2-基)-2-(3-羟丙基)-2h-吲唑-5-基]吡啶-2-羧酰胺
16)n-[6-(2-羟基丙-2-基)-2-(4,4,4-三氟丁基)-2h-吲唑-5-基]-6-(三氟甲基)吡啶-2-羧酰胺
17)n-{6-(2-羟基丙-2-基)-2-[3-(三氟甲氧基)丙基]-2h-吲唑-5-基}-6-(三氟甲基)吡啶-2-羧酰胺
18)n-{6-(2-羟基丙-2-基)-2-[3-(2,2,2-三氟乙氧基)丙基]-2h-吲唑-5-基}-6-(三氟甲基)吡啶-2-羧酰胺
19)5-氟-n-[2-(3-羟基-3-甲基丁基)-6-(2-羟基丙-2-基)-2h-吲唑-5-基]-6-甲基吡啶-2-羧酰胺
20)n-[2-(3-羟基-3-甲基丁基)-6-(2-羟基丙-2-基)-2h-吲唑-5-基]-6-甲基吡啶-2-羧酰胺
21)6-(2-羟基丙-2-基)-n-[6-(2-羟基丙-2-基)-2-(4,4,4-三氟丁基)-2h-吲唑-5-基]吡啶-2-羧酰胺
22)n-{2-[2-(1-羟基环丙基)乙基]-6-(2-羟基丙-2-基)-2h-吲唑-5-基}-6-(三氟甲基)吡啶-2-羧酰胺。
本发明还提供由通式(ii)的化合物制备通式(iii)的化合物的方法,
其中
r1为4,4,4-三氟丁基、3-羟基-3-甲基丁基、3-甲氧基丙基、3-羟丙基、3-羟基-2-甲基丙基、3-羟基-2,2-二甲基丙基、3-三氟甲氧基丙基、2-甲氧基乙基、2-羟乙基、2-(甲基磺酰基)乙基、3-(甲基磺酰基)丙基或2-(1-羟基环丙基)乙基;
r4为二氟甲基、三氟甲基或甲基;且
r5为氢或氟,
所述方法通过在碳酸钾存在下,使(ii)与适当取代的烷基卤化物或4-甲基苯磺酸烷基酯反应而进行。
本发明还提供通式(iii)的化合物,及其非对映异构体、对映异构体、代谢物、盐、溶剂合物或盐的溶剂合物
在通式(iii)中
r1为4,4,4-三氟丁基、3-羟基-3-甲基丁基、3-甲氧基丙基、3-羟基丙基、3-羟基丁基、3-羟基-2-甲基丙基、3-羟基-2,2-二甲基丙基、3-三氟甲氧基丙基、2-甲氧基乙基、2-羟乙基、2-(甲基磺酰基)乙基、3-(甲基磺酰基)丙基或2-(1-羟基环丙基)乙基;
r4为二氟甲基、三氟甲基或甲基;且
r5为氢或氟。
特别优选以下通式(iii)的化合物:
5-{[(5-氟-6-甲基吡啶-2-基)羰基]氨基}-2-(3-羟基-3-甲基丁基)-2h-吲唑-6-羧酸甲酯以及
2-(3-羟基-3-甲基丁基)-5-({[6-(三氟甲基)吡啶-2-基]羰基}氨基)-2h-吲唑-6-羧酸甲酯。
通式(iii)的化合物适合用于制备一部分通式(i)的化合物。
此外,通式(iii)的化合物是白细胞介素-1-受体相关激酶-4(irak4)的抑制剂。
本发明还提供由式(iii)的化合物制备本发明通式(i)的化合物的方法
其中
r1为4,4,4-三氟丁基、3-羟基-3-甲基丁基、3-羟基丁基、3-甲氧基丙基、3-羟丙基、3-羟基-2-甲基丙基、3-羟基-2,2-二甲基丙基、3-三氟甲氧基丙基、2-甲氧基乙基、2-羟乙基、3-(甲基磺酰基)丙基、2-(1-羟基环丙基)乙基;
r2和r3为甲基;
r4为二氟甲基、三氟甲基或甲基;且
r5为氢为氟。
所述方法通过与甲基溴化镁的格式反应(grignardreaction)而进行。
本发明的化合物起irak4激酶抑制剂的作用并且具有不可预见的有用的药理活性谱。
因此,除了上文提及的主题之外,本发明还提供本发明化合物用于治疗和/或预防人和动物疾病的用途。
特别优选用本发明的irak4抑制剂治疗和/或预防妇科疾病、炎症性皮肤疾病、心血管疾病、肺部疾病、眼部疾病、自身免疫性疾病、疼痛病、代谢病、痛风、肝脏疾病、代谢综合征、胰岛素抵抗和癌症。
本发明的化合物适于预防和/或治疗各种疾病以及疾病相关状态,特别是由tlr(除tlr3之外)和/或il-1受体家族介导的疾病和/或病理直接由irak4介导的疾病。irak4-相关疾病包括多发性硬化、动脉粥样硬化、心肌梗死、阿尔茨海默氏病、病毒诱导的心肌炎、痛风、伏格特-小柳-原田三氏综合征、红斑狼疮、牛皮癣脊椎关节炎和关节炎。
本发明化合物还可用于预防和/或治疗由myd88和tlr(除tlr3之外)介导的疾病。这包括多发性硬化、类风湿性关节炎、脊椎关节炎(特别是牛皮癣脊椎关节炎和贝赫捷列夫氏病)、包括胰岛素抵抗糖尿病在内的代谢综合征、骨关节炎、斯耶格伦氏综合征(
由于本发明化合物的作用机理,它们适于预防和/或治疗tlr介导的疾病:贝切特氏病(behcet’sdisease)、痛风、子宫内膜异位症和与子宫内膜异位症相关的疼痛和其他与子宫内膜异位症相关的症状例如痛经、交媾困难、排尿困难和大便困难。此外,本发明化合物适合用于治疗和/或预防移植排斥、红斑狼疮、成人斯蒂尔氏病以及慢性炎性肠疾病如溃疡性结肠炎和克罗恩氏病。
除了已经列出的疾病之外,本发明化合物的使用也适合治疗和/或预防以下疾病:眼部疾病如角膜炎、变应性结膜炎、干燥性角结膜炎、黄斑变性和葡萄膜炎;心血管疾病如动脉粥样硬化、心肌再灌注损伤、心肌梗死、高血压以及神经如阿尔茨海默氏病、中风和帕金森氏病。
本发明化合物的作用机理还允许预防和/或治疗由tlr和il-1受体家族介导的肝部疾病,特别是nafld、nash、ash、肝纤维化和肝硬化。
本发明化合物也提供对瘙痒和疼痛,特别是急性、慢性、炎性和神经性疼痛的预防和/或治疗。
由于本发明化合物的作用机理,它们适合用于预防和/或治疗肿瘤疾病如淋巴瘤、慢性淋巴性白血病、黑色素瘤和肝细胞癌、乳腺癌、前列腺癌以及ras-依赖性肿瘤。
此外,本发明化合物适合用于治疗和/或预防通过il-1受体家族介导的疾病。这些疾病包括:caps(冷吡啉相关周期性综合征(cryopyrin-associatedperiodicsyndromes)),包括fcas(家族性寒冷型自身炎症综合征(familialcoldautoinflammatorysyndrome));mws(muckle-wells综合征);nomid(新生儿多系统炎症性疾病(neonatal-onsetmultisysteminflammatorydisease))和conca(慢性婴儿神经皮肤关节(chronicinfantile,neurological,cutaneous,andarticular))综合征;fmf(家族性地中海热(familialmediterraneanfever));hids(高-igd综合征);traps(肿瘤坏死因子受体1相关周期性综合征);幼年特发性关节炎;成人斯蒂尔氏病;亚-贝二氏综合征(adamantiades-
本发明化合物也可用于治疗和/或预防由il-1受体家族介导的神经障碍,如卒中、阿尔茨海默氏病、颅-脑创伤,以及皮肤疾病如银屑病、特应性皮炎、反常性痤疮、斑秃和变应性接触性皮炎。
此外,本发明化合物还适合用于治疗和/或预防疼痛疾病,特别是急性、慢性、炎性和神经性疼痛。这优选包括痛觉过敏、异常性疼痛、关节炎(例如骨关节炎、类风湿性关节炎和脊椎关节炎)疼痛、经前痛、与子宫内膜异位症相关的疼痛、手术后疼痛、间质性膀胱炎疼痛、crps(复杂性局部疼痛综合征)、三叉神经痛、前列腺炎的疼痛、脊髓损伤引起的疼痛、炎症引发的疼痛、下腰痛、癌痛、化疗相关的疼痛、hiv治疗引发的神经病、烧伤引起的疼痛和慢性疼痛。
本发明另外还提供治疗和/或预防疾病、特别是上文所提及的疾病的方法,所述方法使用有效量的至少一种本发明化合物。
在本发明的上下文中,术语“治疗”包括抑制、延缓、阻止(checking)、缓解、减轻、限制、减少、制止、抵抗或治愈疾病、障碍(condition)、病症、损伤或健康问题,或所述状态的发展、进程或演进和/或所述状态的症状。术语“疗法”在本文中应理解为与术语“治疗”同义。
在本发明的上下文中,术语“预防(prevention)”、“预防(prophylaxis)”和“阻止(preclusion)”同义使用并且指避免或减少感染、经受、遭受或患有疾病、障碍、病症、损伤或健康问题或所述状态的发展或演进和/或所述状态的症状的风险。
可以部分或完全治疗或预防疾病、障碍、病症、损伤或健康问题。
本发明化合物可以单独使用或(如果需要)与其他活性成分结合使用。本发明还提供药物,所述药物包含至少一种本发明化合物和一种或多种其他活性成分,特别用于治疗和/或预防上述病症。适于结合的活性成分的优选实例包括:
通常可提及的活性成分如:抗细菌物质(例如青霉素、万古霉素、环丙沙星(ciprofloxacin))、抗病毒物质(例如阿昔洛维(aciclovir)、奥司他韦(oseltamivir))和抗真菌物质(例如萘替芬(naftifin)、制霉菌素);以及丙种球蛋白化合物、免疫调节化合物和免疫抑制化合物,如环孢菌素(cyclosporin)、
对于肿瘤治疗,应提及以下:免疫疗法(例如阿地白介素(aldesleukin)、阿来组单抗(alemtuzumab)、巴利昔单抗(basiliximab)、卡妥索单抗(catumaxomab)、西莫白介素(celmoleukin)、地尼白介素2(denileukindiftitox)、依库珠单抗(eculizumab)、依决洛单抗(edrecolomab)、吉妥单抗(gemtuzumab)、替伊莫单抗(ibritumomabtiuxetan)、咪喹莫特(imiquimod)、干扰素α(interferon-alpha)、干扰素β(interferonbeta)、干扰素γ(interferon-gamma)、伊普利姆玛单抗(ipilimumab)、来那度胺(lenalidomide)、雷诺司替(lenograstim)、米伐木肽
(mifamurtide)、奥法木单抗(ofatumumab)、奥普瑞白介素(oprelvekin)、溶链菌(picibanil)、普乐沙福(plerixafor)、多糖k(polysaccharide-k)、沙格司亭(sargramostim)、sipuleucel-t、他索纳明(tasonermin)、替西白介素(teceleukin)、托珠单抗(tocilizumab))、抗增殖物质(例如但不限于:安吖啶(amsacrine)、阿加来必(arglabin)、三氧化二砷(arsenictrioxide)、天冬酰胺酶(asparaginase)、博来霉素(bleomycin)、白消安(busulfan)、更生霉素(dactinomycin)、多西他赛(docetaxel)、表柔比星(epirubicin)、培洛霉素(peplomycin)、曲妥单抗(trastuzumab)、利妥昔单抗(rituximab)、阿托珠单抗(obinutuzumab)、奥法木单抗(ofatumumab)、托西莫单抗(tositumomab))、芳香酶抑制剂(aromataseinhibitors)(例如依西美坦(exemestane)、法倔唑(fadrozole)、福美坦(formestane)、来曲唑(letrozole)、阿那曲唑(anastrozole)、伏氯唑(vorozole))、抗雌激素(例如氯地孕酮(chlormadinone)、氟维司群(fulvestrant)、美雄烷(mepitiostane)、他莫西芬(tamoxifen)、托瑞米芬(toremifen))、雌激素(例如雌二醇、polyoestradiolphosphate、雷洛昔芬(raloxifen))、孕激素(例如甲羟孕酮(medroxyprogesterone)、甲地孕酮(megestrol)、拓扑异构酶i抑制剂(例如依立替康(irinotecan)、拓扑替康(topotecan))、拓扑异构酶ii抑制剂(例如氨柔比星(amrubicin)、柔红霉素(daunorubicin)、依利醋铵(elliptiniumacetate)、依托泊苷(etoposide)、伊达比星(idarubicin)、米托蒽醌(mitoxantrone)、替尼泊苷(teniposide))、微管(microtubuli)-活性物质(例如卡巴他赛(cabazitaxel)、艾日布林(eribulin)、紫杉醇(paclitaxel)、长春碱(vinblastine)、长春新碱(vincristine)、长春地辛(vindesine)、长春瑞滨(vinorelbine))、端粒酶抑制剂(例如伊美司他(imetelstat))、烷基化物质和组蛋白脱乙酰酶抑制剂(例如苯达莫司汀(bendamustine)、卡莫司汀(carmustine)、氮芥(chlormethine)、达卡巴嗪(dacarbazine)、雌莫司汀(estramustine)、异环磷酰胺(ifosfamide)、洛莫司汀(lomustine)、二溴甘露醇(mitobronitol)、二溴卫矛醇(mitolactol)、尼莫司汀(nimustine)、泼尼莫司汀(prednimustine)、丙卡巴肼(procarbazine)、雷莫司汀(ranimustine)、链脲霉素(streptozotocin)、替莫唑胺(temozolomide)、噻替派(thiotepa)、苏消安(treosulfan)、曲磷胺(trofosfamide)、伏立诺他(vorinostat)、罗米地辛(romidepsin)、帕比司他(panobinostat));影响细胞分化过程的物质如阿巴瑞克(abarelix)、氨鲁米特(aminoglutethimide)、贝沙罗汀(bexarotene)、mmp抑制剂(肽模拟物、非肽模拟物和四环素如马立马司他(marimastat)、bay12-9566、bms-275291、氯屈膦酸盐(clodronate)、普啉司他(prinomastat)、强力霉素(doxycycline))、mtor抑制剂(例如西罗莫司(sirolimus)、依维莫司(everolimus)、坦罗莫司(temsirolimus)、佐他莫司(zotarolimus))、抗代谢剂(例如氯法拉滨(clofarabine)、去氧氟尿苷(doxifluridine)、氨甲喋呤(methotrexate)、5-氟尿嘧啶、克拉屈滨(cladribine)、阿糖胞苷(cytarabine)、氟达拉滨(fludarabine)、巯基嘌呤(mercaptopurine)、甲氨蝶呤(methotrexate)、培美曲塞(pemetrexed)、雷替曲塞(raltitrexed)、替加氟(tegafur)、硫鸟嘌呤(tioguanine))、铂化合物(例如卡波铂(carboplatin)、顺铂(cisplatin)、顺铂(cisplatinum)、依他铂(eptaplatin)、洛铂(lobaplatin)、米铂(miriplatin)、奈达铂(nedaplatin)、奥沙利铂(oxaliplatin));抗血管生成化合物(例如贝伐单抗(bevacizumab))、抗雄激素化合物(例如贝伐单抗(bevacizumab)、恩杂鲁胺(enzalutamide)、氟他胺(flutamide)、尼鲁米特(nilutamide)、比卡鲁胺(bicalutamide)、环丙孕酮(cyproterone)、醋酸环丙孕酮(cyproteroneacetate))、蛋白酶体抑制剂(例如硼替佐米(bortezomib)、卡非佐米(carfilzomib)、奥普佐米(oprozomib)、onyx0914)、促性腺素释放素激动剂和拮抗剂(例如阿巴瑞克(abarelix)、布舍瑞林(buserelin)、地洛瑞林(deslorelin)、加尼瑞克(ganirelix)、戈舍瑞林(goserelin)、组氨瑞林(histrelin)、曲普瑞林(triptorelin)、地加瑞克(degarelix)、亮丙瑞林(leuprorelin))、甲硫氨酸氨肽酶抑制剂(例如bengamide衍生物、tnp-470、ppi-2458)、乙酰肝素酶(heparanase)抑制剂(例如sst0001、pi-88);遗传修饰的ras蛋白的抑制剂(例如法尼基转移酶抑制剂如洛那法尼(lonafarnib)、替比法尼(tipifarnib))、hsp90抑制剂(例如:格尔德霉素(geldamycin)衍生物如17-烯丙基氨基格尔德霉素、17-脱甲氧基格尔德霉素(17aag)、17-dmag、瑞他霉素盐酸盐(retaspimycinhydrochloride)、ipi-493、auy922、biib028、sta-9090、kw-2478)、驱动蛋白纺锤体蛋白抑制剂(例如sb715992、sb743921、喷他脒(pentamidine)/氯丙嗪(chlorpromazine))、mek(丝裂原活化蛋白激酶激酶)抑制剂(例如曲美替尼(trametinib)、bay86-9766(refametinib)、azd6244)、激酶抑制剂(例如:索拉非尼(sorafenib)、瑞戈非尼(regorafenib)、拉帕替尼(lapatinib)、索坦
对于肿瘤治疗,还合适的是结合疗法:伴有用本发明irak4抑制剂进行药物治疗的非药物疗法,如化学疗法(例如阿扎胞苷(azacitidine)、贝洛替康(belotecan)、依诺他滨(enocitabine)、美法仑(melphalan)、戊柔比星(valrubicin)、长春氟宁(vinflunin)、佐柔比星(zorubicin)、放射疗法(例如i-125粒子(i-125seeds)、钯-103粒子(palladium-103seed)、氯化镭-223(radium-223chloride))或光线疗法(例如替莫泊芬(temoporfin)、他拉泊芬(talaporfin);或者,在非药物肿瘤疗法如化学疗法、放射疗法或光线疗法结束之后,补充用本发明irak4抑制剂进行药物治疗。
除了上文提及的那些活性成分之外,本发明的irak4抑制剂也可以与以下活性成分结合:
用于阿尔茨海默氏治疗的活性成分,例如,乙酰胆碱酯酶抑制剂(例如多奈哌齐(donepezil)、雷司替明(rivastigmine)、加兰他敏(galantamine)、他克林(tacrine))、nmda(n-甲基-d-天冬氨酸盐)受体拮抗剂(例如美金刚胺(memantine));用于治疗帕金森氏病的l-dopa/卡比多巴(carbidopa)(l-3,4-二羟基苯丙氨酸)、comt(儿茶酚-o-甲基转移酶)抑制剂(例如恩他卡朋(entacapone))、多巴胺激动剂(例如罗吡尼洛(ropinrole)、普拉克索(pramipexole)、溴隐亭(bromocriptine))、mao-b(单胺氧化酶-b(monoaminooxidase-b))抑制剂(例如司来吉兰(selegiline))、抗胆碱能药(例如苯海索(trihexyphenidyl))和nmda拮抗剂(例如金刚烷胺(amantadine));用于治疗多发性硬化症的β-干扰素(ifn-β)(例如ifnβ-1b、ifnβ-1a
还应提及用于治疗和预防上述疾病的下述药物,所述药物包含至少一种本发明的化合物和一种或多种其他活性成分,特别是ep4抑制剂(前列腺素e2受体4抑制剂)、p2x3抑制剂(p2x嘌呤受体3)、ptges抑制剂(前列腺素e合成酶抑制剂)或akr1c3抑制剂(醛酮还原酶家族1成员c3抑制剂)。
本发明化合物可系统地和/或局部地作用。为此,其可以以适合的方式给药,例如通过口服、肠胃外、肺、鼻、舌下、舌、颊、直肠、真皮、经皮或结膜途径、经由耳或作为植入物或支架。
本发明化合物可以以适于这些给药途径的给药剂型进行给药。
口服给药的合适的给药剂型是这样的:其根据现有技术工作并快速和/或以改造的方式释放本发明的化合物,并且其含有结晶和/或无定形和/或溶解形式的本发明的化合物,其例如为片剂(未包衣或包衣片剂,所述包衣片剂例如具有控制本发明化合物释放的抗胃液包衣或延迟溶解包衣或不溶包衣)、在口腔中迅速崩解的片剂或软片/扁圆片(oblates)、软片剂/冻干剂、胶囊剂(例如硬或软明胶胶囊剂)、糖衣片剂、颗粒剂、丸剂、粉末剂、乳剂、悬浮剂、气雾剂或溶液剂。
肠胃外给药可通过避过吸收步骤(例如通过静脉内、动脉内、心内、脊椎内或腰椎内途径)或包括吸收(例如通过肌内、皮下、皮内、经皮或腹膜内途径)而完成。适用于肠胃外给药的给药剂型包括溶液剂、悬浮剂、乳剂、冻干剂或无菌粉末剂的形式的注射和输液用制剂。
对于其他的给药途径,适合的实例为可吸入药物形式(包括粉雾剂(powderinhalers)、喷雾剂)、滴鼻剂、溶液剂或喷雾剂,用于舌、舌下或颊给药的片剂、软片/扁圆片或胶囊剂,栓剂、耳用或眼用制剂、阴道胶囊剂、水悬剂(洗液、振荡合剂(shakingmixtures))、亲脂性悬浮剂、软膏剂、乳膏(creams)、经皮治疗系统(例如贴剂)、乳剂(milk)、糊剂、泡沫剂、喷粉剂(sprinklingpowders)、植入物或支架。
优选口服或肠胃外给药,特别是口服给药。
本发明化合物可转化成所提及的给药剂型。这可以以本身已知的方式通过与惰性、无毒、药学上适合的赋形剂混合来完成。这些赋形剂包括载体(例如微晶纤维素、乳糖、甘露醇)、溶剂(例如液体聚乙二醇)、乳化剂和分散剂或润湿剂(例如十二烷基硫酸钠、聚氧脱水山梨醇油酸酯)、粘合剂(例如聚乙烯吡咯烷酮)、合成和天然聚合物(例如白蛋白)、稳定剂(例如抗氧化剂,例如抗坏血酸)、着色剂(例如无机颜料,例如氧化铁)以及矫味剂和/或矫臭剂。
本发明还提供包含至少一种本发明化合物,通常同时包含一种或多种惰性、无毒、药学上适合的赋形剂的药物,及其用于上述目的的用途。
通常,已发现,在肠胃外给药的情况下,给药量为约0.001至1mg/kg体重,优选约0.01至0.5mg/kg体重是有利的,以便达到有效的效果。在口服给药的情况下,剂量为约0.01至100mg/kg体重,优选约0.01至20mg/kg体重且最优选0.1至10mg/kg体重。
然而,在某些情况下,可能有必要偏离规定量,具体地可随体重、给药途径、对活性成分的个体反应、制剂的性质以及给药时间或给药间隔来调整。因此,在有些情况下,用少于上述最小量来处理可能就足够,而在其他情况下,必须超过所提及的上限。在更大给药量的情况下,可取的是将它们分成一天之内的若干单独剂量。
以下工作实施例用于说明本发明。本发明不限于所述实施例。
除非另有说明,以下测试和实施例中的百分比为重量百分比;份为重量份。液体/液体溶液的溶剂比、稀释比和浓度数据在各种情况下均基于体积计。
本发明化合物的制备
本发明化合物的制备通过以下合成方案说明:
用于合成本发明化合物的起始物料是羧酸(中间体v3),其市售可得或者可通过由文献已知的路线或类似于由文献已知的路线来制备(参见例如europeanjournaloforganicchemistry2003,8,1559–1568,chemicalandpharmaceuticalbulletin,1990,38,9,2446–2458,syntheticcommunications2012,42,658–666,tetrahedron,2004,60,51,11869-11874)(参见例如合成方案1)。一些羧酸v3可从羧酸酯(中间体v2)开始,通过水解(参见例如6-(羟甲基)吡啶-2-羧酸乙酯与氢氧化钠水溶液在甲醇中的反应,wo200411328)或——在叔丁酯的情况下——通过与酸如氯化氢或三氟乙酸反应(参见例如daltontransactions,2014,43,19,7176–7190)来制备。羧酸v3也可以其碱金属盐的形式使用。中间体v2任选地也可由带有氯、溴或碘作为取代基x1的中间体v1来制备,所述制备通过在一氧化碳氛围中,任选地在提高的压力下,在膦配体(例如1,3-双(二苯基膦基)丙烷)、钯化合物(例如乙酸钯(ii))和碱(例如三乙胺)存在下,于溶剂(例如二甲亚砜)中添加甲醇或乙醇而进行(对于制备方法,参见,例如wo2012112743、wo2005082866、chemicalcommunications(cambridge,england),2003,15,1948–1949,wo200661715)。中间体v1市售可得或可通过由文献已知的路线制得。示例性制备方法详述于wo2012061926、europeanjournaloforganicchemistry,2002,2,327–330,synthesis,2004,10,1619–1624、journaloftheamericanchemicalsociety,2013,135,32,12122–12134、bioorganicandmedicinalchemistryletters,2014,24,16,4039–4043、us2007185058、wo2009117421中。
合成方案1
x1为氯、溴或碘。
rd为甲基、乙基、苄基或叔丁基。
r4、r5各自如在通式(i)中所定义。
按照合成方案2,由1h-吲唑-6-羧酸甲酯(中间体0)开始,与wo2008/001883类似地,通过硝化和在木炭载钯的存在下用氢还原中间体1的硝基可以获得5-氨基-1h-吲唑-6-羧酸甲酯(中间体2)。对于从中间体2开始来制备中间体3,可以使用由文献已知的各种偶联剂(aminoacids,peptidesandproteinsinorganicchemistry,第3卷–buildingblocks,
catalysisandcouplingchemistry,andrewb.hughes,wiley,第12章-peptide-couplingreagents,407-442;chem.soc.rev.,2009,38,606)。例如,可以结合使用1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐与1-羟基-1h-苯并三唑水合物(hobt,wo2012107475;bioorg.med.chem.lett.,2008,18,2093)、四氟硼酸(1h-苯并三唑-1-基氧基)(二甲基氨基)-n,n-二甲基甲亚铵(tbtu,cas125700-67-6)、六氟磷酸(二甲基氨基)-n,n-二甲基(3h-[1,2,3]三唑并[4,5-b]吡啶-3-基氧基)甲铵(hatu,cas148893-10-1)、丙烷膦酸酐(以乙酸乙酯溶液或dmf溶液的形式,cas68957-94-8)或二-1h-咪唑-1-基甲酮(cdi)作为偶联剂,并在每种情况下向反应混合物中加入碱例如三乙胺或n-乙基-n-异丙基丙-2-胺。优选使用tbtu和n-乙基-n-异丙基丙-2-胺的thf溶液。
合成方案2
取代基r4、r5各自如在通式(i)中所定义。
从中间体3开始,可以制备2-取代吲唑衍生物(中间体4)(参见合成方案3)。为此目的,有用的反应包括与任选取代的烷基氯化物、烷基溴化物、烷基碘化物或4-甲基苯磺酸烷基酯的反应。所用的烷基卤化物或4-甲基苯磺酸烷基酯市售可得,或者可类似于由文献已知的路线来制备(对于4-甲基苯磺酸烷基酯的制备,一个实例是在三乙胺或吡啶的存在下使合适的醇与4-甲基苯磺酰氯反应;参见,例如bioorganicandmedicinalchemistry,2006,14,124277–4294)。任选地,在使用烷基氯化物或烷基溴化物的情况下,还可以添加碱金属碘化物,如碘化钾或碘化钠。所用的碱例如可以是碳酸钾、碳酸铯或氢化钠。就反应性烷基卤化物来说,在一些情况下也可以使用n-环己基-n-甲基环己胺。有用的溶剂包括,例如,1-甲基吡咯烷-2-酮、dmf、dmso或thf。任选地,所用的烷基卤化物或4-甲基苯磺酸烷基酯可具有任选地预先已用保护基团保护起来的官能团(也参见p.g.m.wuts,t.w.greene,greene’sprotectivegroupsinorganicsynthesis,第四版,isbn:9780471697541)。例如,如果使用具有一个或多个羟基基团的烷基卤化物或4-甲基苯磺酸烷基酯,则这些羟基基团任选可用本领域技术人员熟知的叔丁基(二甲基)甲硅烷基或类似的含有硅的保护基团进行保护。或者,也可用四氢-2h-吡喃(thp)基团或乙酰基或苯甲酰基来保护羟基基团。然后,可在合成中间体4之后将所用的保护基团脱去,或在合成(i)之后脱去。例如,如果将叔丁基(二甲基甲硅烷基)基团用作保护基团,那么其可以使用在溶剂如thf中的四丁基氟化铵来脱去。thp保护基团例如可使用4-甲基苯磺酸(任选地以一水合物的形式)来脱去。乙酰基或苯甲酰基可通过用氢氧化钠水溶液处理来脱去。
任选地,所用的烷基卤化物或4-甲基苯磺酸烷基酯可含有可通过本领域技术人员已知的氧化或还原反应进行转化的官能团(参见例如scienceofsynthesis,georgthiemeverlag)。例如,如果所述官能团为硫醚基,则其可通过在文献中已知的方法而氧化为亚砜基或砜基。就亚砜基来说,其可以又被氧化成砜基。对于这些氧化步骤,例如可以使用3-氯过苯甲酸(cas937-14-4)(关于这点,还参见例如,us201094000中关于2-(甲基硫烷基)乙基-1h-吡唑衍生物氧化为2-(甲基亚磺酰基)乙基-1h-吡唑衍生物,以及另外2-(甲基硫烷基)乙基-1h-吡唑衍生物氧化为2-(甲基磺酰基)乙基-1h-吡唑衍生物)。如果所使用的烷基卤化物或甲苯磺酸酯含有酮基,则其可通过本领域技术人员已知的还原方法还原成醇基(参见例如chemischeberichte,1980,113,1907–1920中关于硼氢化钠的使用)。这样的氧化或还原步骤可在合成中间体4后进行,或在合成本发明通式(i)的化合物之后进行。或者,可通过中间体3与任选取代的烷基醇的mitsunobu反应(参见例如k.c.k.swamy等人,chem.rev.2009,109,2551–2651)来制备中间体4。可以结合使用各种膦(例如三苯基膦、三丁基膦或1,2-二苯基膦基乙烷)与文献中提及的偶氮二羧酸二异丙基酯(cas2446-83-5)或其他二氮烯衍生物(k.c.k.swamy等人,chem.rev.2009,109,2551–2651)。优选使用三苯基膦和偶氮二羧酸二异丙基酯。如果烷基醇带有官能团,那么,可以如上述与烷基卤化物的反应一样进行已知的保护基团策略(其他指示可参见p.g.m.wuts,t.w.greene,greene’sprotectivegroupsinorganicsynthesis,第四版,isbn:9780471697541),并且如上述与烷基卤化物的反应一样地,相应于中间体4的合成进行氧化或还原步骤,或在合成本发明通式(i)的化合物之后进行。从中间体4开始,通过格氏反应,可以获得其中r2和r3定义为c1-c6-烷基的本发明通式(i)的化合物(其中r2和r3具有相同的定义)(参见例如ep2489663中的1h-吲唑-6-羧酸甲酯衍生物与甲基溴化镁的反应)。对于格氏反应,可以使用烷基卤化镁。特别优选在thf或二乙醚中或在thf与二乙醚的混合物中的甲基氯化镁或甲基溴化镁。或者,可从中间体4开始,通过与烷基锂试剂反应来获得其中r2和r3定义为c1-c6-烷基的本发明通式(i)的化合物(其中r2和r3具有相同的定义)(参见例如wo2006116412中的2-氨基-4-氯-1-甲基-1h-苯并咪唑-7-羧酸甲酯衍生物与异丙基锂或叔丁基锂的反应)。从中间体4开始,通过用在thf中的氢化铝锂、在thf中的硼氢化锂或在thf中的硼氢化钠(任选添加甲醇)、或硼氢化锂与硼氢化钠的混合物还原,可以制备其中r2和r3定义为h的本发明通式(i)的化合物。
合成方案3
取代基r1、r2、r3、r4、r5各自如在通式(i)中所定义。
从中间体3开始,通过格氏反应,可以获得其中r2和r3定义为c1-c6-烷基的中间体5(其中r2和r3具有相同的定义)(参见例如合成方案4)。为此目的,可以使用在thf或二乙醚中的或在thf与二乙醚的混合物中的合适的烷基卤化镁,例如甲基氯化镁或甲基溴化镁。
从中间体5开始,接着可以制备其中r2和r3定义为c1-c6-烷基的本发明化合物(i)(其中r2和r3具有相同的定义)的部分(i-a)。为此目的,与合成方案3(中间体3的制备)类似,有用的反应是中间体5与任选取代的烷基氯化物、烷基溴化物、烷基碘化物或4-甲基苯磺酸烷基酯的反应。可以使用与在合成方案3中描述的那些类似的保护基团策略。
或者,对于其中r2和r3定义为c1-c6-烷基的本发明化合物(i)(其中r2和r3具有相同的定义)的部分(i-a)的制备,可以利用中间体5与任选取代的烷基醇的mitsunobu反应(与合成方案3类似)。
如果式(i-a)化合物中的r1包含合适的取代基,那么任选地随后可以利用氧化或还原反应来制备其他的本发明化合物(与合成方案3类似)。
合成方案4
取代基r1、r4、r5分别如在通式(i)中所定义。r2和r3总是具有相同的定义,均为c1-c6-烷基。
从中间体1开始,可以以另一种方式制备中间体4(参见合成方案5)。首先,通过如合成方案3中(由中间体3制备中间体4)的方法将中间体1转化成中间体6。
然后,可将中间体6通过硝基的还原而转化成中间体7。例如,硝基可以用碳载钯在氢气氛围下还原(参见例如wo2013174744中关于将6-异丙氧基-5-硝基-1h-吲唑还原为6-异丙氧基-1h-吲唑-5-胺),或通过使用在水或乙醇中的铁和氯化铵还原(还参见例如journalofthechemicalsociety,1955,2412-2419),或通过使用氯化锡(ii)(cas7772-99-8)还原。优选使用在水和乙醇中的铁和氯化铵。由中间体7制备中间体4可类似于合成方案2(由中间体2制备中间体3)地进行。
如合成方案3所描述,在合成方案5的情况下,任选也可以使用保护基团策略。从中间体6或中间体7开始,任选地也可以如合成方案3所描述地进行本领域技术人员已知的氧化或还原反应(参见例如scienceofsynthesis,georgthiemeverlag)。
合成方案5
取代基r1、r4、r5各自如在通式(i)中所定义。
实施例化合物的合成
缩写及说明
术语氯化钠溶液总是表示饱和氯化钠水溶液。
中间体和实施例的化学名称使用acd/labs(batch12.01版)软件生成。
方法
在一些情况中,本发明化合物及其前体和/或中间体通过lc-ms分析。
方法a1:uplc(mecn-hcooh):
仪器:watersacquityuplc-mssqd3001;柱:acquityuplcbehc181.750×2.1mm;洗脱液a:水+0.1体积%甲酸(99%),洗脱液b:乙腈;梯度:0-1.6min1-99%b,1.6-2.0min99%b;流速0.8ml/min;温度:60℃;进样量:2μl;dad扫描:210-400nm;msesi+,esi-,扫描范围160-1000m/z;elsd。
方法a2:uplc(mecn-nh3):
仪器:watersacquityuplc-mssqd3001;柱:acquityuplcbehc181.750×2.1mm;洗脱液a:水+0.2体积%的氨(32%);洗脱液b:乙腈;梯度:0-1.6min1-99%b,1.6-2.0min99%b;流速0.8ml/min;温度:60℃;进样量:2μl;dad扫描:210-400nm;msesi+,esi-,扫描范围160-1000m/z;elsd。
方法a3:(lc-ms)
仪器:agilent1290infinitylc;柱:acquityuplcbehc181.750×2.1mm;洗脱液a:水+0.05体积%的甲酸,洗脱液b:乙腈+0.05体积%的甲酸;梯度:0-1.7min2-90%b,1.7-2.0min90%b;流速1.2ml/min;温度:60℃;进样量:2μl;dad扫描:190-390nm;ms:agilenttof6230。
方法a4:(lc-ms)
仪器:watersacquity;柱:kinetex(phenomenex),50×2mm;洗脱液a:水+0.05体积%的甲酸,洗脱液b:乙腈+0.05体积%的甲酸;梯度:0-1.9min1-99%b,1.9-2.1min99%b;流速1.5ml/min;温度:60℃;进样量:0.5μl;dad扫描:200-400nm。
在一些情况中,本发明的化合物及其前体和/或中间体通过以下说明性的制备型hplc方法纯化。
方法p1:系统:waters自动纯化系统系统:泵2545,样品管理器2767,cfo,dad2996,elsd2424,sqd;柱:xbridgec185μm100×30mm;洗脱液a:水+0.1体积%的甲酸,洗脱液b:乙腈;梯度:0-8min10-100%b,8-10min100%b;流速:50ml/min;温度:室温;溶液:最大250mg/最大2.5mldmso或dmf;进样量:1×2.5ml;检测:dad扫描范围210–400nm;msesi+,esi-,扫描范围160-1000m/z。
方法p2:系统:waters自动纯化系统系统:泵254,样品管理器2767,cfo,dad2996,elsd2424,sqd3100;柱:xbridgec185μm10×30mm;洗脱液a:水+0.2体积%的氨(32%),洗脱液b:甲醇;梯度:0-8min30-70%b;流速:50ml/min;温度:室温;检测:dad扫描范围210–400nm;msesi+,esi-,扫描范围160-1000m/z;elsd。
方法p3:系统:labomatic,泵:hd-5000,馏分收集器:labocolvario-4000,uv检测器:knaueruvd2.1s;柱:xbridgec185μm100×30mm;洗脱液a:水+0.2体积%的氨(25%),洗脱液b:乙腈;梯度:0-1min15%b,1-6.3min15-55%b,6.3-6.4min55-100%b,6.4-7.4min100%b;流速:60ml/min;温度:室温;溶液:最大250mg/2mldmso;进样量:2×2ml;检测:uv218nm;软件:scpaprepcon5。
方法p4:系统:labomatic,泵:hd-5000,馏分收集器:labocolvario-4000,uv检测器:knaueruvd2.1s;柱:chromatorexrpc1810μm125×30mm;洗脱液a:水+0.1体积%的甲酸,洗脱液b:乙腈;梯度:0-15min65–100%b;流速:60ml/min;温度:室温;溶液:最大250mg/2mldmso;进样量:2×2ml;检测:uv254nm;软件:scpaprepcon5。
方法p5:系统:sepiatec:prepsfc100;柱:chiralpakia5μm250×20mm;洗脱液a:二氧化碳,洗脱液b:乙醇;梯度:等度20%b;流速:80ml/min;温度:40℃;溶液:最大250mg/2mldmso;进样量:5×0.4ml;检测:uv254nm。
方法p6:系统:agilent:prep1200,2×prep泵,dla,mwd,gilson:liquidhandler215;柱:chiralceloj-h5μm250×20mm;洗脱液a:己烷,洗脱液b:乙醇;梯度:等度30%b;流速:25ml/min;温度:25℃;溶液:187mg/8ml乙醇/甲醇;进样量:8×1.0ml;检测:uv280nm。
方法p7:系统:labomatic,泵:hd-5000,馏分收集器:labocolvario-4000,uv检测器:knaueruvd2.1s;柱:xbridgec185μm100×30mm;洗脱液a:水+0.1体积%的甲酸,洗脱液b:乙腈;梯度:0-3min:65%b等度,3-13min:65-100%b;流速:60ml/min;温度:室温;溶液:最大250mg/2mldmso;进样量:2×2ml;检测:uv254nm。
方法p8:系统:agilent:prep1200,2×prep泵,dla,mwd,gilson:liquidhandler215;柱:chiralpakif5μm250×20mm;洗脱液a:乙醇,洗脱液b:甲醇;梯度:等度50%b;流速:25ml/min;温度:25℃;溶液:600mg/7mln,n-二甲基甲酰胺;进样量:10×0.7ml;检测:uv254nm。
在一些情况中,物质混合物通过在硅胶上的柱层析法来纯化。
为了制备一些本发明化合物及其前体和/或中间体,在硅胶上使用购自biotage的
起始材料
中间体v2-1
6-(2-羟基丙-2-基)吡啶-2-羧酸甲酯
将2.00g(9.26mmol)2-(6-溴吡啶-2-基)丙-2-醇(cas638218-78-7)溶解于20ml甲醇和20mldmso中。随后,加入250mg1,3-双(二苯基膦基)丙烷、130mg乙酸钯(ii)和3ml三乙胺。在室温下将反应混合物用一氧化碳吹扫三次,并在13bar的一氧化碳气氛下搅拌30min。通过施用真空除去一氧化碳气氛,并将混合物在14bar一氧化碳气氛下在100℃下搅拌24h。将高压釜减压,向反应混合物中加入水,并用乙酸乙酯萃取反应混合物三次,用饱和碳酸氢钠水溶液和氯化钠水溶液洗涤,通过疏水性过滤器过滤,浓缩。这得到1.60g粗产品。
uplc-ms(方法a1):rt=0.76min(uv检测器:tic),质量测量值195.00。
中间体v3-1
6-(2-羟基丙-2-基)吡啶-2-羧酸钾
首先将1.60g中间体0-1粗产品加入15m甲醇中,添加0.74g氢氧化钾,并将混合物在50℃下搅拌16.5h。浓缩后,得到2.1g残余物,其无需进一步纯化即使用。
uplc-ms(方法a1):rt=0.47min(uv检测器:tic),质量测量值181.00。
中间体1-1
5-硝基-1h-吲唑-6-羧酸甲酯
在具有cpg搅拌器、滴液漏斗和内部温度计的三口烧瓶中,将4.60g(26.1mmol)1h-吲唑-6-羧酸甲酯(cas号:170487-40-8)溶解在120ml的硫酸(96%)中并冷却至-15℃。在15min时间内,向该溶液中逐滴加入已预先制备并冷却了的硝化酸(10ml96%硫酸于5ml的65%硝酸中)。待逐滴添加结束后,将混合物再搅拌1h(内部温度为-13℃)。将反应混合物加入到冰中,并抽滤出沉淀,用水洗涤并在干燥箱中在50℃下在减压下干燥。获得5.49g标题标题化合物。
uplc-ms(方法a2):rt=0.75min
ms(esipos):m/z=222(m+h)+
1hnmr(400mhz,dmso-d6):δ[ppm]=3.87(s,3h),7.96(s,1h),8.44(s,1h),8.70(s,1h),13.98(宽单峰,1h)。
中间体2-1
5-氨基-1h-吲唑-6-羧酸甲酯
将4.40g(19.8mmol)5-硝基-1h-吲唑-6-羧酸甲酯(中间体1-1)溶解于236ml甲醇中,并用1.06g(0.99mmol)活性碳载钯在标准氢气压力下在25℃下氢化3h。将反应混合物通过硅藻土过滤,用甲醇洗涤过滤器,并将滤液浓缩。得到3.53g标题化合物。
1hnmr(300mhz,dmso-d6):δ[ppm]=3.85(s,3h)6.01(s,2h)6.98(s,1h)7.79-7.91(m,1h)7.99(s,1h)12.84(宽单峰,1h)。
中间体3-1
5-({[6-(三氟甲基)吡啶-2-基]羰基}氨基)-1h-吲唑-6-羧酸甲酯
首先将4.95g(25.9mmol)6-(三氟甲基)吡啶-2-羧酸加入45mlthf中。加入9.07g(28.2mmol)四氟硼酸o-(苯并三唑-1-基)-n,n,n′,n′-四甲基脲和4.92ml(28.2mmol)n-乙基-n-异丙基丙-2-胺,并将混合物在25℃下搅拌30min。随后,加入4.50g(23.5mmol)5-氨基-1h-吲唑-6-羧酸甲酯(中间体2-1),并将混合物在25℃下搅拌24h。通过薄膜过滤器抽滤反应混合物,用thf和水洗涤固体,并在干燥箱中干燥过夜。得到7.60g标题化合物。
uplc-ms(方法a2):rt=1.16min
ms(esipos):m/z=365(m+h)+
1hnmr(400mhz,dmso-d6):δ[ppm]=3.97(s,3h),8.13-8.27(m,2h),8.30(s,1h),8.33-8.45(m,1h),8.45-8.51(m,1h),9.15(s,1h),12.57(s,1h),13.44(s,1h)。
中间体3-2
5-({[6-(二氟甲基)吡啶-2-基]羰基}氨基)-1h-吲唑-6-羧酸甲酯
首先将2.85g(23.5mmol)6-(二氟甲基)吡啶-2-羧酸加入30mlthf中。加入6.05g(18.8mmol)四氟硼酸o-(苯并三唑-1-基)-n,n,n′,n′-四甲基脲和3.3mln-乙基-n-异丙基丙-2-胺,并将混合物在室温下搅拌10分钟。随后,加入3.00g(15.7mmol)5-氨基-1h-吲唑-6-羧酸甲酯,并将混合物在室温下搅拌过夜。使反应混合物与水混合,抽滤出沉淀,并用水和二氯甲烷重复洗涤。这得到1.53g(理论值的27%)标题化合物。分离滤液的各相,将有机相浓缩,与少量二氯甲烷混合并悬浮于超声浴中,并抽滤出沉淀。这再得到1.03g标题化合物。
1h-nmr(第一产物部分,300mhz,dmso-d6):δ[ppm]=3.99(s,3h),7.09(t,1h),8.00(d,1h),8.21-8.40(m,4h),9.14(s,1h),12.53(s,1h),13.44(s,1h)。
中间体3-3
5-({[6-(2-羟基丙-2-基)吡啶-2-基]羰基}氨基)-1h-吲唑-6-羧酸甲酯
首先将2.10g6-(2-羟基丙-2-基)吡啶-2-羧酸钾(中间体v3-1)加入15mlthf中。加入3.69g(11.5mmol)四氟硼酸o-(苯并三唑-1-基)-n,n,n′,n′-四甲基脲和2.00mln-乙基-n-异丙基丙-2-胺,并将混合物在室温下搅拌15min。随后,加入1.83g(9.58mmol)5-氨基-1h-吲唑-6-羧酸甲酯(中间体2-1),并将混合物在室温下搅拌19h。使混合物与水和乙酸乙酯混合,过滤掉未溶解的固体,分离滤液的各相,并用乙酸乙酯萃取水相两次,用氯化钠溶液洗涤,通过疏水过滤器过滤,浓缩,并通过在硅胶上的柱层析法(己烷/乙酸乙酯)进行纯化。待除去溶剂后,得到黄色泡沫状的1.56g标题化合物。
uplc-ms(方法a1):rt=1.00min(uv检测器:ticsmooth),质量测量值354.00。
1h-nmr(500mhz,dmso-d6):δ[ppm]=1.63(s,6h),3.97(s,3h),5.37(s,1h),7.90-7.95(m,1h),8.03-8.07(m,2h),8.23(s,1h),8.29(s,1h),9.19(s,1h),12.79(s,1h),13.41(宽单峰,1h)。
中间体4-1
2-(氧杂环丁烷-3-基甲基)-5-({[6-(三氟甲基)吡啶-2-基]羰基}氨基)-2h-吲唑-6-羧酸甲酯
将1.00g(2.66mmol)5-({[6-(三氟甲基)吡啶-2-基]羰基}氨基)-1h-吲唑-6-羧酸甲酯(中间体3-1)溶解于10mldmf中,待加入1.10g(7.99mmol)碳酸钾和221mg(1.33mmol)碘化钾后,将混合物在25℃下搅拌30min。加入603mg(3.99mmol)3-溴甲基氧杂环丁烷,并将混合物在25℃下搅拌24h。反应混合物在水和乙酸乙酯之间分层。将混合物用乙酸乙酯萃取两次,并将合并的有机相通过疏水过滤器过滤,浓缩。将残余物通过在硅胶上的柱层析法(己烷/乙酸乙酯)进行纯化。得到260mg标题化合物。
uplc-ms(方法a2):rt=1.24min
ms(esipos):m/z=435(m+h)+
1hnmr(400mhz,dmso-d6):δ[ppm]=3.49-3.64(m,1h),3.95(s,3h),4.49(t,2h),4.68(dd,2h),4.81(d,2h),8.20(dd,1h),8.35-8.41(m,1h),8.43-8.49(m,2h),8.55-8.58(m,1h),9.06(s,1h),12.53(s,1h)。
中间体4-2
2-(2-甲氧基乙基)-5-({[6-(三氟甲基)吡啶-2-基]羰基}氨基)-2h-吲唑-6-羧酸甲酯
将1.00g(2.75mmol)5-({[6-(三氟甲基)吡啶-2-基]羰基}氨基)-1h-吲唑-6-羧酸甲酯(中间体3-1)溶解于5mldmf中,搅拌加入387μl(4.12mmol)2-溴乙基甲基醚、1.14g(8.23mmol)碳酸钾和228mg(1.37mmol)碘化钾。将反应混合物在25℃下搅拌24h,用水稀释并用乙酸乙酯萃取两次。将合并的有机相通过疏水过滤器过滤,浓缩。将残余物通过在硅胶上的柱层析法(己烷/乙酸乙酯)进行纯化。得到12mg标题化合物。
uplc-ms(方法a1):rt=1.24min
ms(esipos):m/z=423(m+h)+
1hnmr(400mhz,dmso-d6):δ[ppm]=3.24(s,3h),3.86(t,2h),3.96(s,3h),4.65(t,2h),8.21(dd,1h),8.35-8.42(m,1h),8.43-8.51(m,2h),8.52(d,1h),9.06(s,1h),12.53(s,1h)。
中间体4-3
2-(3-甲氧基丙基)-5-({[6-(三氟甲基)吡啶-2-基]羰基}氨基)-2h-吲唑-6-羧酸甲酯
将1.00g(2.75mmol)5-({[6-(三氟甲基)吡啶-2-基]羰基}氨基)-1h-吲唑-6-羧酸甲酯(中间体3-1)溶解于5mldmf中,搅拌加入460μl(4.12mmol)1-溴-3-甲氧基丙烷、1.14g(8.23mmol)碳酸钾和228mg(1.37mmol)碘化钾。将反应混合物在25℃下搅拌72h,用水稀释并用乙酸乙酯萃取两次。将合并的有机相通过疏水过滤器过滤,浓缩。将残余物通过在硅胶上的柱层析法(己烷/乙酸乙酯)进行纯化。得到28mg标题化合物。
uplc-ms(方法a1):rt=1.29min
ms(esipos):m/z=437(m+h)+
1hnmr(400mhz,dmso-d6):δ[ppm]=2.17(五重峰,2h),3.24(s,3h),3.33-3.36(m,2h),3.96(s,3h),4.53(t,2h),8.21(dd,1h),8.35-8.42(m,1h),8.45-8.49(m,2h),8.54(d,1h),9.06(s,1h),12.54(s,1h)。
中间体4-4
2-(3-羟基-3-甲基丁基)-5-({[6-(三氟甲基)吡啶-2-基]羰基}氨基)-2h-吲唑-6-羧酸甲酯
制备方法1
首先将930mg(2.55mmol)5-({[6-(三氟甲基)吡啶-2-基]羰基}氨基)-1h-吲唑-6-羧酸甲酯(中间体3-1)、1.06g碳酸钾和212mg碘化钾加入9mldmf中,并将混合物搅拌15min。然后加入0.62ml4-溴-2-甲基丁-2-醇,并将混合物在60℃下搅拌16h。使混合物与水混合并用乙酸乙酯萃取两次,将萃取物用饱和氯化钠溶液洗涤三次,过滤并浓缩。在硅胶上的柱层析法纯化(己烷/乙酸乙酯)得到424mg标题化合物。
uplc-ms(方法a2):rt=1.21min(uv检测器:tic),质量测量值450.00。
1h-nmr(400mhz,dmso-d6):δ[ppm]=1.16(s,6h)2.02-2.11(m,2h)3.96(s,3h)4.51-4.60(m,3h)8.20(dd,j=7.83,1.01hz,1h)8.39(s,1h)8.45(s,2h)8.55(d,j=0.76hz,1h)9.05(s,1h)12.52(s,1h)。
制备方法2
首先将1.95g(7.03mmol)5-氨基-2-(3-羟基-3-甲基丁基)-2h-吲唑-6-羧酸甲酯(中间体7-1)加入30mlthf中。加入1.48g(7.73mmol)6-(三氟甲基)吡啶-2-羧酸、2.71g(8.44mmol)四氟硼酸o-(苯并三唑-1-基)-n,n,n′,n′-四甲基脲和1.47ml(8.44mmol)n-乙基-n-异丙基丙-2-胺,并将混合物在25℃下搅拌20.5h。加入水,用乙酸乙酯萃取混合物三次,将萃取物用氯化钠溶液洗涤,通过疏水过滤器过滤,并浓缩。将残余物通过在硅胶上的柱层析法(己烷/乙酸乙酯梯度)进行分离。得到2.79g标题化合物。
uplc-ms(方法a1):rt=1.23min(uv检测器:tic),质量测量值450.00。
中间体4-5
2-(2-{[叔丁基(二甲基)甲硅烷基]氧基}乙基)-5-({[6-(三氟甲基)吡啶-2-基]羰基}氨基)-2h-吲唑-6-羧酸甲酯
首先将1.00g(2.66mmol,97%)5-({[6-(三氟甲基)吡啶-2-基]羰基}氨基)-1h-吲唑-6-羧酸甲酯(中间体3-1)加入50mldmf中,搅拌加入1.10g(7.99mmol)碳酸钾和221mg(1.33mmol)碘化钾,并将混合物在25℃下搅拌30min。随后,加入857μl(3.99mmol)(2-溴乙氧基)(叔丁基)二甲基硅烷,并将混合物在25℃下搅拌24h。用水稀释反应混合物,并用乙酸乙酯萃取。将合并的有机相通过疏水过滤器过滤,浓缩。将残余物通过在硅胶上的柱层析法(己烷/乙酸乙酯)进行纯化。得到400mg标题化合物。
uplc-ms(方法a1):rt=1.58min
ms(esipos):m/z=523(m+h)+
1hnmr(300mhz,dmso-d6):δ[ppm]=-0.18--0.13(m,6h),0.74(s,9h),3.96(s,3h),4.08(t,2h),4.57(t,2h),8.15-8.25(m,1h),8.32-8.43(m,1h),8.43-8.52(m,3h),9.07(s,1h),12.53(s,1h)。
中间体4-6
2-(3-{[叔丁基(二甲基)甲硅烷基]氧基}丙基)-5-({[6-(三氟甲基)吡啶-2-基]羰基}氨基)-2h-吲唑-6-羧酸甲酯
与中间体4-5类似地,将1.00g(2.75mmol)5-({[6-(三氟甲基)吡啶-2-基]羰基}氨基)-1h-吲唑-6-羧酸甲酯(中间体3-1)溶解于10mldmf中,搅拌加入1.14g(8.24mmol)碳酸钾和228mg(1.37mmol)碘化钾,并将混合物在25℃下搅拌30min。随后,加入1.04g(4.12mmol)(3-溴丙氧基)(叔丁基)二甲基硅烷,并将混合物在25℃下搅拌24h。过滤反应混合物,并用乙酸乙酯洗涤滤饼。反应混合物在水和乙酸乙酯之间分层,用乙酸乙酯萃取水相两次。将合并的有机相通过疏水过滤器过滤,浓缩。通过制备型hplc纯化残余物,得到428mg标题化合物。
uplc-ms(方法a1):rt=1.63min
ms(esipos):m/z=537(m+h)+
1hnmr(400mhz,dmso-d6):δ[ppm]=-0.02-0.06(m,6h),0.87(s,9h),2.14(五重峰,2h),3.62(t,2h),3.96(s,3h),4.54(t,2h),8.20(d,1h),8.35-8.42(m,1h),8.43-8.48(m,3h),8.49-8.53(m,1h),9.06(s,1h)。
中间体4-7
5-({[6-(2-羟基丙-2-基)吡啶-2-基]羰基}氨基)-2-(4,4,4-三氟丁基)-2h-吲唑-6-羧酸甲酯
首先将300mg(0.80mmol)5-({[6-(2-羟基丙-2-基)吡啶-2-基]羰基}氨基)-1h-吲唑-6-羧酸甲酯(中间体3-3)加入4.5mldmf中。加入287mg(1.21mmol)1,1,1-三氟-4-碘丁烷和333mg碳酸钾,并将混合物在100℃下搅拌23h。加入水,将用乙酸乙酯萃取混合物三次。浓缩该混合物并将产物通过制备型hplc纯化。这得到72mg标题化合物。
uplc-ms(方法a1):rt=1.26min(uv检测器:tic),质量测量值464.17。
中间体4-8
5-{[(5-氟-6-甲基吡啶-2-基)羰基]氨基}-2-(3-羟基-3-甲基丁基)-2h-吲唑-6-羧酸甲酯
在19.5h内,类似于中间体4-4(制备方法2),使195mg(0.46mmol)5-氨基-2-(3-羟基-3-甲基丁基)-2h-吲唑-6-羧酸甲酯(中间体7-1)与78mg(0.50mmol)5-氟-6-甲基吡啶-2-羧酸反应。在类似的水后处理之后,得到228mg粗产物。
uplc-ms(方法a1):rt=1.20min(uv检测器:tic),质量测量值414.00。
中间体4-9
2-(3-羟基-3-甲基丁基)-5-{[(6-甲基吡啶-2-基)羰基]氨基}-2h-吲唑-6-羧酸甲酯
在19.5h内,类似于中间体4-4(制备方法2)的制备,使195mg(0.45mmol)5-氨基-2-(3-羟基-3-甲基丁基)-2h-吲唑-6-羧酸甲酯(中间体7-1)与70mg(0.50mmol)6-甲基吡啶-2-羧酸反应。在类似的水后处理之后,得到作为粗产物的278mg标题化合物。
uplc-ms(方法a1):rt=1.14min(uv检测器:tic),质量测量值396.00。
中间体4-10
2-[3-(2,2,2-三氟乙氧基)丙基]-5-({[6-(三氟甲基)吡啶-2-基]羰基}氨基)-2h-吲唑-6-羧酸甲酯
在100℃下,将在3mldmf中的250mg(0.58mmol)5-({[6-(三氟甲基)吡啶-2-基]羰基}氨基)-1h-吲唑-6-羧酸甲酯(中间体3-1)、193mg(0.88mmol)3-溴丙基2,2,2-三氟乙基醚、242mg碳酸钾和145mg碘化钾的混合物搅拌20h。加入水,用乙酸乙酯萃取混合物,并将萃取物用氯化钠溶液洗涤,并浓缩。通过制备型hplc纯化,得到52mg标题化合物。
uplc-ms(方法a1):rt=1.39min(uv检测器:tic),质量测量值504.12。
中间体4-11
5-({[6-(二氟甲基)吡啶-2-基]羰基}氨基)-2-(3-羟基-3-甲基丁基)-2h-吲唑-6-羧酸甲酯
首先将2.00g5-氨基-2-(3-羟基-3-甲基丁基)-2h-吲唑-6-羧酸甲酯(中间体7-1)加入40mlthf中。加入1.50g6-(二氟甲基)吡啶-2-羧酸、2.78g四氟硼酸o-(苯并三唑-1-基)-n,n,n',n'-四甲基脲(tbtu,cas号125700-67-6)和1.5mln-乙基-n-异丙基丙-2-胺,并将混合物在室温下搅拌24h。加入水,用乙酸乙酯萃取混合物三次,将合并的有机相用氯化钠溶液洗涤,并通过疏水过滤器过滤。浓缩混合物,并将残余物通过在硅胶上的柱层析法(己烷/乙酸乙酯)进行纯化。这得到3.05g黄色固体状的标题化合物。
uplc-ms(方法a1):rt=1.15min(uv检测器:tic),质量测量值432.00。
1h-nmr(400mhz,dmso-d6):δ[ppm]=1.17(s,6h),2.04-2.11(m,2h),3.99(s,3h),4.52-4.60(m,3h),7.10(t,1h),8.00(dd,1h),8.28-8.38(m,2h),8.44–8.47(m,1h),8.56(d,1h),9.05(s,1h),12.49(s,1h)。
中间体5-1
n-[6-(2-羟基丙-2-基)-1h-吲唑-5-基]-6-(三氟甲基)吡啶-2-羧酰胺
向1.50g(4.12mmol)5-({[6-(三氟甲基)吡啶-2-基]羰基}氨基)-1h-吲唑-6-羧酸甲酯(中间体3-1)溶于20mlthf的溶液(在冰水冷却浴中冷却)中小心加入6.9ml(5当量)3m的甲基溴化镁的二乙醚溶液。将混合物在用冰浴冷却的同时搅拌1h,并在室温下搅拌19.5h。再加入2当量的甲基溴化镁溶液,并将混合物在室温下再搅拌24h。加入饱和氯化铵水溶液,搅拌混合物并用乙酸乙酯萃取三次。将合并的有机相用氯化钠溶液洗涤,通过疏水过滤器过滤,浓缩。将残余物通过在硅胶上的柱层析法(己烷/乙酸乙酯)进行纯化。得到763mg标题化合物。
1h-nmr(400mhz,dmso-d6):δ[ppm]=1.63(s,6h),5.99(s,1h),7.49(s,1h),8.06(s,1h),8.14-8.19(m,1h),8.37(t,1h),8.46(d,1h),8.78(s,1h),12.32(s,1h),12.97(s,1h)。
中间体5-2
6-(二氟甲基)-n-[6-(2-羟基丙-2-基)-1h-吲唑-5-基]吡啶-2-羧酰胺
类似于中间体5-1的制备,使在10mlthf中的2.40g(6.93mmol)5-({[6-(二氟甲基)吡啶-2-基]羰基}氨基)-1h-吲唑-6-羧酸甲酯(中间体3-2)与三份3m的甲基溴化镁的二乙醚溶液反应(6.9ml,之后在室温下搅拌45min;11.6ml,之后在室温下搅拌2h;6.9ml之后在室温下搅拌2h)。在如对中间体5-1那样的后处理之后,得到2.39g粗产物,其无进一步纯化即进一步使用。
中间体6-1
2-(3-羟基-3-甲基丁基)-5-硝基-2h-吲唑-6-羧酸甲酯
首先将5.00g(22.6mmol)5-硝基-1h-吲唑-6-羧酸甲酯(中间体1-1)加入40mldmf中。加入5.65g(33.9mmol)4-溴-2-甲基丁-2-醇、9.37g(67.8mmol)碳酸钾和5.63g(33.9mmol)碘化钾,并将混合物在100℃下搅拌20h。加入水,用乙酸乙酯萃取混合物三次,将萃取物用氯化钠溶液洗涤,通过疏水过滤器过滤,并浓缩。将残余物通过在硅胶上的柱层析法(己烷/乙酸乙酯)进行纯化。将所得固体用二乙醚搅拌,抽滤出来,用二乙醚洗涤,并干燥。得到2.49g标题化合物。
uplc-ms(方法a1):rt=0.93min(uv检测器:tic),质量测量值307.00。
1h-nmr(400mhz,dmso-d6):δ[ppm]=1.15(s,6h),2.02-2.11(m,2h),3.84(s,3h),4.54(s,1h),4.58-4.65(m,2h),8.05(s,1h),8.69(s,1h),8.86(s,1h)。
中间体7-1
5-氨基-2-(3-羟基-3-甲基丁基)-2h-吲唑-6-羧酸甲酯
将4.53g铁和217mg氯化铵加入到2.49g(8.10mmol)2-(3-羟基-3-甲基丁基)-5-硝基-2h-吲唑-6-羧酸甲酯(中间体6-1)溶于30ml乙醇和10ml水的溶液中,并将混合物在90℃下搅拌21.5h。将混合物通过硅藻土过滤,并用乙醇洗涤三次,将滤液浓缩,并将残余物与水混合。用乙酸乙酯进行三次萃取(为了改进相分离,加入氯化钠溶液)。将合并的有机相用氯化钠溶液洗涤,通过疏水过滤器过滤,浓缩。这得到1.95g(理论值的85%)标题化合物。
uplc-ms(方法a1):rt=0.67min(uv检测器:tic),质量测量值277.00。
1h-nmr(400mhz,dmso-d6):δ[ppm]=1.14(s,6h),1.96-2.08(m,2h),3.85(s,3h),4.39-4.51(m,3h),5.81(s,2h),6.80(s,1h),8.05(s,1h),8.18(s,1h)。
工作实施例
实施例1
n-[6-(2-羟基丙-2-基)-2-(2-甲氧基乙基)-2h-吲唑-5-基]-6-(三氟甲基)吡啶-2-羧酰胺
将75mg(0.18mmol)2-(2-甲氧基乙基)-5-({[6-(三氟甲基)吡啶-2-基]羰基}氨基)-2h-吲唑-6-羧酸甲酯(中间体4-2)溶解于500μlthf中,并混合887μl(0.89mmol)1m的甲基溴化镁的thf溶液。将反应混合物在25℃下搅拌60min。随后,小心地加入1ml饱和氯化铵水溶液,并过滤混合物。用乙酸乙酯萃取水相两次,合并有机相,通过疏水过滤器过滤,浓缩。将残余物溶解于3mldmso中,通过制备型hplc纯化。将含有产物的部分冷冻干燥。得到20mg标题化合物。
uplc-ms(方法a1):rt=1.08min
ms(esipos):m/z=423(m+h)+
1hnmr(300mhz,dmso-d6):δ[ppm]=1.62(s,6h),3.22(s,3h),3.82(t,2h),4.55(t,2h),5.96(s,1h),7.57(s,1h),8.16(d1h),8.29-8.42(m,2h),8.42-8.50(m,1h),8.71(s,1h),12.36(s,1h)
实施例2
n-[6-(羟甲基)-2-(2-甲氧基乙基)-2h-吲唑-5-基]-6-(三氟甲基)吡啶-2-羧酰胺
将13mg(0.36mmol)氢化铝锂悬浮于1mlthf中,并将混合物冷却至0℃。逐滴加入75mg(0.17mmol)2-(2-甲氧基乙基)-5-({[6-(三氟甲基)吡啶-2-基]羰基}氨基)-2h-吲唑-6-羧酸甲酯(中间体4-2)溶于500μlthf中的溶液,并将混合物在25℃下搅拌60min。用水稀释该混合物并用乙酸乙酯萃取两次,将合并的有机相用氯化钠溶液洗涤,通过疏水过滤器过滤,浓缩,并在减压下干燥。这得到13mg标题化合物。
uplc-ms(方法a2):rt=0.99min
ms(esipos):m/z=394(m+h)+
1hnmr(400mhz,dmso-d6):δ[ppm]=3.23(s,3h),3.83(t,2h),4.56(t,2h),4.69(d,2h),5.77(t,1h),7.57(s,1h),8.19(d,1h),8.33-8.41(m,2h),8.43-8.47(m,1h),8.51(s,1h),11.20(s,1h)
实施例3
n-[6-(2-羟基丙-2-基)-2-(3-甲氧基丙基)-2h-吲唑-5-基]-6-(三氟甲基)吡啶-2-羧酰胺
将75mg(0.17mmol)2-(3-甲氧基丙基)-5-({[6-(三氟甲基)吡啶-2-基]羰基}氨基)-2h-吲唑-6-羧酸甲酯(中间体4-3)溶解于500μlthf中,并混合859μl(0.86mmol)1m的甲基溴化镁的thf溶液。将反应混合物在25℃下搅拌60min。随后,小心地加入1ml饱和氯化铵溶液,并过滤混合物。用乙酸乙酯萃取水相两次,合并有机相,通过疏水过滤器过滤,浓缩。将残余物溶解于3mldmso中,并通过制备型hplc纯化。将含有产物的部分冷冻干燥。得到25mg标题化合物。
uplc-ms(方法a1):rt=1.13min
ms(esipos):m/z=437(m+h)+
1hnmr(400mhz,dmso-d6):δ[ppm]=1.62(s,6h),2.14(五重峰,2h),3.23(s,3h),3.26-3.32(m,2h),4.44(t,2h),5.95(s,1h),7.58(s,1h),8.16(d,1h),8.31-8.40(m,2h),8.43-8.48(m,1h),8.72(s,1h),12.36(s,1h).
实施例4
n-[6-(羟甲基)-2-(3-甲氧基丙基)-2h-吲唑-5-基]-6-(三氟甲基)吡啶-2-羧酰胺
将13mg氢化铝锂悬浮于thf中,并将混合物冷却至0℃。逐滴加入75mg(0.17mmol)2-(3-甲氧基丙基)-5-({[6-(三氟甲基)吡啶-2-基]羰基}氨基)-2h-吲唑-6-羧酸甲酯(中间体4-3)溶于thf中的溶液,并使混合物在30min内达到室温。用水稀释该混合物并过滤,将残余物用乙酸乙酯洗涤,并用乙酸乙酯萃取滤液。将合并的乙酸乙酯相用氯化钠溶液洗涤,通过疏水过滤器过滤,浓缩。将残余物通过制备型hplc纯化。
1hnmr(300mhz,dmso-d6):δ[ppm]=2.14(五重峰,2h),3.23(s,3h),3.29(t,2h),4.45(t,2h),4.68(d,2h),5.77(t,1h),7.58(s,1h),8.18(d,1h),8.32-8.48(m,3h),8.51(s,1h),11.21(s,1h)。
实施例5
n-[2-(2-羟乙基)-6-(2-羟基丙-2-基)-2h-吲唑-5-基]-6-(三氟甲基)吡啶-2-羧酰胺
步骤a:
n-[2-(2-{[叔丁基(二甲基)甲硅烷基]氧基}乙基)-6-(2-羟基丙-2-基)-2h-吲唑-5-基]-6-(三氟甲基)吡啶-2-羧酰胺的制备
将100mg(0.19mmol)2-(2-{[叔丁基(二甲基)甲硅烷基]氧基}乙基)-5-({[6-(三氟甲基)吡啶-2-基]羰基}氨基)-2h-吲唑-6-羧酸甲酯(中间体4-5)溶解于1mlthf中,并混合669μl(0.67mmol)1m的甲基溴化镁的thf溶液。将反应混合物在25℃下搅拌60min。加入另外287μl(0.29mmol)1m的甲基溴化镁的thf溶液,将混合物在25℃下搅拌3h。随后,小心加入20ml饱和氯化铵溶液,并过滤混合物。用乙酸乙酯萃取水相两次,合并有机相,通过硫酸镁干燥,过滤,浓缩,并在减压下干燥。这得到50mgn-[2-(2-{[叔丁基(二甲基)甲硅烷基]氧基}乙基)-6-(2-羟基丙-2-基)-2h-吲唑-5-基]-6-(三氟甲基)吡啶-2-羧酰胺。
uplc-ms(方法a2):rt=1.51min
ms(esipos):m/z=523(m+h)+
1hnmr(300mhz,dmso-d6):δ[ppm]=-0.17--0.09(m,6h),0.78(s,9h),1.62(s,6h),4.04(t,2h),4.47(t,2h),5.98(s,1h),7.57(s,1h),8.16(d,1h),8.29(s,1h),8.37(t,1h),8.45(d,1h),8.73(s,1h),12.38(s,1h)。
步骤b:
将50mg(96μmol)n-[2-(2-{[叔丁基(二甲基)甲硅烷基]氧基}乙基)-6-(羟甲基)-2h-吲唑-5-基]-6-(三氟甲基)吡啶-2-羧酰胺溶解于1.0mlthf中,并混合144μl(0.14mmol)1m的四丁基氟化铵的thf溶液。将反应混合物在室温下搅拌1h。用水稀释该混合物并用乙酸乙酯萃取两次,将合并的有机相用饱和氯化钠溶液洗涤,通过疏水过滤器过滤,浓缩。这得到36mgn-[2-(2-羟乙基)-6-(2-羟基丙-2-基)-2h-吲唑-5-基]-6-(三氟甲基)吡啶-2-羧酰胺(实施例5)。
1h-nmr(400mhz,dmso-d6):d[ppm]=1.62(s,6h),3.86(q,2h),4.43(t,2h),4.95(t,1h),5.94(s,1h),7.57(s,1h),8.16(dd,1h),8.30(s,1h),8.37(t,1h),8.45(d,1h),8.72(s,1h),12.36(s,1h)。
uplc-ms(方法a2):rt=0.97min(uv检测器:tic),质量测量值408.00。
实施例6
n-[6-(2-羟基丙-2-基)-2-(3-羟基丙基)-2h-吲唑-5-基]-6-(三氟甲基)吡啶-2-羧酰胺
步骤a:
n-[2-(3-{[叔丁基(二甲基)甲硅烷基]氧基}丙基)-6-(2-羟基丙-2-基)-2h-吲唑-5-基]-6-(三氟甲基)吡啶-2-羧酰胺的制备
将50mg(0.09mmol)2-(3-{[叔丁基(二甲基)甲硅烷基]氧基}丙基)-5-({[6-(三氟甲基)吡啶-2-基]羰基}氨基)-2h-吲唑-6-羧酸甲酯(中间体4-6)溶解于500μlthf中,并混合326μl(0.33mmol)1m的甲基溴化镁的thf溶液。将反应混合物在25℃下搅拌60min。随后,小心地加入20ml饱和氯化铵溶液,并将混合物用乙酸乙酯萃取两次。将合并的有机相通过疏水过滤器过滤,浓缩,并在减压下干燥。将残余物通过制备型hplc纯化。得到40mgn-[2-(3-{[叔丁基(二甲基)甲硅烷基]氧基}丙基)-6-(2-羟基丙-2-基)-2h-吲唑-5-基]-6-(三氟甲基)吡啶-2-羧酰胺。
uplc-ms(方法a1):rt=1.58min
ms(esipos):m/z=537(m+h)+
1hnmr(300mhz,dmso-d6):δ[ppm]=0.02-0.05(m,6h),0.84-0.91(m,9h),1.62(s,6h),2.02-2.18(m,2h),3.55-3.62(m,2h),4.45(t,2h),5.96(s,1h),7.57(s,1h),8.16(d,1h),8.31(s,1h),8.33-8.42(m,1h),8.45(d,1h),8.72(s,1h),12.37(s,1h)。
步骤b:
将37mg(0.07mmol)n-[2-(3-{[叔丁基(二甲基)甲硅烷基]氧基}丙基)-6-(2-羟基丙-2-基)-2h-吲唑-5-基]-6-(三氟甲基)吡啶-2-羧酰胺溶解于500μlthf中,并混合207μl(0.21mmol)1m的四丁基氟化铵的thf溶液。将反应混合物在25℃下搅拌2h。用水稀释该混合物并用乙酸乙酯萃取两次,将合并的有机相用饱和氯化钠溶液洗涤,过滤并浓缩。通过制备型hplc纯化后,得到10mgn-[6-(2-羟基丙-2-基)-2-(3-羟基丙基)-2h-吲唑-5-基]-6-(三氟甲基)吡啶-2-羧酰胺(实施例6,含有次要组分)。
uplc-ms(方法a2):rt=1.00min
ms(esipos):m/z=423(m+h)+
1hnmr所选信号(400mhz,dmso-d6):δ[ppm]=1.61(s),2.00-2.12(m),3.38(t,2h),4.44(t,2h),4.62(宽单峰,1h),5.93(宽单峰,1h),7.55(s,1h),8.13(d,1h),8.27-8.38(m,2h),8.43(d,1h),8.71(s,1h),12.30(宽单峰,1h)。
实施例7
n-[2-(2-羟乙基)-6-(羟甲基)-2h-吲唑-5-基]-6-(三氟甲基)吡啶-2-羧酰胺
步骤a:
n-[2-(2-{[叔丁基(二甲基)甲硅烷基]氧基}乙基)-6-(羟甲基)-2h-吲唑-5-基]-6-(三氟甲基)吡啶-2-羧酰胺
将100mg(0.19mmol)2-(2-{[叔丁基(二甲基)甲硅烷基]氧基}乙基)-5-({[6-(三氟甲基)吡啶-2-基]羰基}氨基)-2h-吲唑-6-羧酸甲酯(中间体4-5)溶解于1mlthf中,并混合191μl(0.38mmol)2m的硼氢化锂溶液混合。将混合物在25℃下搅拌24h。加入14mg(0.38mmol)硼氢化钠和500μl甲醇,并将混合物在25℃下搅拌4h。再加入14mg(0.38mmol)硼氢化钠,并将混合物在25℃下搅拌24h。向反应混合物中小心地加入水,除去有机相。然后将混合物用乙酸乙酯萃取两次,并将合并的有机相用饱和氯化钠溶液洗涤,通过疏水过滤器过滤,浓缩。将残余物置于2mldmso中,并通过制备型hplc纯化。这得到30mgn-[2-(2-{[叔丁基(二甲基)甲硅烷基]氧基}乙基)-6-(羟甲基)-2h-吲唑-5-基]-6-(三氟甲基)吡啶-2-羧酰胺。
uplc-ms(方法a2):rt=1.44min
ms(esipos):m/z=495(m+h)+
1hnmr(300mhz,dmso-d6):δ[ppm]=-0.16--0.12(m,6h),0.75-0.79(m,9h),4.05(t,2h),4.48(t,2h),4.69(d,2h),5.75-5.77(m,1h),7.57(s,1h),8.18(dd,1h),8.30-8.33(m,1h),8.38(t,1h),8.45(d,1h),8.51(s,1h),11.20(s,1h)。
步骤b:
将33mg(0.07mmol)n-[2-(2-{[叔丁基(二甲基)甲硅烷基]氧基}乙基)-6-(羟甲基)-2h-吲唑-5-基]-6-(三氟甲基)吡啶-2-羧酰胺溶解于1mlthf中,并混合100μl(0.10mmol)1m的四丁基氟化铵的thf溶液。将反应混合物在25℃下搅拌1h。用水将该混合物稀释并用乙酸乙酯萃取两次,将合并的有机相用饱和氯化钠溶液洗涤,通过疏水过滤器过滤,浓缩,并在减压下干燥。得到25mgn-[2-(2-羟乙基)-6-(羟甲基)-2h-吲唑-5-基]-6-(三氟甲基)吡啶-2-羧酰胺(实施例7)。
uplc-ms(方法a2):rt=0.87min
ms(esipos):m/z=381(m+h)+
1hnmr(300mhz,dmso-d6):δ[ppm]=3.87(q,2h),4.44(t,2h),4.69(d,2h),4.98(t,1h),5.70-5.81(m,1h),7.57(s,1h),8.11-8.23(m,1h),8.31-8.42(m,2h),8.43-8.49(m,1h),8.51(s,1h),11.20(s,1h)。
实施例8
n-[6-(2-羟基丙-2-基)-2-(氧杂环丁烷-3-基甲基)-2h-吲唑-5-基]-6-(三氟甲基)吡啶-2-羧酰胺
将50mg(0.12mmol)2-(氧杂环丁烷-3-基甲基)-5-({[6-(三氟甲基)吡啶-2-基]羰基}氨基)-2h-吲唑-6-羧酸甲酯(中间体4-1)溶解于500μlthf中,并混合576μl(0.58mmol)1m的甲基溴化镁的thf溶液。将反应混合物在25℃下搅拌60min。随后,小心地加入20ml饱和氯化铵水溶液,并将混合物浓缩。用乙酸乙酯萃取水相两次,合并有机相,通过硫酸镁干燥,过滤,并浓缩。将残余物溶解于2.0mldmso中,并通过制备型hplc纯化。将含有产物的部分冷冻干燥。得到30mg标题化合物。
uplc-ms(方法a2):rt=1.03min
ms(esipos):m/z=435(m+h)+
1hnmr(400mhz,dmso-d6):δ[ppm]=1.62(s,6h),3.45-3.61(m,1h),4.48(t,2h),4.66(dd,2h),4.72(d,2h),5.94(s,1h),7.57(s,1h),8.16(d,1h),8.33-8.42(m,2h),8.42-8.47(m,1h),8.72(s,1h),12.36(s,1h)。
实施例9
n-[6-(羟甲基)-2-(氧杂环丁烷-3-基甲基)-2h-吲唑-5-基]-6-(三氟甲基)吡啶-2-羧酰胺
将75mg(0.17mmol)2-(氧杂环丁烷-3-基甲基)-5-({[6-(三氟甲基)吡啶-2-基]羰基}氨基)-2h-吲唑-6-羧酸甲酯(中间体4-1)溶解于1mlthf/甲醇(1:1)混合物中,并加入8mg(0.21mmol)硼氢化钠。将混合物在25℃下搅拌60min。将反应混合物浓缩,并将残余物与水混合。将悬浮液剧烈搅拌15min,抽滤出固体,用水洗涤两次,用二乙醚洗涤两次,并在减压下干燥。得到48mg标题化合物。
uplc-ms(方法a2):rt=0.94min
ms(esipos):m/z=407(m+h)+
1hnmr(300mhz,dmso-d6):δ[ppm]=3.55(s,1h),4.48(t,2h),4.61-4.77(m,6h),7.57(s,1h),8.18(dd,1h),8.33-8.49(m,3h),8.51(s,1h),11.21(s,1h)。
实施例10
n-{6-(2-羟基丙-2-基)-2-[3-(甲基磺酰基)丙基]-2h-吲唑-5-基}-6-(三氟甲基)吡啶-2-羧酰胺
将在5.0mldmf中的500mg(1.32mmol)n-[6-(2-羟基丙-2-基)-1h-吲唑-5-基]-6-(三氟甲基)吡啶-2-羧酰胺(中间体5-1)、569mg碳酸钾和114mg碘化钾的混合物在室温下搅拌15min。加入414mg1-溴-3-(甲基磺酰基)丙烷,并将混合物在室温下搅拌过夜。加入水,用乙酸乙酯萃取混合物两次,将萃取物用氯化钠溶液洗涤,并浓缩。将残余物通过柱层析法纯化(二氯甲烷/甲醇梯度)。将产物部分用二乙醚搅拌、过滤,并干燥。得到59mg标题化合物。
uplc-ms(方法a2):rt=1.02min
ms(esipos):m/z=485(m+h)+
1h-nmr(300mhz,dmso-d6):δ[ppm]=1.63(s,6h),2.26-2.42(m,2h),2.99(s,3h),3.06-3.16(m,2h),4.55(t,2h),5.96(s,1h),7.60(s,1h),8.16(d,1h),8.33-8.48(m,3h),8.73(s,1h),12.37(s,1h)。
实施例11
n-[2-(3-羟基-3-甲基丁基)-6-(2-羟基丙-2-基)-2h-吲唑-5-基]-6-(三氟甲基)吡啶-2-羧酰胺
制备方法1
首先将705mg(1.57mmol)2-(3-羟基-3-甲基丁基)-5-({[6-(三氟甲基)吡啶-2-基]羰基}氨基)-2h-吲唑-6-羧酸甲酯(中间体4-4)加入到10mlthf中,并在冰水冷却浴中冷却。加入2.6ml(5.0当量)3m的甲基溴化镁溶液(于二乙醚中),将混合物在用冰浴冷却的同时搅拌1h,并在室温下搅拌4.5h。加入又1当量的甲基溴化镁溶液,并将混合物在室温下搅拌20.5h。再加入又1当量的甲基溴化镁溶液,并将混合物在室温下搅拌22h。将反应混合物与饱和氯化铵水溶液混合,搅拌并用乙酸乙酯萃取三次。将合并的有机相用氯化钠溶液洗涤,通过疏水过滤器过滤,并浓缩。这得到790mg残余物,其通过制备型hplc纯化。这得到234mg标题化合物和164mg产物部分,所述产物部分用二乙醚搅拌。抽滤,然后干燥,这之后,又得到146mg标题化合物。
uplc-ms(方法a1):rt=1.10min(uv检测器:tic),质量测量值450.00。
1h-nmr(400mhz,dmso-d6):δ[ppm]=1.14(s,6h),1.61(s,6h),1.99-2.08(m,2h),4.42-4.55(m,3h),5.93(s,1h),7.56(s,1h),8.15(dd,1h),8.32-8.39(m,2h),8.41-8.47(m,1h),8.70(s,1h),12.34(s,1h)。
制备方法2
将在5mldmf中的500mg(1.37mmol)n-[6-(2-羟基丙-2-基)-1h-吲唑-5-基]-6-(三氟甲基)吡啶-2-羧酰胺(中间体5-1)、569mg碳酸钾和114mg碘化钾的混合物在室温下搅拌15min。加入344mg(1.5当量)4-溴-2-甲基丁-2-醇,并将混合物加热至100℃,保持2h。再加入0.5当量的4-溴-2-甲基丁-2-醇,并将混合物在室温下搅拌16h。将混合物与水混合并用乙酸乙酯萃取两次,将合并的有机相用饱和氯化钠溶液洗涤,通过疏水过滤器过滤,并浓缩。将残余物通过在硅胶上的柱层析纯化法(己烷/乙酸乙酯)进行纯化。这得到100mg产物部分,将所述产物部分用二乙醚搅拌。过滤固体并干燥。得到60mg标题化合物。
1h-nmr(400mhz,dmso-d6):δ[ppm]=1.14(s,6h),1.61(s,6h),1.99-2.07(m,2h),4.43-4.52(m,3h)5.94(s,1h)7.57(s,1h)8.15(dd,1h)8.33-8.40(m,2h),8.42-8.48(m,1h),8.71(s,1h),12.35(s,1h)
实施例12
n-{6-(2-羟基丙-2-基)-2-[2-(甲基磺酰基)乙基]-2h-吲唑-5-基}-6-(三氟甲基)吡啶-2-羧酰胺
将160mg(0.44mmol)n-[6-(2-羟基丙-2-基)-1h-吲唑-5-基]-6-(三氟甲基)吡啶-2-羧酰胺(中间体5-1)与182mg碳酸钾和36mg碘化钾一同悬浮于1.0mldmf中,并将混合物在室温下搅拌15min。然后加入123mg2-溴乙基甲基砜(0.66mmol),并将混合物在室温下搅拌过夜。加入水,用乙酸乙酯萃取混合物两次,将萃取物用饱和氯化钠水溶液洗涤,通过疏水过滤器过滤,并浓缩。通过制备型hplc纯化残余物,得到20mg标题化合物。
uplc(方法a2):rt=1.01min;
ms(esipos):m/z=471(m+h)+
1hnmr(400mhz,dmso-d6):δ[ppm]=1.63(s,6h),2.90(s,3h),3.85(t,2h),4.86(t,2h),5.97(s,1h),7.59(s,1h),8.13-8.19(m,1h),8.37(s,1h),8.41-8.48(m,2h),8.74(s,1h),12.37(s,1h)。
实施例13
6-(二氟甲基)-n-[2-(3-羟基-3-甲基丁基)-6-(2-羟基丙-2-基)-2h-吲唑-5-基]吡啶-2-羧酰胺
制备方法1
将在2.5mldmf中的250mg6-(二氟甲基)-n-[6-(2-羟基丙-2-基)-1h-吲唑-5-基]吡啶-2-羧酰胺(中间体5-2的粗产物)、144mg碘化钾和239mg碳酸钾的混合物在室温下搅拌15min。加入145mg(0.87mmol)4-溴-2-甲基丁-2-醇,将混合物在110℃下搅拌3h,再加入96mg4-溴-2-甲基丁-2-醇,并将混合物在110℃下搅拌4h。加入水,用乙酸乙酯萃取混合物两次,并将萃取物用半饱和氯化钠水溶液洗涤,通过疏水过滤器过滤,并浓缩。通过在硅胶上的柱层析法(己烷/乙酸乙酯)进行纯化。得到61mg标题化合物。
uplc-ms(方法a1):rt=1.00min(uv检测器:tic),质量测量值432.00.
1h-nmr(300mhz,dmso-d6):δ[ppm]=1.14(s,6h),1.63(s,6h),1.97-2.08(m,2h),4.41-4.55(m,3h),5.99(s,1h),7.03(t,1h),7.56(s,1h),7.94–8.00(m,1h),8.24-8.38(m,3h),8.71(s,1h),12.49(s,1h)。
制备方法2
类似于实施例11(制备方法1)的制备,使3.00g5-({[6-(二氟甲基)吡啶-2-基]羰基}氨基)-2-(3-羟基-3-甲基丁基)-2h-吲唑-6-羧酸甲酯(中间体4-11)与3m的甲基溴化镁溶液(于二乙醚中)反应。粗产物用二乙醚搅拌,过滤,通过制备型hplc纯化,这之后,得到1.37g标题化合物。
实施例14
6-(二氟甲基)-n-{6-(2-羟基丙-2-基)-2-[2-(甲基磺酰基)乙基]-2h-吲唑-5-基}吡啶-2-羧酰胺
将在2.5mldmf中的250mg6-(二氟甲基)-n-[6-(2-羟基丙-2-基)-1h-吲唑-5-基]吡啶-2-羧酰胺(中间体5-2的粗产物)、144mg碘化钾和239mg碳酸钾的混合物在室温下搅拌15min。加入162mg2-溴乙基甲基砜(0.87mmol),并将混合物在110℃下搅拌3h。加入水,用乙酸乙酯萃取混合物两次,并将萃取物用半饱和氯化钠水溶液洗涤,通过疏水过滤器过滤,并浓缩。通过制备型hplc纯化残余物,并将产物部分通过在硅胶上的柱层析法(己烷/乙酸乙酯)再次纯化。得到40mg标题化合物。
1h-nmr(400mhz,dmso-d6):δ[ppm]=1.65(s,6h),2.90(s,3h),3.85(t,2h),4.85(t,2h),6.03(s,1h),7.04(t,1h),7.59(s,1h),7.98(d,1h),8.25-8.36(m,2h),8.43(s,1h),8.75(s,1h),12.52(s,1h)。
实施例15
6-(二氟甲基)-n-[6-(2-羟基丙-2-基)-2-(3-羟基丙基)-2h-吲唑-5-基]吡啶-2-羧酰胺
步骤a:
n-[2-(3-{[叔丁基(二甲基)甲硅烷基]氧基}丙基)-6-(2-羟基丙-2-基)-2h-吲唑-5-基]-6-(二氟甲基)吡啶-2-羧酰胺的制备
将在2.5mldmf中的250mg6-(二氟甲基)-n-[6-(2-羟基丙-2-基)-1h-吲唑-5-基]吡啶-2-羧酰胺(中间体5-2)、48mg碘化钾和239mg碳酸钾的混合物在室温下搅拌15min。加入219mg(0.87mmol,1.5当量)(3-溴丙氧基)(叔丁基)二甲基硅烷,并将混合物在110℃下搅拌3h。再加入1当量的(3-溴丙氧基)(叔丁基)二甲基硅烷,并将混合物在100℃下搅拌4h。加入水,用乙酸乙酯萃取混合物,并将萃取物用氯化钠水溶液洗涤,通过疏水过滤器过滤,并浓缩。将残余物通过柱层析法(己烷/乙酸乙酯)进行纯化。得到92mg标题化合物。
阶段b:
类似于实施例6步骤b的制备,在1h内使92mgn-[2-(3-{[叔丁基(二甲基)甲硅烷基]氧基}丙基)-6-(2-羟基丙-2-基)-2h-吲唑-5-基]-6-(二氟甲基)吡啶-2-羧酰胺与0.53ml1m的四丁基氟化铵的thf溶液反应。如实施例6中那样进行水后处理,并通过制备型hplc进行纯化,得到46mg标题化合物。
uplc-ms(方法a1):rt=0.92min(uv检测器:tic),质量测量值404.00。
1h-nmr(400mhz,dmso-d6):δ[ppm]=1.64(s,6h),2.05(五重峰,2h),3.35-3.46(m,2h),4.45(t,2h),4.64(t,1h),5.99(s,1h),7.04(t,1h),7.57(s,1h),7.95–7.99(m,1h),8.25-8.36(m,3h),8.73(s,1h),12.50(s,1h)。
实施例16
n-[6-(2-羟基丙-2-基)-2-(4,4,4-三氟丁基)-2h-吲唑-5-基]-6-(三氟甲基)吡啶-2-羧酰胺
将210mg(0.58mmol)n-[6-(2-羟基丙-2-基)-1h-吲唑-5-基]-6-(三氟甲基)吡啶-2-羧酰胺(中间体5-1)于3mldmf中的这一混合物与0.11ml(0.87mmol)1,1,1-三氟-4-碘丁烷和239mg碳酸钾混合,并将混合物在80℃下搅拌6h。在加入水后,用乙酸乙酯萃取混合物三次,并将合并的有机相用饱和氯化钠溶液洗涤,通过疏水过滤器过滤,并浓缩。将粗产物通过制备型hplc纯化。得到19mg标题化合物。
uplc-ms(方法a1):rt=1.27min(uv检测器:tic),质量测量值474.15。
1h-nmr(400mhz,dmso-d6):δ[ppm]=1.62(s,6h),2.10-2.33(m),4.49(t,2h),5.94(s,1h),7.59(s,1h),8.13-8.18(m,1h),8.32-8.41(m,2h),8.41-8.47(m,1h),8.72(s,1h),12.35(s,1h)。
实施例17
n-{6-(2-羟基丙-2-基)-2-[3-(三氟甲氧基)丙基]-2h-吲唑-5-基}-6-(三氟甲基)吡啶-2-羧酰胺
首先将150mg(0.33mmol)n-[6-(2-羟基丙-2-基)-1h-吲唑-5-基]-6-(三氟甲基)吡啶-2-羧酰胺(中间体5-1)加入2mlthf中。加入58mg(0.40mmol)3-(三氟甲氧基)丙-1-醇、131mg三苯基膦和71μl偶氮二羧酸二异丙酯(diad,cas2446-83-5),并将混合物在室温下搅拌19h。加入0.83ml氢氧化钠溶液(2m),并将混合物在40℃下搅拌5h。用水稀释混合物并用乙酸乙酯萃取三次,将合并的有机相浓缩并通过制备型hplc纯化。得到16mg粗产物形式的标题化合物。
uplc-ms(方法a2):rt=1.26min(uv检测器:tic),质量测量值490.14。
1h-nmr(400mhz,dmso-d6,所选信号):δ[ppm]=1.61(s,6h),1.84(d,1h),2.32(五重峰,2h),4.08(t,2h),4.51(t,2h),7.58(s,1h),8.15(d,1h),8.31–8.39(m,2h),8.44(d,1h),8.72(s,1h),12.35(s,1h)。
实施例18
n-{6-(2-羟基丙-2-基)-2-[3-(2,2,2-三氟乙氧基)丙基]-2h-吲唑-5-基}-6-(三氟甲基)吡啶-2-羧酰胺
类似于实施例11的制备(制备方法1),使在3mlthf中的52mg(0.10mmol)的2-[3-(2,2,2-三氟乙氧基)丙基]-5-({[6-(三氟甲基)吡啶-2-基]羰基}氨基)-2h-吲唑-6-羧酸甲酯(中间体4-10)与2×171μl3m的溴化镁的二乙醚溶液反应。通过制备型hplc纯化,得到12mg标题化合物。
uplc-ms(方法a1):rt=1.25min(uv检测器:tic),质量测量值504.16。
1h-nmr(500mhz,dmso-d6):δ[ppm]=1.63(s,6h),2.20(五重峰,2h),3.58(t,2h),4.05(q,2h),4.47(t,2h),5.94(s,1h),7.58(s,1h),8.15(dd,1h),8.32(s,1h),8.36(t,1h),8.45(d,1h),8.73(s,1h),12.36(s,1h)。
实施例19
5-氟-n-[2-(3-羟基-3-甲基丁基)-6-(2-羟基丙-2-基)-2h-吲唑-5-基]-6-甲基吡啶-2-羧酰胺
首先将228mg(0.31mmol)5-{[(5-氟-6-甲基吡啶-2-基)羰基]氨基}-2-(3-羟基-3-甲基丁基)-2h-吲唑-6-羧酸甲酯(中间体4-8)加入4.5mlthf中,并用冰冷却浴冷却。加入0.63ml3m的甲基溴化镁溶液(于二乙醚中),并将混合物在用冰浴冷却的同时搅拌2h,并在室温下搅拌21h。将反应混合物与饱和氯化铵水溶液混合,并用乙酸乙酯萃取三次。将合并的有机相浓缩。将残余物通过制备型hplc纯化。得到82mg标题化合物。
uplc-ms(方法a2):rt=1.03min(uv检测器:tic),质量测量值414.21。
1h-nmr(400mhz,dmso-d6):δ[ppm]=1.13(s,6h),1.63(s,6h),1.99-2.05(m,2h),2.55-2.59(m,3h),4.42-4.50(m,3h),5.95(s,1h),7.54(s,1h),7.83(t,1h),8.05(dd,1h),8.31(s,1h),8.68(s,1h),12.33(s,1h)。
实施例20
n-[2-(3-羟基-3-甲基丁基)-6-(2-羟基丙-2-基)-2h-吲唑-5-基]-6-甲基吡啶-2-羧酰胺
首先将278mg(0.48mmol)2-(3-羟基-3-甲基丁基)-5-{[(6-甲基吡啶-2-基)羰基]氨基}-2h-吲唑-6-羧酸甲酯(中间体4-9)加入5.0mlthf中,并用冰冷却浴冷却。加入0.97ml3m的甲基溴化镁溶液(于二乙醚中),将混合物在用冰浴冷却的同时搅拌2h,并在室温下搅拌20.5h。再加入0.48ml3m的甲基溴化镁溶液,并将混合物在室温下搅拌67h。将混合物与饱和氯化铵水溶液混合,并用乙酸乙酯萃取三次,将萃取物用氯化钠水溶液洗涤,通过疏水过滤器过滤,并浓缩。将残余物通过制备型hplc纯化。得到111mg标题化合物。
uplc-ms(方法a2):rt=0.97min(uv检测器:tic),质量测量值396.22。
1h-nmr(400mhz,dmso-d6):δ[ppm]=1.15(s,6h),1.64(s,6h),2.00-2.08(m,2h),2.61(s,3h),4.41-4.59(m,3h),5.92(s,1h),7.50(dd,1h),7.56(s,1h),7.90-7.99(m,2h),8.33(s,1h),8.70(s,1h),12.39(s,1h)。
实施例21
6-(2-羟基丙-2-基)-n-[6-(2-羟基丙-2-基)-2-(4,4,4-三氟丁基)-2h-吲唑-5-基]吡啶-2-羧酰胺
将72mg(0.16mmol)5-({[6-(2-羟基丙-2-基)吡啶-2-基]羰基}氨基)-2-(4,4,4-三氟丁基)-2h-吲唑-6-羧酸甲酯(中间体4-7)溶于10mlthf中的溶液在冰/水冷却浴中冷却。加入0.26ml3m的甲基溴化镁的二乙醚溶液,并将混合物搅拌2h,然后在室温下搅拌20h。再加入1当量3m的甲基溴化镁溶液,并将混合物在室温下搅拌24h。加入饱和氯化铵水溶液,用乙酸乙酯萃取混合物三次,将萃取物用氯化钠溶液洗涤,并浓缩。制备型hplc得到22mg(理论值的31%)标题化合物。
uplc-ms(方法a2):rt=1.15min(uv检测器:tic),质量测量值464.20。
1h-nmr(400mhz,dmso-d6):δ[ppm]=1.56(s,6h),1.64(s,6h),2.07-2.34(m,4h),4.49(t,2h),5.32(s,1h),6.05(s,1h),7.60(s,1h),7.87(dd,1h),7.99-8.05(m,2h),8.35(s,1h),8.79(s,1h),12.45(s,1h)。
实施例22
n-{2-[2-(1-羟基环丙基)乙基]-6-(2-羟基丙-2-基)-2h-吲唑-5-基}-6-(三氟甲基)吡啶-2-羧酰胺
首先将250mg(0.69mmol)n-[6-(2-羟基丙-2-基)-1h-吲唑-5-基]-6-(三氟甲基)吡啶-2-羧酰胺(中间体5-1)加入5mldmso中。加入159mg(0.96mmol)1-(2-溴乙基)环丙醇、285mg碳酸钾和171mg碘化钾,并将混合物在100℃下搅拌5h。加入水,并用乙酸乙酯萃取混合物三次。将合并的有机相用氯化钠溶液洗涤,通过疏水过滤器过滤,并浓缩。将残余物通过制备型hplc纯化(柱:watersxbridgec185μ100×30mm,洗脱液a:水+0.1体积%的甲酸(99%),洗脱液b:乙腈)。冷冻干燥得到45mg标题化合物。
1h-nmr(500mhz,dmso-d6):δ[ppm]=0.18-0.22(m,2h),0.48-0.52(m,2h),1.62(s,6h),2.08(t,2h),4.54-4.60(m,2h),5.36(s,1h),5.96(s,1h),7.57(s,1h),8.16(dd,1h),8.34-8.39(m,2h),8.45(d,1h),8.72(s,1h),12.36(s,1h)。
生理功效评价
irak4激酶测定
本发明物质的irak4抑制活性在下文中描述的irak4tr-fret测定(tr-fret=时间分辨荧光共振能量转移)中进行测量。
使用来自于n-末端gst(谷胱甘肽-s-转移酶)和人irak4的重组融合蛋白作为酶,所述重组融合蛋白在杆状病毒感染的昆虫细胞(hi5,bti-tn-5b1-4,购自invitrogen的细胞系,目录号b855-02)中表达,并经由亲和色谱法纯化。用于激酶反应的底物为生物素化(biotinylated)肽生物素-ahx-kkarfsrfagsspsqasfaepg(酰胺形式的c末端),其可购自,例如,biosyntangmbh(berlin-buch)。
对于所述测定,由2mm测试物质的dmso溶液制备20μm至0.073nm范围内的11个不同的浓度。将50nl各溶液吸移到黑色低容量384-孔微量滴定板(greinerbio-one,frickenhausen,德国)中,加入2μlirak4于测定缓冲液(50mmhepesph7.5,5mmmgcl2,1.0mm二硫苏糖醇,30μm活化的原钒酸钠,0.1%(w/v)牛γ-球蛋白(bgg)0.04%(v/v)诺乃洗涤剂-p40(sigma))中的溶液,并将混合物温育15min以使所述物质在激酶反应之前预结合至所述酶。然后通过加入3μl三磷酸腺苷(atp,1.67mm=在5μl测定体积中的终浓度:1mm)和肽底物(0.83μm=在5μl测定体积中的终浓度:0.5μm)于测定缓冲液的溶液启动激酶反应,并将所得的混合物在22℃下温育45min的反应时间。irak4的浓度根据酶相应的活性来调节和设置以使测定在线性范围内进行。通常浓度在约0.2nm的量级上。所述反应通过添加5μltr-fret检测试剂[0.1μm链霉抗生素蛋白-xl665(cisbiobioassays;法国,目录号610saxlg)]和1.5nm抗磷酸丝氨酸抗体[merckmillipore,“stk抗体”,目录号35-002]以及0.6nmlanceeu-w1024标记的抗小鼠igg抗体(perkin-elmer,产品号ad0071;或者可使用来自cisbiobioassays的铽穴合物标记的抗小鼠igg抗体)于edta水溶液(100mmedta,0.4%(w/v)牛血清白蛋白[bsa]于25mmhepesph7.5)中的溶液来终止反应。
将所得的混合物在22℃下温育1h以形成生物素化磷酸化底物和检测试剂的复合物。随后磷酸化底物的量通过测量从铕螯合物标记的抗小鼠igg抗体到链霉抗生素蛋白-xl665的共振能量转移进行评价。为此,利用tr-fret测量仪器,例如rubystar(bmglabtechnologies,offenburg,德国)或viewlux(perkin-elmer),测量在350nm激发之后,在620nm和665nm的荧光发射。取665nm和622nm的发射比作为磷酸化底物的量的量度。将数据归一化(无测试物质的酶反应=0%抑制,具有所有其他测定组分而不含酶=100%抑制)。通常,将测试物质以20μm至0.073nm范围内的11个不同浓度(20μm、5.7μm、1.6μm、0.47μm、0.13μm、38nm、11nm、3.1nm、0.89nm、0.25nm和0.073nm)于相同的微量滴定板上测试。稀释系列在测定之前(在100%dmso中的2mm至7.3nm)通过系列稀释制备。使用4-参数拟合计算ic50值。
表1:在irak4激酶测定中实施例化合物的ic50值
在上文描述的irak4tr-fret测定中同样测定了本发明通式(iii)的物质关于irak4的抑制剂活性。以下示例性地提及:化合物中间体4-2具有ic50=21.7nm、中间体4-3具有ic50=13.0nm,以及中间体4-4具有ic50=6.2nm。
thp-1细胞中的tnf-α分泌
该测试适于测试物质抑制thp-1细胞(人单核细胞急性白血病细胞系)中tnf-α(肿瘤坏死因子α)分泌的能力。tnf-α为参与炎症性过程的细胞因子。在该测试中,tnf-α分泌通过细菌脂多糖(lps)温育而触发。
将thp-1细胞保存于连续悬浮细胞培养基(含有l-glutamax的rpmi1460培养基(gibco,目录号61870-044),补充有胎牛血清(fcs)10%(invitrogen,目录号10082-147)、1%青霉素/链霉素(gibcobrl,目录号15140-114))中,并且不应超过1×106个细胞/ml的细胞浓度。所述测定在细胞培养基(含有l-glutamax的rpmi1460培养基,补充有fcs10%)中进行。
在各情况下,将每孔2-2.5μl的细胞悬浮液(对应4000个细胞)分配至384-孔测试板(greiner,目录号784076)中,其中在各情况下,40-50nl物质被溶于100%dmso中。对于每种物质,这使用在范围20μm至0.073nm内的10个不同浓度来完成。将细胞在室温下温育15min。然后将2-2.5μl的溶于细胞培养基中的0.1μg/ml的lps(sigma,大肠杆菌(escherichiacoli)055:b5,目录号l5418)(终浓度0.05μg/ml)分配至每孔中。作为中性对照,细胞用0.05μg/mllps和1%dmso进行处理,作为抑制对照,仅用1%dmso处理。
将板以80g离心30s,并在37℃、5%co2和95%大气湿度下温育17h。tnf-α的量使用tnf-αhtrf检测试剂盒(cisbio,目录号62tnfpeb/c)测定。为此,在各情况下,加入2μl的检测溶液——其由抗-tnf-α-xl665缀合物和抗-tnf-α-穴合物缀合物组成,根据制造商的说明书溶于重建缓冲液中——用于htrf(均相时间分辨荧光)测试。加入后,将混合物在室温下温育3h或在4℃温育过夜。然后使用支持htrf的测量仪器如bmgpherastar读取620/665nm处的信号。
物质的活性表示为以百分比计的中性对照和抑制对照之间的比例。使用4-参数拟合计算ic50值。
表2:实施例化合物关于thp-1细胞中tnf-α分泌的ic50值。
体外lps(脂多糖)-诱导的人pbmc(外周血单核细胞)中细胞因子产生
考察本发明通式(i)的化合物对于人pbmc中诱导性细胞因子产生的功效。此处,细胞因子产生由lps——tlr4配体,其导致irak4-介导的信号途径的激活——诱导。
人pbmc由人抗凝全血获得。为此目的,首先将15mlficoll-paque(biochrom,目录号l6115)移液到leucosep管中,并加入20ml人血。将800g该血在室温下离心15min后,移除并弃去包含血小板的血浆。将pbmc转移至离心管中并补充pbs(磷酸盐缓冲盐水)(gibco,目录号14190)。将250g细胞悬浮液在室温下离心10min并弃去上清液。将pbmc重新悬浮于完全培养基(rpmi1640,不含l-谷氨酰胺(paa,目录号e15-039),10%fcs;50u/ml青霉素,50μg/ml链霉素(paa,目录号p11-010)和1%l-谷氨酰胺(sigma,目录号g7513))中。
测定也是在完全培养基中进行。将pbmc以2.5×105个细胞/孔的细胞密度接种到96-孔板。将本发明化合物进行一系列稀释,稀释在等容的100%dmso中,并以10μm至3nm范围内的8个不同浓度应用于测定中,使得最终的dmso浓度为0.4%dmso。在实际刺激之前,将细胞随其预温育30min。为了诱导细胞因子分泌,用0.1μg/mllps(sigma,escherichiacoli0128:b12,目录号l2887)刺激细胞24小时。细胞生存力使用celltiter-glo发光测定(promega,目录号g7571(g755/g756a))按照制造商的说明书进行测定。细胞培养上清液中分泌的tnf-α的量使用humanproinflammatory9-plextissueculturekit(msd,目录号k15007b)按照制造商的说明书进行测定。例如,实施例化合物11和实施例化合物12具有≤1μm的活性。
体外tlr-4/tlr-7诱导的人树突细胞(dc)的白细胞介素(il)-23分泌
在人dc中考察本发明通式(i)的化合物对促炎细胞因子il-23的诱导产生的功效,所述促炎细胞因子il-23对th-17细胞的产生起重要作用。据报道,th-17细胞在疾病如类风湿性关节炎、牛皮癣性关节炎、别赫捷列夫病(强直性脊柱炎(ankylosingspondylitis))或多发性硬化的发病机理中起到关键作用(lubberts,nat.rev.rheumatol.,2015;marinoni等人,auto.immun.highlights,2014;isailovic等人,j.autoimmun.,2015;staschke等人,jimmunol.,2009)。为了检测本发明化合物对il-23产生的影响,使人原代单核细胞(使用磁分离从人pbmc中分离[miltenyibiotech,monocyteisolationkit,目录号130-091-153]并在完全培养基(vle(非常低的内毒素)rpmi1640[biochromag,目录号fg1415]、10%胎牛血清(fbs)[gibco,目录号10493-106];50μmβ-巯基乙醇([gibco,目录号31350]、50u/ml青霉素和链霉素[gibco,目录号15140-114])中加入生长因子(重组型人gm-csf[peprotech,目录号300-03]和il-4[peprotech,目录号200-04])在培养基中在6天内分化为dc。在收获dc后,将其重悬浮于完全培养基中并以2×105个细胞/孔的细胞密度接种于96-孔板(costar,目录号3599)中。将本发明化合物进行一系列稀释,稀释在等容的100%dmso中,并以10μm至1nm范围内的9个不同浓度用于检测中。此处确保对于使用的9个浓度的每一个,存在的dmso浓度总为0.1%。用本发明化合物对dc进行30分钟的预培养。然后,通过添加10ng/mllps(sigma,大肠杆菌(escherichiacoli)血清型serotype0127:b8,目录号l3129)(tlr4配体)和2.5μg/ml的tlr-7/8配体r848(invivogen,目录号tlrl-r848-5)(它们均激活irak4介导的信号途径),在培养箱(37℃,95%rh,5%co2)中刺激dc产生il-23,进行24小时。在24小时的培养后,收获上清液并使用市售可得的hil-23elisa(ebiosciences,目录号88-7237-88)进行分析,这根据制造商的说明书进行。以实施例化合物12为例,对人dc中il-23的抑制的结果示于图1中。
体外tlr-7/8-或tlr-9诱导的人浆细胞样树突细胞(pdc)的ifnα产生
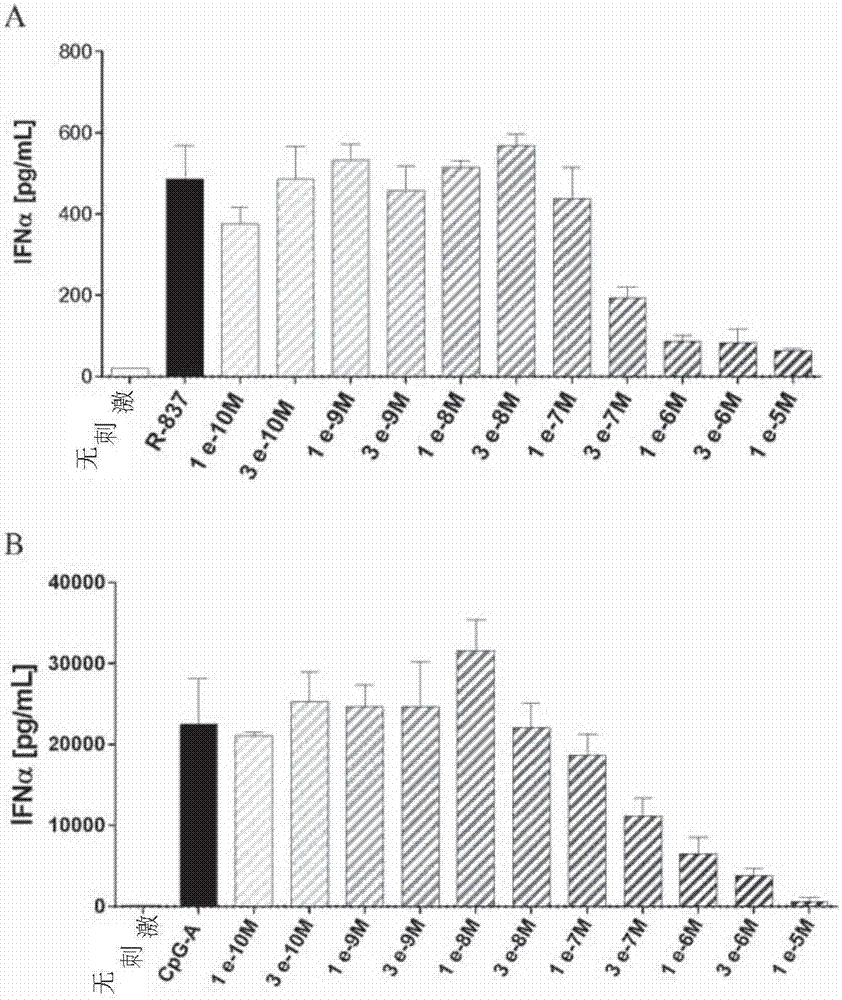
借助该测试,可以研究本发明通式(i)的化合物对人pdc中的ifnα(干扰素α)(系统性红斑狼疮发病机理中的关键细胞因子)的产生的影响(mathian等人,arthritisrheum,2009;crowm.k.,rheumdisclinnam,2010)。为此目的,如上所述地从全血中分离人pbmc,并使用市售可得的细胞分离试剂盒从中分离出浆细胞样dc(pdc)(miltenyibiotech,plasmacytoiddendriticcellisolationkitii,目录号130-097-415)。将得到的pdc重悬浮于完全培养基(补充有10%fbs[gibco,目录号10493-106]和50u青霉素/链霉素[gibco,目录号15140-114]的rpmi1640+glutamax[gibco,目录号61870-010])中,并以5×104个细胞/孔的细胞密度接种于96-孔微量滴定板(costar,目录号3599)中。将本发明化合物在等容的100%dmso中进行一系列稀释,并以10μm至1nm范围内的9个不同的浓度用于检测中。确保对于使用的9个浓度中的每一个,存在的dmso浓度始终为0.1%。用本发明化合物对pdc进行30分钟的预培养。用tlr7/8配体(咪喹莫特,r837,invivogen,目录号tlrl-imq)或用tlr-9配体(cpg-a,odn2216,invivogen,目录号tlrl-2216-1)刺激pdc,这导致将irak4介导的信号途径激活。在培养24小时后,除去细胞培养物上清液,并使用市售可得的人ifnαelisa(ifnalphamulti-subtypeelisakit,pblassayscience,目录号41105-1)进行分析。以实施例化合物12为例,对人浆细胞样dc中ifnα的抑制的结果示于图2中。
tlr-介导的炎症的体内模型
在体内tlr-介导的炎症模型中考察本发明通式(i)的化合物的体内功效。由于使用了lps-介导的炎症模型,因此该机理模型特别示出了本发明化合物对于tlr4-介导的疾病的潜在功效。在该模型中,将雌性balb/c小鼠(约8周大;charlesriver实验室,德国)分组,每组5只动物。用其中溶解所述物质的赋形剂(物质赋形剂)和其中溶解lps的赋形剂处理对照组。对物质处理组以及阳性对照组以0.2mglps/kg体重(sigma,目录号l4391)(脂多糖来自e.coli0111:b4)经腹膜内(i.p.)给药。此外,阳性对照组用上述的物质赋形剂处理。在通过给药lps诱导炎症前16小时,口服给药所述物质。为了考察本发明的化合物对于炎症的功效,1.5小时后从所述动物中采取血样。使用mouseproinflammatory7-plextissueculturekit(msd,目录号k15012b)按照制造商的说明书测定血浆中特定细胞因子的浓度。irak4抑制剂在tlr-介导的炎症模型中是有效的。图3示出了血浆中tnf-α的量,与lps-诱导的浓度相比,其通过给药实施例化合物11以剂量依赖性方式降低。
il-1β-介导的炎症的体内模型
为了评价本发明通式(i)的化合物在il-1β-介导的疾病中的潜在功效,对雌性balb/c小鼠(约8周大;charlesriver实验室,德国)经腹膜内给药il-1β,并考察了本发明的化合物对于il-1β-介导的细胞因子分泌的功效。每组有5只动物。对照组用能够用于溶解所述物质和il-1β的赋形剂进行处理。对物质处理组和阳性对照组分别经腹膜内给药90μgil-1β/kg体重(r&d,目录号401-ml/cf)。在给药il-1β前6小时,在阳性对照组中给药所述物质或其赋形剂。在给药il-1β后2小时,使用mouseproinflammatory7-plextissueculturekit(msd,目录号k15012b)按照制造商的说明书测定从血液分离的血浆中的tnf-α。il-1β的给药导致了升高的tnf-α血浆浓度,其通过实施例化合物11和12处理而抑制。这由图4示出。
体内佐剂诱导的关节炎模型
为了测定本发明通式(i)的化合物的抗炎症活性,在关节炎模型中考察它们的体内功效。为此目的,在第0天,将各雄性lewis大鼠(约100-125g,charlesriverlaboratories,germany)向尾基部皮下内给药100μl的完全弗式佐剂(cfa)溶液(结合分枝杆菌h37ra[difolab,目录号-231141]溶解于不完全弗式佐剂[difcolab,目录号-263910]中)。在每组中有n=8只大鼠。健康对照组和患病对照组均纳入研究中。各对照组仅用测试物质赋形剂进行口服处理。以预防方式,即从第0天开始,通过口服给药来进行用不同剂量测试物质的治疗。在第0天,还根据疾病活动评分(基于点系统的关节炎严重程度分级(ratingoftheseverityofarthritisbasedonapointssystem))来确定动物的起始状况。此处,对存在包括关节肿胀在内的红斑,根据关节发炎程度,将两双后爪判定为0至4点(0=无;1=轻度;2=中度;3=明显;4=严重),并加和。为了测定化合物的抗炎功效,从第8天(当动物最先出现发炎迹象时)开始,借助疾病活性评分对动物的疾病活动性进行评分,随后每周3次,直到结束(第20天)。使用单因素方差分析(anova)进行统计分析,并通过多重比较分析(dunnett's检验)与对照组进行比较。
在大鼠中的cfa皮下给药导致大鼠具有有明显关节发炎的急性关节炎。通过用实施例化合物11治疗,该诱导关节炎被抑制。这由图5说明。
小鼠体内胶原抗体诱导的关节炎模型
在另一种鼠类关节炎模型中考察本发明通式(i)的化合物的抗炎作用。为此目的,在第0天,将每只雌性balb/c小鼠(约9周大,charlesriverlaboratories,kingston,canada)向尾静脉中静脉内注射200μl胶原抗体混合剂(10mg/ml;arthritomab,mdbioproducts)(研究中包括的健康对照组除外)。然后,在第6天,使这些小鼠再分别接受腹膜内注射200μllps。每组有n=10只小鼠。健康对照组和疾病对照组均纳入研究中。对各对照组仅用测试物质赋形剂进行口服处理。以预防方式,即从第0天开始,通过口服给药进行用不同剂量测试物质的治疗。在实验过程中,基于疾病活动评分点判定系统(apointawardsystemforthediseaseactivityscore)对所有四只爪的患病程度进行评分。在该点判定中,对于健康的爪判定为没有点,而对于从脚趾通过跖关节至踝关节发生的特定程度的关节发炎,分别判定为1点[轻度发炎,例如例如脚趾发炎]至4点[延伸到整个爪子的严重发炎],说明如下:
●0=正常
●1=限于跗节或踝关节或脚趾的红斑和轻度肿胀
●2=从踝关节延伸至跖骨的红斑和轻度肿胀(2阶段)
●3=从踝关节延伸至远至跖骨关节的红斑和中度肿胀
●4=涵盖跖骨、足和趾的红斑和严重肿胀
对于该参数,在开始实验的前一天(第-1天)事先确定起始条件,且随后从第8天开始对该疾病活动评分每周评分三次。使用单因素方差分析(anova)进行统计分析,并通过多重比较分析(dunnett's检验)与对照组进行比较。
在小鼠中静脉给药胶原抗体混合剂,包括随后腹膜内给药lps,这导致具有严重关节发炎的急性关节炎。通过用实施例化合物12治疗,该诱导关节炎被抑制。这由图6说明。
体内nash小鼠模型
为了实验诱导nash,在45只雄性2天大的c57bl/6小鼠中分别皮下注射200μg链脲霉素(stz;sigma-aldrich,usa)。从4周龄开始,对这些动物随意喂食高脂肪饮食(hfd;57kcal%脂肪,购自clea,japan的#hfd32)。6周龄时,将动物随机分为3组(每组15只动物)。这些组中的一组不接受任何治疗,但其他2组在4周内每天口服给予赋形剂或测试物质。4周的治疗后,将所有动物在麻醉下无痛处死,移去肝脏并固定在布安溶液(bouin'ssolution)中,以用于组织学研究(h.denk,"fixierunghistologischer
体内db/db小鼠模型
使用30只雄性8周龄的db/db小鼠。该模型是广泛接受的肥胖、胰岛素抵抗和2型糖尿病模型(aileenjfking;theuseofanimalmodelsindiabetesresearch;britishjournalofpharmacology166(2012),877–894)。在实验期间,使动物接受标准饮食(rm1(e)801492,sds)并自由饮用自来水。将动物随机分为3组(每组10只)并在6周内用测试物质口服治疗。在研究期间,在不同时间点(在治疗开始前、治疗开始后3周和治疗结束前2天)从动物取血,以测定胰岛素敏感性参数(例如hba1c、葡萄糖含量、胰岛素含量)。此外,作为用于确定胰岛素敏感性的参数的ogtt(口服葡萄糖耐受试验)是在治疗开始前1天和治疗结束后2天进行。此外,计算homa-ir指数(空腹胰岛素水平(mu/l)*空腹血糖水平(mmol/l)/22.5)。
体内b细胞淋巴瘤相关的异种移植模型
在鼠类异种移植模型中研究本发明通式(i)的化合物的抗肿瘤活性。为此目的,将雌性c.b-17scid小鼠皮下植入人b细胞淋巴瘤细胞系,例如tmd-8。在平均肿瘤大小为20-30mm2的情况下,开始用本发明化合物口服单药治疗,或通过将给药本发明化合物与标准治疗相结合,各自均为口服给药。然而,事先,动物是随机的。一旦未经治疗的对照组具有大的肿瘤,则治疗立即结束。每周对肿瘤大小和体重测量三次。体重减轻是治疗-相关毒性的量度(>10%=临界,停止治疗直到恢复,>20%=有毒,终止)。通过电子测径仪检测肿瘤面积[长度(mm)×宽度(mm)]。在研究结束时,也测定肿瘤重量。抗肿瘤功效定义了治疗组与对照组的肿瘤重量之比(t/c)[在第x天治疗组肿瘤重量/在第x天对照组肿瘤重量]或治疗组与对照组的肿瘤面积之比[在第x天治疗组的肿瘤面积/在第x天对照组的肿瘤面积]。t/c大于0.5的化合物被定义为活性(有效)。使用单因素方差分析anova进行统计分析,并通过对-比-对的比较分析(dunnett's检验)与对照组进行比较。
图1:实施例化合物12对人单核细胞产生的dc中il-23的抑制。数据显示为具有标准偏差的平均值。
图2:实施例化合物12对(a)咪喹莫特(r837)-或(b)cpg-a-刺激的人浆细胞样dc中inf-α的抑制。数据显示为具有标准偏差的平均值。
图3:用实施例化合物11治疗lps诱导的炎症导致分泌的tnf-α量减少。数据显示为具有标准偏差的平均值。
图4:用实施例化合物11(左)和12(右)治疗il-1β诱导的炎症导致分泌的tnf-α的量的剂量依赖性降低。数据显示为具有标准偏差的平均值。
图5:在类风湿性关节炎动物模型(佐剂诱导的大鼠模型)中,实施例化合物11的抗发炎功效。基于疾病活动评分测定的类风湿性关节炎的显著程度和剂量依赖性抑制。数据对应于平均值+标准偏差。单因素anova方差分析,随后通过dunnett’s检验进行与cfa对照组的多重比较分析;*p<0.05;**p<0.01;***p<0.001;****p<0.0001。
图6:在类风湿性关节炎动物模型(胶原抗体引导的小鼠模型)中,实施例化合物12的抗发炎功效。基于疾病活动评分测定的类风湿性关节炎的显著程度和剂量依赖性抑制。数据对应于平均值+标准偏差。通过单因素anova方差分析,随后多重比较分析(dunnett’s检验)来计算胶原抗体(ak)对照组和治疗组之间的统计显著性(*p<0.05;**p<0.01;***p<0.001;****p<0.0001)。
- 还没有人留言评论。精彩留言会获得点赞!