一种两亲性多功能聚合物及其制备的纳米胶束和应用的制作方法
本发明涉及一种两亲性多功能聚合物及其制备的纳米胶束和应用,特别涉及一种侧链分别含有细胞外层膜两性离子磷酰胆碱,胆固醇和叶酸的两亲性多功能聚合物及其纳米载药胶束的制备方法及应用,属于高分子化学与物理及生物医用材料技术领域。
背景技术:
随着纳米医药的快速发展,近几十年来纳米药物载体备受关注。纳米药物传输体系(DDS)是以纳米颗粒作为抗癌药物及基因载体,将药物等包载在纳米颗粒空隙中或吸附在其表面,通过血液循环的方式,利用增强的渗透和滞留(EPR)效应实现纳米颗粒物理靶向到癌症组织并被癌细胞摄入细胞内,实现安全有效的靶向药物输送和基因治疗。
然而随着研究的不断深入,发现当纳米颗粒通过静脉注射或口服的方式在血液循环过程中,在到达其病变部位之前会经历被识别为外源物质而通过网状内皮系统(RES)的高吞噬性单核吞噬细胞系统 (MPS)摄取而离开循环系统。这种摄取的纳米药物累积在其它正常器官组织中产生毒副作用,并严重影响药物输送的效率。此外,纳米载药载体进入体内后受高倍稀释及其它因素的影响,载体解离引起药物提前释放影响载体的临床应用。还有,虽然叶酸已被用于不同抗癌药的靶向性组分研究,来降低药物对正常组织细胞的伤害,增加对肿瘤细胞杀伤作用,但许多研究报道叶酸组分的靶向作用较难表现(Lee J. H., et al. J. Controlled Release, 2015, 209, 219-228;Qiu L. Y., et al. International Journal of Pharmaceutics, 2013, 456, 315-324)。因此,从仿生角度出发进行纳米颗粒载体的设计或表面仿生改性有可能改善其在体内的稳定性、外表面携带细胞外层膜两性离子基团使负载药物的纳米颗粒很难被体内免疫系统识别及清除,更容易实现血液长循环性能及高选择性的靶向作用。
技术实现要素:
本发明以提高纳米载药系统对癌细胞的靶向作用、延长在血液中循环时间为突破口,从细胞膜仿生角度出发,设计了一种含靶向基团叶酸、仿细胞膜结构的两性离子亲水基团和强疏水性胆固醇侧链的仿生多功能两亲性随机共聚物。
本发明另一个目的是提供一种仿细胞膜结构两亲性随机共聚物胶束的制备方法,通过控制制备条件达到叶酸基团尽可能多地在胶束外表面分布,以便达到更有效地与癌细胞表面叶酸受体蛋白结合进入癌细胞的目的,获得了一种既具良好的胶束稳定性、体内隐形性、低毒性、又具有被动和主动靶向作用的新型多功能载药胶束。
本发明还有一个目的是提供具有仿细胞膜结构的体内隐形及肿瘤靶向性纳米载药胶束的具体应用。其能像人的红细胞一样在血液中长循环,不易被人体免疫系统识别,在癌变部位高效富集,达到治疗癌症的目的。
本发明的实现过程如下:
结构通式(I)所示的两亲性多功能聚合物,简称为PMNCF,其中R为氢或甲基;
其中,x为10~1000的正整数,y为5~500的正整数,z为0~500的正整数;在x、y、z中,x摩尔百分数为40~75%,y为10~30%,z为0~35%;优选为x摩尔百分数为40~75%,y为10~30%,z为10~35%;
n1 为1~3的正整数,R1为同时带有正负电荷的两性离子亲水基团
n2为5~50的正整数,R2为含有胆固醇的憎水基团
n3为5~50的正整数,R3为含有叶酸的肿瘤叶酸受体靶向基团
上述两亲性多功能聚合物的制备方法:PMNCF由含有两性离子及活性酯的两种可聚合单体通过在溶液中自由基引发随机共聚首先得到两性离子单元摩尔分数x为40%~75%的二元随机共聚物PMN(Gong Y. K., et al. Macrom. Biosci., 2012, 12, 979-985),然后用含有氨基的胆固醇及含有氨基的叶酸分子对聚合物中的活性酯单元进行酰胺化接枝反应,活性酯单元1-x = 60%~25%,得到胆固醇单元摩尔分数y为10%~30%,叶酸单元摩尔分数z为0%~35%的多功能聚合物。
上述聚合反应在无水有机溶剂二甲亚砜中进行。
上述方法制备的两亲性多功能聚合物制备纳米载药胶束的方法:用二甲基亚砜溶解PMNCF聚合物及憎水性药物,将占聚合物质量百分数10%~50%的药物溶液与聚合物溶液加入快速搅拌的水溶液中自动形成直径30~150 纳米的载药胶束,形成稳定的纳米载药胶束水溶液。
上述制备过程中,调节水溶液的pH为4~6很关键,大于6或小于4,将导致胶束不稳定,靶向基团暴露不充分,靶向性差。
所述具有憎水性药物选自阿霉素、紫杉醇、表柔比星、羟基喜树碱、吡柔比星、多西他赛、异长春花碱、奥沙利铂。
上述多功能型两亲性聚合物在水溶液中可自组装形成胶束,可作为疏水性抗癌药物的载体,制备过程中,用超滤离心方法对有机溶剂及游离药物进行分离,提纯及浓缩纳米载药胶束。
具体地说,多功能两亲性聚合物载药胶束采取如下方法制备:将两亲性聚合物(PMNCF)和药物如阿霉素溶于DMSO中,滴加到pH为4~6的水中,利用两亲性聚合物自组装实现药物的负载。然后通过透析或超滤离心的方式除去有机溶剂以及游离的阿霉素得到载药胶束。将形成的载药胶束通过测量其粒径、Zeta电位、储存稳定性、细胞毒性实验和细胞吞噬实验等,评估载药胶束的性能。
本发明的优点与积极的效果:(1)本发明通过在两亲性聚合物侧链上引入细胞外层膜磷酰胆碱强亲水基团、胆固醇强疏水基团及叶酸靶向基团,在弱酸性水溶液中自组装容易形成稳定的可负载药物的仿细胞膜结构胶束,赋予胶束体内“隐形”功能;(2)本发明在弱酸性水溶液中组装增加了叶酸基团的溶解,有较多叶酸基团分布于胶束外表面可最大限度地发挥主动靶向作用;(3)本发明聚合物各单体基团摩尔含量可根据实际需求来控制合成,因此形成的胶束粒径范围、靶向基团含量等可控,可以进行长循环及靶向性能的优化筛选;(4)形成的纳米载药胶束亲水层外连接有设计含量的叶酸基团,与乳腺癌细胞、KB细胞及HeLa细胞有2~4倍的高选择性靶向作用;纳米载药胶束具有仿细胞外层膜亲水层结构,在体内抗免疫系统识别及清除作用优异;(5)本发明制备方法简单,可降低应用成本。与普遍使用的两亲性嵌段共聚物的合成制备相比,制备两亲性随机共聚物的条件及工艺过程非常简便易行,容易推广应用。
附图说明
图1为聚合物PMNCF-23的1H NMR谱图;
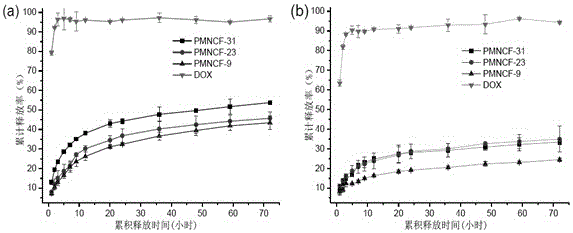
图2为系列载药PMNCF胶束在不同的释放介质中的药物累积释放率(a)pH=5.0; (b) pH=7.4;
图3不同浓度载阿霉素的PMNCF胶束与MADB-106细胞培48 h养后的癌细胞存活率;
图4为小鼠腹腔巨噬细胞对不同聚合物胶束摄取2 h后的荧光显微镜照片;
图5为大鼠乳腺癌细胞MADB-106不同时间对无FA修饰以及FA摩尔百分比不同的胶束摄取后的荧光显微镜照片。
具体实施方式
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
实施例1 氨基化胆固醇的制备
将50 mL的无水二氯甲烷和37.5 mL的无水乙二胺加入到250 mL三颈圆底烧瓶中,置于冰盐浴中使反应温度调节至0℃。然后称取5.02 g(0.0112 mol)的氯甲酸胆固醇酯,将其溶解于60 mL 的无水二氯甲烷中,溶解充分后将溶液转移至恒压滴液漏斗中。在高速搅拌状态下将该溶液滴加到前述三颈圆底烧瓶中,反应结构式如下:
滴加完毕后,室温条件下避光反应过夜。将反应液用等体积的蒸馏水萃取三次,除去乙二胺盐酸盐和乙二胺,用大量无水硫酸镁干燥有机相,过夜除去少量的水。将干燥后的有机相减压抽滤除去硫酸镁固体,得到的清液在室温条件下避光旋蒸然后于30℃真空干燥,所得乳白色固体即为Chol-NH2。
实施例2 氨基化叶酸的制备
第一步:单氨基保护乙二胺(BOC-NH2)的合成:
将4.40 g(0.0732 mol)乙二胺溶解在110 mL含10%三乙胺的甲醇溶液中,在剧烈搅拌下,将溶解在10 mL甲醇中的3.63 g(0.0172 mol)二碳酸二叔丁基酯慢慢滴加到上述溶液中,室温搅拌反应过夜。反应完毕后,室温旋蒸除去甲醇,得到油状产物,将其溶解在100 mL二氯甲烷中,用10%碳酸钠水溶液洗涤除去乙二胺,有机相用无水硫酸镁干燥过夜,过滤,真空干燥后得到单氨基保护的产物(BOC-NH2)。
第二步:叶酸活性酯与单氨基保护的乙二胺反应合成:
将1.00 g(0.0023 mol)叶酸(FA)加入到40 mL无水DMSO中,再加入0.5 mL三乙胺,避光搅拌过夜。加入0.50 g(0.0023 mol)DCC和0.52 g(0.0046 mol)NHS,避光继续搅拌24 h对叶酸的γ位羧基进行活化。过滤除去不溶物后,向滤液中加0.39 g(0.0025 mol)BOC-NH2,室温避光反应过夜。过滤除去不溶物后,慢慢滴加到剧烈搅拌的400 mL无水乙醚和丙酮中(1:1,V/V),然后冰水浴0℃冷却,静置得到黄色沉淀。离心得到黄色沉淀然后用乙醚洗涤三次除去残留的DMSO,得到的黄色粉末常温真空干燥一天,得到单氨基保护的产物(FA-NHBOC)。
第三步:FA-BOC去保护:
将0.46 g(0.0008 mol)产物溶解于4 mL三氟乙酸中,室温搅拌2 h后旋转蒸发浓缩后用30 mL无水乙醚沉淀。沉淀用5 mL DMF溶解后再用25 mL乙醚沉淀,弃去上清液后用乙醚洗涤三次,4 000 rpm/min离心得到黄色沉淀。最后室温真空干燥一天,得到产物FA-NH2。
实施例3 可聚合活性脂单体(NPEM)的制备
含有对硝基苯氧甲酰基易离去基团的对硝基苯氧甲酰聚乙二醇甲基丙烯酸脂(NPEM)的制备作过程如下:在250 mL三颈圆底烧瓶中,加入17.05 g (0.0324 mol)甲基丙烯酸聚乙二醇酯,4.80 g(0.0475 mol)三乙胺及60 mL氯仿使其溶解。称取9.62 g(0.0531 mol)对硝基苯氧甲酰氯溶解在100 mL氯仿溶液中用恒压滴液漏斗以3 s/d的速度滴加至机械搅拌条件下-20℃的三颈烧瓶内。滴加完毕后保持此温度继续反应2 h,然后恢复室温反应过夜。反应完毕后,用旋转蒸发仪将反应液浓缩,再加入等体积50 mL冷的乙醚沉淀滤除三乙胺盐酸盐。室温旋蒸除去乙醚,加入等体积的氯仿,得到淡黄色的液体。用等体积的pH= 3.0~4.0的磷酸缓冲溶液萃取以除去残余的三乙胺盐及三乙胺,重复3次后将收集的有机相在30℃旋蒸至没有液滴出现为止,得到的淡黄色油状物即为活性酯单体对硝基苯氧甲酰聚乙二醇甲基丙烯酸酯(NPEM)。
实施例4合成含磷酰胆碱基团和活性酯基团的二元聚合物(PMN)
在氮气保护下,向250 mL三颈圆底烧瓶中加入10 mL无水乙醇,称取0.11 g偶氮二异丁腈(AIBN)溶于6 mL THF,待完全溶解后取该溶液的四分之一体积转移至上述三颈瓶内,升温至70 ℃恒温,磁力搅拌,保持该状态30 min。向100 mL恒压滴液漏斗内加入60 mL溶有NPEM 3.57 g(0.0068 mol)和2.00 g(0.0068 mol)磷酰胆碱(MPC)的无水乙醇溶液,以及余下四分之三体积溶解有AIBN 的THF溶液。待充分混合后,将该溶液缓慢滴加至前述三颈瓶内反应24 h,得到淡黄色的透明溶液。反应完成后,减压旋蒸除去三分之二溶剂后,在截留分子量为3 500 Da的透析袋内透析。先用其良溶剂无水乙醇透析3次,然后用pH=3.0~4.0的磷酸缓冲液透析6次,每次3~8 h。之后-50 ℃冷冻干燥,得到的白色絮状物即为共聚物PMN。1H-NMR 测得共聚物PMN中NPEM组分的摩尔百分含量为39%。同样的方法来合成一系列NPEM组分的摩尔百分含量分别为27%、36%和42%的共聚物。
实施例 5仿细胞膜结构两亲性多功能共聚合物PMNCF的合成
利用活性酯基团在弱碱性条件下将氨基化的叶酸和胆固醇接枝到聚合物PMN分子链上,称取0.50 克 PMN-39,将其转移至250 mL三颈圆底烧瓶内,量取20 mL的DMSO转移至其中,再加入200 μL三乙胺,温度调节至80 ℃恒温搅拌4 h使其充分溶解。称取氨基化胆固醇0.15 g(0.0003 mol),将其溶解于30 mL的DMSO中,待溶解充分,将溶液转移至分液漏斗滴入烧瓶内恒温反应3 h。然后向该反应烧瓶内滴加含0.59 g(0.0012 mol)FA-NH2的30 mL DMSO溶液,80 ℃恒温避光反应20 h。反应结束后将反应液用截留分子量为3 500 Da的透析袋透析。先用DMSO于45 ℃透析3次后,再用蒸馏水避光透析8次,每次3~8 h。透析完毕后,将产物在-50℃下冷冻干燥,即得聚合物PMNCF。用1H-NMR确定聚合物及各组分的摩尔百分含量,测得共聚物PMNCF中各组分的摩尔百分含量为 MPC/Chol/FA = 61/16/23,用PMNCF-23表示(图1)。
实施例6 PMNCF-9胶束制备
将2 mL 5 mg/mL PMNCF-9聚合物的DMSO溶液缓慢滴入到快速搅拌的10 mL pH 5.0的去离子水中,滴加完毕后,继续搅拌6 h。将混合溶液转移至截留相对分子质量为3 500的透析袋中,在20 mL超纯水中透析48 h,其间每隔3~4 h更换新鲜超纯水。透析完成后,移出透析袋内的溶液,以6 000 rpm/min离心20 min除去大颗粒杂质。移取上清液用动态光散射仪(DLS)分别测定胶束分散液的Zeta电位和粒径大小及其分布。
实施例7 PMNCF-31胶束制备
50 mg PMNCF-31聚合物于搅拌下溶解于10 mL DMSO中,然后将该溶液缓慢滴入到50mL快速搅拌下pH=5.0的去离子水中,滴加完毕后继续搅拌6 h。将胶束溶液转移至截留相对分子质量为3 000的超滤离心管中,以4 000 rpm/min离心超滤20 min,重复3次除去DMSO。浓缩液用超纯水定容得到一定浓度(1 mg/mL)的胶束溶液,动态光散射得Zeta电位-13.9±0.8 mV,数目平均水合粒径56.0±7.5 nm, PDI=0.219。
实施例8 载阿霉素PMNCF胶束
称取30 mg 的PMNCF-23聚合物溶于6 mL DMSO。将11.4 mg盐酸阿霉素溶于2 mL DMSO后加入6.1 mg三乙胺搅拌4 h。与上述PMNCF-23溶液混合均匀后以3 s/d滴加到快速搅拌的30 mL去离子水中(pH=5.12),滴加完成后继续搅拌6 h。再将混合溶液转移至截留相对分子质量为3 500 Da的透析袋中,于500 mL超纯水中透析48 h,其间每隔3~8 h更换新鲜超纯水。透析完成后,取出透析袋内的溶液,以6 000 rpm/min离心20 min,除去大颗粒杂质。上清液用截留分子量为3 000 Da的超滤离心管在4 000 rpm/min离心超滤20 min,最后用 0.45 μm滤膜过滤,稀释定容得到6 mg/mL和1 mg/mL的胶束溶液。移取1 mg/mL的载药胶束溶液用动态光散射仪测得Zeta电位-8.7±1.7 mV,数目平均水合粒径87.1±4.9 nm, PDI=0.072。
实施例9 载药胶束控制释放特征曲线
取4.0 mL载药阿霉素胶束(1 mg/mL)溶液加入截留相对分子质量为3 500 Da的透析袋中,并将透析袋置于50 mL旋盖离心管中,用量筒量取20 mL的释放介质(pH=7.4或pH=5.0)的缓冲溶液。在恒温37℃,100 rpm/min摇床上进行体外释放实验,间隔一定时间取透析介质3 mL分析释药浓度,同时补加3 mL新鲜介质透析液继续释药过程。得到的阿霉素释药曲线如图2所示。与游离阿霉素的释放曲线相比,载药胶束具有明显的缓释效果。
实施例10载阿霉素PMNCF胶束的细胞毒性
通过四唑盐比色法(MTT法)检测细胞存活率,从而判断细胞毒性,评估空白胶束、载药胶束和游离阿霉素对细胞毒性、浓度依赖性和载药胶束缓释效果。本实验用大鼠乳腺癌(MADB-106)细胞进行评价。
MADB-106细胞于96孔板内贴壁培养24 h后,用含PMNCF胶束的RPMI 1640培养液替换细胞培养液,培养24 h、48 h。吸出培养板孔内的培养液后加入无菌PBS洗去死细胞,淋洗3次。用倒置显微镜下观察不同浓度的聚合物胶束对细胞形态的影响。然后向每孔加入20 μL 浓度为5 mg/mL MTT的RPMI 1640培养液继续在37℃、5% CO2培养箱内孵育4 h。小心吸掉上清液后每孔加入DMSO 200 μL,置于恒温37℃的摇床上振荡10 min使其灰色结晶充分溶解,用酶标仪在490 nm波长处测各孔的OD值,计算得到各试样细胞相对成活率(图3)。
实施例11 载荧光探针香豆素-6 胶束的制备
称取25 mg PMNCF聚合物溶于5 mL二甲基亚砜中,搅拌6 h使其溶解充分。加入50 μL浓度为0.5 mg/mL香豆素-6的三氯甲烷溶液混合均匀后,在剧烈搅拌下滴加到25 mL去离子水中(pH=5.12),滴加完成后继续搅拌6 h。然后将胶束溶液转移至截留相对分子质量为3 500 Da的透析袋中,于500 mL蒸馏水中透析48 h,其间每隔3~8 h更换一次蒸馏水。透析后取出透析袋内的溶液,在离心机中以6 000 rpm/min离心20 min,除去大颗粒杂质。取上清液(10 mL)用截留分子量为3 000 Da的超滤离心管在离心机中以4 000 rpm/min离心20 min,然后再补加超纯水定容到10 mL,以此方法再离心数次上清液达到浓缩和进一步除去游离香豆素-6 的目的。最后将浓缩液定容到5或25 mL得到浓度为5 mg/mL或1 mg/mL的载荧光探针胶束溶液。
实施例12 体外细胞摄取率测定
用小鼠腹腔巨噬细胞(MPM)来测定对不同胶束或纳米颗粒的摄取率。
第一步:用含10%小牛血清的RPMI 1640培养液细胞培养基配制浓度1.0×106个/mL的MPM细胞细胞悬液分注于24孔培养板内,每孔1 000 μL,在37℃的恒温细胞培养箱内培养5 h使细胞贴壁。
第二步:弃去原培养后,实验组加入用RPMI 1640培养液稀释好的载香豆素-6的PMNCF胶束培养液(0.20 mg/mL)1 000 μL,空白组加细胞培养基1 000 μL,对照组加0.20 mg/mL的载等量香豆素-6的聚乳酸纳米颗粒1 000 μL,每组设4个复孔;置入37℃、5% CO2、饱和湿度的恒温培养箱内分别培养2 h。
第三步:2 h后移出并回收含有未被摄取的香豆素-6培养液于离心管中,1 500 rpm/min条件下离心10 min,上清液用荧光分光光度计在430 nm处激发,激发狭缝和发射狭缝宽度为5 nm,扫描速度1200 nm/min,激发电压700 V,扫描445~630 nm波长范围的荧光发射光谱,读取500 nm处的荧光发射峰的强度。
以加入的载香豆素-6胶束分散液荧光强度为对照,按照以下公式计算巨噬细胞对聚合物胶束的摄取率。
其中I0——加入的载荧光探针聚合物胶束分散液的荧光强度
I ——被巨噬细胞摄取后,载荧光探针聚合物胶束分散液上清液的荧光强度。
第四步:细胞培养板每个孔用200 µL PBS淋洗三次洗去吸附在细胞表面并未牢固结合的聚合物胶束或纳米颗粒,然后在倒置荧光显微镜下通过明场和荧光场观察细胞形貌及有无荧光现象,定性判断巨噬细胞对胶束的吞噬情况。利用荧光分光光度计计算摄取率的结果与荧光倒置显微镜定性观察明场和荧光场巨噬细胞吞噬情况基本一致。对比说明含PC基团聚合物胶束大大降低了被巨噬细胞吞噬的几率。吞噬率计算结果如图4所示。
实施例13 叶酸受体靶向胶束的靶向性测定
以大鼠乳腺癌细胞MADB-106细胞为模型细胞,考察肿瘤细胞摄取胶束的情况,评价体外癌细胞靶向性能。具体实验过程如下:
MADB-106细胞于含10% FBS、含双抗及不含叶酸的RPMI-1640培养液中以密度为5×104个细胞/孔的密度种于24孔培养板中。培养24 h后移去培养液,每孔加入0.20 mg/mL的一系列负载香豆素-6胶束分散液1.0 mL,在37℃、饱和湿度下、5% CO2培养箱中孵育不同时间(2 h、6 h、12 h),通过明场和荧光场定性的考察不同培养时间肿瘤细胞对胶束摄取的情况。培养不同时间后,收集含有未被摄取的胶束培养液,测荧光强度定量判断肿瘤细胞的摄取效率。用PBS反复淋洗孔板内细胞三次,洗去吸附在细胞表面并未牢固结合的胶束。在倒置荧光显微镜下观察明场和荧光场,定性判断肿瘤细胞摄取情况。如图5结果显示,PMNCF-31的胶束摄取率是无叶酸修饰胶束的3~5倍,说明胶束通过叶酸受体介导可以显著提高癌细胞对胶束的摄取能力,从而实现载药胶束的细胞靶向性。
- 还没有人留言评论。精彩留言会获得点赞!