一种发射红光的聚合物及其制备方法与流程
本发明涉及有机聚合物,具体涉及一种能够发射红光的聚合物及其制备方法,以及其在有机光电显示器件中的应用。
背景技术:
有机聚合物作为新兴材料领域的热点受到许多研究人员的广泛关注。这主要是由于聚合物长的重复单元所构成的骨架能够实现良好的能量传递,从而使其具有强的光捕获能力和光学信号放大效应。与大多数小分子化合物相比,有机聚合物展示出更优良的光学性能、细胞兼容性、低毒性和易修饰等特点,这使其被广泛的应用于发光材料,化学生物传感及成像等领域。喹啉及其衍生物由于其高的荧光量子产率和出色的电子传输性能在有机发光材料、太阳能电池等新兴材料研究得到了广泛关注;同时,其对金属离子强的鳌合能力使得在化学生物传感方面也成为研究热点。作为三原色之一的红光聚合物材料在有机电致发光器件(OLEDs)显示领域一直处于相对紧缺的状况。噻吩基取代的苯并噻二唑功能团已经被证明具有潜在的红光发射能力和高的量子产率。因此,本发明的目的是通过采用相关的合成手段将噻吩、苯并噻二唑、苯以及喹啉四个单元连接起来,得到能够发射红光的聚合物发光材料。
技术实现要素:
本发明的目的是提供一种发射红光的聚合物及其制备方法,该聚合物能够发射红光,可作为发光材料应用在光电功能材料显示领域,所得聚合物具有好的热稳定性和光电性质,所采用的制备方法操作简单、反应条件温和。
本发明提供的一种发射红光的聚合物,其结构式为:
本发明提供的一种发射红光的聚合物的制备方法,包括如下步骤:
1)、将3,5-二溴苯胺、二氯乙醇和碳酸钙加入蒸馏水中,再将催化量的碘化钠加入上述体系中,100℃下搅拌反应12h,得到3,5-二溴-N-(2’-羟基乙基)苯胺(II);
2)、在冰浴下,将溶有对甲基苯磺酰氯的四氢呋喃溶液缓慢滴入含有氢氧化钠的水溶液和3,5-二溴-N-(2’-羟基乙基)苯胺(II)的四氢呋喃混合体系中,保持体系温度低于5℃搅拌反应12h,得到3,5-二溴-N-(2’-对甲苯磺酰基氧基乙基)苯胺(III);对甲基苯磺酰氯、氢氧化钠和3,5-二溴-N-(2’-羟基乙基)苯胺(II)的摩尔比为3∶3∶1,水和四氢呋喃的体积比为2∶15;
3)、将8-羟基喹啉加入DMF和碱的混合体系中,搅拌30min后,溶有3,5-二溴-N-(2’-对甲苯磺酰基氧基乙基)苯胺(III)的DMF溶液缓慢滴入上述混合体系中,80℃搅拌反应20h,得到3,5-二溴-N-[2’-(8”-喹啉基氧基)乙基]苯胺(IV);8-羟基喹啉、碱和3,5-二溴-N-(2’-对甲苯磺酰基氧基乙基)苯胺(III)的摩尔比为1.2∶10∶1;
4)、在氮气保护下,以Pd(dppf)Cl2为催化剂,将3,5-二溴-N-[2’-(8”-喹啉基氧基)乙基]苯胺(IV)、联硼酸频哪醇酯和碱依次加入高沸点的有机溶剂中,在100℃下反应得到3,5-二(4’,4’,5’,5’-四甲基-1’,3’,2’-二氧杂戊硼基)-N-[2’-(8”-喹啉基氧基)乙基]苯胺(V);
5)、在氮气保护下,以Pd(PPh3)4为催化剂,将溶有碱的水溶液加入含有3,5-二(4’,4’,5’,5’-四甲基-1’,3’,2’-二氧杂戊硼基)-N-[2’-(8”-喹啉基氧基)'乙基]苯胺(V)和4,7-二(5’-溴-2’-噻吩基)-2,1,3-苯并噻二唑的高沸点有机溶剂中,在100℃下反应得到发射红光的聚合物(I);水和高沸点有机溶剂的体积比为1∶3。
步骤1)中,所述的3,5-二溴苯胺、二氯乙醇和碳酸钙的摩尔比为1∶1~4∶1;
步骤3)中,所述的碱为碳酸钾、碳酸钠或叔丁醇钾;
步骤4)中,所述的3,5-二溴-N-[2’-(8”-喹啉基氧基)乙基]苯胺(IV)、联硼酸频哪醇酯和碱的摩尔比为1∶2~4∶10,所述的高沸点的有机溶剂为DMF、DMSO或1,4-二氧六环,碱为乙酸钾、碳酸钾或碳酸钠,反应时间为8~18h;
步骤5)中,所述的4,7-二(5’-溴-2’-噻吩基)-2,1,3-苯并噻二唑、3,5-二(4’,4’,5’,5’-四甲基-1’,3’,2’-二氧杂戊硼基)-N-[2’-(8”-喹啉基氧基)'乙基]苯胺(V)和碱的摩尔比为1∶1~1.2∶4,所述的高沸点的有机溶剂为甲苯或DMF,碱为乙酸钾、碳酸钾或碳酸钠,反应时间为24~48h。
本发明提供的发射红光的聚合物发光材料,具有如下光电性质:
1)在DMSO溶剂中的最大紫外吸收和荧光发射波长分别为490nm和610nm;
2)玻璃化温度(Tg)为135℃,热分解温度(Td,5%)为228℃;
3)以饱和甘汞电极为参比电极,测试了材料的氧化还原(CV)曲线,所得起始氧化电位为+0.47V,通过经验公式[HOMO=-(0.47+4.5+0.24)eV计算得到材料的最高占有轨道(HOMO)的能级为-5.21eV,通过公式[LUMO=HOMO+Eg]计算得到材料的最低空轨道(LUMO)的能级为-2.68eV,其中能带隙(Eg=1240/ab(490nm)),饱和甘汞电极电势为+4.5V,标准氢电极电势为+0.24V。
本发明发光材料可以在有机光电显示器件中应用。
与现有技术相比本发明的优点和效果:
本发明得到的含有噻吩、苯并噻二唑、苯及喹啉功能团的聚合物是一种红光发光材料,该材料具有好的热稳定性和电化学性质,是紧缺的红光发光材料。该发光材料能够作为光电功能材料在显示器领域应用。所采用的制备方法反应操作简单、条件温和。
说明书附图
图1本发明聚合物在DMSO中的紫外吸收和荧光发射光谱图。
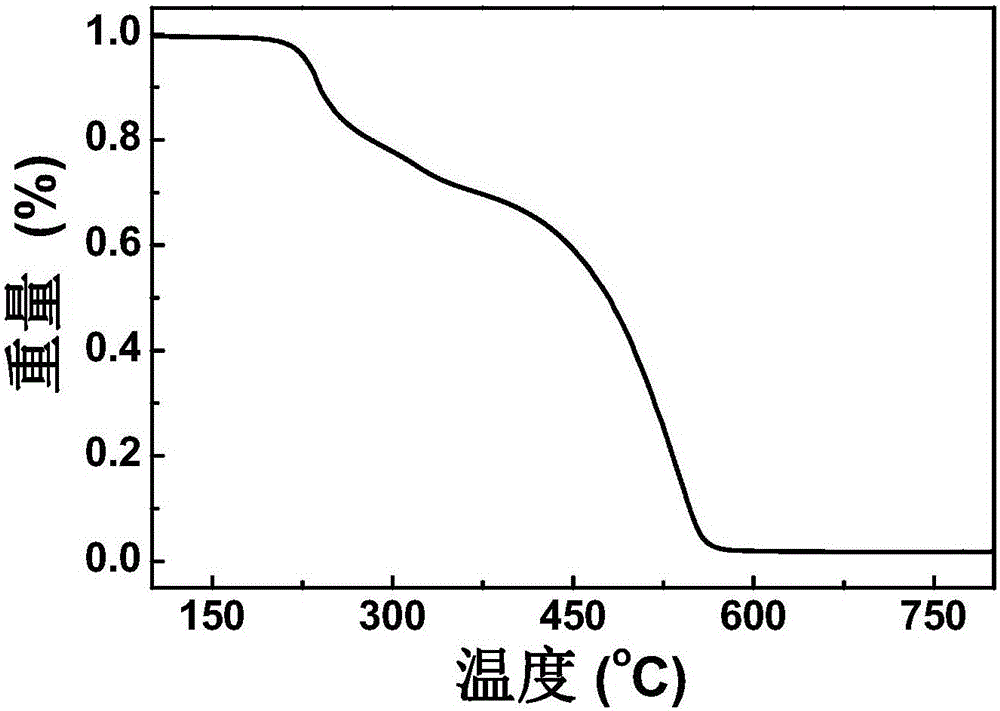
图2本发明聚合物的热重分析TG曲线图。
图3本发明聚合物电化学性质CV曲线图。
具体实施方式
实施例1
在装有磁力搅拌的100mL三口瓶中加入3.50g(0.014mol)3,5-二溴苯胺、1.13g(0.014mol)二氯乙醇、1.40g(0.014mol)碳酸钙、0.20g(1.33mmol)碘化钠和50mL蒸馏水后,加入到100℃搅拌反应12h。搅拌下,将反应液倒入50mL冰水中,用二氯甲烷(50mL×3)萃取三次,合并有机相,将所得有机相水洗三次,经无水硫酸钠干燥,减压旋除溶剂得粗产品,粗产品经硅胶柱色谱分离(展开剂:乙酸乙酯/石油醚=1/4,v/v)得产品3,5-二溴-N-(2’-羟基乙基)苯胺(II)1.55g,产率37.5%。1H NMR(CDCl3,400MHz)δ7.01(s,1H),6.72-6.74(s,2H),3.85-3.88(t,2H),3.27-3.30(t,2H);13C NMR(CDCl3,100MHz)δ151.23,122.87,116.54,60.45,46.21;MS-ESI for C8H9Br2NO(m/z)295.92[M+1]。
实施例2
在装有磁力搅拌的100mL三口瓶中加入3.50g(0.014mol)3,5-二溴苯胺、2.26g(0.028mol)二氯乙醇、1.40g(0.014mol)碳酸钙、0.20g(1.33mmol)碘化钠和50mL蒸馏水后,加入到100℃搅拌反应12h。搅拌下,将反应液倒入50mL冰水中,用二氯甲烷(50mL×3)萃取三次,合并有机相,将所得有机相水洗三次,经无水硫酸钠干燥,减压旋除溶剂得粗产品,粗产品经硅胶柱色谱分离(展开剂:乙酸乙酯/石油醚=1/4,v/v)得产品3,5-二溴-N-(2’-羟基乙基)苯胺(II)1.85g,产率44.8%。1H NMR(CDCl3,400MHz)δ7.00(s,1H),6.71-6.74(s,2H),3.86-3.88(t,2H),3.26-3.31(t,2H);13C NMR(CDCl3,100MHz)δ151.11,123.21,116.23,61.15,46.16;MS-ESI for C8H9Br2NO(m/z)295.94[M+1]。
实施例3
在装有磁力搅拌的100mL三口瓶中加入3.50g(0.014mol)3,5-二溴苯胺、4.52g(0.056mol)二氯乙醇、1.40g(0.014mol)碳酸钙、0.20g(1.33mmol)碘化钠和50mL蒸馏水后,加入到100℃搅拌反应12h。搅拌下,将反应液倒入50mL冰水中,用二氯甲烷(50mL×3)萃取三次,合并有机相,将所得有机相水洗三次,经无水硫酸钠干燥,减压旋除溶剂得粗产品,粗产品经硅胶柱色谱分离(展开剂:乙酸乙酯/石油醚=1/4,v/v)得产品3,5-二溴-N-(2’-羟基乙基)苯胺(II)2.12g,产率51.3%。1H NMR(CDCl3,400MHz)δ7.00(s,1H),6.72-6.75(s,2H),3.85-3.87(t,2H),3.27-3.30(t,2H);13C NMR(CDCl3,100MHz)δ151.13,123.28,115.97,61.16,46.08;MS-ESI for C8H9Br2NO(m/z)295.93[M+1]。
实施例4
在冰浴下,向装有磁力搅拌的50mL三口瓶中,依次加入2mL溶有0.80g(0.02mol)氢氧化钠的水溶液、10mL溶有1.98g(6.6mmol)3,5-二溴-N-(2’-羟基乙基)苯胺(II)的四氢呋喃溶液和5mL溶有3.80g(0.02mol)对甲基苯磺酰氯的四氢呋喃溶液,保持温度低于5℃搅拌反应12h。将反应液浓缩至2~3mL,倒入100mL冰水中,用二氯甲烷萃取三次,合并有机相,将有机相水洗三次,经无水硫酸钠干燥,减压旋除有机溶剂得粗产品。粗产品经柱色谱分离(展开剂:乙酸乙酯/石油醚=1/5,v/v)得产品3,5-二溴-N-(2’-对甲苯磺酰基氧基乙基)苯胺(III)2.13g,产率69.8%。1H NMR(CDCl3,400MHz)δ7.77-7.79(d,2H),7.34-7.36(d,2H),6.98(s,1H),6.56(s,2H),4.16-4.22(t,2H),3.38-3.41(t,2H),2.48(s,3H);13C NMR(CDCl3,100MHz)δ148.79,145.28,132.38,129.96,127.90,123.51,123.19,114.44,114.42,67.61,42.27,21.70;MS-ESI for C15H15Br2NO3S(m/z)449.92[M+1]。
实施例5
在装有磁力搅拌的50mL三口瓶中加入10mL DMF和1.38g(0.01mol)碳酸钾,搅拌30min,再加入0.17g(1.2mmol)8-羟基喹啉,继续搅拌30min。然后将10mL溶有0.5g(0.001mol)3,5-二溴-N-(2’-对甲苯磺酰基氧基乙基)苯胺(III)的DMF溶液滴加入上述混合体系中,80℃下搅拌反应20h。将反应液倒入100mL冰水中,用二氯甲烷萃取三次,将所得有机相水洗3次,经无水硫酸钠干燥,减压旋除有机相得粗产品。粗产品经柱色谱分离(展开剂:乙酸乙酯/石油醚=1/3,v/v)得产品3,5-二溴-N-[2’-(8”-喹啉基氧基)乙基]苯胺(IV)0.28g,产率66.4%。1H NMR(CDCl3,400MHz)δ8.99-9.00(d,1H),8.20-8.24(d,1H),7.49-7.54(m,3H),7.16-7.20(t,1H),6.95-6.96(s,1H),6.76-6.77(s,2H),5.48(broad,1H),4.43-4.45(t,2H),3.66-3.68(t,2H);13C NMR(CDCl3,100MHz)δ150.20,149.04,136.74,129.68,126.92,123.44,122.25,121.78,120.90,114.40,111.38,68.15,42.74;MS-ESI for C17H14Br2N2O1(m/z)422.91[M+1]。
实施例6
在装有磁力搅拌的50mL三口瓶中加入10mL DMF和1.06g(0.01mol)碳酸钠,搅拌30min,再加入0.17g(1.2mmol)8-羟基喹啉,继续搅拌30min。然后将10mL溶有0.5g(0.001mol)3,5-二溴-N-(2’-对甲苯磺酰基氧基乙基)苯胺(III)的DMF溶液滴加入上述混合体系中,80℃下搅拌反应20h。将反应液倒入100mL冰水中,用二氯甲烷萃取三次,将所得有机相水洗3次,经无水硫酸钠干燥,减压旋除有机相得粗产品。粗产品经柱色谱分离(展开剂:乙酸乙酯/石油醚=1/3,v/v)得产品3,5-二溴-N-[2’-(8”-喹啉基氧基)乙基]苯胺(IV)0.20g,产率47.4%。1H NMR(CDCl3,400MHz)δ8.99-9.01(d,1H),8.19-8.24(d,1H),7.49-7.56(m,3H),7.18-7.23(t,1H),6.92-6.95(s,1H),6.73-6.76(s,2H),5.51(broad,1H),4.41-4.44(t,2H),3.65-3.68(t,2H);13C NMR(CDCl3,100MHz)δ150.21,149.12,136.85,129.63,126.88,123.24,122.02,121.14,120.84,114.34,111.42,68.18,42.66;MS-ESI for C17H14Br2N2O1(m/z)422.92[M+1]。
实施例7
在装有磁力搅拌的50mL三口瓶中加入10mL DMF和1.12g(0.01mol)叔丁醇钾,搅拌30min,再加入0.17g(1.2mmol)8-羟基喹啉,继续搅拌30min。然后将10mL溶有0.5g(0.001mol)3,5-二溴-N-(2’-对甲苯磺酰基氧基乙基)苯胺(III)的DMF溶液滴加入上述混合体系中,80℃下搅拌反应20h。将反应液倒入100mL冰水中,用二氯甲烷萃取三次,将所得有机相水洗3次,经无水硫酸钠干燥,减压旋除有机相得粗产品。粗产品经柱色谱分离(展开剂:乙酸乙酯/石油醚=1/3,v/v)得产品3,5-二溴-N-[2’-(8”-喹啉基氧基)乙基]苯胺(IV)0.15g,产率35.5%。1H NMR(CDCl3,400MHz)δ8.99-9.00(d,1H),8.19-8.22(d,1H),7.47-7.54(m,3H),7.19-7.24(t,1H),6.92-6.956(s,1H),6.71-6.75(s,2H),5.48(broad,1H),4.42-4.46(t,2H),3.66-3.69(t,2H);13C NMR(CDCl3,100MHz)δ150.22,149.3,136.91,129.78,126.86,123.32,122.06,121.18,120.92,114.32,111.38,68.14,42.52;MS-ESI for C17H14Br2N2O1(m/z)422.91[M+1]。
实施例8
氮气保护下,在装有磁力搅拌器的50mL三口瓶中依次加入0.15g(0.36mmol)3,5-二溴-N-[2’-(8”-喹啉基氧基)乙基]苯胺(IV)、0.18g(0.72mmol)联硼酸频那醇酯和20mL DMF,待完全溶解后再加入0.50g(3.6mmol)碳酸钾和0.015g Pd(dppf)Cl2,加热升温至100℃,搅拌反应8h。反应结束后,将反应液倒入100mL冰水中,用二氯甲烷萃取三次,合并有机相,并水洗三次,经无水硫酸钠干燥,减压旋除有机相得粗产品。粗产品经柱色谱分离(展开剂:乙酸乙酯/石油醚=1/3,v/v)得产品3,5-二(4’,4’,5’,5’-四甲基-1’,3’,2’-二氧杂戊硼基)-N-[2’-(8”-喹啉基氧基)'乙基]苯胺(V)0.08g,产率43.2%。1H NMR(CDCl3,400MHz)δ8.99-9.00(d,1H),8.15-8.18(d,1H),7.67(s,1H),7.43-7.48(m,3H),7.22-7.25(s,2H),7.11(s,1H)4.42-4.45(t,2H),3.81-3.83(t,2H),1.34(s,24H);13C NMR(CDCl3,100MHz)δ154.49,149.21,146.63,140.24,136.16,130.74,129.53,126.73,122.17,121.64,120.11,109.83,83.60,67.98,42.92,24.86;MS-ESI for C29H38B2N2O5(m/z)517.32[M+1]。
实施例9
氮气保护下,在装有磁力搅拌器的50mL三口瓶中依次加入0.15g(0.36mmol)3,5-二溴-N-[2’-(8”-喹啉基氧基)乙基]苯胺(IV)、0.27g(1.08mmol)联硼酸频那醇酯和20mL DMSO,待完全溶解后再加入0.38g(3.6mmol)碳酸钠和0.015g Pd(dppf)Cl2,加热升温至100℃,搅拌反应18h。反应结束后,将反应液倒入100mL冰水中,用二氯甲烷萃取三次,合并有机相,并水洗三次,经无水硫酸钠干燥,减压旋除有机相得粗产品。粗产品经柱色谱分离(展开剂:乙酸乙酯/石油醚=1/3,v/v)得产品3,5-二(4’,4’,5’,5’-四甲基-1’,3’,2’-二氧杂戊硼基)-N-[2’-(8”-喹啉基氧基)'乙基]苯胺(V)0.09g,产率48.6%。1H NMR(CDCl3,400MHz)δ8.96-8.99(d,1H),8.14-8.17(d,1H),7.71(s,1H),7.44-7.48(m,3H),7.21-7.24(s,2H),7.12(s,1H)4.42-4.46(t,2H),3.80-3.83(t,2H),1.35(s,24H);13C NMR(CDCl3,100MHz)δ154.46,149.31,146.28,140.34,136.24,130.53,129.63,126.85,122.23,121.58,120.24,109.55,83.61,67.96,42.89,24.88;MS-ESI for C29H38B2N2O5(m/z)517.36[M+1]。
实施例10
氮气保护下,在装有磁力搅拌器的50mL三口瓶中依次加入0.15g(0.36mmol)3,5-二溴-N-[2’-(8”-喹啉基氧基)乙基]苯胺(IV)、0.37g(1.44mmol)联硼酸频那醇酯和20mL 1,4-二氧六环,待完全溶解后再加入0.35g(3.6mmol)乙酸钾和0.015g Pd(dppf)Cl2,加热升温至100℃,搅拌反应18h。反应结束后,将反应液倒入100mL冰水中,用二氯甲烷萃取三次,合并有机相,并水洗三次,经无水硫酸钠干燥,减压旋除有机相得粗产品。粗产品经柱色谱分离(展开剂:乙酸乙酯/石油醚=1/3,v/v)得产品3,5-二(4’,4’,5’,5’-四甲基-1’,3’,2’-二氧杂戊硼基)-N-[2’-(8”-喹啉基氧基)'乙基]苯胺(V)0.12g,产率64.9%。1H NMR(CDCl3,400MHz)δ8.97-8.99(d,1H),8.14-8.18(d,1H),7.73(s,1H),7.42-7.48(m,3H),7.20-7.24(s,2H),7.15(s,1H)4.43-4.46(t,2H),3.80-3.84(t,2H),1.34(s,24H);13C NMR(CDCl3,100MHz)δ154.44,149.32,146.21,140.30,136.22,130.57,129.64,126.81,122.26,121.59,120.23,109.56,83.63,67.97,42.86,24.84;MS-ESI for C29H38B2N2O5(m/z)517.33[M+1]。
实施例11
氮气保护下,在装有磁力搅拌器的50mL三口瓶中,依次加入0.10g(0.2mmol)3,5-二(4’,4’,5’,5’-四甲基-1’,3’,2’-二氧杂戊硼基)-N-[2’-(8”-喹啉基氧基)'乙基]苯胺(V)、0.092g(0.2mmol)4,7-二(5-溴-2-噻吩基)-2,1,3-苯并噻二唑和15mL甲苯,搅拌至完全溶解。再将3mL溶有0.11g(0.8mmol)碳酸钾的水溶液和0.015g Pd(PPh3)4加入上述混合体系中,100℃下搅拌反应48h。反应结束后,将反应液倒入100mL冰水中,用三氯甲烷萃取三次,合并有机相,并水洗三次,经无水硫酸钠干燥,减压浓缩有机相至1~2mL,倒入甲醇中沉降,离心,所得固体重新溶剂在三氯甲烷中,重复沉降、离心两次,真空干燥得到聚合物(I)0.0722g,产率65.2%。1H NMR(CDCl3,400MHz)δ8.98-9.01(d,1H),8.15-8.19(d,1H),7.76(s,1H),7.88-7.92(d,2H),7.41-7.46(m,3H),7.20-7.28(m,6H),7.12(s,1H)4.49-4.53(t,2H),3.74-3.77(t,2H);13C NMR(CDCl3,100MHz)δ156.34,154.44,148.12,147.68,142.56,140.22,139.65,138.61,136.71,131.33,129.64,128.28,127.15,126.11,122.78,121.89,120.23,111.66,107.56,1.5.32,68.12,43.26;Mn=9786,Mw=17532,PDI=1.79。
实施例12
氮气保护下,在装有磁力搅拌器的50mL三口瓶中,依次加入0.12g(0.24mmol)3,5-二(4’,4’,5’,5’-四甲基-1’,3’,2’-二氧杂戊硼基)-N-[2’-(8”-喹啉基氧基)'乙基]苯胺(V)、0.092g(0.2mmol)4,7-二(5-溴-2-噻吩基)-2,1,3-苯并噻二唑和15mL DMF,搅拌至完全溶解。再将3mL溶有0.085g(0.8mmol)碳酸钠的水溶液和0.015g Pd(PPh3)4加入上述混合体系中,100℃下搅拌反应36h。反应结束后,将反应液倒入100mL冰水中,用三氯甲烷萃取三次,合并有机相,并水洗三次,经无水硫酸钠干燥,减压浓缩有机相至1~2mL,倒入甲醇中沉降,离心,所得固体在溶剂在三氯甲烷中,重复沉降、离心两次,真空干燥得到聚合物(I)0.0692g,产率61.6%。1H NMR(CDCl3,400MHz)δ8.99-9.02(d,1H),8.13-8.18(d,1H),7.74(s,1H),7.86-7.91(d,2H),7.42-7.46(m,3H),7.21-7.28(m,6H),7.15(s,1H)4.48-4.53(t,2H),3.73-3.77(t,2H);13C NMR(CDCl3,100MHz)δ156.38,154.42,148.22,147.55,142.54,140.26,139.61,138.42,136.12,131.18,129.46,128.24,127.18,126.14,122.72,121.88,120.21,111.61,107.52,1.5.33,68.22,43.28;Mn=10234,Mw=16890,PDI=1.65。
实施例13
氮气保护下,在装有磁力搅拌器的50mL三口瓶中,依次加入0.12g(0.24mmol)3,5-二(4’,4’,5’,5’-四甲基-1’,3’,2’-二氧杂戊硼基)-N-[2’-(8”-喹啉基氧基)'乙基]苯胺(V)、0.092g(0.2mmol)4,7-二(5-溴-2-噻吩基)-2,1,3-苯并噻二唑和15mL甲苯,搅拌至完全溶解。再将3mL溶有0.078g(0.8mmol)乙酸钾的水溶液和0.015g Pd(PPh3)4加入上述混合体系中,100℃下搅拌反应24h。反应结束后,将反应液倒入100mL冰水中,用三氯甲烷萃取三次,合并有机相,并水洗三次,经无水硫酸钠干燥,减压浓缩有机相至1~2mL,倒入甲醇中沉降,离心,所得固体重新溶解在三氯甲烷中,重复沉降、离心两次,真空干燥得到聚合物(I)0.0651g,产率58.1%。1H NMR(CDCl3,400MHz)δ8.96-8.99(d,1H),8.15-8.18(d,1H),7.77(s,1H),7.87-7.92(d,2H),7.41-7.45(m,3H),7.22-7.29(m,6H),7.16(s,1H)4.48-4.53(t,2H),3.74-3.78(t,2H);13C NMR(CDCl3,100MHz)δ156.35,154.47,148.16,147.69,142.58,140.24,139.68,138.66,136.74,131.41,129.58,128.34,127.18,126.21,122.54,121.74,120.12,111.56,107.42,1.5.22,68.18,43.32;Mn=10520,Mw=18412,PDI=1.93。
实施例14
配制0.1mg/mL的聚合物(1)的DMSO溶液100mL,并通过稀释的方法配制10mL 0.01mg/mL的测试液。准确移取2.0mL上述测试液加入荧光杯中,在HITACHI F-4600荧光仪上测定,激发和发射狭缝宽度分别为5nm和10nm。最大激发波长为435nm,最大发射波长为610nm,测试在室温和外界大气压下进行。同样通过稀释的方法配制0.04mg/mL的聚合物(I)的DMSO溶液10mL。准确移取2.0mL加入紫外杯中,然后在HITACHI UH5300紫外吸收仪上测定,最大紫外吸收峰为490nm,测试归一化结果如图1。
实施例15
在氮气保护下通过PerkineElmer Pyris 1TGA进行热重分析(TGA)(5%重量损失时的温度)得到分解温度为228℃,升温速率都为5℃/min;采用DSC-Q10仪器进行该材料的差示扫描量热(DSC)得到玻璃化温度为135℃,测量结果如图2。
实施例16
配制0.1mg/mL的聚合物(1)的乙腈溶液100mL,并通过稀释的方法配制10mL 0.04mg/mL的测试液。然后准确移取4.0mL上述溶液加入10.0mL烧杯中,在三电极系统AUTOLAB(model PGSTAT30)中测该化合物的循环伏安曲线,参比电极为饱和甘汞电极,支持电解质为0.10mol/L的四丁基高氯酸盐,室温下扫描数度为50mV/s。测量结果如图3。
- 还没有人留言评论。精彩留言会获得点赞!