金黄色葡萄球菌分选酶A高效突变体的制作方法
本发明涉及生物工程领域的蛋白酶定向进化,特别涉及通过构建高通量的筛选平台,进化得到了金黄色葡萄球菌分选酶A的突变体,其可以高效的催化LPXTG与α-Gly或α-Glyn之间的连接反应。
背景技术:
金黄色葡萄球菌分选酶A(Sa-SrtA)是革兰氏阳性菌中普遍存在的一类半胱氨酸转肽酶,典型的,其可以催化底物LPXTG(X代表任意氨基酸)与α-Glyn(寡聚甘氨酸)之间的连接反应,这一反应因此被命名为分选酶介导的连接反应(Sortase-Mediated Ligation,SML)。同时,分选酶A还可以催化LPXTG与α-Gly之间的反应,然而,相对于其催化α-Glyn的反应,反应活性更低。
利用分选酶介导的连接反应,可以实现各种蛋白质的定点标记与偶合,进而应用于生命科学的基础研究以及制药行业。然而,由于野生型分选酶A催化效率较低,基于高通量筛选的定向进化以及理性设计的方法提升分选酶A的活性成为一种必要。前人的研究中也发现了5个点突变P94R/D160N/D165A/K190E/K196T(Chen I.et al.ProcNatl AcadSci USA 2011,108,11399-11404),可以在一定程度上提升其活性。
野生型金黄色葡萄球菌分选酶A是一个包含206个氨基酸残基的蛋白酶,是在前人的研究中发现,截掉氮端25个氨基酸残基的截短体可以在大肠杆菌中高水平、可溶性的表达(Ton-That H.et al.ProcNatl AcadSci USA 1999,96,12424–12429),因此在研究中分选酶A基本上都以这种截短体的形式存在,本发明涉及的高效突变体描述的也是这种截短体的突变体。
技术实现要素:
本发明的技术目的是提供催化LPXTG与α-Gly反应活性更高的金黄色葡萄球菌分选酶A突变体,同时这些突变体也可以进一步提升LPXTG与α-Glyn之间反应的活性。本发明构建了基于两个荧光蛋白的荧光共振能量转移的筛选平台,以野生型金黄色葡萄球菌分选酶A及其P94R/D160N/D165A/K190E/K196T突变体分别作为出发分选酶1和2,分别进行了定向进化和理性设计,最终构建得到活性更高的分选酶A突变体,使其可以更好的催化LPXTG与α-Gly或α-Glyn之间的连接反应。
本发明得到的分选酶A突变体既可以提升已知分选酶A催化LPXTG与非典型底物α-Gly之间反应的效率,同时又可以提升其催化LPXTG与典型底物α-Glyn之间反应的效率。
本发明所获得的分选酶A突变体活性的提高,以测定的动力学常数Kcat,KmLPETG和KmGGG或KmGAG进行表征,其中,Kcat代表反应的速率,KmLPETG、KmGGG和KmGAG分别代表酶对底物LPETG、GGG和GAG的识别效率。
具体的,本发明所提供的分选酶A突变体包含下述突变中的一种或多种:D124G、Y187L、E189R和F200L。
本发明提供的分选酶A突变体还可以包含下述突变中的一种或多种:P94R、D160N、D165A、K190E和K196T。
本发明优选的分选酶A突变体是下述突变体之一:
突变体1:P94R/D124G/D160N/D165A/K190E/K196T
突变体2:P94R/D160N/D165A/Y187L/E189R/K190E/K196T
突变体3:P94R/D124G/D160N/D165A/Y187L/E189R/K190E/K196T
突变体4:D124G/Y187L/E189R/F200L
突变体5:P94R/D124G/D160N/D165A/Y187L/E189R/K190E/K196T/F200L
下面的表1给出了野生型分选酶A已知突变体P94R/D160N/D165A/K190E/K196T(出发分选酶2)及突变体4和5催化LPXTG与α-Gly的连接反应的动力学常数Kcat,KmLPETG和KmGAG;表2给出了野生型分选酶A、出发分选酶2及上述五种突变体催化LPXTG与α-Glyn的连接反应的动力学常数Kcat,KmLPETG和KmGGG,以Kcat/KmLPETG指示催化效率,可以看出各个突变体的效率都有大幅度的提升。
表1
表2
本发明通过定向进化和理性设计相结合的方法构建得到催化活性提高的分选酶A突变体,由野生型金黄色葡萄球菌分选酶A的基因(GenBank登录号:BA000018,ORFID:SA2316)及一种已知突变体(P94R/D160N/D165A/K190E/K196T)的基因出发,运用易错PCR和位点饱和突变得到分选酶A突变文库,再利用构建的基于荧光共振能量转移的筛选平台,经过多轮的筛选以及突变的整合得到一系列进化的分选酶A突变体,在突变的氨基酸序列中包含了D124G,Y187L,E189R,F200L和已知突变中的一个或多个突变。
本发明实施例在原核表达系统中表达的分选酶A及其突变体是其截去氮端25个氨基酸残基的截短体形式,其中:包含有6个突变位点的分选酶A突变体1的氨基酸序列如序列表中SEQ ID NO.1所示;包含有7个突变位点的分选酶A突变体2的氨基酸序列如序列表中SEQ ID NO.2所示;包含有8个突变位点的分选酶A突变体3的氨基酸序列如序列表中SEQ ID NO.3所示;包含有4个突变位点的分选酶A突变体4的氨基酸序列如序列表中SEQ ID NO.4所示;包含有9个突变位点的分选酶A突变体5的氨基酸序列如序列表中SEQ ID NO.5所示。序列表中SEQ ID NO.1至SEQ ID NO.5均各自包含181个氨基酸残基,对应于野生型金黄色葡萄球菌分选酶A的第26至206位氨基酸残基序列,上述突变位点也是相对于全长野生型金黄色葡萄球菌分选酶A而言。
序列表中SEQ ID NO.1至SEQ ID NO.5所示氨基酸序列对应的基因序列依次可以分别如SEQ ID NO.6至SEQ ID NO.10所示,当然,根据密码子的简并性,也可以是利用同一氨基酸的不同密码子而获得的编码相同蛋白质的其他核苷酸序列。
含有这些基因序列的载体、细胞和宿主菌也在本发明的保护范围内。
本发明利用构建的筛选平台,对通过易错PCR及位点饱和突变的方法构建的金黄色葡萄球菌分选酶A的基因突变文库进行了高通量筛选,得到了催化效率有很大提高的突变体,其催化LPXTG与典型底物α-Glyn以及非典型底物α-Gly的效率都有了很大提升。
附图说明
图1显示了基于荧光共振能量转移原理的分选酶A筛选平台的构建原理。
图2显示了筛选平台指示分选酶A活性的效果。
图3显示了位点突变对于分选酶A活性的影响。
图4显示了野生型及突变体分选酶A催化LPXTG与α-Gly反应的动力学常数Kcat,KmLPETG与KmGAG。
图5显示了野生型及突变体分选酶A催化LPXTG与α-Glyn反应的动力学常数Kcat与KmLPETG。
图6显示了野生型及突变体分选酶A催化LPXTG与α-Glyn反应的动力学常数KmGGG。
具体实施方式
实施例中涉及的培养基配方如下:
LB液体培养基:蛋白胨1%,酵母提取物0.5%,NaCl 1%,pH7.4。
实施例1、利用易错PCR构建金黄色葡萄球菌分选酶A随机突变文库
利用易错PCR在体外向金黄色葡萄球菌分选酶A基因引入核苷酸突变,易错PCR具体条件如下:
PCR模板是包含野生型金黄色葡萄球菌分选酶A基因的质粒,本质粒通过将野生型分选酶A的基因(Ton-That H.et al.ProcNatl AcadSci USA 1999,96,12424–12429)出发,利用亚克隆将第26位到206位的氨基酸序列对应的核苷酸序列克隆入pet28a载体的NdeI和XhoI酶切位点之间得到。
上游引物:5’-GGAATTCCATATGAAACCACATATCGATAATTATC-3’(SEQ ID NO.11)
下游引物:5’-GGTAGGCACTCGAGTTATTTGACTTCTGTAGCTAC-3’(SEQ ID NO.12)
PCR扩增条件:95℃5min;95℃1min,55℃1min,72℃1min,30个循环;72℃10min。
易错PCR扩增产物经PCR产物纯化试剂盒纯化,限制性内切酶NdeI和XhoI分别对PCR产物和pet28a载体进行酶切,连接,转化至大肠杆菌DH10B,涂布于含有100μg/mL卡那霉素的LB平板,37℃培养箱生长12小时后,收取全部克隆,稀释至液体LB培养基中继续生长,12小时后提取质粒,得到突变文库。将得到的质粒转化至大肠杆菌BL21(DE3),37℃培养箱生长12小时后,得到突变文库的表达菌,待用。
实施例2、点突变PCR构建金黄色葡萄球菌分选酶A位点饱和突变文库
利用点突变PCR的方法向分选酶A的P94R/D160N/D165A/K190E/K196T突变体的两个位点Tyr187和Glu189引入饱和突变,PCR条件如下:
PCR模板是出发分选酶2的基因,通过将实施例1中含有野生型分选酶A基因的pet28a质粒突变所得到。
上游引物:5’-CATTAATTACTTGTGATGATNNKAATNNKGAGACAGGCGTTTGGG-3’(SEQ ID NO.13)
下游引物:5’-CCCAAACGCCTGTCTCMNNATTMNNATCATCACAAGTAATTAATG-3’(SEQ ID NO.14)
上述引物中,N代表A、C、G、T四种碱基中的一种,K代表G或T,M代表A或C。
PCR扩增条件:95℃5min;95℃45s,55℃45s,72℃7min,23个循环;72℃10min。
点突变PCR产物经DpnI酶切,转化于大肠杆菌DMT菌株中,涂布于含有100μg/mL卡那霉素的LB平板,37℃培养箱生长12小时后,收取全部克隆,稀释至液体LB培养基中继续生长,12小时后提取质粒,得到双位点的饱和突变文库。将得到的质粒转化至大肠杆菌BL21(DE3),37℃培养箱生长12小时后,得到饱和突变文库的表达菌,待用。
实施例3、基于荧光共振能量转移的筛选系统构建及验证
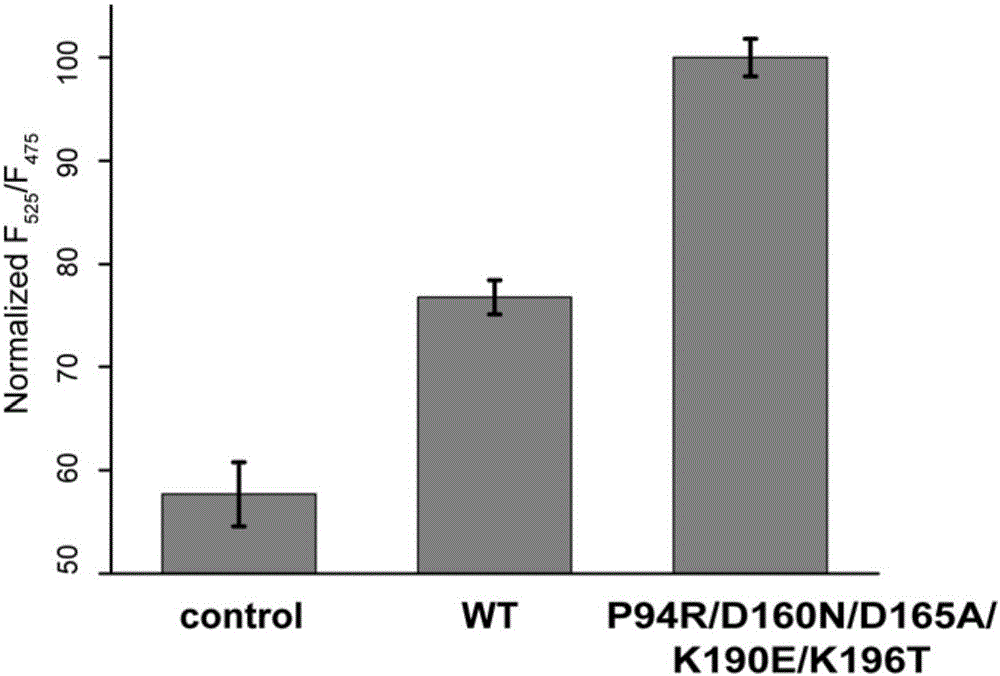
利用亚克隆的方法分别在pet28a载体上融合表达eGFP-LPETG和G-cpV的荧光蛋白,利用6×His标签进行纯化,纯化得到的蛋白进行分选酶介导的连接反应,如图1所示,EGFP和cpV蛋白是合适的荧光共振能量转移(FRET)供体和受体,当分选酶A介导两个蛋白之间的连接反应时,由于两个蛋白距离的拉近,两个蛋白之间的荧光共振能量转移效率提升,分选酶活性越高,则荧光功能能量转移效率越高。利用野生型分选酶A和出发分选酶2对筛选平台进行验证,证明了分选酶A活性与荧光共振能量转移效率成正比,如图2所示。
实施例4、高催化活性分选酶A突变体的筛选
挑取实施例1和2构建的基因文库,在含有1ml LB(含100μg/ml卡那霉素)培养基的深孔96孔板中,37℃摇床中过夜培养,1:100转接到新的深孔96孔板中,37℃摇床培养至OD600达0.6左右,加入1mM IPTG诱导,37℃继续培养3小时。4700rmp离心10分钟,弃上清,每孔加入200μL裂解液(30mM Tris,150mM NaCl,5mM CaCl2,1%Triton X-100,0.15mg/mL溶菌酶),37℃摇床裂解2小时,离心去除细胞碎片,得到细胞裂解液。200μL反应体系中加入50μL细胞裂解液,100μM eGFP-LPETG-His6,200μM G-cpV,37℃反应2小时。利用酶标仪,435nm激发,收取475nm和525nm荧光,通过525nm和475nm荧光强度比值代表不同的荧光共振能量转移效率,从而得到不同催化效率的突变体。如图3所示,本发明得到了四个可以提升分选酶A活性的突变,包含D124G,Y187L,E189R和F200L。将这四个突变中的一个或多个突变与出发分选酶2的五个突变进行整合,得到最终的突变体。
实施例5、金黄色葡萄球菌分选酶A活性测定
金黄色葡萄球菌分选酶A活性测定依据文献的方法(Kruger R.G.;Dostal P;McCafferty D.G.Anal Biochem 2004,326:42–48),不同的是,测定LPXTG与α-Glyn反应的动力学常数,以GGG作为反应底物;测定LPXTG与α-Gly反应的动力学常数,以GAG作为反应底物。如图4所示,以Abz-LPETGK(Dnp)-CONH2和GAG作为底物进行测定,突变体分选酶A催化LPETG与α-Gly反应的活性(Kcat/KmLPETG)相对于野生型得到了约7~79倍不同的提升,最好的突变体相对于出发分选酶2也有大于5倍的提升,同时其对于GAG的识别(KmGGG)也有1.3倍左右的提升。如图5和6所示,以Abz-LPETGK(Dnp)-CONH2和GGG作为底物进行测定,可以看出相对于野生型分选酶A,突变体分选酶A催化LPETG与α-Glyn反应的活性(Kcat/KmLPETG)相对于野生型得到了20~245倍不同的提升,最好的突变体相对于出发分选酶2也有近11倍的提升,同时其对于GGG的识别(KmGGG)也有2倍左右的提升。
- 还没有人留言评论。精彩留言会获得点赞!