亲和配基、构建方法、亲和层析介质、制备方法及应用与流程
本发明属于蛋白纯化领域,涉及一种经改造的NpuDnaE-N端剪接结构域(IN)形成的亲和配基,以及通过其C端与层析微球共价交联构建出一种新型蛋白亲和纯化的层析介质。目标蛋白只需在分子水平上构建于IC的C端并与IC融合表达,通过在体外IC与IN的亲和结合以及控制条件诱导断裂,即可实现目的蛋白的纯化。
背景技术:
纯化标签的应用极大的简化了重组蛋白纯化的过程,对于现代生物技术有着不可估量的应用价值。但是,目标蛋白中引入的亲和纯化标签必须经过蛋白酶水解或化学裂解试剂的处理才能除去。因此,在大规模生产中,除去纯化标签问题制约着纯化标签的广泛应用。为解决这种问题,人们发明了无需使用蛋白酶的内含肽介导的自发断裂纯化标签。
内含肽(又称蛋白质内含子,intein)是前体未成熟蛋白中的一段多肽链,它通过一系列重排、转酯、环化等自我催化的反应过程,可以从前体蛋白中切除并将两端的蛋白多肽链(蛋白质外显肽,extein)通过一个天然肽键连接。断裂内含肽是在结构上N端区域(IN)和C端区域(IC)相互分离的一种内含肽。当IN和IC两个片段连接恢复结构后可按照标准内含肽剪接途径完成两端外显肽的拼接。断裂内含肽的剪接活性是通过IN和IC的亲和结合而产生的,两者具有极强的相互识别能力,这是内含肽应用于亲和纯化系统的基础。
一般来说,内含肽会在还原剂存在的条件下自发进行N-/C-端断裂反应,将一端的目标蛋白切割下来。由于这一系列的反应可以在体外、不需要酶的作用自发进行,因此,利用断裂内含肽途径进行蛋白质表达纯化,能在有效纯化的同时除去纯化的同时除去纯化标签。
尽管断裂内含肽在蛋白纯化方面是值得肯定的,但在其应用过程中也存在一些不足。首先,IN是通过纯化标签与介质间的亲和吸附而固定到层析微球上的,一旦溶液条件改变(pH、温度或者还原剂),亲和标签极有可能从介质上脱落,造成目的蛋白的二次污染;另外,内含肽的断裂反应速率及对断裂反应速率的控制存在问题。有些内含肽的断裂反应速率较慢(12h以上),这会延长纯化过程的时间,降低纯化效率。但快速断裂的内含肽,如NpuDnaE,对其断裂反应的有效抑制存在问题,这会导致目标蛋白在清洗杂蛋白阶段的流失,降低纯化效率。
Zhilei Chen等人通过研究IN与IC之间的相互作用模式发现,目标蛋白与介质之间的空间位阻可能会影响断裂内含肽的剪切活性。根据空间位阻的作用原理,本发明的实验研究中发现,用于纯化亲和配基片段IN和IC与目标蛋白的融合表达片段的His-tag的位置也会影响断裂反应的速率。对于断裂内含肽介导的亲和纯化系统,提高系统纯化效率的关键不仅在于提高断裂反应的速率,也在于上样和清洗杂蛋白阶段能够抑制断裂反应。研究发现,仅在NpuDnaE的首位氨基酸为Cys的情况下,Zn2+能够与内含肽NpuDnaE中的特定位点结合从而抑制断裂反应的进行。因此,本发明在未对NpuDnaE的首位氨基酸进行突变的前提下,在上样和清洗杂蛋白阶段加入Zn2+有效抑制了提前断裂,从而提高系统的纯化效率。
技术实现要素:
本部分的目的在于概述本发明的实施例的一些方面以及简要介绍一些较佳实施例。在本部分以及本申请的说明书摘要和发明名称中可能会做些简化或省略以避免使本部分、说明书摘要和发明名称的目的模糊,而这种简化或省略不能用于限制本发明的范围。
鉴于上述和/或现有针亲和配基及用途中存在的问题,提出了本发明。
因此,本发明其中一个目的是提供一种经改造的NpuDnaE N端剪接结构域(IN)形成的亲和配基。
为解决上述技术问题,根据本发明的一个方面,本发明提供了如下技术方案:一种亲和配基重组IN*蛋白,所述亲和配基的构建是在对NpuDnaE-N,即天然IN的结构进行改造的基础上进行的;其中,天然IN的C端添加一个半胱氨酸,用于与层析微球的共价结合;天然IN的N端首位氨基酸引入突变Cys1Ala,避免N端断裂反应的发生;His-tag置于天然IN片段的N端,用于纯化配基片段。
作为本发明所述亲和配基的一种优选方案,其中:所述天然NpuDnaE基因序列模板如序列表SEQ ID No.3所示。
作为本发明所述亲和配基的一种优选方案,其中:所述His-tag置于天然IN片段的N端,突变Cys1Ala,天然IN的C端添加一个半胱氨酸,其基因序列如序列表SEQ ID No.4所示,其蛋白质序列如序列表SEQ ID No.6所示。
本发明其中另一个目的是提供一种亲和配基的构建方法。
为解决上述技术问题,根据本发明的另一个方面,本发明提供了如下技术方案:对天然断裂型内含肽NpuDnaE的N端剪接结构域进行分子改造,改造后的IN片段命名为IN*,包括,在天然IN的C端添加一个Cys;在IN片段的N端添加His-tag序列;在引物中添加Nde I、Hind III两个酶切位点并利用其将IN*片段插入表达载体pET28a,获得的蛋白即为亲和配基片段。
作为本发明所述亲和配基的构建方法的一种优选方案,其中:所述引物,其中,IN*序列改造的上、下游引物基因序列分别如序列表SEQ ID No.1和SEQ ID No.2所示。
作为本发明所述亲和配基的构建方法的一种优选方案,其中:还包括,重组菌的构建,以pRSFDuet-1-NpuDnaE质粒为模板进行PCR,获得改造后的片段IN*,利用载体pMD19-T构建重组质粒pMD19-T-IN*,转化感受态E.coli JM109,然后利用Nde I和Hind III两个酶切位点将构建好的IN*序列与表达质粒pET-21b进行酶切连接,得到重组表达质粒pET-21b-IN*,最后转化感受态E.coli BL21(DE3),得到改造后的重组IN*表达菌株E.coli BL21(DE3)/pET-21b-IN*;NpuDnaEIN*的表达纯化,对重组菌E.coli BL21(DE3)/pET-21b-IN*进行诱导表达,获得改造后的重组IN*蛋白。
作为本发明所述亲和配基的构建方法的一种优选方案,其中:与重组IN*蛋白相配对的IC-GFP片段的基因序列和蛋白质序列如序列表SEQ ID No.5和SEQ ID No.7所示。
本发明再一个目的是提供一种以上述亲和配基偶联得到亲和层析介质。
为解决上述技术问题,根据本发明的再一个方面,本发明提供了如下技术方案:一种利用亲和配基偶联得到的亲和层析介质,其以IN*片段为亲和配基,通过活化中间臂共价偶联到琼脂糖微球,形成对IC融合蛋白具有亲和作用的亲和层析介质,其结构为琼脂糖微球-活化中间臂-IN*亲和配基:
本发明第四个目的是提供一种以上述亲和配基偶联得到亲和层析介质的方法。
为解决上述技术问题,根据本发明的第四个方面,本发明提供了如下技术方案:一种利用亲和配基的偶联制备方法,以IN*片段为亲和配基,通过共价偶联到琼脂糖微球,形成对IC融合蛋白具有亲和作用的亲和层析介质,包括,使用双环氧化合物1,4-丁二醇二缩水甘油醚对含有羟基的琼脂糖进行活化,得到含一长亲水链的活化环氧琼脂糖;所述活化环氧琼脂糖上的环氧乙烷基团与IN*片段C端Cys的巯基反应,将亲和配基片段IN*与活化后的琼脂糖介质进行偶联得到亲和层析介质。
本发明还一个目的是提供一种上述亲和层析介质的应用,其是将亲和层析介质装柱;用含有1mmol/L Zn2+的PBS缓冲液进行平衡;将含有目的蛋白的IC融合蛋白粗样进行上样;用不含Zn2+的PBS缓冲液进行清洗;用含有50mmol/L DTT的断裂缓冲液冲洗层析介质,室温下静置3h;用洗脱缓冲液洗脱断裂后的目标蛋白并进行收集;IN*亲和层析柱进行再生。
本发明所具有的有益效果:本发明依靠内含肽自身的断裂反应完成,既降低成本又可防止对目标蛋白的污染;本发明在还原剂存在的条件下3h的断裂率依然很高,并且,本发明构建的亲和纯化介质具有较好的纯化效果和较高的重复利用率。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其它的附图。其中:
图1是本发明断裂内含肽NpuDnaE-N端亲和配基及其构成的亲和纯化系统说明图;
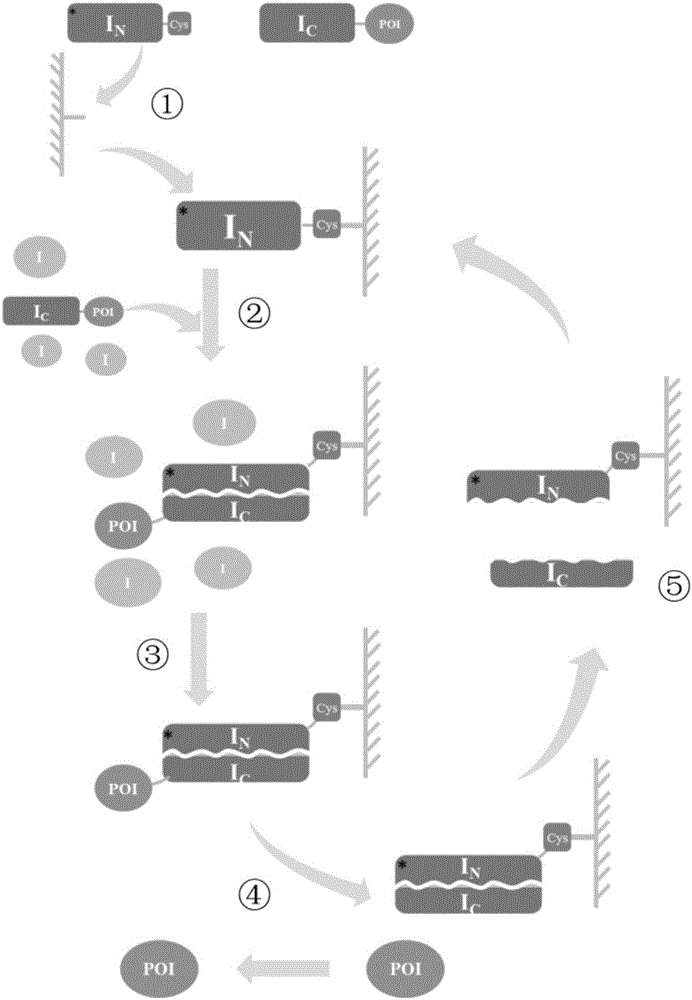
图2是本发明IN*亲和层析介质的亲和纯化流程图,其中,①表示亲和层析介质的制备,②表示上样,③表示清洗杂蛋白,④表示诱导断裂和洗脱,⑤表示亲和层析介质的再生;
图3是本发明IN*亲和层析柱对目标蛋白纯化过程图,其中1表示上样,2表示不含Zn2+的Buffer A清洗,3表示加入断裂缓冲液并维持5h,4表示用洗脱缓冲液洗脱;
图4是本发明IN*亲和层析柱对目标蛋白纯化效率的SDS-PAGE验证图,其中,1表示蛋白Marker,2表示IC-GFP片段粗样品,3表示图3中A阶段的样品穿透液,4表示图3中B阶段的样品,5表示图3中C阶段的洗脱样品,6表示Buffer D洗脱样品;
图5是本发明IN*亲和层析柱的重复利用效率折线图。
具体实施方式
为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合说明书附图对本发明的具体实施方式做详细的说明。
在下面的描述中阐述了很多具体细节以便于充分理解本发明,但是本发明还可以采用不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似推广,因此本发明不受下面公开的具体实施例的限制。
其次,此处所称的“一个实施例”或“实施例”是指可包含于本发明至少一个实现方式中的特定特征、结构或特性。在本说明书中不同地方出现的“在一个实施例中”并非均指同一个实施例,也不是单独的或选择性的与其他实施例互相排斥的实施例。
本发明设计了一种经改造的NpuDnaE的N端剪接结构域(IN*)形成的亲和配基,通过其C端与层析微球共价交联构建出一种新型蛋白亲和纯化的层析介质。目标蛋白只需在分子水平上构建于IC的C端(相当于亲和标签的作用)并与IC融合表达,通过在体外IC与IN的亲和结合以及控制条件诱导下的剪接反应即可实现目的蛋白的纯化。
亲和配基片段的构建是在对NpuDnaE-N(IN)的结构进行改造的基础上进行的。在IN的C端添加一个半胱氨酸,用于与层析微球的共价结合;在天然IN的N端首位氨基酸引入突变Cys1Ala,避免N端断裂反应的发生;将用于纯化配基片段的His-tag置于IN片段的N端。
所述的经改造的NpuDnaE N端剪接结构域亲和配基的构建方法的步骤为:
步骤一:引物设计
本发明对天然断裂型内含肽NpuDnaE的N端剪接结构域进行分子改造。改造后的IN片段命名为IN*,改造的内容为在天然IN的C端添加一个Cys,并在IN片段的N端添加His-tag序列。由于改造的位点位于目标片段的两端,因此可以直接通过设计引物完成对IN片段的改造。在引物中添加Nde I、Hind III两个酶切位点并利用其将IN*片段插入表达载体pET21b,经这种方式表达获得的蛋白即为所需的亲和配基片段。
步骤二:重组菌的构建
本发明根据步骤一所设计的引物,以pRSFDuet-1-NpuDnaE质粒为模板进行PCR,获得改造后的IN片段IN*,利用载体pMD19-T构建重组质粒pMD19-T-IN*,转化感受态E.coli JM109进行甘油冻管保藏。然后利用Nde I和Hind III两个酶切位点将构建好的IN*序列与表达质粒pET-21b进行酶切连接,得到重组表达质粒pET-21b-IN*,最后转化感受态E.coli BL21(DE3),得到改造后的重组IN*表达菌株E.coli BL21(DE3)/pET-21b-IN*,制备甘油冻管保藏备用;
步骤三:NpuDnaEIN*的表达纯化
本发明使用IPTG对步骤(2)所构建的重组菌E.coli BL21(DE3)/pET-21b-IN*进行诱导表达,获得改造后的重组IN*蛋白。利用Ni亲和层析柱获得纯化的IN*,用于与层析微球的交联。
步骤四:IN*作为配基的亲和层析介质的制备
使用双环氧化合物1,4-丁二醇二缩水甘油醚(BDCE)对含有羟基的琼脂糖进行活化,可以得到含一长亲水链的活化环氧琼脂糖。活化琼脂糖上的环氧乙烷基团与IN*片段C端Cys的巯基(-SH)反应,将亲和配基片段IN*与活化后的琼脂糖介质进行偶联得到对IC融合蛋白具有亲和作用的亲和层析介质。
(1)引物设计
实施例1
使用PCR技术对天然断裂型内含肽NpuDnaE的N端剪接结构域进行分子改造,并将改造后的IN片段命名为IN*。根据GeneBank提供的基因序列,利用分子生物学软件Primer Premier 5设计IN*的正向引物S’-N和反向引物A’-N:
S’-N:GGAATTCCATATGCATCATCATCATCATCACGCATTAAGCTATGAAACGGAAA
A’-N:CCCAAGCTTTTAACAATTCGGCAAATTATCAAC
正向引物和反向引物分别引入Nde I和Hind III酶切位点,其中斜体部分为酶切位点,S’-N下划线部分为添加的His tag标签和IN首位氨基酸Cys1Ala的突变,A’-N下划线部分为添加的一个半胱氨酸和一个终止密码子。将所设计的引物交由生工生物工程(上海)股份有限公司合成。
(2)重组载体pMD19-T-IN*的构建
实施例2
提取质粒pRSFDuet-1-NpuDnaE,利用实施例1设计的S’-N、A’-N为引物,质粒pRSFDuet-1-NpuDnaE为模板,利用ExTaq DNA聚合酶对IN*序列进行PCR。按照ExTaq DNA聚合酶说明书,选择50μL体系进行。
PCR反应条件:预变性94℃反应5min;变性94℃反应30s,退火温度46℃反应30s,延伸温度72℃延伸30s,进行30个循环;最后72℃保持10min。
利用琼脂糖凝胶回收试剂盒回收IN*片段,得到两端各带有一个腺嘌呤的IN*序列,利用碱基互补配对原则将IN*序列连接到T载体pMD19-T上,得到重组质粒pMD19-T-IN*。将重组质粒转化感受态细胞E.coli JM109,得到重组菌E.coli JM109/pMD19-T-IN*进行甘油冻管保藏备用。
(3)重组载体pET-21b-IN*的构建
实施例3
过夜培养实验室保藏菌株E.coli JM109/pMD19-T-IN*,提取质粒,然后利用限制性内切酶Nde I和Hind III对质粒pMD19-T-IN*进行酶切,将酶切产物胶回收后进行连接,得到重组表达质粒pET-21b-IN*,最后转化感受态E.coli BL21(DE3),得到改造后的重组IN*表达菌株E.coli BL21(DE3)/pET-21b-IN*,制备甘油冻管保藏备用。
(4)NpuDnaEIN*的表达纯化及IN*亲和层析柱的制备
实施例4
将实施例3得到的重组菌E.coli BL21(DE3)/pET-21b-IN*过夜培养,转接50mL LB培养基,培养至OD600=0.6时,添加IPTG至终浓度0.1M,16℃180rpm诱导表达。离心收集培养后的菌体,超声破碎细胞,离心收集上清。上清液上样至预先用平衡缓冲液(20mM咪唑;0.5M NaCl;10mM Tris-HCl;pH 8.0)平衡的Ni亲和层析柱,平衡缓冲液洗脱7-8个柱体积至平衡,然后用洗脱缓冲液(250mM咪唑;0.5M NaCl;10mM Tris-HCl;pH 8.0)洗脱。收集洗脱的IN*,用SDS-PAGE检测其浓度。利用Ni亲和层析填料纯化所表达的亲和配基片段IN*,将纯化产物进行冷冻干燥备用。
实施例5
使用1,4-丁二醇而缩水甘油醚(BDEC)对含有羟基的琼脂糖6FF进行活化,可以得到含一条亲水链的活化环氧琼脂糖。将等量琼脂糖微球与1,4-丁二醇而缩水甘油醚混合,加入等量0.6mol/L NaOH,30℃,200r/min,10h。反应结束后,活化的琼脂糖微球用20%的乙醇和大量的去离子水洗净备用。
实施例6
用偶联缓冲液(0.1mol/L Na2CO3/NaHCO3,pH 10.0)溶解亲和配基片段IN*,与环氧活化的琼脂糖进行偶联制备IN*亲和层析介质。偶联条件为:40℃,150r/min,16h。偶联后的亲和介质用去离子水和20%的乙醇洗净并用布氏漏斗抽干,在20%乙醇中4℃条件下保存。
以IN*片段为亲和配基,通过活化中间臂共价偶联到琼脂糖微球,形成对IC融合蛋白具有亲和作用的亲和层析介质,其结构为琼脂糖微球-活化中间臂-IN*亲和配基:
(5)IC-目的基因融合蛋白的表达纯化
实施例7
将待纯化的目标蛋白,利用融合PCR技术,连接在NpuDnaE的C端剪接结构域的C末端。利用上述实施例2、3的方法,将融合DNA片段连接pET28a载体,并转化感受态E.coli BL21(DE3),获得IC与目标蛋白GFP的融合表达菌株。利用实施例4所述的诱导表达条件,对目的基因融合片段IC-GFP进行表达。
实施例8
将实施例5的IC与目的基因融合蛋白的表达产物按照实施例4的方法进行表达。用超滤的方法将含有融合蛋白表达片段的粗蛋白样品的缓冲液更换为平衡缓冲液Buffer A(1mmol/L Zn2+;20mmol/L咪唑;0.5mol/L NaCl;20mmol/L Na2HPO4;pH 6.5)。
基于AKTA purifier层析系统,利用本发明中构建的亲和层析系统对目标蛋白进行纯化的具体过程如下:
1)平衡。用3倍柱体积的平衡缓冲液Buffer A(1mmol/L Zn2+;20mmol/L咪唑;0.5mol/L NaCl;20mmol/LNa2HPO4;pH 6.5)对介质进行平衡。
2)上样。未纯化的粗蛋白液上样,此处蛋白的缓冲液环境为Buffer A。
3)清洗杂蛋白。用4倍柱体积的Buffer A充分冲洗,除去未结合的蛋白。用2倍体积不含Zn2+的Buffer A冲洗。
4)诱导断裂。3倍体积的断裂缓冲液Buffer B(50mmol/L DTT,20mmol/L EDTA,0.5mol/L NaCl,10mmolLTris-HCl,pH 8.0)冲洗层析介质,将层析介质中的缓冲液置换为断裂缓冲液。室温下静置3h。
5)洗脱。用洗脱缓冲液Buffer C(0.5mol/L NaCl,10mmol/L Tris-HCl,pH 8.0)洗下断裂后的目标蛋白并进行收集。
(6)IN*亲和层析柱的再生
实施例9
将目标蛋白洗脱完毕后,用再生缓冲液Buffer D(0.5M NaCl,50mmol/L Na2HPO4/NaOH,pH 11.4)将与亲和介质结合的IC片段洗脱,用20%乙醇冲洗并在4℃条件下保存。
按照以上程序,重复纯化目标蛋白多次,检验IN*亲和层析柱的重复利用次数在40次以上纯化效率没有明显下降。
将亲和层析介质装柱;用含有1mmol/L Zn2+的PBS缓冲液进行平衡;将含有目的蛋白的IC融合蛋白粗样进行上样;用不含Zn2+的PBS缓冲液进行清洗;用含有50mmol/L DTT的断裂缓冲液冲洗层析介质,室温下静置3h;用洗脱缓冲液洗脱断裂后的目标蛋白并进行收集;IN*亲和层析柱进行再生。
由此可见,本利用本发明表达的IN*作为亲和配基制备亲和层析填料具有以下优点:
(1)与传统的亲和层析相比,本发明对目标蛋白的切割无须任何蛋白酶的参与,依靠内含肽本身的断裂反应完成,既降低成本又可防止对目标蛋白的污染。
(2)与当前已存在的一些断裂内含肽纯化系统相比,本发明将亲和配基片段IN的C端与介质连接,同时将His-tag的位置移动到IN的N端。通过降低IN和IC相互识别结合的过程中的空间位阻提高断裂活性,在还原剂存在的条件下3h的断裂率达到95%。
(3)本发明实现的Zn2+对断裂反应的有效控制,提高系统的纯化效率。但未对首位氨基酸进行突变会导致N端断裂反应不能被阻止,继而使断裂反应变为剪接反应。内含肽的剪接反应会使N端外显肽序列与C端外显肽相连,即在目标蛋白GFP的N端添加了位于IN片段N端的额外氨基酸序列。在构建内含肽亲和纯化体系的实际应用中IN片段作为亲和配基与介质共价连接并且进行反复使用,因此目标蛋白N端的外加氨基酸现象大部分在首次纯化中出现。由于Asp118突变使C端断裂反应不依赖于N端,因此,理论上在IN N端所有氨基酸转移至目标蛋白N端后即可产生不含额外氨基酸的目标蛋白GFP。断裂组合在实际亲和纯化体系中作为商品应用时,可以预先进行一次纯化除去IN N端的额外氨基酸,之后便可作为正常的纯化介质使用。
(4)此外,本发明改变了传统的通过Tag与介质之间的亲和结合来固定IN片段,将Tag替换为一个Cys并采用Cys与层析微球共价交联的方式固定亲和配基IN*。实验证明,这种新型的亲和纯化介质介导的纯化系统纯化结果经SDS-PAGE分析得到单一的目标蛋白条带,经蛋白浓度测定并计算得纯化效率为50.9%。亲和纯化介质经重复使用40次后纯化效率没有明显下降,说明本发明构建的亲和纯化介质具有较好的纯化效果和较高的重复利用率。
应说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,其均应涵盖在本发明的权利要求范围当中。
- 还没有人留言评论。精彩留言会获得点赞!