膨胀床法分离纯化藻蓝蛋白的方法与流程
本发明涉及生化分离工程技术领域,特别涉及一种膨胀床法分离纯化藻蓝蛋白的方法。
背景技术:
藻蓝蛋白是一种天然的蛋白资源,应用前景可观。但由于传统藻蓝蛋白分离纯化过程步骤繁琐、耗时多、处理量低的原因,使得分离纯化的成本高,限制了藻蓝蛋白的广泛应用。21世纪以来藻蓝蛋白的作用备受关注,尤其是关于藻蓝蛋白的提取和纯化方面的研究很多,但是在已知的技术中藻蓝蛋白的纯度得率不高。日本DIC是世界上以及有些文献中发表的方法,则完全局限于实验室规模,包括盐析、凝胶过滤,吸附色谱,离子交换色谱,以及其它更昂贵的方法,这些方法大多不适于制备食品色素级的产品。这些方法首先成本高,第二得到的纯度不高。随着藻蓝蛋白荧光试剂的深入研究和进一步的推广使用,要实现藻蓝蛋白在荧光探针等生物化学领域的运用,必需做到提取成本相对降低和纯度达到很高的要求。
藻蓝蛋白虽然用途很多,但其受到分离纯化过程的成本高限制,未能得到广泛的应用。传统分离纯化过程是细胞破壁后的藻蓝蛋白溶液经硫酸铵盐沉淀、离心和透析后得到藻蓝蛋白粗提取物,然后选用两种或两种以上的传统色谱方法进一步纯化。其最大的缺点在于分离纯化过程步骤多,导致产率降低、成本增加。
膨胀床吸附是近年出现的一种新型生物分离技术,具有集成化优势,可以直接从含有颗粒的料液中捕获目标产物,集料液澄清、目标产物浓缩和分离纯化为一体,从而达到简化操作步骤,提高产品收率,降低生产成本的目的。膨胀床吸附技术现已成功用于各种未澄清粗提液中直接捕获蛋白质等生物制品的领域,如E.coli匀浆、酵母发酵液、哺乳动物细胞培养液、牛奶和动物组织提取物等,也有应用在天然产物小分子物质分离领域中。膨胀床兼有固定床和流化床的优点和集成化的特点,降低了分离纯化的成本,该技术在藻蓝蛋白分离纯化过程中的应用为实现藻蓝蛋白生产的规模化提供了可能。
目前,缺乏一种产率高,成本低的膨胀床法分离纯化藻蓝蛋白的方法。
技术实现要素:
本发明的目的是提供一种产率高,成本低的膨胀床法分离纯化藻蓝蛋白的方法。
为了实现上述技术问题,本发明提供的技术方案为:本发明的一种膨胀床法分离纯化藻蓝蛋白的方法,包括如下步骤:
(1)制备藻蓝蛋白粗提液:称取螺旋藻干粉,用反复冻融法进行细胞破壁,提取藻蓝蛋白;
(2)吸附剂Streamline DEAE静态吸附藻蓝蛋白;
(3)膨胀床吸附分离藻蓝蛋白。
进一步地,在步骤(1)中,以螺旋藻干粉与磷酸钠盐缓冲液的固液比为1:150g/mL,在-20℃和37℃反复冻融5次,每次冻融时间为4h;将冻融5次后的破壁液于5000rpm下离心30min,收集上清液得到藻蓝蛋白的粗提液,置于4℃冰箱中储藏备用。
进一步地,在步骤(2)中,称取0.15g吸附剂Streamline DEAE于50mL的具塞三角瓶中,并加入藻蓝蛋白粗提液,在200rpm/min,25℃下进行恒温振荡吸附;吸附1.5小时后取上清液取样一次。
更进一步地,在步骤(3)中,将吸附剂Streamline DEAE装入膨胀柱中,打开出水口,使吸附剂Streamline DEAE均匀沉降,达到沉降床层高度为H0=10.0cm时,停止加入吸附剂并关闭出水口,最后使柱中吸附剂表面上留有1cm高度的溶液;
用蠕动泵将平衡缓冲液从膨胀床底部入口泵入柱中,吸附剂Streamline DEAE在柱中不断向上移动,当上升至膨胀床层高度为H为20.0cm不再上升时,将顶部调节器固定在床层上1-2cm处,继续平衡20-30min,使床层稳定;
待膨胀床稳定后,将进口流体从平衡缓冲液切换成藻蓝蛋白粗提液,开始进样,整个吸附过程中,控制进样流速,保持膨胀床层的膨胀率稳定;用自动部分收集器每2min收集一次流出液;停止进样后,进口流体从藻蓝蛋白粗提液切换成平衡缓冲液,进行向上冲洗,去除膨胀床中的杂质和弱结合蛋白,制得藻蓝蛋白。
进一步地,在步骤(3)中,所述膨胀柱为400mm×16mm。
进一步地,在步骤(3)中,所述缓冲液为25mM中性磷酸钠盐缓冲液。
有益效果:本发明以螺旋藻为对象,采用膨胀床吸附技术来分离纯化藻蓝蛋白,提高产品的收率和纯度,产率高,缩短操作时间,降低成本,再生性能好,可重复使用,适合规模化生产。相对于现有技术,本发明具有如下优点:
(1)膨胀床吸附技术是一种集料液澄清、目标产物浓缩和分离纯化为一体的新型生物分离技术,可以作为经济、高效、适合规模化生产的纯化方法,在获得高产品纯度和收率的同时也能够保持产品的生物活性。采用该技术代替传 统纯化方法可以直接从细胞破壁后的藻蓝蛋白溶液中捕获藻蓝蛋白,大大简化操作步骤。
(2)膨胀床法分离纯化藻蓝蛋白,具有集成化优点,减少了传统纯化方法中的离心、蛋白沉淀、透析等步骤,可快速有效的富集分离藻蓝蛋白,藻蓝蛋白的光谱纯度(A620nm/A280nm)可由粗提液的0.23最高提高至2.02,藻蓝蛋白浓度从粗提液的0.17mg/mL提高为2.15mg/mL,膨胀床分离富集藻蓝蛋白的回收率为59.45%。
(3)吸附剂颗粒在膨胀床中的膨胀率E(H/H0)随着流体流速的增加而增加。粒径和密度小的吸附剂在膨胀床中的膨胀率高。基于孔体积因素,建立了形成不同膨胀率的大孔树脂膨胀床的流体流速预测模型。膨胀床法代替传统分离纯化方法,省去离心、蛋白沉淀、透析等步骤,减少了步骤,提高产率,降低成本。
附图说明
图1是藻蓝蛋白粗提液颜色随pH变化图;
图2是在不同盐浓度粗提液中藻蓝蛋白的吸附量随时间变化图;
图3是离子强度对吸附效率的影响图;
图4是pH对藻蓝蛋白吸附的影响图;
图5是pH对吸附前后上清液藻蓝蛋白纯度的影响图;
图6是固液比对藻蓝蛋白吸附的影响图;
图7是固液比对吸附后上清液纯度的影响图;
图8是温度对藻蓝蛋白吸附的影响图;
图9是藻蓝蛋白膨胀床吸附的穿透曲线图;
图10是藻蓝蛋白吸附量随进样体积变化图;
图11是冲洗阶段A620nm变化图;
图12是藻蓝蛋白洗脱曲线图;
图13是洗脱组分的藻蓝蛋白纯度图;
图14是洗脱速度对藻蓝蛋白洗脱的影响图。
具体实施方式
为了阐明本发明的技术方案及技术目的,下面结合图及具体实施方式对本发明做进一步的介绍。
实验材料与仪器
螺旋藻干粉,赐百年生物科技有限公司提供;磷酸氢二钠、磷酸二氢钠、氢氧化钠、叠氮化钠、氯化钠、硫酸铵、浓盐酸、柠檬酸、甘氨酸、醋酸、异丙醇、乙醇,试剂均为分析纯(AR),购自国药集团化学试剂有限公司;膨胀床吸附剂Streamline DEAE,购自GE healthcare公司。
玻璃层析柱(规格:400mm×16mm,液体分布器为200目丝网),上海锦华层析设备厂;BT100-2J DG-2(10滚轮)型蠕动泵,河南保定兰格恒流泵有限公司;FA2004电子天平,CH1010超级恒温水浴,上海衡平仪器仪表厂;TDL-60B低速台式离心机,常州诺基仪器有限公司;BSZ型自动部分收集器,上海泸西分析仪器厂有限公司;SHB-Ⅲ循环水式多用真空泵,郑州长城科工贸有限公司;S-25型pH计,上海精科雷磁公司;TU-1901型双光束紫外-可见分光光度计,北京普析通用仪器有限责任公司;THZ-82型恒温振荡器,常州国华电器有限公司;DHG-9140型电热恒温鼓风干燥箱,上海精宏实验设备有限公司。
本发明的一种膨胀床法分离纯化藻蓝蛋白的方法,包括如下步骤:
(1)制备藻蓝蛋白粗提液:称取螺旋藻干粉,用反复冻融法进行细胞破壁,提取藻蓝蛋白;
(2)吸附剂Streamline DEAE静态吸附藻蓝蛋白;
(3)膨胀床吸附分离藻蓝蛋白。
在步骤(1)中,以螺旋藻干粉与磷酸钠盐缓冲液的固液比为1:150g/mL,在-20℃和37℃反复冻融5次,每次冻融时间为4h;将冻融5次后的破壁液于5000rpm下离心30min,收集上清液得到藻蓝蛋白的粗提液,置于4℃冰箱中储藏备用。
在步骤(2)中,称取0.15g吸附剂Streamline DEAE于50mL的具塞三角瓶中,并加入藻蓝蛋白粗提液,在200rpm/min,25℃下进行恒温振荡吸附;吸附1.5小时后取上清液取样一次。
在步骤(3)中,将吸附剂Streamline DEAE装入膨胀柱中,打开出水口,使吸附剂Streamline DEAE均匀沉降,达到沉降床层高度为H0=10.0cm时,停止加入吸附剂并关闭出水口,最后使柱中吸附剂表面上留有1cm高度的溶液;
用蠕动泵将平衡缓冲液从膨胀床底部入口泵入柱中,吸附剂Streamline DEAE在柱中不断向上移动,当上升至膨胀床层高度为H为20.0cm不再上升时,将顶部调节器固定在床层上1-2cm处,继续平衡20-30min,使床层稳定;
待膨胀床稳定后,将进口流体从平衡缓冲液切换成藻蓝蛋白粗提液,开始进样,整个吸附过程中,控制进样流速,保持膨胀床层的膨胀率稳定;用自动部分收集器每2min收集一次流出液;停止进样后,进口流体从藻蓝蛋白粗提液切换成平衡缓冲液,进行向上冲洗,去除膨胀床中的杂质和弱结合蛋白,制得藻蓝蛋白。
所述膨胀柱为400mm×16mm。
所述缓冲液为25mM中性磷酸钠盐缓冲液。
实施例1
缓冲液配制
取39.0mL 0.2mol/L NaH2PO4和61.0mL 0.2mol/L Na2HPO4,充分混合即为0.2mol/L的pH=7.0磷酸钠盐缓冲液。根据需要,稀释一定的倍数,配制成不同浓度的pH=7.0磷酸钠盐缓冲液。
取7.71mL 0.2mol/L Na2HPO4和12.29mL 0.1mol/L柠檬酸,充分混合后即为0.1mol/L pH=4.0磷酸氢二钠-柠檬酸缓冲液。取11.15mL 0.2mol/L Na2HPO4和12.29mL 0.1mol/L柠檬酸,充分混合后即为0.1mol/L pH=5.4磷酸氢二钠-柠檬酸缓冲液,根据需要配成不同浓度的缓冲液。
取50mL 0.2mol/L甘氨酸和4.0mL 0.2mol/L氢氧化钠加水稀释至200mL,即为0.05mol/L pH=8.0甘氨酸-氢氧化钠缓冲液。取50mL 0.2mol/L甘氨酸和32.0mL 0.2mol/L氢氧化钠加水稀释至200mL,即为0.05mol/L pH=10.0甘氨酸-氢氧化钠缓冲液,根据需要配成不同浓度的缓冲液。
藻蓝蛋白粗提液制备
称取螺旋藻干粉,用反复冻融法进行细胞破壁,提取藻蓝蛋白。提取条件为:以固液比(m(g):V(mL))=1:150加入25mM磷酸钠盐缓冲液(pH7.0),在-20℃和37℃反复冻融5次,每次冻融时间为4h。将冻融5次后的破壁液于5000rpm下离心30min,收集上清液得到藻蓝蛋白的粗提液,置于4℃冰箱中储藏备用。粗提取藻蓝蛋白的得率YPC按式(1)计算。
(1)式中
YPC—粗提取的藻蓝蛋白得率(mg/g);
mPC—粗提液中藻蓝蛋白的质量(mg);
m0—螺旋藻干粉的质量(g);
CPC—粗提液中藻蓝蛋白的含量(mg/mL);
V—粗提液的体积(mL)。
藻蓝蛋白含量及纯度测定
将待测的样品稀释至一定倍数后,用紫外可见分光光度计分别测定280nm、565nm、620nm和650nm处的吸光度,参考Bennett&Bogorad的公式计算藻蓝蛋白、别藻蓝蛋白和藻红蛋白含量。
(2)、(3)、(4)式中
CPC、CAPC、CPE—藻蓝蛋白、别藻蓝蛋白、藻红蛋白的含量(mg/mL);
A280nm、A565nm、A620nm、A650nm—样品在280nm、565nm、620nm和650nm处的吸光度值。
藻蓝蛋白的纯度(purity)由A620nm/A280nm表示。
Streamline DEAE静态吸附藻蓝蛋白
称取一定量的Streamline DEAE(以干重计)于50mL的具塞三角瓶中,并加入一定体积的藻蓝蛋白粗提液,在200rpm/min,25℃下进行恒温振荡吸附。吸附一段时间后取上清液,取样频率为每1.5小时取样一次。取得的上清液稀释一定倍数后分别测定280nm、565nm、620nm和650nm处的吸光度,按公式计 算藻蓝蛋白的含量,并由式(5)、(6)计算Streamline DEAE对藻蓝蛋白的静态吸附容量和吸附效率。
(5)、(6)式中
Q—静态吸附容量(mg/g吸附剂干重);
CPC,0—加入的粗提液中初始的藻蓝蛋白含量(mg/mL);
CPC,t—吸附后上清液中的藻蓝蛋白含量(mg/mL);
V—藻蓝蛋白粗提液体积(mL);
m—吸附剂Streamline DEAE干重(g)。
E—吸附率(%)。
膨胀床吸附分离藻蓝蛋白
将Streamline DEAE装入膨胀柱(400mm×16mm)中,缓慢地打开出水口,控制流速,使Streamline DEAE均匀沉降,达到沉降床层高度为H0=10.0cm时,停止加入吸附剂并关闭出水口,最后使柱中吸附剂表面上留有1cm左右高度的溶液。用蠕动泵将平衡缓冲液(25mM中性磷酸钠盐缓冲液)从膨胀床底部入口泵入柱中,Streamline DEAE在柱中不断向上移动,当上升至膨胀床层高度为H为20.0cm不再上升时,将顶部调节器固定在床层上1-2cm处,继续平衡20-30min,使床层稳定。形成稳定膨胀床后,分别对距离柱底为10、12、14、16、18和20cm的区域进行局部取样,取样范围分别为10-12cm、12-14cm、14-16cm、16-18cm和18-20cm。将取得的吸附剂放入10mL量筒中,静置30-40min后,读取吸附剂的沉降体积Vs。按公式(7)计算各区域内的床层间隙率(局部床 层间隙率),每个取样点重复测定3次,结果的相对误差小于5%。获得局部床层间隙率随轴向高度变化的规律。
(7)式中local—局部床层间隙率;
VS—吸附剂沉降体积(mL);
V′—局部床层体积,mL。
待膨胀床稳定后,将进口流体从平衡缓冲液切换成藻蓝蛋白粗提液,开始进样。整个吸附过程中,控制进样流速,保持膨胀床层的膨胀率稳定。用自动部分收集器每2min收集一次流出液,测定流出液在620nm和650nm处的吸光度值,计算藻蓝蛋白的含量。以进样体积为横坐标,流出液与进样粗提液中藻蓝蛋白含量的比值为纵坐标,绘制穿透曲线,根据穿透曲线,由公式(8)计算出Streamline DEAE膨胀床动态吸附容量。
(8)式中
Qd—动态吸附容量(mg/g吸附剂);
C0—进样粗提液中藻蓝蛋白含量(mg/mL);
Vb—穿透曲线10%处所对应的进样体积(mL);
m—吸附剂Streamline DEAE干重(g)。
停止进样后,进口流体从藻蓝蛋白粗提液切换成平衡缓冲液,进行向上冲洗,去除膨胀床中的杂质和弱结合蛋白。当流出液在620nm处测定的吸光度值为0时,冲洗停止。膨胀床静置,吸附剂Streamline DEAE沉降。
实施例2
离子强度对藻蓝蛋白粗提取效率的影响
采用去离子水和不同离子强度的磷酸钠盐缓冲液(pH=7.0)进行反复冻融法提取藻蓝蛋白。结果如表1所示,表1为不同离子强度对藻蓝蛋白提取效率的影响,25mM磷酸钠盐缓冲溶液提取的效果最好,优于0mM(去离子水)提取效果,这与缓冲溶液有利于维持藻蓝蛋白构象及功能的稳定有关。不同离子强度的磷酸钠盐缓冲溶液粗提液中,除了100mM粗提液中的藻蓝蛋白含量和纯度偏低以外,其他几种离子强度缓冲溶液提取的粗提液中各蛋白质含量和纯度依次下降。说明离子强度过高,溶液极性增强,使得蛋白质疏水链间的作用力减弱,易自聚发生盐析现象,对提取不利。因此,反复冻融提取藻蓝蛋白时,选用25mM磷酸钠盐缓冲溶液为提取溶剂。
表1
pH对藻蓝蛋白粗提取效率的影响
用pH值分别为4.0、5.4、7.0、8.6和10.0的25mM缓冲溶液反复冻融提取藻蓝蛋白,考察提取提取溶剂的pH值对藻蓝蛋白粗提取效率的影响。结果表明,提取溶剂的pH值对粗提液影响很大,不同pH提取溶剂得到的藻蓝蛋白粗提液中藻蓝蛋白含量和纯度差别很大,甚至粗提液的颜色发生明显变化。如图1所示,为藻蓝蛋白粗提液颜色随pH变化图;从左往右分别是pH为4.0,5.4,7.0, 8.6,10.0的25mM缓冲溶液提取的粗提液。说明水溶液中pH环境的变化影响到藻蓝蛋白中的生色基团的结构,从而使得藻蓝蛋白粗提液的颜色产生巨大变化。当pH=4.0,粗提液的蓝色极浅,随着pH增加至中性,蓝色逐渐加深;当pH=8.6和10.0时,粗提液的颜色已经不再呈蓝色,藻蓝蛋白的色素基团被破坏。
不同pH条件下,粗提液中藻蓝蛋白含量和纯度如表2所示。表2为溶剂pH对藻蓝蛋白粗提液影响。当提取溶剂pH=4.0和pH=10.0时,得到的粗提液中藻蓝蛋白含量和纯度极低,分别仅为pH=5.4和pH=7.0时藻蓝蛋白含量的12.42%和11.97%,纯度的20.69%和15.38%。由于藻蓝蛋白在酸性或碱性条件下,稳定性明显降低,用酸性或碱性的溶剂进行反复冻融提取藻蓝蛋白,会导致藻蓝蛋白含量低,纯度低的情况。在pH=7.0下,粗提液中藻蓝蛋白的纯度较pH=5.4的纯度低,分析原因,此时的溶液呈中性,胞内物质在中性条件下具有良好的稳定性,当细胞破壁提取时,粗提液中除了藻蓝蛋白外,其他的胞内物质也会增多,造成了pH=7.0下藻蓝蛋白的纯度偏低。综合藻蓝蛋白稳定性和纯度考虑,采用中性缓冲液对藻蓝蛋白进行粗提取。
表2
实施例3
离子强度对藻蓝蛋白吸附的影响
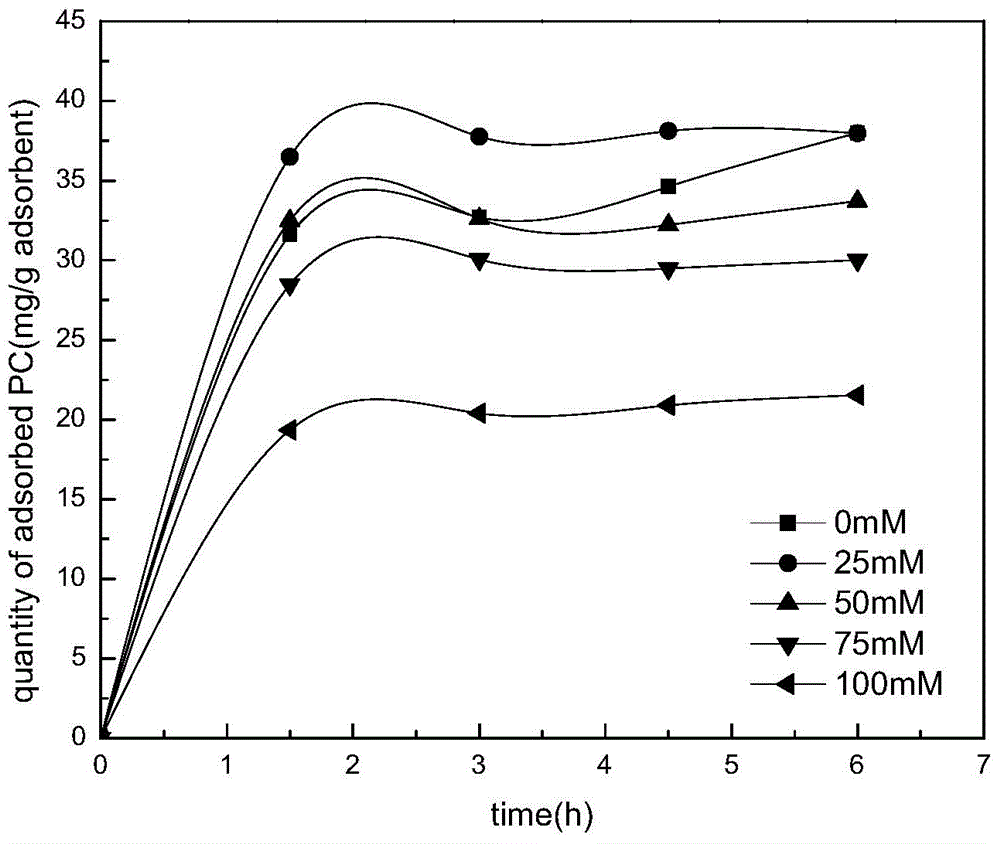
Streamline DEAE属于阴离子交换树脂,离子强度会影响其吸附效果。图2为Streamline DEAE自不同离子强度粗提液中吸附藻蓝蛋白的吸附量随时间变化图。从该图结果可以看出,Streamline DEAE吸附藻蓝蛋白的吸附速度快,吸附1.5h后,Streamline DEAE对藻蓝蛋白的吸附几乎达到平衡。从结果还可以看出Streamline DEAE自25mM的粗提缓冲溶液中对藻蓝蛋白的吸附容量最高,是浓度为100mM的缓冲液中吸附量的1.85倍。当溶液中盐浓度超过25mM后吸附容量随着离子强度的增加而减小。由于Streamline DEAE是离子交换树脂,体系中的离子强度的变换会影响其表面与吸附质的静电作用,电解质离子还会与吸附质离子产生离子交换竞争进而影响吸附效果。结果还可以看到,Streamline DEAE在浓度为25mM的粗提缓冲溶液中的吸附效果优于0mM的粗提缓冲溶液条件下,说明溶液中具有一定的低离子强度可以有助于吸附质的吸附,对吸附有利。图3为Streamline DEAE在不同离子强度下,对藻蓝蛋白静态吸附3h的吸附。
pH对藻蓝蛋白吸附的影响
图4所示为pH值对Streamline DEAE吸附藻蓝蛋白的影响。从图中可以看出,pH为6-7时,藻蓝蛋白的吸附容量高,pH7.0以后,随着pH值的增加,吸附容量逐渐减少。当pH调至4.0时,粗提液中开始出现部分蛋白沉淀,溶液变浑浊,这样造成吸附初始藻蓝蛋白含量减少,纯度降低。分析原因,pH4.0为藻蓝蛋白等电点附近,分子间双电层结构被破坏,蛋白质分子容易发生相互聚集沉淀。另一方面,Streamline DEAE为弱碱性阴离子交换树脂,在酸性条件下,吸附剂的吸附性能大大降低,在中性条件下,藻蓝蛋白带有负电荷,与吸附剂上的配基作用增强,易于吸附,但随着碱性增加,在pH>9.0时,因碱性条件下的藻蓝蛋白稳定性差部分发生变性,使得粗提液中藻蓝蛋白含量及纯度低。而 且pH增加,吸附剂上的配基离子化程度减弱,也导致吸附容量降低。
吸附前后粗提液中A620nm/A280nm变化见图5。结果表明在pH=7.0条件下,Streamline DEAE对藻蓝蛋白吸附具有较好的选择性,吸附前后上清液纯度由0.28变为0.13。因此,选择pH7.0条件下,Streamline DEAE吸附藻蓝蛋白。
固液比对藻蓝蛋白吸附的影响
图6所示为改变吸附剂干重与加入藻蓝蛋白粗提液体积比对藻蓝蛋白静态吸附的影响。从图中结果表明,随着Streamline DEAE干重与藻蓝蛋白粗提液体积的比值减小,Streamline DEAE对藻蓝蛋白的吸附容量增加,固液比1:400的吸附容量是1:150的1.95倍,分别为42.64mg/g吸附剂和21.90mg/g吸附剂。但固液比为1:300之后,Streamline DEAE对藻蓝蛋白的吸附容量的增加量明显减少。说明此固液比下,Streamline DEAE对藻蓝蛋白的吸附几乎达到饱和,继续减小固液比值,增加藻蓝蛋白体积,吸附容量的增加量不多。
从固液比对吸附后上清液纯度影响图7可以看出,纯度(A620nm/A280nm)的值随固液比值减小而增加,说明增加加入的藻蓝蛋白粗提液体积,Streamline DEAE除了对藻蓝蛋白的吸附容量增加,对杂质蛋白的吸附也有所增加。因此,考虑Streamline DEAE对藻蓝蛋白的吸附容量和吸附选择性,将固液比1:300作为吸附的最佳固液比。
温度对藻蓝蛋白吸附的影响
在藻蓝蛋白稳定性允许的温度范围内,考察温度对藻蓝蛋白吸附的影响,结果如图8所示。在20℃条件下,Streamline DEAE吸附藻蓝蛋白的吸附容量最高,随着温度的升高,藻蓝蛋白的吸附容量减少。说明较低温度下有利于藻蓝蛋白的吸附,Streamline DEAE吸附藻蓝蛋白过程可能是放热过程。在不同的温度吸附下,吸附后上清液纯度(A620nm/A280nm)随着温度的升高而增加,因为温度升 高,分子运动加快,藻蓝蛋白吸附和解吸速度加快,温度高时不利于藻蓝蛋白的吸附,高温有利于解吸,最终使得吸附后的上清液纯度增加。
实施例4
Streamline DEAE膨胀床吸附藻蓝蛋白
形成稳定的膨胀床后,切换泵入藻蓝蛋白粗提液(浓度0.1734mg/mL,纯度A620nm/A280nm0.23),流出液收集频率为14.2mL/2min。随着藻蓝蛋白粗提液不断地进入膨胀床,Streamline DEAE颜色逐渐由白色变为蓝色,流出液的颜色为浅蓝绿色。吸附过程中,由于吸附剂对藻蓝蛋白的吸附,使其密度有所增加,造成相同流速下,膨胀率降低;另一方面,藻蓝蛋白粗提液的料液性质与平衡缓冲液不同,会造成膨胀率的变化。所以,随着进样体积的增加,膨胀床高度略有所下降,根据Streamline DEAE的U-E关系,适当控制进样流速,保持恒定的膨胀率,以维持吸附操作条件稳定。
根据进样体积和流出液与粗提液藻蓝蛋白含量的比值,得到藻蓝蛋白膨胀床吸附的穿透曲线,如图9所示。由曲线可知C/C0=0.1时,进样体积为227.2mL,Streamline DEAE对藻蓝蛋白的膨胀床动态吸附容量为9.24mg/g吸附剂(干重)。动态吸附容量值低于静态吸附最佳固液比下的藻蓝蛋白吸附容量值,是因为动态吸附过程中,吸附质与吸附剂接触时间短,固液相达到平衡的时间不充分。
图10所示为Streamline DEAE对藻蓝蛋白吸附量随进样体积的变化。当进样体积为1050.8mL后,藻蓝蛋白自粗提液中被吸附的量明显降低,C/C0也增加,而C0在进样时保持不变,说明藻蓝蛋白浓度开始急速增加。故在进样体积为1050.8mL后,停止进样,此时C/C0=0.33,最大进样量为1050.8mL。该最大进样体积与静态吸附最佳固液比确定的进样体积(1278.8mL)相比,是其的82.2%,误差主要还是来源于动态吸附过程与静态吸附过程的差异。整个膨胀床吸附过 程的吸附效率为80.15%。
图11所示为停止进样后,通过冲洗去除膨胀床中杂质和弱结合蛋白的结果。在冲洗阶段过程中,膨胀床中的Streamline DEAE吸附剂的膨胀率仍保持为2.0左右,用平衡缓冲液向上冲洗膨胀床,至流出液无色,洗出的流出液A620nm回到基线,所用冲洗体积大约为397.6mL(约20SBV)。
实施例5
洗脱液离子强度对洗脱效果的影响
结果可知,在高浓度的磷酸钠盐缓冲液(PBS)中,Streamline DEAE对藻蓝蛋白的吸附效率低,不利于藻蓝蛋白在Streamline DEAE上的吸附。根据此研究结果,以500mM磷酸钠盐缓冲溶液(pH=7.0)进行洗脱,并以此作为研究离子强度对洗脱效果影响的实验基本点,考察不同离子强度下的洗脱效果,结果如图3-14所示。图3-14为不同离子强度下,各洗脱组分中的藻蓝蛋白纯度。
由图12所示,各洗脱曲线中均出现对称的尖峰,说明高离子强度的缓冲液对藻蓝蛋白的洗脱效果好,能够将藻蓝蛋白从Streamline DEAE上很好地洗脱下来。当洗脱体积约为100mL(5SBV)后,A620nm值几乎不变,藻蓝蛋白的洗脱达到平衡,确定洗脱实验的洗脱液用量为5个固定床体积。另外,随着离子强度进一步增加,洗脱的尖峰峰宽越窄,峰顶处A620nm值越高。分别收集500mM PBS、500mM PBS+0.25M NaCl和500mM PBS+0.5M NaCl洗脱液洗脱下来的6-14min的蓝色组分,藻蓝蛋白含量分别为2.15、2.53和2.54mg/mL,洗脱回收率R分别为74.18%、81.34%和80.76%。说明离子强度越高,对藻蓝蛋白的洗脱能力越强。
与此同时,离子强度越高,洗脱组分中藻蓝蛋白所能达到的最高纯度(A620nm/A280nm)越低,依次为2.02、1.76和1.56,如图13所示。合并蓝色洗脱组分,得到的藻蓝蛋白纯度分别为0.94、0.70和0.58。分析原因,离子强度的 增加,不仅削弱了吸附剂与藻蓝蛋白之间的相互结合作用力,而且减弱了杂质蛋白的吸附作用力,离子强度越高,杂质蛋白洗脱越多,导致洗脱组分的纯度越低。在500mM磷酸钠盐缓冲液+0.25M NaCl和500mM磷酸钠盐缓冲液+0.5M NaCl洗脱液洗脱下,洗脱组分中藻蓝蛋白的纯度都有出现突然增加的情况,含有0.5M NaCl的洗脱液更为明显,这是因为杂蛋白先于藻蓝蛋白洗脱下来,离子强度增加,洗脱能力强,洗脱下来的杂蛋白比不加NaCl的溶液洗脱的多,随着洗脱体积增加,藻蓝蛋白后洗脱下来,所以藻蓝蛋白的纯度又会有所提高。
综合考虑藻蓝蛋白的洗脱回收率和藻蓝蛋白的纯度,选择500mM磷酸钠盐缓冲溶液(pH=7.0)为适合的洗脱液,其对藻蓝蛋白的洗脱效果好,合并蓝色组分,最后得到的藻蓝蛋白浓度为2.15mg/mL,纯度为0.94,整个洗脱过程的洗脱回收率为74.18%。
洗脱速度对洗脱效果的影响
用500mM磷酸钠盐缓冲液(pH=7.0)以不同速度对膨胀床吸附的藻蓝蛋白进行洗脱,不同洗脱速度下藻蓝蛋白的洗脱曲线如图14所示。从图14可以看出洗脱速度对洗脱曲线的影响并不明显,在较高洗脱流速150cm/h下,洗脱峰略有拖尾现象,在较低流速80cm/h下,洗脱峰较为集中。但不同流速下,合并收集16-56mL的蓝色组分中藻蓝蛋白的纯度差异大,如表3所示。表3为不同洗脱速度下,收集组分中藻蓝蛋白的含量及纯度;
表3
组分中藻蓝蛋白的纯度分别为0.65、0.94和1.00,低流速下的纯度小于较高流速下的纯度,因为在洗脱速度低的情况下,当洗脱体积一定时,洗脱时间相对延长,杂质蛋白的洗脱量增加,造成收集的洗脱组分纯度降低。因此,在对藻蓝蛋白进行洗脱操作时,应该选择适中的洗脱流速,既能保证藻蓝蛋白可以有效地洗脱下来,也能获得藻蓝蛋白纯度较高的洗脱组分。
本发明中,采用反复冻融法粗提取藻蓝蛋白的最佳条件为:提取溶剂为pH=7.0,25mM的磷酸钠盐缓冲溶液,提取得率为26.01-32.27mg/g藻干粉,得到的藻蓝蛋白粗提液中藻蓝蛋白的含量为0.1734-0.2151mg/mL,纯度为0.23-0.28。
Streamline DEAE对藻蓝蛋白的吸附受溶液中盐浓度、pH、固液比和温度等因素的影响。通过比较静态吸附实验的结果,选择出藻蓝蛋白的最佳吸附条件,条件为:在pH为7.0,25mM磷酸钠盐缓冲溶液中,以固液比1:300加入藻蓝蛋白粗提液,20℃下恒温吸附3h,吸附容量为45.21mg/g吸附剂(干重)。
在膨胀柱规格为16mm×400mm的Streamline DEAE膨胀床中,进行膨胀床吸附藻蓝蛋白操作。固定床层高度为10.0cm,进样流速为201.5cm/h,膨胀率E=2.0,最大进样体积为1050.8mL(约52SBV),即C/C0=0.33,膨胀床吸附过程的吸附效率为80.15%。吸附后用397.6mL(约20SBV)平衡缓冲液冲洗膨胀柱,以除去杂质微粒及弱结合蛋白。
Streamline DEAE吸附藻蓝蛋白的最佳洗脱操作条件为:固定床模式向下洗脱,洗脱流速为120cm/h,洗脱液为500mM磷酸钠盐缓冲溶液(pH=7.0),洗脱液用量100mL,洗脱峰的藻蓝蛋白纯度为2.02,收集合并蓝色洗脱组分,得到的藻蓝蛋白溶液含量为2.15mg/mL,纯度为1.00,藻蓝蛋白回收率为74.18%。通过膨胀床吸附,藻蓝蛋白含量从粗提液的0.17mg/mL提高为2.15mg/mL,浓缩 10倍以上,藻蓝蛋白纯度提高4倍,从0.23到1.00,藻蓝蛋白回收率为59.45%。
以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,本发明要求保护范围由所附的权利要求书、说明书及其等效物界定。
- 还没有人留言评论。精彩留言会获得点赞!