基于基因组改组的吩嗪‑1‑甲酰胺高产菌株的育种方法与流程
本发明涉及生物工程技术领域,具体涉及一种基于基因组改组的吩嗪-1-甲酰胺高产菌株的育种方法。
背景技术:
吩嗪-1-甲酰胺(PCN)是一种有效的新型生物农药,具有广谱的抑制植物病原真菌的作用。绿针假单胞菌HT66(Pseudomonas chlororaphis HT66)CCTCCNO:M2013467是从水稻根际土壤中分离到一株产吩嗪-1-甲酰胺(PCN)的绿针假单胞菌,安全性很高,且PCN产量高达420mg/L,是国际上报道的吩嗪化合物产量最高的野生株。该菌分泌吩嗪化合物的能力很强,能够将细胞内合成的吩嗪化合物快速运输到胞外,在培养基中形成绿色晶体,不仅降低了代谢调控中的反馈抑制现象,具有高产PCN的巨大潜力,而且绿色晶体可以作为筛选指标,有利于PCN高产菌株的选育。
PCN具有良好的应用前景,对此开展高产菌株的选育,有利于其工业应用。目前,经过十轮的物理和化学方法诱变,PCN产量提高了很多;但是由于前期诱变引入的负突变较多,后期继续以诱变育种的方法提高PCN产量的难度较大。
1998年Maxygen公司的Stemmer等人提出了一种新的分子育种方法——全基因组重排技术(genome shuffling),这种技术是分子定向进化在全基因组水平上的延伸,它将重组的对象从单个基因扩展到整个基因组,因此可以在更为广泛的范围内对菌种的目的性状进行优化组合。
基因组重排的原理是,首先通过诱变育种得到一个含有各种不同正突变的基因组库,然后通过原生质体的融合将这些正突变菌株的基因组进行随机重组,并筛选目的性状得到进一步改进的菌株来进行下一轮基因组重排,这样可以快速、高效地选育出表型得到较大改进的杂交菌种。基因组重排技术提出后的短短几年时间,在菌种改进方面已经取得了很突出的成果。
Zhang等[Zhang Y,Perry K,Vinci V,et al.Genome shuffling leads to rapid phenotypic improvement in bacteria,Nature,2002,415:644-646]通过基因组重排提高了弗氏链霉菌的泰乐菌素产量。实验在经过一轮诱变和两轮基因组重排筛选得到高产菌株,其生产能力与通过20轮连续诱变筛选得到的泰乐菌素高产菌株生产能力相同,这说明基因组重排在育种方面可以更加快速有效。
Hida等[Hida H,Yamada T,et al.Genome shuffling of Streptomyces sp U121for improved production of hydroxycitric acid.Applied Microbiology and Biotechnology,2007,73(6):1387-1393]利用基因组重排的方法改进了Streptomyces sp.U121生产HCA的能力,实验中用亚硝基胍处理诱变来处理U121的孢子,得到突变株进行原生质体融合,三轮融合后筛选到高产融合子,其产量比野生型菌株提高5倍。
在国内,也有类似的通过基因组重排方法来进行菌种的育种从而提高产品产量,如梁惠仪[梁惠仪,郭勇.全基因组重排育种技术提高豆豉纤溶酶菌产酶量.中国生物工程杂志,2007,27(10):39-43]等通过对DC-12进行紫外诱变和亚硝基胍诱变构建突变库,以筛选到的4株诱变菌株作为融合亲本,采用电融合的方法进行基因组重排,结合双灭活的筛选方法,筛选出的菌株比亲本菌株的酶活提高了4~5倍。
浙江大学朱惠等[朱惠,金志华,岑沛霖.纳他霉素产生菌基因组重排育种.中国抗生素杂志,2006,31(12):739-742]将Streptomyces gilvosporeus SG21原生质体经紫外线诱变并筛选链霉素抗性菌株,在高产突变株中选择4株作为亲本进行基因组重排育种,筛选得到了高产重组菌株,其产量比原始出发菌株提高1.17倍。
总之,在微生物育种方面,基因组重排有很多的应用研究,也有很大的应用潜力。基因组重排(Genome shuffling)技术是自2002年发展起来的一种新型的微生物育种方法,通过原生质体的递归融合使正向突变的表型快速聚集。在理论上这种方法相较于传统诱变选育能够更快速的改良菌株。然而,采用该技术用于吩嗪-1-甲酰胺高产菌株的育种尚未见有相关报道。此外,传统的基因组改组方法需要预先对融合前的两株亲本进行分别标记,包括整合型标记、遗传缺陷型标记、抗药性标记等,然后根据标记筛选融合子,最后从融合子中筛选高产株,因此该方法的步骤繁琐、工作难度较大,实施周期长,而且有些标记可能对染色体造成损害。本专利旨在优化融合条件,提高融合效率,以多株正突变株进行随机融合,直接筛选高产株以缩短育种时间。
技术实现要素:
针对现有技术中的缺陷,本发明的目的在于提供一种基于基因组改组的吩嗪-1-甲酰胺高产菌株的育种方法。本发明的方法无需对诱变获得的高产菌株进行标记,而且直接以高通量筛选的方法获得高产PCN的融合子,大大提高了工作效率。
本发明的目的是通过以下技术方案实现的:
本发明提供了一种基于基因组改组的吩嗪-1-甲酰胺高产菌株的育种方法,包括以下步骤:
A、以绿针假单胞菌HT66为出发株,通过诱变处理获得含有各种不同正突变的基因组库,然后筛选出高PCN产量的若干株突变菌株;
B、将突变菌株进行原生质体制备、原生质体融合,筛选出高PCN产量的融合子。
优选地,步骤A中,所述诱变处理包括物理诱变和/或化学诱变。
优选地,步骤B中,所述原生质体制备包括以下步骤:所述原生质体制备具体采用以下步骤:将突变菌株重悬于SMM缓冲液中,添加溶菌酶、渗透压稳定剂和螯合剂进行酶解,然后离心吸去溶液,用磷酸缓冲液清洗后重悬,得原生质体悬浮液。
优选地,所述溶菌酶的浓度为0.2mg/mL,渗透压稳定剂为浓度0.5M甘露醇,螯合剂为浓度0.1%的EDTA;所述酶解时间为1h,突变菌株的菌龄为18h。所述EDTA的浓度为质量浓度,0.1g/100mL。
优选地,所述SMM缓冲液中含有以下浓度的各组分:蔗糖0.5mol/L,顺丁烯二酸20mmol/L,六水合氯化镁20mmol/L。
优选地,步骤B中,所述原生质体融合包括以下步骤:将突变株的原生质体悬浮液混合,离心,去上清液后,加入磷酸缓冲液,吹打原生质体沉淀重新悬浮;再加入PEG和DMSO,定溶后充分混匀,水浴中保温静置即可。
优选地,所述DMSO添加量为1%,所述PEG的浓度为35%,PEG分子量为8000。所述DMSO添加量为质量添加量,1g/100mL;PEG的浓度为质量浓度,35g/100mL。
优选地,所述原生质体悬浮液混合前,需将菌株分别置于70℃条件下处理15min或者750W的微波炉中低热档处理50s。
优选地,所述水浴温度为32℃,所述保温静置时间为5分钟。
优选地,步骤B中,所述筛选的方法包括以下步骤将经原生质体融合后获得的融合子进行稀释涂布培养,根据菌落上绿色晶体的产量进行筛选,即可获得高PCN产量的融合子。
与现有技术相比,本发明具有如下的有益效果:
1、本发明采用诱变处理和基因组改组技术对绿针假单胞菌HT66的突变株进行筛选,并获得了一种吩嗪-1-甲酰胺高产菌株,与出发株相比,其吩嗪-1-甲酰胺的产量最高提高了2.8倍。
2、本发明优化了原生质体制备与融合的相关参数,提高了基因组改组的效率。
3、本发明的方法操作简单,无需进行标记,缩短了育种周期,大大节省劳动成本。
附图说明
通过阅读参照以下附图对非限制性实施例所作的详细描述,本发明的其它特征、目的和优点将会变得更明显:
图1为本发明实施例1制备的高产融合子的PCN产量变化图;
图2为本发明实施例2制备的高产融合子的PCN产量变化图。
具体实施方式
下面结合具体实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进。这些都属于本发明的保护范围。
实施例1
1.1 NTG诱变与初筛
本实施例以绿针假单胞菌HT66为出发株,采用化学诱变剂处理获得高产的突变株。所述的诱变处理可以为NTG诱变,但不限于该方法。采用NTG诱变处理时,其步骤如下:
配制浓度为10g/L的NTG母液,使用时按比例稀释。吸取1mL对数期菌悬液,用无菌0.01mol/L的PBS缓冲液(pH7.4)洗涤菌体两次;加入1mL PBS缓冲液重悬菌体,加入适量的NTG母液,使NTG终浓度为50、100、200、500、1000g/L,28℃处理20min;加入0.5mL 1mol/L的NaCl溶液终止反应,使用无菌培养基洗涤菌体3次彻底去除残留NTG,适量稀释后涂布平板,24h后计数平板上长出的菌落个数,得到致死率。当NTG处理剂量为100ppm时,菌株HT66的致死率约为75%。因此,首次使用NTG诱变的处理浓度为100ppm,以同样的方法进行诱变处理。
培养至平板上的菌落可以明显看出有绿色结晶,观察菌落的大小,以及绿色结晶出现时间的早晚和绿色结晶的多少,根据这三点直接筛选出产量较高的四个单菌落,分别为1,2,3,4。分别挑取4个菌株的单菌落接种于5mL液体培养基的小瓶中,放置于28℃,180rpm的摇床上培养48h后取样,每个样品中加入1mL的乙腈,并且充分振荡混匀溶解样品。将乙腈溶解的抽提物用0.22μm有机相滤头过滤至进样瓶中,进行HPLC检测。
色谱柱采用岛津WondaSil-WR C-18反相柱(5μm×250mm),检测波长为254nm,流速为1mL/min,柱温为30℃。检测条件为:0-2min:乙腈8%,5mmol/L乙酸铵92%;2-20min:乙腈由8%升至60%,5mmol/L乙酸铵由92%降至40%;20-21min:乙腈8%,5mmol/L乙酸铵92%。
将筛选的四株产量较高的菌株1(HT66-N1),2(HT66-N2),3(HT66-N3),4(HT66-N4)以及出发株(HT66)分别进行摇瓶发酵,取样以HPLC产量测定峰面积并计算出PCN的实际产量,测定结果如下表1所示。
表1 突变株的PCN产量
从图中可以看出,筛选的四个突变株的PCN产量相对于HT66原始菌株的产量有明显提高,其中HT66-N2的产量最高,按照48h的PCN产量来算的话,可以达到886mg/L,比原始菌株提高了100%。即使是产量最低的突变株HT66-N4在48h的产量也达到了816mg/L,相比原始菌株提高了85%。
1.2 原生质体制备
原生质体的制备主要依靠溶菌酶的作用,但是在制备体系中添加渗透压稳定剂(甘露醇浓度分别为0.3M、0.5M和0.7M)、螯合剂(Na-EDTA的浓度分别为0.1%、0.2%和0.3%)以及选择不同菌龄(18h,24h,30h)都是影响原生质体制备和再生效率的重要因素,利用正交试验来探索绿针假单胞菌原生质体制备的最优条件。
将培养一定时间的菌液离心收集菌体,重新悬浮于SMM缓冲液中(含蔗糖0.5mol/L,顺丁烯二酸20mmol/L,六水合氯化镁20mmol/L)。然后添加浓度为0.2mg/mL的溶菌酶及不同浓度的渗透压稳定剂、螯合剂,置于37℃恒温水浴锅中酶解一小时后取出,6000rpm离心后吸去溶液,用pH6.8磷酸缓冲液清洗两次后重悬,稀释一定倍数,吸取100μL分别涂布在KB培养基的平板,将平板置于28℃恒温培养箱中培养。
定期观察所有平板上的菌落生长情况,到所有平板上的菌落都生长到可以明确计数的时候,对每个平板上的菌落的数量进行计数。
A组平板上的菌落数代表为原始菌液中的细胞数。
B组平板上的菌落数代表经溶菌酶处理之后的菌液中没有成为原生质体的细胞数,因为原生质体失去了细胞壁无法在基本培养基上生长。
C组平板上的菌落数代表经溶菌酶处理后没有成为原生质体的细胞以及制备为原生质体且成功再生出来的细胞数,因为在再生培养基上,不仅完整的细胞可以生存,失去细胞壁的部分原生质体也可以再生。
按照上述的A,B,C的含义,可以知道原生质体的制备率ZB和再生率ZS的计算公式:
正交试验结果见下表2所示。
表2 正交试验结果
从上表2中可以看出,各因素最高平均综合分的条件为:菌龄为18h,甘露醇浓度0.5M,EDTA浓度为0.1%。
1.3 原生质体融合
原生质体的融合过程就是基因组重排的过程,所以不仅需要选择最佳的融合条件,而且要选择融合的亲本菌株。研究发现,融合条件如PEG分子量和浓度、促融化合物DMSO对融合效率有较大影响。本专利以NTG诱变得到的四株高产突变株为亲本,分别制备为原生质体溶液后等体积混合,可以筛选到高产融合子。
分别吸取0.25mL的四株亲本的原生质体悬浮液在1.5mL离心管中,四株亲本分为两组,第一组四株亲本的原生质体悬浮液置于70℃条件下处理15min,第二组四株亲本的原生质体悬浮液置于750W的微波炉中低热档处理50s。
将第一组和第二组共计8个离心管中的原生质体悬浮液等量混合,离心,去除上清液。
加入0.1mL的pH6.8磷酸缓冲液,吹打原生质体沉淀,重新悬浮。
然后加入一定量的PEG和DMSO,以pH6.8磷酸缓冲液定容到1mL,充分混匀。
放在32℃水浴中保温静置。
5分钟后取出即可。
融合之后,按照一定的比例稀释融合液,每个稀释倍数吸取100μL涂布在高渗KB培养基的平板上。放在28℃恒温培养箱中进行培养。
培养三天后,每天定期过来观察平板上的菌落生长情况,等到菌落生长到可以清晰计数的时候,就可以计算融合率了。
融合率=(融合后平板菌落数X相应稀释倍数)/(灭活前双亲等量混合平板菌落数X相应稀释倍数)X100%
通过计算不同融合条件下原生质体的融合率,可以得到绿针假单胞菌原生质体融合的最佳条件。下表3是不同条件下的融合率。
表3 不同融合条件下的融合率
从上表可以看出,使用浓度为25%的PEG8000为融合剂,添加1%的DMSO时原生质体的融合率最高,可达82.1%。
1.4 高产PCN融合子的筛选
将融合子培养至可以看出菌落上的绿色结晶的时候,按照绿色结晶的多少来直接筛选产量较高的菌株,进行摇瓶发酵和PCN产量测定。由平板上筛选到四株绿色结晶较多的菌株,分别编号为HT66-SF1,HT66-SF2,HT66-SF3,HT66-SF4。
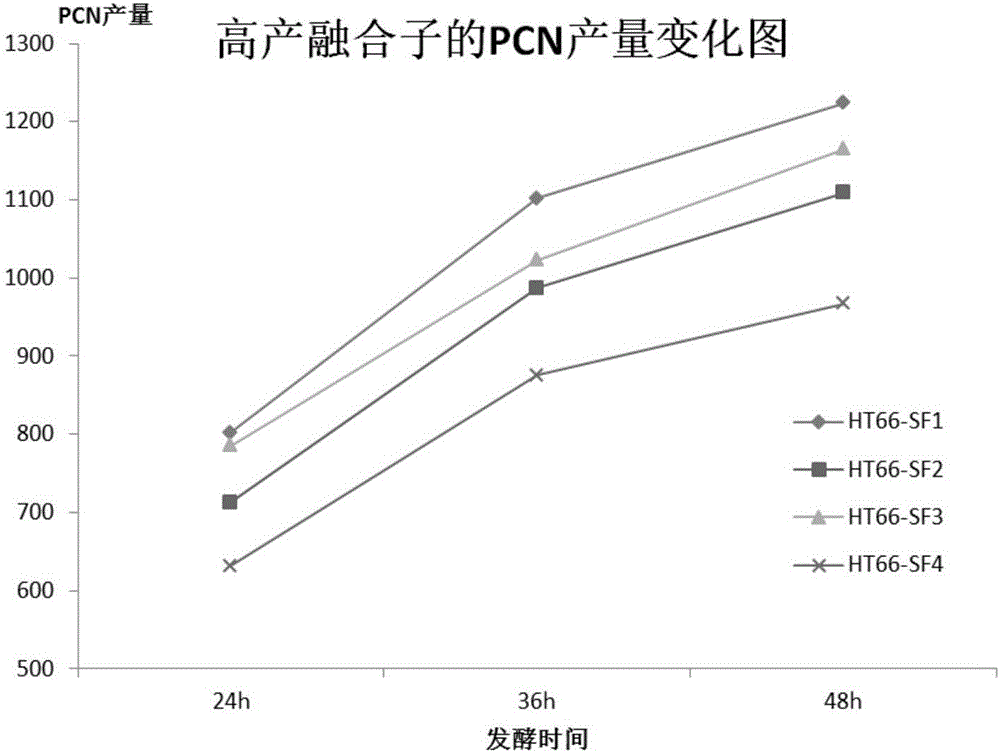
对这四个高产PCN的融合子进行发酵实验,根据高产融合子的24h,26h,48h的PCN产量绘制产量变化图,如图1所示。
从图1中可以看出,筛选到的四个融合子的产量都有所提高,产量最高是菌株HT66-SF1,48h的PCN产量达到了1224mg/L,是HT66野生型产量的2.8倍。
实施例2
2.1 钴-60γ射线诱变与初筛
本实施例以绿针假单胞菌HT66为出发株,采用物理诱变处理获得高产的突变株。所述的诱变处理可以为钴-60γ射线诱变,但不限于该方法。具体方法包括以下步骤:
1.取出发菌株HT66,活化并培养为种子液。
2.取种子液离心,吸去培养基,以PBS缓冲液重悬菌体,使细胞浓度约为107至108个/mL。
3.将细胞悬浮液分装至灭菌的玻璃进样小瓶中,置于钴-60γ射线放射环境中接受辐照;对照组菌液小瓶不接受辐照。
各组细胞悬浮液接受的吸收剂量分别为0.225、0.320、0.430、0.490和0.905kGy。
4.辐照完毕后,吹打混匀各组菌液,进行梯度稀释并涂布,每组设置3个平行。待菌落长出后,挑选平板上的菌落数介于30至300个之间的计数,对各组中菌落数进行计数并计算活菌数和致死率,如表4所示。
钴-60(60Co)半衰期为5.27a,可通过β衰变释放出能量为315keV的高速电子成为镍-60,并放出两束γ射线,其能量分别为1.17及1.33MeV。其衰变反应方程式为:
考虑到对于照射量率常数为Γ的放射性同位素放射性活度为A的放射源,物体在距离点源距离为R处辐照时间为t,其接受的吸收剂量为:
其中,f为照射剂量换算为吸收剂量的常数,为照射量率,钴-60的照射量率常数Γ为1.32Rm2/(h·Ci)。可见,对于特定的放射源,物体接受的吸收剂量与辐照时间成正比,与到点源距离的平方成反比,故R和t是可用于控制吸收剂量的变量。考虑到放射源的具体特征及多次进出放射室的的危险性,实验通过将菌液小瓶摆放在于点源距离不同的位置一次性辐照相同时间,以控制吸收剂量。
表4 各吸收剂量下的活菌数和致死率
5.对吸收剂量为0.225kGy的菌株进行筛选
将辐照后的菌悬液转接至KB培养基中,随后稀释涂布KB平板。培养至平板上的菌落可以明显看出有绿色结晶,观察菌落的大小,以及绿色结晶出现时间的早晚和绿色结晶的多少,根据这三点直接筛选出产量较高的四个单菌落,分别为5,6,7,8。分别挑取4个菌株的单菌落接种于5mL液体培养基的小瓶中,放置于28℃,180rpm的摇床上培养48h后取样,每个样品中加入1mL的乙腈,并且充分振荡混匀溶解样品。将乙腈溶解的抽提物用0.22μm有机相滤头过滤至进样瓶中,进行HPLC检测。
色谱柱采用岛津WondaSil-WR C-18反相柱(5μm×250mm),检测波长为254nm,流速为1mL/min,柱温为30℃。检测条件为:0-2min:乙腈8%,5mmol/L乙酸铵92%;2-20min:乙腈由8%升至60%,5mmol/L乙酸铵由92%降至40%;20-21min:乙腈8%,5mmol/L乙酸铵92%。
将筛选的四株产量较高的菌株5(HT66-Q5),6(HT66-Q6),7(HT66-Q7),8(HT66-Q8)以及出发株(HT66)分别进行摇瓶发酵,取样以HPLC测得PCN的产量,结果如下表5所示。
表5 突变株的PCN产量
从上表中可以看出,四株筛选到的突变株相对于原始菌株的产量均有所提高,其中产量提高最明显的是HT66-Q6突变株,48h的平均产量可以达到803mg/mL。这四株突变株均可以作为之后基因组重排的亲本菌株,来筛选产量更高的融合子。
2.2 原生质体制备
将筛选的四株产量较高的菌株5(HT66-Q5),6(HT66-Q6),7(HT66-Q7),8(HT66-Q8)培养,当菌体培养至18h进行原生质体制备。取5mL菌液离心收集菌体,重新悬浮于相同体积的SMM缓冲液中(含蔗糖0.5mol/L,顺丁烯二酸20mmol/L,六水合氯化镁20mmol/L)。然后添加浓度为0.2mg/mL的溶菌酶及0.5M甘露醇、0.1%的EDTA,置于37℃恒温水浴锅中酶解一小时后取出,6000rpm离心后吸去溶液,用pH6.8磷酸缓冲液清洗两次后重悬,稀释一定倍数,吸取100μL分别涂布在KB培养基的平板,将平板置于28℃恒温培养箱中培养。
定期观察所有平板上的菌落生长情况,到所有平板上的菌落都生长到可以明确计数的时候,对每个平板上的菌落的数量进行计数。根据实施例1的方法计算原生质体的制备率ZB和再生率ZS,结果见下表6所示。
表6 正交试验结果
2.3 原生质体融合
分别吸取0.25mL的四株亲本的原生质体悬浮液在1.5mL离心管中,四株亲本分为两组,第一组四株亲本的原生质体悬浮液置于70℃条件下处理15min,第二组四株亲本的原生质体悬浮液置于750W的微波炉中低热档处理50s。
将第一组和第二组共计8个离心管中的原生质体悬浮液等量混合,离心,去除上清液。
加入0.1mL的pH6.8磷酸缓冲液,吹打原生质体沉淀,重新悬浮。
然后加入一定量的PEG和DMSO,以pH6.8磷酸缓冲液定容到1mL,充分混匀。
放在32℃水浴中保温静置。
5分钟后取出即可。
融合之后,按照一定的比例稀释融合液,每个稀释倍数吸取100μL涂布在高渗KB培养基的平板上。放在28℃恒温培养箱中进行培养。
2.4 高产PCN融合子的筛选
将融合子培养至可以看出菌落上的绿色结晶的时候,按照绿色结晶的多少来直接筛选产量较高的菌株,进行摇瓶发酵和PCN产量测定。由平板上筛选到五株绿色结晶较多的菌株,分别编号为HT66-QC1,HT66-QC3,HT66-QC5,HT66-QC6,HT66-QC9。
对这五个高产PCN的融合子进行发酵实验,根据五株高产融合子的24h,26h,48h的PCN产量绘制产量变化图,如图2所示。
根据图2的数据可以看出,用基因组重排的方法选育出来的五个融合子的产量有明显的提高,产量最高的是HT66-QC6菌株,48h达到了1398mg/L,是原始出发菌株HT66的2.6倍。
综上所述,本发明提供了一种新的吩嗪-1-甲酰胺高产菌株的育种方法,通过诱变处理和基因组改组的结合,制备出了产量提高达2.8倍的吩嗪-1-甲酰胺高产菌株。该方法可以采用任何诱变方法,只要能获得正突变株即可,且无需对亲本菌株进行标记,将多个突变的高产株制备成融合子后随机融合,可以缩短育种周期,工作效率大幅度提高。
本发明具体应用途径很多,以上所述仅是本发明的优选实施方式。应当指出,以上实施例仅用于说明本发明,而并不用于限制本发明的保护范围。对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进,这些改进也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种新型的15种人乳头瘤病毒亚型分型试剂盒和方法与流程
- 一种与水稻稻瘟病抗性基因紧密连锁的分子标记、引物及其应用的制造方法与工艺
- 一种无创高通量甲基化结肠癌诊断、研究和治疗方法与流程
- 用于检测CDKN2B基因变异的试剂盒及CDKN2B基因变异率的定量检测方法与流程
- 用于基因甲基化检测的引物和探针、采样方法、试剂盒与流程
- 一种癌症相关基因突变高灵敏度检测方法和试剂盒与流程
- 基于高通量测序法的人类多基因突变检测试剂盒的制造方法与工艺
- 一种用于检测德尔卑沙门氏菌的靶基因、特异性引物对及检测方法和试剂盒与流程
- 一种检测测序平台索引序列污染的方法及引物与流程
- 无物种限制的真核生物同时进行基因敲除和基因过表达的制造方法与工艺