一种人羊膜间充质干细胞分离培养方法与流程
本发明涉及干细胞提取培养领域,具体而言,涉及一种人羊膜间充质干细胞分离培养方法。
背景技术:
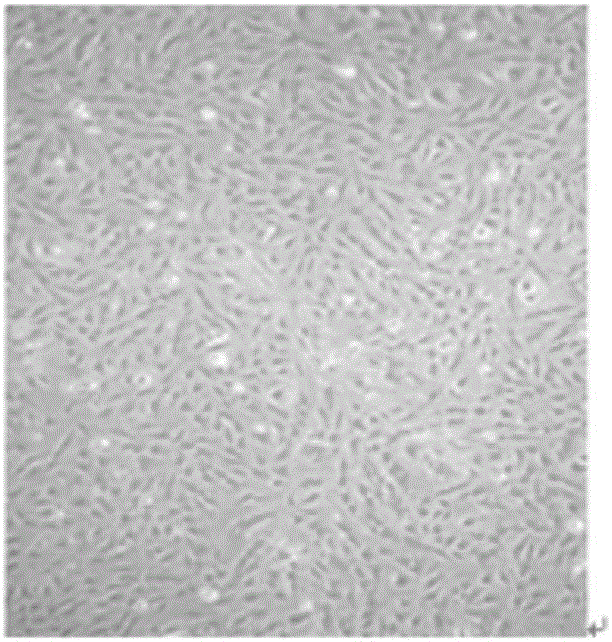
:糖尿病是一种常见的由内分泌系统代谢障碍引起的慢性终身疾病,长期患病可导致神经系统、心血管系统、泌尿系统等多种系统的慢性损害。随着我国经济的发展以及人民生活水平的提高,糖尿病患病率逐年增加,严重危害人们的健康,给家庭和社会带来沉重的经济负担。最新大样本流行病学调查显示,中国成人糖尿病患病率为11.6%,其中男性患病率为12.1%,女性患病率为11%,城市居民为14.3%,农村居民为10.3%;调查结果还显示糖尿病前期率为50.1%。目前主要是使用口服降糖药及胰岛素替代治疗,不能根治,且存在很多不足。人羊膜来源干细胞包括人羊膜上皮细胞(humanamnioticepithelialcells,hAEC)、人羊膜间充质干细胞(humanamnioticmes-enchymalstromalcells,hAMSC)。人羊膜干细胞可在体内及体外向外胚层来源的神经细胞、神经胶质细胞,内胚层来源的胰腺细胞、肝脏细胞以及中胚层来源的心肌样细胞、肌细胞、成骨细胞、脂肪细胞方向分化,并且具有无性集落形成能力和抗炎性。作为很多细胞的前体,羊膜干细胞又能抑制细胞免疫。不同的抗血管生成和抗炎症的蛋白都在羊膜干细胞中表达,这也解释了羊膜的抗血管生成和抗炎症的作用。这些性质使得羊膜干细胞已在很多治疗起到辅佐作用,而且大多数效果显著。人羊膜干细胞在具有类似胚胎干细胞性质的同时,因其无致瘤性、低免疫排斥性、含量丰富、容易获取、不引起伦理争议,极有潜力成为临床应用的干细胞来源之一。近年来,随着干细胞技术的发展,羊膜干细胞移植已经成为新的疾病治疗的发展方向。在临床应用上,羊膜干细胞在结膜损伤修复、重建眼表、防治睑球粘连与视网膜移植等眼科临床已开展了大量工作,而且在糖尿病难愈性皮肤溃疡、烧伤等创面修复愈合方面也有积极的疗效。而且,已经有实验证据证明羊膜干细胞能够分化在一定条件下能够分化为胰岛细胞。同时,也有学者报道了人羊膜间充质干细胞治疗糖尿病的病例,并取得了良好的效果。虽然现在羊膜干细胞的应用研究上已经取得了一定的成果,并已经开始利用人羊膜间充质干细胞进行糖尿病治疗的研究。然而,现有的人羊膜间充质干细胞的提取和培养的方法仍比较复杂,且无法得到具有较高纯度和活性的人羊膜间充质干细胞。因此,开发一种便捷高效且能够产业化、规模化提取和培养人羊膜间充质干细胞的方法,就成了目前亟待解决的技术问题。有鉴于此,特提出本发明。技术实现要素:本发明的第一目的在于提供一种人羊膜间充质干细胞分离培养方法,所述方法中,通过将人羊膜间充质干细胞从胎盘组织上分离、提取并纯化,然后在体外扩大增殖培养,因而能够简易、便捷且规模化的得到人羊膜间充质干细胞。从而能够解决现有技术人羊膜间充质干细胞提取分离方法复杂等技术问题。为了实现本发明的上述目的,特采用以下技术方案:一种人羊膜间充质干细胞提取分离方法,所述方法包括如下步骤:(1)将羊膜从胎盘组织上剥离,并清洗;(2)将清洗后的羊膜剪碎后,加入胰酶处理;(3)将胰酶处理后的组织清洗后,加入胶原酶I消化处理;(4)将消化处理后的组织过滤,并离心;(5)用培养液将离心后得到的细胞重悬后接种培养;(6)培养后细胞汇合度达到80~90%后,加入胰酶消化,然后加入培养基终止消化,并传代培养,即得到人羊膜间充质干细胞。本发明中,通过将人羊膜间充质干细胞从胎盘组织上分离、提取并纯化,然后在体外扩大增殖培养,因而能够简易、便捷且规模化的得到人羊膜间充质干细胞。可选的,本发明中,步骤(1)中所述清洗为以含3%双抗的HBSS缓冲溶液清洗。本发明中,通过使用含有双抗的HBSS缓冲溶液清洗剥离后所得的组织,从而能够在有效去除残留血迹的同时,还能够起到进一步消毒的作用。本发明中,步骤(1)中所述剥离是在无菌条件下进行的。本发明中,步骤(1)中所述剥离是采用机械法将羊膜从胎盘组织上剥离。本发明中,所述HBSS缓冲溶液为平衡盐溶液。本发明中,所述含3%双抗的HBSS缓冲溶液为含有3%青霉素和链霉素的HBSS缓冲溶液。本发明中,步骤(1)中所述清洗为多次清洗。可选的,本发明中,步骤(2)中所述胰酶处理为在33~38℃条件下处理25~35min;优选的,本发明中,步骤(2)中所述胰酶处理为在35~37℃条件下处理30~32min。可选的,本发明中,步骤(2)中所述胰酶为处理2~3次。本发明中,通过多次胰酶处理,从而能够充分的将羊膜上皮除去,从而得到高纯度的人羊膜间充质干细胞。可选的,本发明中,步骤(3)中所述消化处理为以浓度为0.3~0.6mg/ml的胶原酶I消化处理;优选的,本发明中,步骤(3)中所述消化处理为以浓度为0.4~0.5mg/ml的胶原酶I消化处理。可选的,本发明中,步骤(3)中所述消化处理为在35~39℃条件下消化处理1~2h;优选的,本发明中,步骤(3)中所述消化处理为在37~38℃条件下消化处理1~2h。本发明中,通过对消化处理温度和时间的调整,从而能够提高酶活性,并进一步提高酶解处理效率;同时还不会由于酶解时间过长所导致的处理效率过低以及对目标细胞组织的破坏。可选的,本发明中,步骤(3)中所述的消化处理是在水浴条件下进行的。可选的,本发明中,步骤(4)中所述离心为在转速为1300~1600rpm条件下,离心8~15min;优选的,本发明中,步骤(4)中所述离心为在转速为1400~1500rpm条件下,离心8~10min。本发明中,通过对离心转速以及离心时间等条件的选择和调整,从而能够在将人羊膜间充质干细胞充分离心得到的同时,还能够避免由于离心时间过长所导致的整体纯化处理效率的降低。可选的,本发明中,步骤(5)中所述培养是在35~38℃条件下CO2培养箱内进行的培养;优选的,本发明中,步骤(5)中所述培养是在36~37℃条件下CO2培养箱内进行的培养。可选的,本发明中,步骤(6)中所述胰酶消化是在35~38℃条件下消化3~6min;优选的,本发明中,步骤(6)中所述胰酶消化是在36~37℃条件下消化4~5min。本发明中,通过对消化处理温度和时间的调整,从而能够提高酶活性,并进一步提高酶解处理效率;同时还不会由于酶解时间过长所导致的处理效率过低以及对目标细胞组织的破坏。可选的,本发明中,步骤(5)所述接种培养是先将离心处理所得的细胞按1×106的细胞密度接种于10mm培养皿内,再放入37℃条件下的CO2培养箱内进行培养。可选的,本发明中,步骤(6)中所述培养基为DMEM/F12培养基。与现有技术相比,本发明的有益效果为:(1)本发明中,通过将人羊膜间充质干细胞从胎盘组织上分离、提取并纯化,然后在体外扩大增殖培养,因而能够简易、便捷且规模化的得到人羊膜间充质干细胞;(2)本发明中,通过对酶解消化处理等步骤条件的选择、调整以及优化,从而进一步提高了本发明间充质干细胞提取纯化效率。附图说明为了更清楚地说明本发明实施例或现有技术中的技术方案,以下将对实施例或现有技术描述中所需要使用的附图作简单地介绍。图1为培养48h后,在4×显微镜下观察到的培养基中细胞形态;图2为培养基中细胞汇合度达到80%-90%时,4×显微镜下观察到的培养基中细胞形态;图3为P5代羊膜间充质干细胞在4×显微镜下观察到的培养基中细胞形态;图4为P10代羊膜间充质干细胞在4×显微镜下观察到的培养基中细胞形态;图5为P15代羊膜间充质干细胞在4×显微镜下观察到的培养基中细胞形态;图6为细胞表面子在羊膜间充质干细胞上的表达分析检测图谱;图7A为未经诱导分化处理的P3代羊膜间充质干细胞在10×显微镜下观察到的细胞形态。图7B为经成脂诱导试剂诱导分化处理后P3代羊膜间充质干细胞在10×显微镜下观察到的细胞染色情况。图7C为经成骨诱导试剂诱导分化处理后P3代羊膜间充质干细胞在10×显微镜下观察到的细胞染色情况。具体实施方式下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。实施例1(1)在无菌条件下,采用机械法将羊膜从胎盘组织上剥离,然后,用含3%双抗HBSS冲洗数次清除残留血迹;(2)将清洗后的羊膜组织剪碎,并加入胰酶进行处理,从而去除羊膜上皮细胞;(3)将步骤(2)处理后所得组织用HBSS清洗3次后,加入浓度为0.5mg/ml胶原酶I,并在37℃水浴锅中消化处理1-2h;(4)将消化处理后所得混合物用筛网过滤,并去掉未消化组;然后在1500rpm条件下,离心处理10min.(5)用羊膜间充质干细胞培养液重悬离心处理所得的细胞,并按1×106的细胞密度接种于10mm培养皿内,并放入37℃条件下的CO2培养箱内进行培养,并在培养48小时后,得到图1所示细胞形态的培养基,并更换为新的DMEM/F12培养基;(6)如图2所示,细胞汇合度达到80%-90%后,加入胰酶37℃消化5min加入培养基终止消化,按1:3进行传代培养。本发明方法培养的人羊膜间充质干细胞可稳态由如图3所示的P5代、如图4所示的P10代一直传代培养至图5所示的P15代。实验例1流式细胞仪检测收集实施例1步骤(3)中消化处理后,过滤离心得到的人羊膜间充质干细胞,并收集约106个细胞;将收集得到的细胞用PBS缓冲溶液洗涤2次,并适当稀释;然后在流式细胞仪上加样检测;检测后,采用软件分析CD73、CD90、CD44、CD45、CD105等5种细胞表面子在人羊膜间充质干细胞上的表达,分析结果如图6所示;进一步根据图6所示分析结果进行积分计算,得出5种细胞表面子在各代的表达情况,结果如下:CD73表达情况:种群数量占母本比例(%)占总体比例总体10000—100.0P1代617161.761.7P2代6168100.061.7CD90表达情况:种群数量占母本比例(%)占总体比例总体10000—100.0P1代602860.360.3P2代587297.458.7CD105表达情况:种群数量占母本比例(%)占总体比例总体10000—100.0P1代616461.661.6P3代611899.361.2CD45表达情况:种群数量占母本比例(%)占总体比例总体10000—100.0P1代635763.663.6P3代240.40.2CD44表达情况:种群数量占母本比例(%)占总体比例总体10000—100.0P1代621862.262.2P3代616199.161.6然后统计各标志物表达情况,结果如下表所示:细胞表面标志物羊膜间充质干细胞CD73100%CD4499.1%CD10599.3%CD9097.4%CD450.4%检测结果显示,本发明人羊膜间充质干细胞高表达了CD73、CD44、CD105以及CD90,基本不表达CD45。实验例2成脂及成骨分化的实验研究干细胞具有自我复制及多项分化的潜能。到目前为止人们已经陆续从脐带,胎盘,骨髓,脂肪,皮肤,毛囊等组织提取分离出间充质干细胞。分离方法主要有种植法和酶消化法两种。不同的方法和实验程序对提取的干细胞的质量和纯度有很大差异。所以干细胞的分化实验是世界上普遍认可的干细胞鉴定标准。具体检测方法如下:a、将实施例1步骤(5)中P3代羊膜间充质干细胞以1x105ml-1的密度接种于12孔板,待其融合度达到70%-80%后,加入成脂诱导液,并有对照孔。每周换液两次,诱导14-18天后,进行油红O染色鉴定脂滴形成,显微镜下观察并拍照,见图7B。b、将实施例1步骤(5)中P3代羊膜间充质干细胞细胞以1x105ml-1的密度接种于12孔板,待其融合度达到70%-80%加入成骨诱导液,并有对照孔。每周换液两次,诱导21-25天后,进行茜素红染色鉴定骨结节形成,显微镜下观察并拍照,见图7C。图7A为阴性对照,经对照检测发现,本发明羊膜间充质干细胞具有良好的成脂、成骨能力。经对照检测发现,本发明羊膜间充质干细胞具有良好的成脂、成骨能力。本发明方法中,通过将人羊膜间充质干细胞从胎盘组织上分离、提取并纯化,然后在体外扩大增殖培养,因而能够简易、便捷且规模化的得到人羊膜间充质干细胞。尽管已用具体实施例来说明和描述了本发明,然而应意识到,在不背离本发明的精神和范围的情况下可以作出许多其它的更改和修改。因此,这意味着在所附权利要求中包括属于本发明范围内的所有这些变化和修改。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1