一类新型双三酰胺有机化合物的制备及其用途的制作方法
本发明属于放射性废物处理领域,涉及新型对称双三酰胺有机化合物的制备及应用,适用于Th(IV)/U(VI)及Pu(IV)/U(VI)的分离,并适用于Ln(III)/Ac(III)分离及裂片元素Tc(VII)的分离。
背景技术:
目前,面临能源危机以及生态环境的恶劣趋势,世界上若干国家都积极发展核电项目,主要是以铀作为核燃料,而其乏燃料后处理十分困难,并具有挑战性。同时,为了提高对铀的使用率,欧美国家研究新型核反应堆,即第四代核反应堆,如快堆,钍堆,高温气冷堆等。因此,动力堆、第四代核反应堆的开发必然会带来核废物的处置以及乏燃料的分离和回收。乏燃料的后处理主要涉及Th(IV)/U(VI)的分离和纯化,Pu(IV)/U(VI)的分离和纯化,Ln(III)/Ac(III)分离和纯化,其他裂片元素,如Tc(VII)、Zr(IV)、Sr(II)等的分离纯化。
对于Th(IV)/U(VI)的分离和纯化,其中最主要的工艺流程是Thorex(Thorium Uranium extraction)流程,磷酸三丁酯(TBP),DMHMP(di(1-methyl-heptyl) methyl phosphonate)以及伯胺N1923等萃取剂均可用于Th(IV)/U(VI)的分离和纯化,但是也存在如下缺点,分配比低,分离系数低,易形成三相等。
对于Pu(IV)/U(VI)的分离和纯化,主要采用Purex(Plutonium uranium recovery by extraction)流程,该流程以磷酸三丁酯(TBP)为萃取剂。但是,TBP存在不耐辐照,易降解以及产生大量的次级放射性废物等缺点。此外,在分离纯化Pu(IV)时,容易形成第三相。
对于Ln(III)/Ac(III)的分离和纯化,可通过DIAMEX(diamide extraction)流程或TODGA(N, N, N’, N’-tetraoctyl diglycolamide)流程等共萃萃余液中的Ln(III)和Ac(III),再通过含N或含S类的萃取剂选择性萃取锕系,从而实现Ln(III)/Ac(III)分离。目前,BTPhen(2,9-bis(1,2,4-triazin-3-yl)-1,10-phenanthroline),仅含CHN元素,该萃取剂能够高效高选择性分离Ln(III)/Ac(III),SFAm/Eu = 400。但是,由于反萃困难,以及合成BTPhen萃取剂步骤繁琐,困难,成本高等缺点,这不利于该萃取剂应用于工业流程之中。最后,对于裂片元素如Tc(VII)的分离,在Purex流程中,Tc和Pu被TBP共萃后,可通过5 mol.L-1HNO3反萃负载在有机相(30%TBP正十二烷)中的Tc,剩余的Tc最后通过离子交换除去。但是,存在的缺点是离子交换去除不干净不彻底。
面对Th(IV)/U(VI)、Pu(IV)/U(VI)、Ln(III)/Ac(III)以及裂片元素的分离和纯化所存在的问题,迫切需要研发新型的萃取剂。其中含S、P元素等的萃取剂对生态环境具有严重的危害性,易形成第三相,不耐强酸以及分配比低等,而仅含CHON元素的萃取剂易于完全焚化,对环境友好,在一定程度上能够克服三相的形成以及具有较高的萃取能力和选择性。如符合CHON原则的NTAamideC8(N, N, N’, N’, N’’ ,N’’ -hexaoctylnitrilotriacetamide)萃取剂被用于萃取Th(IV),并具有较好的选择性,也可实现Ln(III)/Ac(III)的分离。但是该萃取剂浓度为0.01 mol.L-1,萃取体系介质为3 mol.L-1的HNO3溶液,以煤油为稀释剂,DTh = 20 - 30,所需萃取剂的浓度过大,分配比仍较低,不能够更好的应用于对Th(IV)的分离和纯化。因此,为了克服萃取剂稳定性差,对环境污染大,不易焚化等缺陷,以及在液液萃取过程中出现三相的问题,设计和合成了一系列的新型对称双三酰胺萃取剂。本发明所设计的一类新型对称双三酰胺萃取剂,具有仅含CHON元素,可被完全焚化,相对于含P、S等元素的萃取剂而言,对环境污染小;经多步合成,但快速简便,目标产品产率均在80 - 99%,经济高效;含有对称双三酰胺,并具有对称双三脚架结构,通过改变双三酰胺之间碳链的长短控制对Th(IV)以及U(VI)的萃取能力;通过调节酰胺氮原子上的烷基(R)碳链增强其与水不互溶,可应用于液液萃取流程;在一定程度上能够克服三相的形成等特点。该类新型双三酰胺萃取剂可应用于Th(IV)/U(VI)、Pu(IV)/U(VI)、Ln(III)/Ac(III)以及裂片元素Tc(VII)的分离。
技术实现要素:
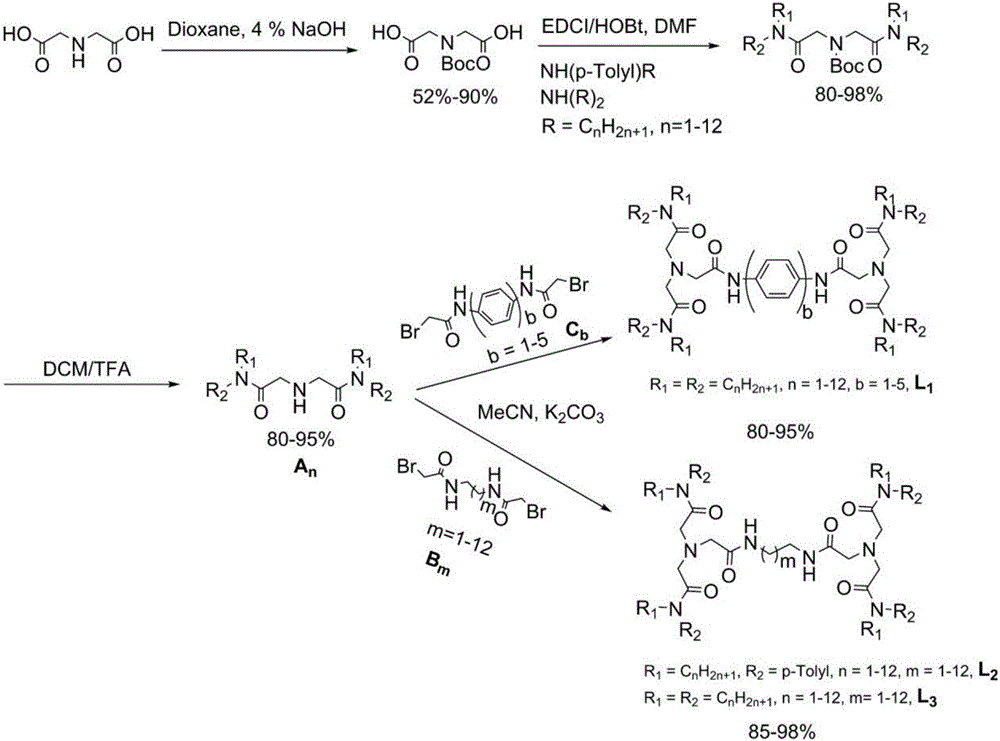
合成了一系列新型双三酰胺类有机化合物,仅由CHON四种元素组成,具有对称双三酰胺结构以及对称双三脚架结构,双三酰胺之间通过烷基链或芳基链接起来,此外,酰胺分子中的酰胺氢可以被烷基或者芳基等取代。上述结构可分为四类,如下所示(L1,L2,L3,L4)。
上述结构的新型双三酰胺类有机化合物以亚氨基二乙酸为原料(图1),亚氨基被二碳酸二叔丁酯((Boc)2)保护后,经酰胺化反应,再通过三氟乙酸(TFA)脱去Boc(叔丁氧羰基)保护基,经三步反应获得中间体仲胺An;以溴乙酰溴与不同碳链的二氨基(伯胺或仲胺)烷烃为起始原料反应(图2),溶剂可选氯仿、二氯甲烷、乙酸乙酯与水等为溶剂的条件下获得二溴化物Bm。最后,将An与Bm在有机溶剂中反应,溶剂可选四氢呋喃,乙腈,氯仿,二氯甲烷,甲苯等,加入碱,碱的选择可为Na2CO3,K2CO3,Cs2CO3,NaH,三乙胺;加入催化剂,可选为NaI,KI等;在40-110 ℃条件下反应,即可获得产率在80 - 99%的结构相似的含不同基团的新型双三酰胺类有机化合物。
该类化合物可通过改变双三酰胺之间碳链的长短控制对Th(IV)及U(VI)的萃取能力;此外,通过调节酰胺氮原子上的烷基(R)碳链增强其与水不互溶,使其溶于芳香类,烷基类,含卤素溶剂等,从而应用于液液萃取流程。该类新型双三酰胺萃取剂可应用于Th(IV)/U(VI)分离、Pu(IV)/U(VI)分离、Ln(III)/Ac(III)分离以及裂片元素Tc(VII)的分离。该类有机化合物可在高浓度硝酸条件下对Th(IV)萃取均具有较高的分配比,并具有显著的选择性,从而实现Th(IV)/U(VI)分离。此外,因Th(IV)和Pu(IV)具有相似的化学性质,因此,该酰胺类萃取剂也能够用于实现Pu(IV)/U(VI)分离。
尤其是本发明的双三酰胺L3-58萃取剂,以煤油为稀释剂,萃取体系的介质为1.0 10-3 - 10 mol.L-1 HNO3溶液,萃取剂浓度在2.0 10-3 - 1.0 mol.L-1条件下高效高选择性萃取Th(IV),分配比DTh = 10 - 1.0 103,分离系数SFTh/U = 1.0 102 –1.0 103,无三相形成。所设计的这类萃取剂,在1.0 10-3 - 10 mol.L-1 HNO3条件下,DAm= 2 - 2.0 102,SFAm/Eu = 2 - 1.0 103,可实现Ln(III)/Ac(III)分离。对于裂片元素Tc(VII)的分离,主要是在Purex流程中,因Re(VII)和Tc(VII)具有相似的化学性质,Re(VII)可以代替Tc(VII)作为研究,DRe = 2 - 2.0 102。
本发明可以通过以下技术方案实现。
一系列新型酰胺类有机化合物,仅由CHON四种元素组成,具有对称双三酰胺结构以及对称双三脚架结构,双三酰胺之间通过烷基链或芳基链接起来,根据酰胺氮原子上烷基链碳原子数目不同以及不同的芳基基团,可溶于不同极性的有机溶剂以及水相之中。
本发明提供了制备新型双三酰胺有机化合物的合成工艺,如图1所示,包括如下步骤:
以亚氨基二乙酸为原料,亚氨基被二碳酸二叔丁酯((Boc)2)保护后,经酰胺化反应,再通过三氟乙酸(TFA)脱Boc保护基团,经多步反应获得中间体仲胺(An);
以溴乙酰溴与不同碳链的二氨基(伯胺或仲胺)烷烃为起始原料反应(图2),溶剂可选为氯仿,二氯甲烷,乙酸乙酯与水等条件下获得二溴化物(Bm);
将An与Bm在有机溶剂中反应,溶剂可选择为如四氢呋喃,乙腈,氯仿,二氯甲烷,甲苯等;加入碱,碱的选择可为Na2CO3,K2CO3,Cs2CO3,NaH,三乙胺;加入催化剂,可选为NaI,KI等;在40-110 ℃条件下反应,即可获得产率在80 - 99%的结构相似的含不同基团的新型双三酰胺类化合物。
作为可选,该类新型对称双三酰胺有机化合物在高酸度条件下进行液液萃取实验,浓度为2.0 10-3 - 1.0 mol.L-1的有机化合物在萃取之后,水相与有机相两层分层清晰,无三相形成,对Th(IV)具有较高的萃取能力,分配比DTh = 3 - 1.0 103,分离系数SFTh/U = 5 - 1.0 103,可实现Th(IV)/U(VI)分离。因Th(IV)和Pu(IV)具有相似的化学性质,在同等条件下,适用于Pu(IV)的萃取,从而实现Pu(IV)/U(VI)分离。
作为可选,该类新型双三酰胺化合物还能够实现Ln(III)/Ac(III)分离,如萃取剂L3-58以煤油为稀释剂,浓度在2.0 10-3 - 1.0 mol.L-1,能够在1.0 10-3 - 10 mol.L-1HNO3溶液条件下,以铕(Eu)作为镧系的代表元素,以镅(Am)作为锕系的代表元素,从镧系之中高效高选择性萃取Am(III),DAm = 2 – 2.0 102,SFAm/Eu = 2 – 1.0 103,无三相形成。
作为可选,该类新型双三酰胺化合物能够高效萃取Re(VII),其特征在于,在1.0 10-3 - 10 mol.L-1 HNO3中,浓度在2.0 10-3 - 1.0 mol.L-1条件下,DRe = 2 – 2.0 102,无三相形成。因Re(VII)与Tc(VII)具有相似的化学性质,因此,同样适合对Tc(VII)的萃取。
该类新型对称双三酰胺可应用于放射性废物处理领域,可在1.0 10-3 - 10 mol.L-1 HNO3条件下,实现Th(IV)/U(VI)分离;因Th(IV)和Pu(IV)具有相似的化学性质,也可实现Pu(IV)/U(VI)分离。此外,还可以用于Ln(III)/Ac(III)的分离以及裂片元素Tc(VII)分离。
本说明书中公开的所有特征,或公开的所有方法或过程中的步骤,除了互相排斥的特征和/或步骤以外,均可以以任何方式组合。
本发明的有益效果:
本发明经多步、简单便捷、高效经济的合成方法合成了上述新型对称双三酰胺类化合物,并具有产率高(80-99%),分离纯化容易等优点。此外,这类新型对称双三酰胺化合物应用于液液萃取流程中,能够适用于高酸度条件下实现Th(IV)/U(VI)分离,Pu(IV)/U(VI)分离,Ln(III)/Ac(III)分离以及裂片元素Tc(VII)的分离。尤其是本发明的新型双三酰胺L3-58,以煤油为稀释剂,在1.0 10-3 - 10 mol.L-1 HNO3条件下高效高选择性萃取Th(IV),DTh = 10 - 1.0 103,SFTh/U = 1.0 102 –1.0 103,无三相形成,实现Th(IV)/U(VI)分离。在同等条件下,因Th(IV)和Pu(IV)具有相似的化学性质,还可实现Pu(IV)/U(VI)分离。同时可以在煤油体系里用于Ln(III)/Ac(III)分离及裂片元素Tc(VII)的分离。由于该类新型双三酰胺化合物仅含CHON等元素,相对于含P、S等元素的萃取剂而言,可被完全焚化,对环境污染小,同时在酸度体系里并更稳定。尤其重要的是这类结构的物质通过调节R基团可以在高酸度体系里,以煤油作为稀释剂应用于Th(IV)/U(VI)分离,Pu(IV)/U(VI)分离,Ln(III)/Ac(III)分离以及裂片元素Tc(VII)的分离,因此容易在中高放废液处理流程的不同流程段的使用。
附图说明
图1为本发明新型双三酰胺类有机化合物的合成路线图。
图2为本发明新型双三酰胺类有机化合物中间体的合成路线图。
图3新型酰胺类有机化合物L3-34和L3-54分别萃取Th(IV)、U(VI)实验数据。
图4新型酰胺类有机化合物L3-58分别萃取Th(IV)、U(VI)实验数据。
具体实施方式
以下通过实施例的具体实施方式对本发明的上述内容作进一步的详细说明。此处所描述的具体实例仅仅用以解释本发明,并不用于限定本发明。在不脱离本发明的精神和原则之内做的任何修改,以及根据本领域普通技术知识和惯用手段做出的等同替换或者改进,均应包括在本发明的保护范围内。
实施例1新型酰胺类有机化合物L3类萃取剂(图1),L3-58制备如下:
以亚氨基二乙酸为最初原料,亚氨基二乙酸在4% NaOH水溶液,以二氧六环为溶剂,反应72 h,经二碳酸二叔丁酯((Boc)2)保护亚氨基后,经在乙酸乙酯与正己烷,体积比(1:2)条件下重结晶,获得含有叔丁氧羰基(Boc)保护的二乙酸纯品。然后,获得Boc保护的二乙酸再以N, N –二甲基甲酰胺(DMF)为溶剂,以1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDCI),1-羟基苯并三唑(HOBt)为催化剂,在氮气保护下,在0-25 ℃反应24 h,加入二正辛胺,进行酰胺化反应。反应完全之后,通过加入乙酸乙酯萃取产品,再通过饱和柠檬酸,饱和碳酸氢钠,饱和食盐水溶液依次洗涤三次,经干燥过滤之后除去有机溶剂,获得粗产品,在将此粗产品通过柱层析,以乙酸乙酯:石油醚(1:10)为洗脱剂进行纯化,从而获得含Boc保护基的二酰胺化合物;最后,该Boc保护基的二酰胺化合物再通过三氟乙酸:二氯甲烷(v:v=1:1),在0-25 ℃反应24 h脱Boc保护基团,通过蒸馏方法除去溶剂以及三氟乙酸,然后依次经过饱和碳酸氢钠溶液,饱和食盐水洗涤,硫酸镁干燥后过滤得到中间体仲胺A8。
中间体二溴化物的制备是以溴乙酰溴与1,6-己二胺为原料,以氯仿和水为溶剂,在5 ℃反应2 h,烧瓶底部出现白色沉淀,将白色沉淀不断用蒸馏水洗涤若干次,60 ℃真空干燥后获得纯品B5,产率在80 - 96%。
最后,将所制备的中间体仲胺与二溴化物在乙腈为溶剂的条件下,40 - 85 ℃反应3 - 5 h。反应完全后,除去溶剂,加入乙酸乙酯萃取产品,依次通过5%盐酸水溶液,饱和碳酸氢钠溶液,饱和食盐水溶液洗涤三次之后,无水硫酸钠干燥之后除去溶剂,经60 ℃干燥获得纯品L3-58。此外,L3-14萃取剂(R = n-C4H9, m = 1);L3-34萃取剂(R = n-C4H9, m = 3);L3-54萃取剂(R = n-C4H9, m = 5),合成方法及步骤与L3-58一致,产率80 - 99%。
表征结果如下:
L3-141H NMR (400 MHz, CDCl3) δ 8.85 (s, 2H), 3.60 (s, 8H), 3.40 (d, 8H), 3.27 (m, 8H), 3.11 (m, 8H), 1.46 (m, 16H), 1.27 (m, 16H), 0.91 (td, 24H).
13C NMR (100 MHz, CDCl3) δ 172.32, 170.20, 59.90, 55.15, 46.79, 45.92, 38.89, 31.08, 29.89, 20.28, 20.05, 13.91, 13.86.
ESI-MS: m/z [M+Na]+ 873.6831.
L3-341H NMR (400 MHz, CDCl3) δ 8.76 (s, 2H), 3.55 (s, 8H), 3.39 (s, 4H), 3.24 (m, 12H), 3.07 (m, 8H), 1.53 (s, 4H), 1.43 (dd, 16H), 1.24 (dt,16H), 0.88 (t, 24H).
13C NMR (100 MHz, CDCl3) δ 171.98, 170.14, 60.13, 55.34, 46.76, 45.94, 38.89, 31.07, 29.88, 27.19, 20.27, 20.05, 13.89.
ESI-MS: m/z [M+Na]+ 901.7146, 462.3527.
L3-541H NMR (400 MHz, CDCl3) δ 8.73 (s, 2H), 3.57 (s, 8H), 3.41 (s, 4H), 3.23 (m, 12H), 3.10 (m, 8H), 1.46 (m, 20H), 1.27 (m, 20H), 0.90 (t, 24H).
13C NMR (100 MHz, CDCl3) δ 171.88, 170.10, 60.11, 55.33, 46.76, 45.93, 39.11, 31.07, 29.88, 29.59, 26.81, 20.26, 20.04, 13.90, 13.84.
ESI-MS: m/z [M+Na]+ 929.7449, 476.3679.
L3-581H NMR (400 MHz, CDCl3) δ 8.71 (t, 2H), 3.57 (s, 8H), 3.41 (s, 4H), 3.22 (m, 12H), 3.09 (m, 8H), 1.47 (m, 16H), 1.28 (m, 88H), 0.86 (td, 24H).
13C NMR (100 MHz, CDCl3) δ 171.83, 170.06, 77.36, 77.04, 76.72, 60.11, 55.32, 47.06, 46.27, 39.12, 31.78, 29.63, 29.25, 27.80, 27.09, 26.83, 22.62, 14.08.
ESI-MS: m/z [M+Na]+ 700.6207.
实施例2新型酰胺类有机化合物L1类萃取剂(图1),L1-14制备如下:
合成步骤如图2所示,其中,中间体仲胺A4的制备与实施例1相同,而二溴化物C1的制备是通过以溴乙酰溴,对苯二胺为原料(图2),以四氢呋喃(THF)为溶剂,在0 - 25 ℃条件下反应2 h,然后通过水不断洗涤产品若干次,即可获得固体产品。
最后,将A4和C1在乙腈为溶剂的条件下,40 - 85 ℃反应5 h。反应完全后,除去溶剂,加入乙酸乙酯萃取产品,依次通过5%盐酸水溶液,饱和碳酸氢钠溶液,饱和食盐水溶液洗涤三次之后,无水硫酸钠干燥之后除去溶剂,经60 ℃干燥获得淡黄色固体产品L1-14,产率80 - 95%。
表征结果如下:
L1-141H NMR (400 MHz, CDCl3) δ 10.95 (s, 2H), 7.72 (s, 4H), 3.67 (s, 8H), 3.55 (s, 4H), 3.31 (m, 8H), 3.11 (m, 8H), 1.48 (m, 16H), 1.28 (dt, 16H), 0.91 (td, 24H).
13C NMR (100 MHz, CDCl3) δ 170.36, 170.25, 134.69, 119.79, 61.13, 55.77, 46.82, 46.09, 31.15, 29.97, 20.36, 20.12, 13.94.
ESI-MS: m/z [M+Na]+ 921.6876, 472.3379。
实施例3新型酰胺类有机化合物L3-14用于Th(IV)、U(VI)的液液萃取实验。
具体方法如下:
在甲苯中配制浓度为0.01 mol.L-1的L3-14作为有机相;并分别在不同浓度的硝酸体系中(1.0 10-3 - 10 mol.L-1 HNO3)配制大约为50 mg.L-1的硝酸钍水溶液、硝酸铀酰水溶液作为水相。分别取相同体积(1 - 2 mL)有机相以及水相混合,在25 ℃条件下搅拌,大约1小时后,萃取达到平衡。然后静置使得有机相和水相分层,离心,然后通过ICP-AES分别测试水相中金属钍离子以及铀酰离子的含量,最后分别计算出有机相以及水相中同一金属离子的含量的比值,即为分配比DM。其中,在0.1 mol.L-1硝酸条件下,DTh = 5.10 0.2,DU = 0.012 0.001。
实施例4新型酰胺类有机化合物L3-34,L3-54用于Th(IV)、U(VI)的液液萃取实验。
具体方法如下:
在硝基苯中分别配制浓度为0.01 mol.L-1的L3-34,L3-54作为有机相;并分别在不同浓度的硝酸体系中(1.0 10-3 - 10 mol.L-1 HNO3)分别配制大约为50 mg.L-1的硝酸钍水溶液、硝酸铀酰水溶液作为水相。具体方法与实施例3一致。其中,在1.0 10-3 - 3 mol.L-1HNO3范围内,L3-34,L3-54的萃取数据如图3。
实施例5新型酰胺类有机化合物L3-58用于Th(IV)、U(VI)的液液萃取实验。
具体方法如下:
在煤油中配制浓度为2.0 10-3 mol.L-1的L3-58作为有机相;并分别在不同浓度的硝酸体系中(1.0 10-3 - 10 mol.L-1 HNO3)分别配制大约为50 mg.L-1的硝酸钍水溶液、硝酸铀酰水溶液作为水相。具体方法与实施例3一致。其中,在1.0 10-3 - 3 mol.L-1 HNO3范围内,L3-58的萃取数据如图4。
实施例6新型酰胺类有机化合物L3-58用于Th(IV)/U(VI)混合的液液萃取实验。
具体方法如下:
在煤油中配制浓度为2.0 10-3 mol.L-1的L3-58作为有机相;并分别在不同浓度的硝酸体系中(1.0 10-3 - 10 mol.L-1 HNO3)配制大约为50 mg.L-1的硝酸钍、硝酸铀酰的混合水溶液作为水相。分别取相同体积(1 - 2 mL)有机相以及水相混合,在25 ℃条件下搅拌,大约1小时后,萃取达到平衡。然后静置使得有机相和水相分层,离心,尽量保持水相里面不混有有机物,然后通过ICP-AES测试水相中各金属离子的含量,再分别计算有机相中以及水相中同一金属离子含量的比值,即为分配比DM。最后,通过计算得出的钍的分配比DTh,该值与铀酰离子的分配比DU的比值,即可得出钍对铀酰离子的分离系数SFTh/U。其中,在0.1 mol.L-1硝酸条件下,2.0 10-3 mol.L-1L3-58萃取剂,DTh = 13.53 0.01,DU = 0.11 0.01, SFTh/U = 123。
实施例6新型酰胺类有机化合物L3-58用于Ln(III)/Ac(III)混合液液萃取实验。
具体方法如下:
在煤油中配制浓度为2.0 10-3 mol.L-1的L3-58作为有机相;并分别在不同浓度的硝酸体系中(1.0 10-3 - 10 mol.L-1 HNO3)配制大约为50 mg.L-1的硝酸铕、硝酸镅的混合水溶液作为水相。分别取相同体积(1 - 2 mL)有机相以及水相混合,在25 ℃条件下搅拌,大约1小时后,萃取达到平衡。然后静置使得有机相和水相分层,离心,尽量保持水相里面不混有有机物,然后通过ICP-AES测试水相中各金属离子的含量,再分别计算有机相中以及水相中同一金属离子含量的比值,即为分配比DM。最后,通过计算得出的镅的分配比DAm,该值分别与铕金属离子的分配比DEu的比值,即可得出镅对铕金属离子的分离系数SFAm/Eu。其中,在0.1 mol.L-1硝酸条件下,2.0 10-3 mol.L-1L3-58萃取剂,DAm = 2.49 0.01,DEu = 0.21 0.01, SFAm/Eu = 11.8。
实施例7新型酰胺类有机化合物L3-34用于Re(VII)的液液萃取实验。
具体方法如下:
在硝基苯溶液中配制浓度为0.01 mol.L-1L3-34作为有机相;并分别在不同浓度的硝酸体系中(1.0 10-3 - 10 mol.L-1 HNO3)配制大约为50 mg.L-1的硝酸铼水溶液作为水相。分别取相同体积(1 - 2 mL)有机相以及水相混合,在25 ℃条件下搅拌,大约1小时后,萃取达到平衡。然后静置使得有机相和水相分层,离心,尽量保持水相里面不混有有机物,然后通过ICP-AES测试水相中金属离子铼的含量,再计算有机相中以及水相中金属离子铼含量的比值,即为分配比DRe。其中,在0.1 mol.L-1硝酸条件下,DRe = 25 0.5。
- 还没有人留言评论。精彩留言会获得点赞!